GEBRAUCHSINFORMATON: INFORMATION FÜR PATIENTEN
Werbung

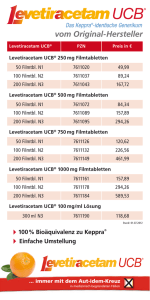
GEBRAUCHSINFORMATON: INFORMATION FÜR PATIENTEN LEVETIRACETAM TEVA 100 mg/ml KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Levetiracetam Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie oder Ihr Kind mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen. • Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. • Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, Apotheker oder Ihre Pflegefachkraft. • Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. • Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder Ihre Pflegefachkraft. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4. WAS IN DIESER PACKUNGSBEILAGE STEHT 1. Was ist Levetiracetam Teva und wofür wird es angewendet? 2. Was sollten Sie vor der Anwendung von Levetiracetam Teva beachten? 3. Wie ist Levetiracetam Teva anzuwenden? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Levetiracetam Teva aufzubewahren? 6. Inhalt der Packung und weitere Informationen 1. Was ist Levetiracetam Teva und wofür wird es angewendet? Levetiracetam ist ein Antiepileptikum (ein Arzneimittel, das zur Behandlung von epileptischen Anfällen angewendet wird). Levetiracetam Teva ist angewendet: • allein bei Erwachsenen und Jugendlichen ab 16 Jahren mit neu diagnostizierter Epilepsie zur Behandlung partieller Anfälle mit oder ohne sekundärer Generalisierung (eine sekundäre Generalisierung liegt vor, wenn sich der Anfall auf das ganze Gehirn ausbreitet) bei Erwachsenen und Jugendlichen ab einem Alter von 16 Jahren, bei denen erstmals Epilepsie festgestellt wurde. • als Zusatzbehandlung zu antiepileptischen Arzneimitteln zur Behandlung von: partiellen Ausbruchanfällen mit oder ohne Generalisierung bei Erwachsenen, Jugendlichen und Kindern ab 4 Jahren myoklonischen Anfällen (kurze schockartige Zuckungen eines Muskels oder einer Muskelgruppe) bei Erwachsenen und Jugendlichen ab 12 Jahren mit juveniler myoklonischer Epilepsie. primär generalisierten tonisch-klonischen Anfällen (ausgeprägte Anfälle, einschließlich Bewusstlosigkeit) bei Erwachsenen und Jugendlichen ab 12 Jahren mit idiopathischer generalisierter Epilepsie (die Form von Epilepsie, die genetisch bedingt zu sein scheint). 1/8 Levetiracetam Teva Konzentrat zur Herstellung einer Infusionslösung ist eine Alternative für Patienten, wenn die Verabreichung des antiepileptischen oralen Levetiracetam Teva Arzneimittels vorübergehend nicht durchführbar ist. 2. Was sollten Sie vor der Anwendung von Levetiracetam Teva beachten? Levetiracetam Teva darf NICHT angewendet werden, • wenn Sie allergisch gegen Levetiracetam, Pyrrolidonderivate , oder einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Arzneimittels sind. Warnhinweise und Vorsichtsmaßnahmen Sprechen Sie mit Ihrem Arzt, bevor Ihnen Levetiracetam Teva verabreicht wird, • Wenn Sie an Nierenproblemen leiden, befolgen Sie die Anweisungen Ihres Arztes. Er kann entscheiden, ob Ihre Dosis angepasst werden sollte. • Wenn Sie eine Verzögerung im Wachstum oder eine unerwartete Pubertätsentwicklung bei Ihrem Kind feststellen, nehmen Sie Kontakt mit Ihrem Arzt auf. • Wenn Sie eine Verstärkung der Schwere der Anfälle feststellen (z. B. Anstieg der Häufigkeit der Fälle), nehmen Sie Kontakt mit Ihrem Arzt auf. • Eine kleine Anzahl Personen, die mit Antiepileptika wie Levetiracetam Teva behandelt werden, haben daran gedacht, sich selbst zu verletzen oder sich das Leben zu nehmen. Wenn Sie irgendwelche Symptome von Depression und/oder Selbstmordgedanken haben, nehmen Sie bitte Kontakt mit Ihrem Arzt auf. Kinder und Jugendliche Levetiracetam Teva darf nicht zur alleinigen Behandlung (Monotherapie) bei Kindern und Jugendlichen unter 16 Jahren angewendet werden. Anwendung von Levetiracetam Teva zusammen mit anderen Arzneimitteln Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen, kürzlich andere Arzneimittel eingenommen haben oder beabsichtigen andere Arzneimittel einzunehmen, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat. Levetiracetam Teva darf während der Schwangerschaft nicht angewendet werden, es sei denn, es ist unbedingt erforderlich. Ein Risiko von Geburtsfehlern für Ihr ungeborenes Kind kann nicht vollständig ausgeschlossen werden. Levetiracetam hat unerwünschte reproduktive Wirkungen in Tierstudien zu Dosen gezeigt, die höher sind als diejenigen, die Sie benötigen, um Ihre Anfälle zu kontrollieren. Vom Stillen wird während der Behandlung abgeraten. Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen Levetiracetam Teva kann Ihre Fähigkeit zum Führen von Fahrzeugen oder Maschinen zu bedienen beeinträchtigen, da Levetiracetam Teva Sie schläfrig machen kann. Dies ist zu Beginn der Behandlung 2/8 oder nach einer Erhöhung der Dosis wahrscheinlicher. Sie dürfen keine Fahrzeuge führen oder Maschinen bedienen, bis nachgewiesen ist, dass Ihre Fähigkeit, solche Aktivitäten auszuüben, nicht beeinträchtigt ist. Levetiracetam Teva enthält Natrium Eine maximale Einzeldosis Levetiracetam Konzentrat Teva enthält 2,5 mmol (oder 57 mg) Natrium 0,8 mmol (oder 19 mg) Natrium pro Durchstechflasche. Wenn Sie eine kochsalzarme Diät einhalten müssen, sollten Sie dies berücksichtigen. 3. Wie ist Levetiracetam Teva anzuwenden? Ein Arzt oder eine Pflegefachkraft wird Ihnen Levetiracetam Teva als intravenöse Infusion verabreichen. Levetiracetam Teva muss zweimal pro Tag verabreicht werden, einmal morgens und einmal abends, ungefähr zum gleichen Zeitpunkt jeden Tag. Die intravenöse Formel ist eine Alternative zu Ihrer oralen Verabreichung. Sie können von den Filmtabletten oder von der Lösung zum Einnehmen auf die intravenöse Formel wechseln oder direkt umgekehrt ohne Dosisanpassung. Ihre gesamte Tagesdosis und Verabreichungshäufigkeit bleiben identisch. Monotherapie Dosis bei Erwachsenen und Jugendlichen (ab 16 Jahren): Übliche Dosis: zwischen 1.000 mg und 3.000 mg täglich. Wenn Sie zum ersten Mal Levetiracetam Teva anwenden, wird Ihnen Ihr Arzt eine niedrigere Dosis über einen Zeitraum von 2 Wochen verschreiben, bevor er Ihnen die niedrigste übliche Dosis verabreicht. Zusatztherapie Dosis bei Erwachsenen und Jugendlichen (12 bis 17 Jahre), die 50 kg oder mehr wiegen: Übliche Dosis: zwischen 1.000 mg und 3.000 mg täglich. Dosis bei Kindern (4 bis 11 Jahre) und Jugendlichen (12 bis 17 Jahre), die weniger als 50 kg wiegen: Übliche Dosis: zwischen 20 mg pro kg Körpergewicht und 60 mg pro kg Körpergewicht täglich. Art der Verabreichung und Verabreichungsweg: Levetiracetam Teva wird in mindestens 100 ml eines kompatiblen Verdünnungsmittels verdünnt und über 15 Minuten infundiert. Für Ärzte und Pflegefachkräfte sind detailliertere Informationen zur korrekten Anwendung von Levetiracetam Teva im Abschnitt 6 vorhanden. Dauer der Behandlung: Es gibt keine Erfahrung mit der Verabreichung von intravenösem Levetiracetam über einen längeren Zeitraum als 4 Tage. Wenn Sie die Anwendung von Levetiracetam Teva abbrechen 3/8 Bei Abbruch der Behandlung sollte, wie mit anderen Antiepileptika, Levetiracetam Teva allmählich reduziert werden, um eine Verstärkung der Anfälle zu vermeiden. Ihr Arzt entscheiden sollte, die Behandlung mit Levetiracetam Teva zu beenden, wird er/sie Ihnen mitteilen, wie Sie Levetiracetam Teva schrittweise absetzen sollen. Wenn Ihnen eine größere Menge von Levetiracetam Teva verabreicht wurde, kontaktieren Sie sofort Ihren Arzt, Ihren Apotheker oder das Antigiftzentrum (070/245.245). Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker. 4. Welche Nebenwirkungen sind möglich? Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Die am häufigsten berichteten Nebenwirkungen sind Entzündungen des Nasen-Rachen-Raumes (Nasopharyngitis), Schläfrigkeit (Somnolenz), Kopfschmerzen, Müdigkeit und Schwindel. Zu Behandlungsbeginn oder bei einer Dosissteigerung können Nebenwirkungen wie Schläfrigkeit, Müdigkeit und Schwindel häufiger auftreten. Diese Wirkungen sollten jedoch im Laufe der Zeit abnehmen. Sehr häufig: kann mehr als 1 von 10 Personen betreffen • Nasopharyngitis; • Somnolenz (Schläfrigkeit), Kopfschmerzen. Häufig: kann bis zu 1 von 10 Personen betreffen • Anorexie (Appetitmangel); • Depression, Feindseligkeit oder Aggression, Angst, Schlaflosigkeit, Nervosität oder Reizbarkeit; • Konvulsionen, Gleichgewichtsstörung, Schwindel (Gefühl von Wackeligkeit), Lethargie (Mangel an Energie und Begeisterungsfähigkeit), Tremor (unwillkürliches Zittern); • Vertigo (Drehgefühl); • Husten; • Bauchschmerzen, Durchfall, Dyspepsie (Verdauungsstörung), Erbrechen, Übelkeit; • Rash; • Asthenie/Fatigue (Müdigkeit). Gelegentlich: kann bis zu 1 von 100 Personen betreffen • verminderte Zahl der Blutplättchen, verminderte Zahl der weißen Blutzellen; • Gewichtsabnahme, Gewichtszunahme; • Suizidversuch und Suizidideation, Geistesstörung, abnormales Verhalten, Halluzinationen, Ärger, Verwirrtheit, Panikattacken, emotionale Instabilität/Stimmungsschwankungen, Agitiertheit; • Amnesie (Gedächtnisverlust), Gedächtnisbeeinträchtigung (Vergesslichkeit), abnormale Koordination/Ataxie (beeinträchtigte koordinierte Bewegungen), Parästhesie (Prickeln), Aufmerksamkeitsstörung (Konzentrationsmangel); • Diplopie (Doppelsehen), verschwommenes Sehen; • erhöhte/anormale Werte in Leberfunktionstests; 4/8 • • • Haarausfall, Ekzem, Pruritus; Muskelschwäche, Myalgie (Muskelschmerzen); Verletzung. Selten: kann bis zu 1 von 1.000 Personen betreffen • Infektion; • verminderte Zahl aller Blutzelltypen; • Schwerwiegende allergische Reaktionen (DRESS, anaphylaktische Reaktion [schwerwiegende allergische Reaktion], Quincke-Ödem [Schwellung von Gesicht, Lippen, Zunge und Rachen]) • Verringerte Natriumkonzentration im Blut; • Suizid, Persönlichkeitsstörungen (Verhaltensprobleme), abnormales Denken (langsames Denken, Unfähigkeit, sich zu konzentrieren); • unkontrollierbare Muskelspasmen an Kopf, Rumpf und Gliedmaßen; Schwierigkeit, die Bewegungen zu kontrollieren, Hyperkinesie (Hyperaktivität); • Pankreatitis; • Leberinsuffizienz, Hepatitis; • Hautausschlag, der Blasen bilden kann und wie kleine Scheiben aussieht (zentrale dunkle Flecken mit blasser Umrandung, mit einem dunklen Ring um den Rand) (Erythema multiforme), ein verbreiteter Ausschlag mit Blasenbildung und Abschälen der Haut, insbesondere um den Mund, die Nase, die Augen und die Genitalien (Stevens-Johnson-Syndrom), und eine schwerere Form, die auf mehr als 30 % der Körperfläche ein Abschälen der Haut hervorruft (toxische epidermale Nekrolyse). Meldung von Nebenwirkungen Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über die Föderalagentur für Arzneimittel und Gesundheitsprodukte - Abteilung Vigilanz EUROSTATION II - Victor Hortaplein, 40/40 - B-1060 BRÜSSEL - Website: www.fagg-afmps.be - E-Mail: [email protected] anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden. 5. Wie ist Levetiracetam Teva aufzubewahren? Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf. Sie dürfen dieses Arzneimittel nach dem auf dem Umkarton und der Durchstechflasche nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats. Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Haltbarkeit: Aus mikrobiologischer Sicht soll das Produkt unmittelbar nach dem Verdünnen angewendet werden. Falls das gebrauchsfertige Produkt nicht unverzüglich angewendet wird, liegen Lagerzeit und Lagerbedingungen in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 24 Stunden bei 2 bis 8°C betragen, es sei denn, die Verdünnung wurde unter kontrollierten und validierten aseptischen Bedingungen durchgeführt. 5/8 Sie dürfen Levetiracetam Teva nicht verwenden, wenn Sie sichtbare Anzeichen von Nichtverwendbarkeit bemerken. Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei. 6. Inhalt der Packung und weitere Informationen Was Levetiracetam Teva enthält: Der Wirkstoff ist: Levetiracetam. Jede ml Konzentrat zur Herstellung einer Infusionslösung enthält 100 mg Levetiracetam. Die sonstigen Bestandteile sind: Natriumacetat-Trihydrat, Natriumchlorid, Glazial-Essigsäure, Wasser für Injektionszwecke Wie Levetiracetam Teva aussieht und Inhalt der Packung Levetiracetam Teva ist eine klare, farblose sterile Flüssigkeit Levetiracetam Teva Konzentrat 5 ml Durchstechflasche ist in einem Umkarton mit 1 Durchstechflasche 10 Durchstechflaschen verpackt. Pharmazeutischer Unternehmer und Hersteller Teva Pharma Belgium AG Laarstraat 16 B-2610 Wilrijk Hersteller Haupt Pharma Wülfing GmbH Bethelner Landstrasse 18 31028 Gronau/Leine Deutschland Zulassungsnummer BE403977 Art der Abgabe Verschreibungspflichtig Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen: NL, BE : Levetiracetam Teva DE, LU : Levetiracetam-ratiopharm FR : Levetiracetam TEVA IT : Levetiracetam Teva Italia 6/8 Diese Packungsbeilage wurde zuletzt genehmigt im 06/2016. ------------------------------------------------------------Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt: Die Anweisungen zur korrekten Anwendung von Levetiracetam Teva sind im Abschnitt 3 angeführt. Eine Durchstechflasche von Levetiracetam Teva Konzentrat enthält 500 mg Levetiracetam (5 ml Konzentrat à 100 mg/ml). Siehe Tabelle 1 für die empfohlene Zubereitung und Verabreichung von Levetiracetam Teva Konzentrat, um eine gesamte Tagesdosis von 500 mg, 1000 mg, 2000 mg zu erreichen, oder 3000 mg in zwei Dosen. Tabelle 1. Zubereitung und Verabreichung von Levetiracetam Teva Konzentrat. Dosis 250 mg 500 mg 1000 mg 1500 mg Entnommenes Volumen 2,5 ml (halbe Durchstechflasche à 5 ml) 5 ml (eine Durchstechflasche à 5 ml) 10 ml (2 Durchstechflaschen à 5 ml) 15 ml (drei Durchstechflaschen à 5 ml) VoluInfusionsmen des zeit Verdünnungsmittel Häufigkeit der Verabreichung Gesamte Tagesdosis 500 mg/Tag 100 ml 15 Minuten Zweimal täglich 100 ml 15 Minuten Zweimal täglich 1000 mg/Tag 100 ml 15 Minuten Zweimal täglich 2000 mg/Tag 100 ml 15 Minuten Zweimal täglich 3000 mg/Tag Das Arzneimittel ist nur zur einmaligen Verwendung bestimmt. Jede nicht verbrauchte Lösung ist zu verwerfen. Haltbarkeit: Aus mikrobiologischer Sicht soll das Produkt unmittelbar nach dem Verdünnen angewendet werden. Falls das gebrauchsfertige Produkt nicht unverzüglich angewendet wird, liegen Lagerzeit und Lagerbedingungen in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 24 Stunden bei 2 bis 8 °C betragen, es sei denn, die Verdünnung wurde unter kontrollierten und validierten aseptischen Bedingungen durchgeführt. Nach Mischen mit den nachfolgend aufgeführten Verdünnungsmitteln ist Levetiracetam Teva Konzentrat über mindestens 24 Stunden bei Aufbewahrung in PVC-Beuteln unter kontrollierter Temperatur (15-25° C) physikalisch kompatibel und chemisch stabil. Verdünnungsmittel: • Natriumchlorid-Injektionslösung 9 mg/ml (0,9 %) • Ringer-Lactat-Injektionslösung 7/8 • Dextrose-Injektionslösung 50 mg/ml (5 %) 8/8