Zusammenfassung Thermodynamik von Reinhard Honegger
Werbung

Zur Thermodynamik des idealen Gases (GK Physik 1)
Zusammenfassung im Hinblick auf Prozesse. Reinhard Honegger, im Januar 2012.
1
1.1
Grundbegriffe
Zustandsgleichung = Ideale Gasgleichung
p Druck, V Volumen, T Temperatur eines idealen Gases von N Teilchen. Diese Größen
sind immer strikt positiv. Die Temperatur T wird stets vom absoluten Nullpunkt aus
genommen. Dann ist die Zustandsgleichung gegeben durch
pV
= N kB = νNA kB = νR ,
(1.1)
T
mit der Boltzmann Konstanten kB > 0. Die Avogadro oder Loschmidt Zahl NA ist
die Anzahl der Teilchen in einem mol, und ν ist die Anzahl der mole, also N = νNA .
R = NA kB ist die ideale Gaskonstante. Zahlenwerte siehe Skript.
1.2
Innere Energie: proportional zur Temperatur
Die innere Energie E eines idealen Gases mit N Teilchen ist proportional zu seiner
Temperatur T ,
E=
f
N kB T
|2 {z }
= CV
=⇒
dE = CV dT .
(1.2)
Hierbei ist f die Anzahl der Freiheitsgrade. Wir haben f = 3 bei einatomigem idealen
Gas wie z.B. Helium, f = 5 bei zweiatomigen idealen Gas wie z.B. Sauerstoff oder
Stickstoff oder näherungsweise bei Luft.
1.3
Die Arbeit in der Thermodynamik
Die Arbeit in der Thermodynamik ist infinitesimal definiert als
δW = −pdV .
Das Minuszeichen in δW = −pdV ist so gestaltet (beachte p > 0), dass die Arbeit
positiv ist, falls man Arbeit ins Gassystem hinein steckt, d.h. falls das Volumen verkleinert
wird, ∆V < 0. Umgekehrt, vergrößert sich das Volumen, ∆V > 0, so wird Arbeit =
mechanische Energie an die Umgebung abgegeben, welche negativ angerechnet wird.
1.4
Erster Hauptsatz = Energieerhaltung
Der Erste Hauptsatz der Thermodynamik lautet für infinitesimale Änderungen
dE = δQ + δW .
(1.3)
Der Zuwachs bzw. die Abnahme dE der inneren Energie erfolgt durch Wärmezufuhr
bzw. –abfuhr δQ und/oder durch Arbeitszufuhr bzw. –abfuhr δW = −pdV . Dabei wird
zugeführte Wärme positive angerechnet, ∆Q > 0, und abgezogene negativ, ∆Q < 0.
1
1.5
Definition der Entropie
Die Entropiezuwächse sind infinitesimal definiert als
dS =
δQ
,
T
mit der Temperatur T , die sich im Laufe eines Prozesses im Allgemeinen verändert.
Die absolute Entropie ist über die Wahrscheinlichkeit ω eines Zustands definiert als
S = kB ln(ω). Hier betrachten wir aber keine absolute Entropie, sondern nur Entropiedifferenzen ∆S , und den Referenzpunkt (= “Nullpunkt”) der Entropie wählen wir in
Unterkapitel 3.5 völlig willkürlich.
1.6
Anmerkung zur Notation von infinitesimalen Änderungen
Druck p, Volumen V , Temperatur T , innere Energie E und Entropie S sind Zustandsgrößen eines idealen Gases. (Per Konstruktion. Deren Änderungen in einem Prozess
hängen nur von Anfangs– und Endpunkt ab, aber nicht vom Prozessweg. Für S zeigen
wir das später in Unterkapitel 3.5.) Die Teilchenzahl N ist natürlich auch eine Zustandsgröße, aber Letztere wollen wir hier in der Zusammenfassung als konstant annehmen.
Infinitesimale Änderungen (= totale Differenziale) der Zustandsgrößen werden mit dem
infinitesimalen “d” bezeichnet, also mit dp, dV , dT , dE , bzw. dS .
Die Wärme(energie) ‘Q’ und die Arbeit ‘W ’ hängen vom Prozessweg ab, und nicht
nur vom Anfangs– und Endpunkt. Deshalb können sie keine Zustandsgrößen darstellen.
Um von Zustandsgrößen zu unterscheiden, bezeichnen wir deren infinitesimale Änderungen mit einem “δ ”, also mit δQ bzw. δW , vgl. Skript.
2
Abhängigkeit der Zustandsgrößen & Diagramme
Gegeben sei ein ideales Gas mit f Freiheitsgraden und N Teilchen, beides, f und N ,
seien hier festgehaltene Größen.
Lassen wir zunächst die Entropie S außen vor, so haben wir p, V , T und E als die
vier Zustandsgrößen, die den Zustand des Gases beschreiben.
Nach Gl. (1.2) ist E = CV T , also können T und E als synonym angesehen werden, T ∼
= E . Die drei Zustandsgrößen p, V und T ∼
= E sind aufgrund der idealen
Gasgleichung (1.1) voneinander abhängig,
pV
= N kB = konstant ,
T
Fazit: Gegeben zwei Zustandsgrößen aus {p, V, T ∼
= E}, so lässt sich die verbleibende Zustandsgröße daraus berechnen. Damit genügen nur zwei Zustandsgrößen, um den
Zustand des idealen Gases eindeutig zu bestimmen.
Nehmen wir als Beispiel p, V . Dann ist die Temperatur bzw. innere Energie
T ≡ T (p, V ) =
pV
N kB
⇐⇒
E ≡ E(p, V ) = CV T (p, V ) =
f
pV
2
(2.1)
eine Funktion von den Parametern p und V . Ein Zustand des idealen Gases ist daher
eindeutig als Punkt (p, V ) im zwei–dimensionalen p, V –Diagramm darstellbar.
2
Äquivalent erhalten wir den Zustand als Punkt im p, T –Diagramm oder im V, T –
Diagramm (bzw. E(∼
= T ) anstatt T ).
Später in Unterkapitel 3.5 werden wir sehen, dass das Ganze auch noch funktioniert,
wenn man die Entropie S hinzunimmt: Gegeben zwei Zustandsgrößen aus {p, V, T ∼
=
E, S}, so lassen sich die verbleibenden beiden Zustandsgrößen daraus eindeutig errechnen.
Dies führt auf das S, p–Diagramm, bzw. das S, T –Diagramm, usw. Es lassen sich die
Zustandspunkte in allen möglichen zwei–dimensionalen Diagrammen eindeutig ineinander
umrechnen.
3
Allgemeine Prozesse
Gegeben sei ein ideales Gas mit f Freiheitsgraden und N Teilchen, welche wieder festgehaltene Größen seien.
3.1
Prozess vom Anfangszustand ‘anf ’ in den Endzustand ‘end’
Wir starten mit einem Anfangszustand ‘anf’ unseres idealen Gases beschrieben durch
die Zustandsgrößen panf , Vanf , Tanf , Eanf , Sanf . Durch irgendwelche Einwirkungen (=
Prozessführung) gelangt das ideale Gas in den Endzustand ‘end’ gegeben durch pend , Vend ,
Tend , Eend , Send . Während des Prozessverlaufes weichen in der Regel alle momentanen
Zustandsgrößen p, V , T , E , S von den Anfangs– bzw. Endgrößen ab.
Der Übergang vom Anfangs– in den Endzustand wird als Prozess bezeichnet. Es
gibt unendlich viele Möglichkeiten für die Prozessführung, d.h., für den konkreten Weg
vom Anfangs– zum Endzustand. Eine Prozessführung soll jedoch stets quasistatisch von
statten gehen, d.h. “unendlich langsam”, so dass innerhalb des Gesamtgassystems stets
Gleichgewicht herrscht, und somit hin und zurück die Gesamtentropieänderung verschwindet, ∆Sgesamt = ∆Shin + ∆Szurück = 0.
3.2
Zustandsgrößen–Differenz unabhängig vom Prozessweg
Differenzen von Zustandsgrößen sind stets gegeben durch Endzustand minus Anfangszustand, also z.B. für den Druck oder die Temperatur durch
Z pend
Z Tend
∆p =
dp = pend − panf ,
∆T =
dT = Tend − Tanf ,
panf
Tanf
und analog für alle anderen, und zwar völlig unabhängig von der konkreten Prozessführung
von ‘anf’ nach ‘end’.
Entsprechend der idealen Gasgleichung (1.1) haben wir für jeden Zwischenzustand
p, V , T einer konkreten Prozessführung von ‘anf’ nach ‘end’, dass
panf Vanf
pend Vend
pV
= N kB =
=
= konstant .
T
Tanf
Tend
Folglich erhalten wir – beispielhaft bezüglich des p, V –Diagramms – die Temperaturdifferenz bzw. Änderung der inneren Energie über den Prozess hinweg als
∆T =
1
(pend Vend − panf Vanf ) ,
N kB
∆E = CV ∆T =
3
f
(pend Vend − panf Vanf ) .
2
(3.1)
3.3
Wärme und Arbeit abhängig vom Prozessweg
Mit dem Ersten Hauptsatz (1.3) bekommen wir die Änderung der inneren Energie über
den gesamten Prozess als
∆E = ∆Q + ∆W .
(3.2)
Während ∆E unabhängig von der Prozessführung ist, sind im Gegensatz dazu die beiden
Nichtzustandsgrößen Wärme(menge) ∆Q und Arbeit ∆W wohl davon abhängig, auf
welchem Weg (= Kurve) der Prozess vom Anfangszustand ‘anf’ zum Endzustand ‘end’
geführt wird. Sie werden als “reine Differenzen” über Prozessweg–Integrale erhalten,
Z
Z
T dS ,
∆W = −
pdV .
∆Q =
Prozessweg
Prozessweg
Prozessweg–Integrale werden mittels einer Parametrisierung des Weges ausgerechnet, ähnlich zum Arbeits– bzw. Weg–Integral in der Mechanik. Dies wollen wir im nächsten
Unterkapitel beispielhaft für das p, V –Diagramm ausführen.
3.4
Prozessführung auf gewähltem Weg im p,V–Diagramm
Anfangszustand (panf , Vanf ), Endzustand (pend , Vend ). Der Prozess führt vom Anfangszustand zum Endzustand entlang eines festgelegten Weges (= Kurve) im p, V –Diagramm.
Diesen Weg parametrisieren wir mit einem reellen Parameter t,
(p, V ) ≡ (p(t), V (t)) ,
t ∈ [ta , te ] ,
Parametrisierung des Weges.
(3.3)
Hierbei ta < te für den Anfangs– bzw. Endparameter, insbesondere
p(ta ) = panf , V (ta ) = Vanf ,
p(te ) = pend , V (te ) = Vend .
(Manchmal kann man mit V parametrisieren: (p, V ) ≡ (p(V ), V ) mit V ∈ [Vanf , Vend ].)
Die Arbeit, die während der Prozessführung verrichtet wird, ist gegeben durch das
Prozessweg–Integral als t–Parameter–Integral (“Erweitern mit dt”)
Z
Z te
dV (t)
dt .
(3.4)
p(t)
∆W = −
pdV = −
dt
ta
Prozessweg
Kommen wir zum Prozessweg–Integral für ∆Q. Das totale Differenzial der inneren
Energie E ist mit (2.1) im p, V –Diagramm gegeben durch
∂E(p, V )
∂E(p, V )
f
f
dp +
dV = V dp + pdV .
∂p
∂V
2
2
Mit dem Ersten Hauptsatz δQ = dE − δW und mit δW = −pdV erhalten wir damit
f
f
T dS = δQ = dE − δW = V dp +
+ 1 pdV .
(3.5)
2
2
Also ist das Prozessweg–Integral für ∆Q das t–Parameter–Integral (“Erweitern mit dt”)
Z
Z
f
Z te
f te
dp(t)
dV (t)
dt +
+1
dt .
∆Q =
T dS =
V (t)
p(t)
2 ta
dt
2
dt
Prozessweg
ta
dE =
Andererseits, aus der Formulierung (3.2) des Ersten Hauptsatzes erhalten wir
∆Q = ∆E − ∆W = CV ∆T − ∆W
für die Wärmemengendifferenz, mit ∆T bzw. ∆E von Gl. (3.1) und ∆W von (3.4). So
hätten wir uns das Prozessweg–Integral für ∆Q ersparen können.
4
3.5
Mit
Relative Entropie als Zustandsgröße
1
T
=
N kB
pV
erhalten wir aus Gl. (3.5) das Entropie–Differenzial dS im p, V –Diagramm,
f
dV
δQ
f dp
dp
dV
dS =
= N kB
+ N kB
+1
= CV
+ Cp
.
T
2
p
V
| {z 2} p
|
{z
} V
= CV
= Cp
Folglich ist die Entropiedifferenz entlang unseres Prozessweges gegeben durch das t–
◦
Parameter–Integral (Substitutionen p ↔ t und V ↔ t beim Gleichheitszeichen =)
Z te
Z
Z te
Z te
dS
1 dp(t)
1 dV (t)
dS =
∆S =
dt = CV
dt + Cp
dt
ta dt
Prozessweg
ta p(t) dt
ta V (t) dt
(3.6)
Z Vend
Z pend
p V dV
dp
◦
end
end
+ Cp
= CV ln
+ Cp ln
.
= CV
p
V
panf
Vanf
Vanf
panf
Wir erkennen: Die Entropieänderung hängt nur vom Anfangs– und Endzustand ab, nicht
aber vom spezifisch gewählten Weg von ‘anf’ nach ‘end’.
Diese ausschließliche Abhängigkeit nur vom Anfangs– und Endzustand zeigt, dass die
Entropie tatsächlich eine Zustandsgröße darstellt. Definieren wir die Entropie eines fest
gewählten Anfangszustandes (p0 , V0 ) als S0 ≡ S(p0 , V0 ), dann ist die Entropie S eines
beliebigen Endzustandes (p, V ) relativ zum Referenzpunkt (p0 , V0 ) gegeben als
p
V S ≡ S(p, V ) := S0 + ∆S = S0 + CV ln
+ Cp ln
.
p0
V0
Damit wird jedem Zustandspunkt (p, V ) im p, V –Diagramm eindeutig der Entropiewert
S ≡ S(p, V ) zugeordnet. Der Referenzpunkt (p0 , V0 ) kann als Entropie–“Nullpunkt”
angesehen werden, eventuell noch mit der Wahl von S0 = 0.
Klar, das lässt sich eindeutig umrechnen in die anderen Diagramme.
4
Spezielle Prozesse
Wir verlassen nun den allgemeinen Prozessweg. Denn die Parameterintegrale vereinfachen
sich, wenn während des Prozesses bestimmte Größen konstant bleiben. Solche speziellen
Prozessführungen wollen wir in den nachfolgenden Unterkapiteln untersuchen. Wieder sei
ein ideales Gas mit f Freiheitsgraden und N Teilchen gegeben, wobei f und N fest.
4.1
Isochore Prozessführung: V = konstant
Isochor bedeutet bei konstantem Volumen V , d.h. während des ganzen Prozesses haben
wir dasselbe Volumen V = Vanf = Vend . Somit wird mit der idealen Gasgleichung (1.1),
N kB
panf
pend
p
=
=
=
= konstant
T
Vanf
Tanf
Tend
für den Zusammenhang von Druck p und Temperatur T während des Prozessverlaufes.
Insbesondere wird
p=
N kB
T
Vanf
=⇒
dp =
N kB
dT .
Vanf
5
(4.1)
Für die Arbeit, die über den gesamten isochoren Prozess hinweg verrichtet wird,
erhalten wir aus δW = −pdV , dass
Z Vend =Vanf
pdV = 0 ,
∆W = −
Vanf
denn untere und obere Grenze des Integrals sind identisch. Aus der Formulierung (3.2)
des Ersten Hauptsatzes folgt somit
∆Q = ∆E = CV ∆T .
= f2 N kB die spezifische Wärme für den isochoren Prozess.
Hier ist CV = ∆Q
∆T
Die infinitesimale Entropieänderung ergibt sich zu
δQ
dT
dp
dS =
= CV
= CV
,
T
T
p
= dp
. Damit
weil aus (4.1) folgt dass dT
T
p
Z Tend
Z pend
T p dT
dp
end
end
∆S = CV
= CV ln
= CV
= CV ln
.
T
Tanf
p
panf
Tanf
panf
Letzteres ergibt sich auch aus (3.6) mit Vanf = Vend .
4.2
Isobare Prozessführung: p = konstant
Isobar bedeutet bei konstantem Druck p, d.h. während des ganzen Prozesses haben wir
denselben Druck p = panf = pend . Somit wird mit der idealen Gasgleichung (1.1)
Vanf
Vend
N kB
V
=
=
= konstant
=
T
panf
Tanf
Tend
für den Zusammenhang von Volumen V und Temperatur T während des Prozessverlaufes.
Insbesondere wird
N kB
N kB
V =
T
=⇒
dV =
dT .
(4.2)
panf
panf
Für die Arbeit, die über den gesamten isobaren Prozess hinweg verrichtet wird, erhalten wir mit konstantem p = panf = pend , dass
Z
Z Vend
pdV = −panf
dV = −panf ∆V .
∆W = −
Prozessweg
Vanf
Aus dem Ersten Hauptsatz (3.2) folgt mit ∆V =
N kB
∆T
panf
nach Gl. (4.2),
∆Q = CV ∆T + panf ∆V = (CV + N kB )∆T = Cp ∆T .
| {z } | {z }
| {z }
= ∆E = −∆W
= Cp
Cp = ∆Q
= CV + N kB = N kB f2 + 1 ist die spezifische Wärme für den isobaren Prozess.
∆T
Infinitesimal, δQ = Cp dT . Die infinitesimale Entropieänderung ergibt sich somit zu
δQ
dT
dV
dS =
= Cp
= Cp
,
T
T
V
weil aus (4.2) folgt, dass dT
= dV
. Damit
T
V
Z Tend
Z Vend
T V dT
dV
end
end
∆S = Cp
= Cp ln
= Cp
= Cp ln
T
Tanf
V
Vanf
Tanf
Vanf
Letzteres ergibt sich auch aus (3.6) mit panf = pend .
6
4.3
Isotherme Prozessführung: T = konstant
Isotherm bedeutet bei konstanter Temperatur T , d.h. während des ganzen Prozesses
haben wir dieselbe Temperatur T = Tanf = Tend . Somit wird mit (1.1),
pV = N kB Tanf = panf Vanf = pend Vend = konstant
(4.3)
für den Zusammenhang von Druck p und Volumen V während des Prozessverlaufes.
Insbesondere wird
N kB Tanf
dV ,
V2
p=
N kB Tanf
V
=⇒
dp = −
V =
N kB Tanf
p
=⇒
dV = −
(4.4)
oder
N kB Tanf
dp .
p2
Für die Arbeit, die über den gesamten isothermen Prozess hinweg verrichtet wird,
erhalten wir aus δW = −pdV und mit Gl. (4.4), p ≡ p(V ) = N kB Tanf V −1 , (und der
Wahl von V als Parameter der Prozessweg–Parametrisierung), dass
Z
Z Vend
V p dV
end
end
= −N kB Tanf ln
= N kB Tanf ln
,
∆W = −
pdV = −N kB Tanf
Vanf
panf
Vanf V
Prozessweg
anf
= VVend
nach (4.3) folgt.
wobei das letzte Gleichheitszeichen aus ppend
anf
Mit ∆T = 0 und dem Ersten Hauptsatz (3.2) erhalten wir
∆E = CV ∆T = 0 ,
∆Q = −∆W .
Die Entropieänderung ergibt sich wegen T = Tanf = Tend = konstant zu
∆S =
4.4
∆Q
.
Tanf
Adiabatischer Prozess: kein Wärmeaustausch, S = konstant
Adiabatisch bedeutet, dass während des gesamten Prozesses keinerlei Wärmeenergie mit
der Umgebung ausgetauscht wird. Mathematisch etwas inkorrekt, schreiben wir suggestiv
“δQ = 0”, was äquivalent ist zu “dS = δQ
= 0”. D.h., die Entropie S bleibt während
T
des gesamten Prozessverlaufs konstant. Insbesondere wird für die Gesamtänderungen
über den adiabatischen Prozess hinweg ∆Q = 0 = ∆S .
Im Laufe des Prozesses ändern sich aber alle drei Größen p, V , T ∼
= E , wobei stets
pV
panf Vanf
pend Vend
= N kB =
=
= konstant .
T
Tanf
Tend
Allerdings kann man hier zeigen (siehe Skript oder Vorlesung), dass gilt,
κ
κ
pV κ = panf Vanf
= pend Vend
=: c0 = konst.,
κ :=
Cp
f +2
2
=
= 1 + > 1.
CV
f
f
Benutzen wir die ideale Gasgleichung (1.1), so wird N kB =
1−κ
konstant. Somit ist V T = konstant, oder eben
κ−1
κ−1
V κ−1 T = Vanf
Tanf = Vend
Tend = konstant .
7
pV
T
1−κ
= pV k V T
1−κ
= c0 V T
=
Für die Arbeit, die über den ganzen adiabatischen Prozesses hinweg verrichtet wird,
erhalten wir mit p ≡ p(V ) = c0 V −κ (und V als Parameter der Prozessweges), dass
Z
Z Vend
κ−1
dV
c0 h 1 iVend
◦ panf Vanf Vanf
=
−
1
∆W = −
pdV = −c0
=
κ−1
κ
κ − 1 V κ−1 V =Vanf
κ − 1 Vend
Vanf V
Prozessweg
V κ−1 T
f
†
? N kB
anf
anf
=
−
T
= N kB (Tend − Tanf ) = CV ∆T .
anf
κ−1
κ−1
2
Vend
◦
?
κ
Beim Gleichheitszeichen = benutzten wir c0 = panf Vanf
, beim Gleichheitszeichen = haben
†
κ−1
κ−1
wir panf Vanf = N kB Tanf eingesetzt, und bei = haben wir Vanf
Tanf = Vend
Tend verwendet.
f
Beachten wir noch κ − 1 = 2/f und CV = 2 N kB so wird der Rest. Bedeutend einfacher hätten wir die Arbeit ∆W jedoch über den Ersten Hauptsatz (3.2) erhalten unter
Berücksichtigung von ∆Q = 0 (da adiabatisch, s.o.), nämlich,
∆W = ∆E = CV ∆T .
5
Kreisprozesse
Ein Kreisprozess ist ein Prozess bei dem Anfangs– und Endzustand übereinstimmen, also
‘anf’=‘end’, dies heisst,
panf = pend ,
Vanf = Vend ,
Tanf = Tend ,
Eanf = Eend ,
Sanf = Send .
Insbesondere folgt daraus ∆Sgesamt = 0 und ∆Egesamt = 0. Mit ∆Egesamt = 0 folgt aus
Gleichung (3.2) des Ersten Hauptsatzes, dass stets,
∆Wgesamt = −∆Qgesamt
für die Gesamtwärmemenge ∆Qgesamt und Gesamtarbeit ∆Wgesamt eines Kreisprozesses.
Ist ∆Wgesamt = −∆Qgesamt < 0, so wird im Verlaufe des gesamten Kreisprozesses
die Wärmemenge ∆Qgesamt zugeführt und in die mechanische Arbeit A := |∆Wgesamt |
umgewandelt, wobei Letztere nach außen abgegeben wird. Hier wird der Kreisprozess als
Wärmekraftmaschine eingesetzt.
Ist umgekehrt ∆Wgesamt = −∆Qgesamt > 0, so wird die reingesteckte mechanische
Arbeit ∆Wgesamt benutzt, um dem Gassystem die Wärmemenge |∆Qgesamt | zu entziehen.
Hier wird der Kreisprozess zur Kühlung verwendet.
Teilschritte eines Kreisprozesses können aus isochoren, isobaren, isothermen, und/oder
adiabatischen (Teil–) Prozessführungen bestehen. Beachte aber, für einen Teilprozess gilt
jedoch im Allgemeinen nicht, dass ∆E oder ∆S verschwinden.
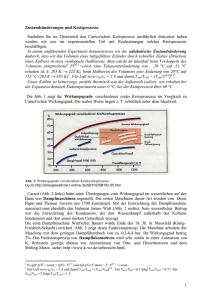
Beispielhaft besteht der Carnot’sche Kreisprozess aus 4 Teilprozessschritten und 4
Zwischenzuständen A =‘anf’=‘end’, B , C , und D :
A −→ B
B −→ C
C −→ D
D −→ A
:
:
:
:
adiabatische Kompression,
isotherme Expansion,
adiabatische Expansion,
isotherme Kompression.
Für Details zum Carnot Kreisprozess sei auf die Vorlesung bzw. das Skript verwiesen.
Weitere Kreisprozesse finden sich in den Übungsaufgaben.
8