Kein Folientitel - Riehl
Werbung

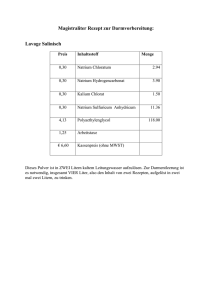
VersuchWilhelm - Heinrich - Riehl - Kolleg Landeshauptstadt Düsseldorf Der zweite Bildungsweg Grundkenntnisse für Biologiekurse Teil 17 Hergestellt mit Microsoft Office PowerPoint 2003 - Bildschirmauflösung 1024 x 768 Pixel © Wilhelm-Heinrich-Riehl-Kolleg - www.riehl-kolleg.de - Düsseldorf 2009 - Alle Rechte vorbehalten. - Gestaltung und Inhalt: Richard Fischer 1 Versuch Chlorgas Ventil kurzzeitig öffnen Natrium Verbrennungsrohr Porzellanschiffchen Gasbrenner 2 Versuch starke Wärmeentwicklung und grellgelbes Licht Chlorgas Natrium Ventil kurzzeitig öffnen Verbrennungsrohr Porzellanschiffchen 3 Versuch starke Wärmeentwicklung und grellgelbes Licht weißer kristalliner Feststoff 4 Versuch Chlorgas Aufbau Ventil Natrium Verbrennungsrohr Porzellanschiffchen Gasbrenner Durchführung Beobachtungen • Natrium bis zum Schmelzen erhitzen. • Es findet eine heftige Reaktion statt: starke Wärmeentwicklung und grellgelbes Licht. • Gasbrenner entfernen. • Brennrohr mit Chlorgas füllen. • Der Gasraum entfärbt sich je nach Menge des Chlorgases. • Es bildet sich ein weißer kristalliner Feststoff an der Wand des Rohrs. 5 Erklärung Reaktionsschema: Reaktionsgleichung: Natrium + Chlor → Natriumchlorid (= Kochsalz) 2 Na + Cl2 → 2 NaCl wird gespalten in 2 Cl-Atome Elektronenübergang 1e - 11 Protonen und 10 Elektronen 17 Protonen und 18 Elektronen Kation Anion IONEN 6 Erklärung Reaktionsschema: Natrium + Reaktionsgleichung: 2 Na Chlor → Natriumchlorid (= Kochsalz) + Cl2 → 2 NaCl wird gespalten in 2 Cl-Atome Elektronenübergang 11 Protonen und 11 Elektronen 1e - 17 Protonen und 17 Elektronen 11 Protonen und 10 Elektronen 17 Protonen und 18 Elektronen Kation Anion IONEN 7 Anordnung der Ionen Kochsalzkristalle 8 Anordnung der Ionen Jedes Cl ist von sechs Na + umgeben, jedes Na + von sechs Cl - ! Koordinationszahl = 6 Cl mittlere Ebene - Na + NaCl-Ionengitter vordere Ebene 181 pm 102 pm reale Größenverhältnisse (1 pm = 10 -12 m) 9 Bindungskräfte Anziehung Abstoßung anziehende Kräfte > abstoßende Kräfte • Die anziehenden und abstoßenden Kräfte der Ionen wirken in alle Richtungen des Raums! • Der Abstand zwischen den ungleichartig geladenen Teilchen ist größer als zwischen den gleichartig geladenen! Netto-Anziehung • Die Bindung, die durch die Netto-Anziehung zwischen Kationen und Anionen entsteht, heißt Ionenbindung. • Verbindungen, bei denen eine Ionenbindung vorliegt, nennt man Ionenverbindungen oder Salze. • Salze entstehen oft bei der Verbindung von Metallatomen und Nichtmetallatomen, z.B. immer bei der Verbindung von Alkalimetallen mit Halogenen. 10 Das NaCl-Ionengitter Anziehung • Jedes Cl ist von sechs Na + umgeben, jedes Na+ von sechs Cl - ! Koordinationszahl = 6 • Die anziehenden und abstoßenden Kräfte der Ionen wirken in alle Richtungen des Raums! Abstoßung anziehende Kräfte > • Der Abstand zwischen den ungleichartig geladenen Teilchen ist größer als zwischen den gleichartig geladenen! abstoßende Kräfte Netto-Anziehung • Die Bindung, die durch die Netto-Anziehung zwischen Kationen und Anionen entsteht, heißt Ionenbindung. • Verbindungen, bei denen eine Ionenbindung vorliegt, nennt man Ionenverbindungen oder Salze. • Salze entstehen oft bei der Verbindung von Metallatomen und Nichtmetallatomen, z.B. immer bei der Verbindung von Alkalimetallen mit Halogenen. 11 Ende 12