Oxidationszahlen - bei EQIOOKI ••• eqiooki.de
Werbung
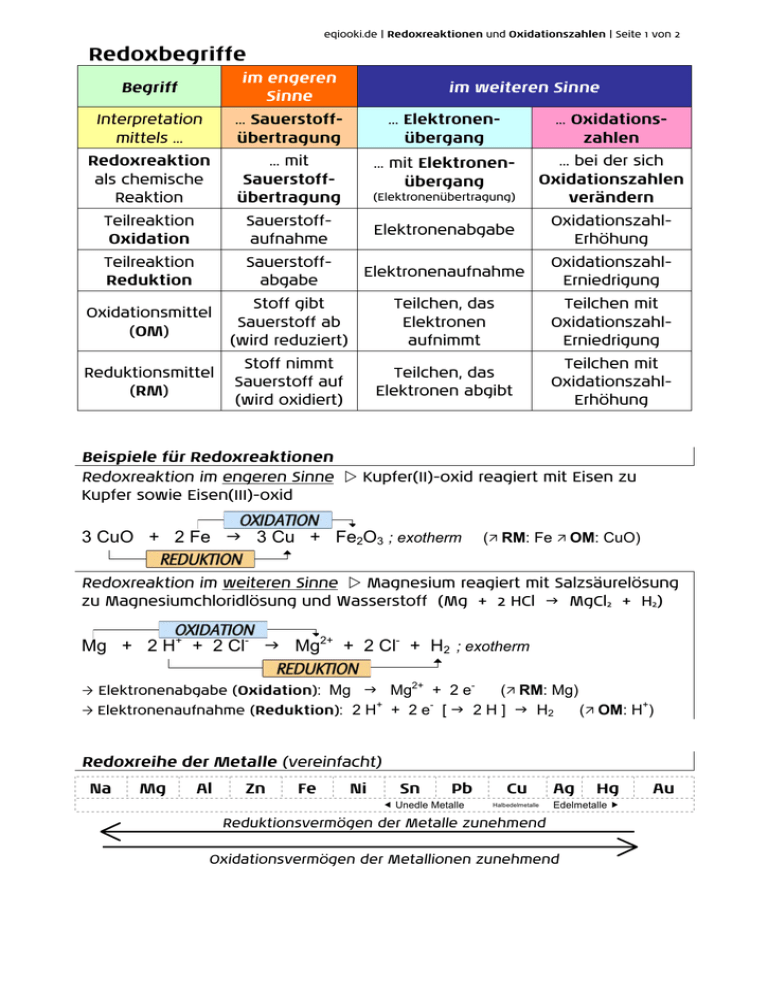
eqiooki.de | Redoxreaktionen und Oxidationszahlen | Seite 1 von 2 Redoxbegriffe Begriff im engeren Sinne Interpretation mittels ... ... Sauerstoffübertragung ... Elektronenübergang ... Oxidationszahlen Redoxreaktion als chemische Reaktion ... mit Sauerstoffübertragung ... mit Elektronenübergang ... bei der sich Oxidationszahlen verändern Teilreaktion Oxidation Sauerstoffaufnahme Elektronenabgabe OxidationszahlErhöhung Teilreaktion Reduktion Sauerstoffabgabe Elektronenaufnahme OxidationszahlErniedrigung Oxidationsmittel (OM) Stoff gibt Sauerstoff ab (wird reduziert) Teilchen, das Elektronen aufnimmt Teilchen mit OxidationszahlErniedrigung Reduktionsmittel (RM) Stoff nimmt Sauerstoff auf (wird oxidiert) Teilchen, das Elektronen abgibt Teilchen mit OxidationszahlErhöhung im weiteren Sinne (Elektronenübertragung) Beispiele für Redoxreaktionen Redoxreaktion im engeren Sinne w Kupfer(II)-oxid reagiert mit Eisen zu Kupfer sowie Eisen(III)-oxid 3 CuO + 2 Fe g 3 Cu + Fe2O3 ; exotherm (Ö RM: Fe Ö OM: CuO) Redoxreaktion im weiteren Sinne w Magnesium reagiert mit Salzsäurelösung zu Magnesiumchloridlösung und Wasserstoff (Mg + 2 HCl g MgCl2 + H2) Mg + 2 H+ + 2 Cl- g Mg2+ + 2 Cl- + H2 ; exotherm Mg g Mg2+ + 2 e(Ö RM: Mg) + Ò Elektronenaufnahme (Reduktion): 2 H + 2 e [ g 2 H ] g H2 (Ö OM: H+) Ò Elektronenabgabe (Oxidation): Redoxreihe der Metalle (vereinfacht) Na Mg Al Zn Fe Ni Sn Pb Unedle Metalle Cu Halbedelmetalle Ag Hg Edelmetalle Reduktionsvermögen der Metalle zunehmend Oxidationsvermögen der Metallionen zunehmend Au eqiooki.de | Redoxreaktionen und Oxidationszahlen | Seite 2 von 2 Oxidationszahlen Begriff w Oxidationszahlen kennzeichnen Art und Anzahl der Ladung von Teilchen unabhängig von der Bindungsart. Schreibweise w Es sind arabische oder römische Ziffern z.T. mit Vorzeichen üblich. Abhängigkeit w Oxidationszahlen hängen von Art und Anzahl der verbundenen Teilchen ab. Ò Erläuterungen zu einigen Beispielen w Magnesium erhält in Verbindungen die Oxidationszahl +2, da Magnesiumatome 2 Außenelektronen abgeben können und so 2-fach positiv geladene Ionen bilden. Wasserstoffmoleküle sind neutral und erhalten so Oxidationszahl 0. Wasserstoffionen einfach positiv geladen; daher bekommt Wasserstoff in Verbindungen allerdings immer die Oxidationszahl +1. Manchmal erhält die 0 auch den Zusatz ± 0. u Oxidationszahlen [OZ] und PSE Hauptgruppennummer = Differenz 8 – Hauptgruppe = größte OZ [+I ... +VII]; kleinste OZ I. bis III. Hgr. [–1 ... –3]; Anzahl positiver Ionenladungen I. bis IV. Hgr. kleinste OZ IV. bis VII. Hgr. [–4 ... –7]; Anzahl negativer Ionenladungen V. bis VII. Hgr. u Regeln ID Es gilt für ... ... die Festlegung: 1 freie Elemente [Elementsubstanzen] Oxidationszahl ist stets Null 2 Metalle in Verbindungen Oxidationszahl [positiv] = Wertigkeit = Ionenladung 3 Wasserstoff in Verbindungen Oxidationszahl stets +1 4 Sauerstoff in Verbindungen fast immer Oxidationszahl –2 5 einfache Ionen Oxidationszahl = Ladung 6 zusammengesetzte Ionen Summe der Oxidationszahlen = Ladung 7 ganzes Molekül bzw. Elementargruppe Summe aller Oxidationszahlen einer Verbindung ergibt Null 8 organische Moleküle [Stets (verkürzte) Strukturformel benutzen!] Summe der Oxidationszahlen je Atomgruppe ist Null [Eine Atomgruppe bilden alle Atome an einem C-Atom.] Beispiele Beispiel SO42-: -2 = 1·(+6)+4·(-2) Beispiel H2SO4: 0 = 2·(+1)+1·(+6)+4·(-2) Redoxreaktion w Reaktionsart, bei der sich Oxidationszahlen verändern Oxidation w Teilreaktion mit Oxidationszahlerhöhung Reduktion w Teilreaktion mit Oxidationszahlerniedrigung
