Bindungslehre Inhalte
Werbung

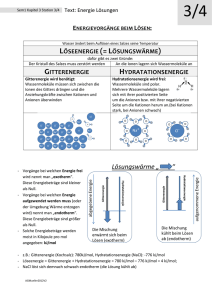
Bindungslehre Prof. Dr. S. Prys Chemie SSB @designed by ms Inhalte 1. 2. 3. 4. 5. 6. 7. Aggregatzustände und Phasen Physikalische und chemische Wechselwirkungen Kristalline Festkörper Amorphe Festkörper Flüssigkristalle Polymere Herstellung von Si-Wafern 1 1 Aggregatzustände und Phasen Fest Flüssig Gasförmig Geordnete Teilchenbewegung – ungeordnete Teilchenbewegung 1.2 Aggregatzustände Bose-Einstein-Kontinuum schmelzen fest fest flüssig verfestigen sublimieren resublimieren verdampfen flüssig gasförmig gasförmig kondensieren gasförmig ionisieren plasmatisch 2 1.2.1 Eigenschaften der Aggregatzustände • • • Gas - Unordnung – Geringe Dichte – Hohe Kompressibilität – Sehr geringer Formänderungswiderstand – Sehr geringe Wärmeleitfähigkeit Flüssigkeit - Nahordnung – Mittlere bis hohe Dichte – Geringe Kompressibilität – Geringer Formänderungswiderstand – Geringe Wärmeleitfähigkeit Festkörper - Fernordnung – Mittlere bis hohe Dichte – Geringe Kompressibilität – Hoher Formänderungswiderstand – Geringe bis hohe Wärmeleitfähigkeit 1.3 Phasendefinition Thermodynamische Phase = Materiebereich mit gleichen Eigenschaften Physikalische Eigenschaften Dichte, Farbe, Oberflächenglanz, Härte, Wärmeleitfähigkeit, elektrische Leitfähigkeit, Magnetisierbarkeit, Schmelztemperatur, Siedetemperatur, Erweichungsbereich, Verformbarkeit, optische Aktivität Chemische Eigenschaften Brennbarkeit, Löslichkeit, Verhalten gegenüber verschiedenen Chemikalien, Verhalten beim Erhitzen 3 1.3.1 Phasenarten • Homogene Phasen – Aggregatzustände eines reinen Stoffes (z.B. Wasser) • Homogene Mehrphasensysteme – Verschiedene Aggregatzustände eines reinen Stoffes (z.B. Wasser / Eis) • Heterogene Phasen – Verschiedener Stoffe, die sich nicht mischen (z.B. Wasser / Öl) im selben Aggregatzustand • Heterogene Mehrphasensysteme – Verschiedener Stoffe, die sich nicht mischen (z.B. Wasser / Holz) in verschiedenen Aggregatzuständen 1.3.2 Phasendiagramm 104 Homogenes Phasendiagramm H2O Kritischer Punkt 102 Flüssig • Tripelpunkt – 3 Phasen koexistent – 6.11 . 10-3 bar – 273.16 K • Kritischer Punkt – Dichte Wasserdampf = Wasser p [bar] 100 Fest 10-2 Dichte Tripelpunkt 10-4 Dampfförmig 10-6 -100 0 100 200 300 400 T [°C] 4 1.3.3 Stoffbegriff - Eigenschaften Stoffe mit ähnlichen Eigenschaften: • • • • • Metalle ... leiten elektrischen Strom und Wärme gut, sind leicht verformbar, haben im reinen Zustand Oberflächenglanz (erscheinen aber im feinverteilten Zustand schwarz) ... Nichtmetalle ... leiten den elektrischen Strom schlecht ... Salzartige Stoffe ... haben hohe Schmelz- und Siedetemperaturen, leiten als Schmelzen oder Lösungen den elektrischen Strom, sind spröde aber spaltbar ... Leichtflüchtige Stoffe ... haben niedrige Schmelz- und Siedetemperaturen, ... Makromolekulare Stoffe ... haben oft hohe Schmelz- und Siedepunkte, zersetzen sich aber meist schon bei niedrigeren Temperaturen (Beispiele: Kunststoffe, Proteine, Polysaccharide, DNA) 1.3.4 Stoffbegriff - GefStoffV 1 2 3 4 5 6 7 8 Reinstoffe sind einheitlich zusammengesetzt und mit physikalischen Methoden nicht in Bestandteile auftrennbar (Verbindungen oder Elemente). Zubereitungen sind aus mindestens zwei oder mehreren Stoffen bestehende Gemenge, Gemische oder Lösungen Mischungen von Stoffen entstehen wenn Flüssigkeiten mit anderen Flüssigkeiten oder Feststoffen vermischt werden, ohne dass dabei chemische Reaktionen oder Wärmetönungen auftreten Gemenge sind ungeordnete Gemische von beliebigen Reinstoffen in ihrer festen Form Legierungen sind Gemenge aus zwei oder mehr Metallen Lösungen zeigen bei Ihrer Herstellung häufig Wärmetönungen Dispersionen sind Gemenge aus mindestens zwei Stoffen, die sich nicht oder kaum ineinander lösen oder chemisch miteinander verbinden Emulsionen bestehen aus mindestens zwei miteinander nicht mischbare Flüssigkeiten 5 1.3.5 Stoffbegriff - Verbindungen Chemisches Element Unter einem chemischen Element versteht man einen Stoff, • der sich chemisch nicht mehr weiter in andere Stoffe zerlegen lässt und • der aus Atomen mit gleichen chemischen Eigenschaften aufgebaut ist. Chemische Verbindung Unter einer chemischen Verbindung versteht man einen Stoff, • der aus Atomen mehrerer verschiedener Elemente besteht und • einheitliche physikalisch-chemische Eigenschaften wie z.B. Schmelz- und Siedepunkt aufweist. 2 Physikalische und chemische Wechselwirkungen Physikalische Wechselwirkungen Intermolekulare Wechselwirkungen Festkörper, Flüssigkeiten (elektrostatisches Potenzial, Ladungsausgleich) Moleküle Chemische Wechselwirkungen Atome Interatomare Wechselwirkungen Moleküle (chemisches Potenzial, Streben nach Edelgaskonfiguration) 6 2.1 Wechselwirkungsarten Chemische Bindungen (Hauptbindungsarten) aufgefüllte Elektronenschalen Physikalische Wechselwirkungen (Nebenbindungsarten) elektrostatische Wechselwirkungen Atombindung 200 - 900 kJ / mol Ionenbindung bis einige 100 kJ / mol Metallbindung Van der Waals-Bindung 0,8 - 8,5 kJ / mol Dipol-Dipolbindung 4 - 25 kJ / mol Ion-Dipol-Wechselwirkung 40 - 680 kJ / mol Wasserstoffbrückenbindung 8 - 42 kJ / mol Komplexbindung 2.1.1 Chemische Bindungen homöopolare Bindung = Atombindung gleichmäßige Aufteilung von Elektronen ähnliche Elektronegativitäten heteropolare Bindung = Ionenbindung ungleichmäßige Aufteilung von Elektronen stark unterschiedliche Elektronegativitäten Elektronenmangelbindung = Metallbindung Allseitiger Mangel an Elektronen 7 2.2 Atombindungen Chemische Wechselwirkungen Atome Interatomare Wechselwirkungen Moleküle (chemisches Potenzial, Streben nach Edelgaskonfiguration) verschiedene Modelle: Elektronenpaarschreibweise Visualisierung der „Nutzungsrechte“ Elektronenpaarabstoßungsmodell Visualisierung der Molekülgeometrie in 3D VB- und MO- Methode Berechnung von Energiezuständen und Geometrieeigenschaften Welches sind die Elektronenkonfigurationen ? H N O F 8 2.2.1 Elektronenpaarschreibweise Elektronenpaare werden als Striche angegeben bindende Elektronenpaare nichtbindende Elektronenpaare Einzelne Elektronen werden als Punkte angegeben H ⋅ + ⋅H → H −H | NM + MN | → | N ≡ N | O: + :O → O=O | F ⋅ + ⋅F | → | F − F | H2 N2 O2 F2 2.2.2 Elektronenpaarabstoßungsmodell • Elektronenpaare = Raumladungswolken – symbolisiert in der Elektronenpaarschreibweise • Elektronenpaarabstoßung – COULOMB-Abstoßung zwischen Elektronenpaaren – maximales Ausweichen – maximale Raumausfüllung 9 2.2.2.1 2 Bindungspartner Bei Einfach- und Doppelbindungen ! AB2, z.B. CO2 2-wertig linear ∠180° 2.2.2.2 3 + 4 Bindungspartner AB3, z.B. BF3 3-wertig trigonal ∠ 120° AB4, z.B. CH4 , SiH4 4-wertig tetragonal ∠ 109,5 ° 10 2.2.2.3 5 + 6 Bindungspartner AB5, z.B. PF5 5-wertig trigonal bipyramidal AB6, z.B. SF6 6-wertig oktaedrisch 2.2.4 MO- Methode Molecular Orbital Theory Molekülorbitaltheorie Überlappung von Atomorbitalen führt zu Molekülorbitalen, die als „Elektronenwolken“ dargestellt werden können Elektronenkonfiguration H: 1s1 H+H s1 AO + H2 s1 σ2 AO MO 11 2.2.4.1 Atomorbitale s px dz2 dx2-y2 py dxy pz dyz dxz 2.2.5 σ - Bindungen Rotationssymmetrische Molekülorbitale + s1 s1 σ2 AO MO s-s σ-Bindungen z.B. H2 (E = - 436 kJ / mol) AO p1 s1 + AO AO p1 p1 + AO AO s-p σ-Bindungen σ2 z.B. HCl (E = - 431 kJ / mol) MO σ2 p-p σ-Bindungen z.B. Cl2 (E = - 242 kJ / mol) MO 12 2.2.6 π - Bindungen Nicht-Rotationssymmetrische Molekülorbitale z z π x+ x + π y AO π AO π y MO AO AO MO p-p π-Bindungen 2.2.6.1 Das Wasserstoffmolekül H2 Darstellung im Energieschema Darstellung als Orbitale E Elektronenkonfiguration H: 1s1 H+H H2: σ∗ AO AO H: 1s H: 1s s1 AO + H2 s1 σ2 AO MO H2: σ MO AO = Atomorbital, MO = Molekülorbital 13 2.2.6.2 Das Stickstoffmolekül N2 Darstellung im Energieschema σx∗ E pz py px πy∗ πy πz∗ πz px py pz |N≡N| (E = - 945 kJ / mol) σx σs∗ N: s2p3 σs N2 N: s2p3 AO MO AO 2.2.6.3 Das Sauerstoffmolekül O2 Darstellung im Energieschema σx∗ E pz py px πy∗ πy πz∗ πz px py pz O=O (E = - 626 kJ / mol) σx σs∗ O: s2p4 σs O2 O: s2p4 AO MO AO 14 2.2.6.4 Das Kohlenstoffatom C Elektronenkonfiguration: 1s2 2s2 2p2 C: 2px 2py 2pz C: 2s IV Hauptgruppe 4 wertig C: 1s 2.2.7 sp3 - hybridisierte Orbitale Elektronenkonfiguration: 1s2 2s2 2p2 (sp3)4 E IV Hauptgruppe 4 wertig (sp3) C: 2(sp3) 2 ( sp3 ) 2 ( sp3 ) 2 ( sp3 ) C: 1s Elektronenpaarabstoßungsmodell 15 2.2.7.1 C-C Einfachbindungen H H H H Es bildet sich eine σ-Bindung aus, z.B. C2H6 H H 2.2.7.2 Kohlenwasserstoffe H H Methan H H H H H H Ethan H Propan H H H H H H H H H Ethan Propan Butan Pentan Hexan Heptan 16 2.2.7.3 KW - Modelle Methan: CH3-H E = - 435 kJ / mol Schmp: - 182,5 °C Sdp: - 164 °C Erdgas Ethan: H3C-CH3 E = - 368 kJ / mol Schmp: - 172 °C Sdp: - 88,6 °C Hantelmodell Kalottenmodell KW = Kohlenwasserstoffe HC = hydro carbons 2.2.8 sp2 - hybridisierte Orbitale Elektronenkonfiguration: E 1s2 2s2 2p2 C: 2(sp2) 2 ( sp2 ) 2 ( sp2 ) 2p (sp2)3 p1 (sp2) C Elektronenpaarabstoßungsmodell C: 1s 17 2.2.8.1 C=C Doppelbindungen H H C C H H Es bildet sich eine σ- und eine π-Bindung aus, z.B. C2H4 H H C C H Ethen, Ethylen H2C = CH2 ECC = - 720 kJ / mol H 2.2.9 sp - hybridisierte Orbitale Elektronenkonfiguration: E 1s2 2s2 2p2 C: 2(sp) 2 ( sp ) 2p (sp)2 p2 2p C (sp) Elektronenpaarabstoßungsmodell C: 1s 18 2.2.9.1 C≡ ≡C Dreifachbindungen H C C H Es bildet sich eine σ- und zwei π-Bindungen aus, z.B. C2H2 Acetylen, Ethin H C C H-C≡C-H E = - 963 kJ / mol H 2.2.10 Resonanz • • • • O Oktette nicht aufteilbar Partielle Überschussladungen Schwingen zwischen Grenzformen ! Andere Bezeichnung: Mesomerie + + O O O - - O O 19 2.2.11 Beispiele H H H Salzsäure Wasser H H H H H Ammoniak H H Methan 2.2.11.1 Diamant Gitterstruktur und chemische Bindung bedingen Werkstoffeigenschaften ! Diamant • Extrem hart (Ritzen von Glas) • Kubisches Gitter • Alle C-Atome in σ-Bindungen • gewellte Schichten im Raumnetz • Verschiedene Farben • schmilzt bei ca. 3550 °C • ρ = 3,150 bis 3,513 g/cm3 • Wärmeleitfähigkeit gut • Halbleiter bis Isolator • Löst sich schlecht in Metallschmelzen • Diamant ↔ Graphit + 1,897 kJ http://www.reciprocalnet.org/common/browse/BrowseCM.html 20 2.2.11.2 Graphit Gitterstruktur und chemische Bindung bedingen Werkstoffeigenschaften ! Graphit • Weich, spaltbar • > 2500 °C plastisch verformbar • Hexagonale Kristallstruktur • Schichtstruktur – Alpha-Modifikation ABABAB – Beta-Modifikation ABCABCABC • • • • • • • Zwischen Schichten π-Bindungen Schwarze Farbe amorpher Graphit: ρ = 1,8 bis 2,1 g/cm3, kristalliner Graphit ρ = 1,9 bis 2,3 g/cm3. Wärmeleitfähigkeit schlecht Elektrische Leitfähigkeit vorhanden Löst sich gut in Metallschmelzen http://www.reciprocalnet.org/common/browse/BrowseCM.html 2.2.11.3.1 Graphitanwendungen • Erhitzen von Steinkohle – Kohleelektroden, Schmiermittel Koks • Unvollständige Verbrennung – besonders geringe Dichte: 1,85 g / cm3 – Schwärzungsmittel – Zusatzstoff für Autoreifen Ruß • • • • Sinterfreie Verkohlung Verkohlen von Thermoplaste Verkohlen von Duroplaste Verkohlen von geschäumten Kunststoffen Aktivkohle C - Fasern C - Glas C - Schaum 21 2.2.11.4 Fullerene Fullerene http://www.reciprocalnet.org/common/browse/BrowseCM.html • Fußballmolekül C60 • • • 30 Doppelbindungen kristallin, geringe Härte Zerfall oberhalb 1000°C • Elektronenstruktur zwischen Graphit und Diamant Halbleiter, Aufnahme von bis zu 6 Elektronen absorbiert Licht beliebige Rotationen möglich! • • 2.2.11.5 Diamantstrukturen Diamantgittertyp Härte (Mohs) C (Diamant) Si Ge ZnS Diamant 10 6,5 6 3,5 - 4 Si Polykristall Ge Mineral ZnS Mineral, Quelle: www.wikipedia.org 22 2.3 Ionenbindungen Metalle reagieren mit Nichtmetallen zu Salzen ! + Na ⋅ + ⋅ Cl | → Na + − Cl |− volle Schalen ! Ionen Na ⋅ + ⋅ Br | → Na + − Br |− Fr ⋅ + ⋅F | → Fr + − F |− 2.3.1 Ionenwechselwirkung Elektrostatische Wechselwirkungen Ladungen wirken allseitig regelmäßige Anordnung Kristallgitter Kation Anion 23 2.3.2 Ionengitter von Kochsalz ClNa+ 2.3.3 Gitterenergie Gitterenergie Die Energie, die frei wird, wenn sich aus gasförmigen Ionen ein Ionengitter bildet, bezeichnet man als Gitterenergie z.B. Na+(g) und Cl-(g) 24 2.3.3.1 Gitterenergie von NaCl & NaBr EGitter = EKat/An - (EKat + EAn) Eigenschaften von NaCl und NaBr Farbe: löslich in Wasser Schmelzpunkt: Siedepunkt: Gitterenergie: farblos bis weiß (Na+,Cl -) 808 °C 1465 °C (NaCl (g) ) 766 kJ / mol farblos bis gelblich (Na+,Br -) 747 °C 1393 °C 737 kJ / mol 2.4 Metallbindungen Metalleigenschaften • Keine Edelgasstruktur • Aufteilen aller Elektronen: "Elektronengas" • geringe Ionisierungsenergie • relativ große Atomradien • elektrische Leitfähigkeit + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + · Elektronen + Metallionen 25 2.4.1 Einteilung der Metalle Dichte Leichtmetalle ρ < 4 - 5 g/cm3 Schwermetalle ρ > 4 - 5 g/cm3 elektrochemische Spannungsreihe leicht oxidierbar: unedle Metalle schwer oxidierbar edle Metalle 2.5 Komplexbindungen Koordinationsbindung Zentralteilchen: Liganden: Zentralteilchen Liganden Metallatom oder –ion (Elektronenpaarakzeptor) Moleküle oder Ionen (Elektronenpaardonator) Häufig farbige Komplexverbindungen, z.B.: CuSO4 + H2O [Cu(H2O)6]2+ + SO42Weiss kationische Zentralionen: neutrale Zentralatome: Liganden: anorganische Liganden: organische Liganden: Blau Cu2+, Mg2+, Fe2+, Fe3+, Ni2+ Fe0, Cr0, Ni0 Anionen: Cl−, CN−, SCN−, Triphosphate neutral: H2O, NH3, CO, NO Kationen: NO+ Porphin-Ringsystem (z. B. Chlorophyll, Hämoglobin), einige Polycyclen (z.B. Alizarin, 8-Hydroxychinolin), Tartrate, Ethylendiamin, Pyridin, EDTA („Titriplex“), NTA 26 2.6 Übergangsformen zwischen Bindungsarten Atombindung Dipole Ionenbindung Atombindung Halbleiter Metallbindung 2.7 Dipole δ- δ+ Chlorwasserstoff HCl H EN = 2.1 Cl EN = 3.0 Elektrische Dipole: Elektronegativitätsdifferenz negative und positive Partialladungen fallen nicht zusammen Polarisierung des Moleküls Entstehung von Dipol-Dipol-Wechselwirkungen 27 2.7.1 Beispiele Wasser H2O Kohlendioxid CO2 δ− − δ+ H H δ+ Starker Dipol δ− δ+ δ− O C O kein Dipol ! 2.7.2 Dipol-Dipol-Kräfte Dipol-Dipol-Bindungen (z.B. H2O ED-D ~ 8 % Ekov) ∆EN > 0,5 – 1,4 + − + − + − schwächer als Wasserstoffbrückenbindungen Stärker als van-der Waals-Kräfte 28 2.7.3 Ion-Dipol-Kräfte Ion-Dipol-Bindungen (z.B. NaCl in H2O) Hydratation + − − + − + + + − + − − − + + − Kation + − Anion 2.8 Van der Waals-Kräfte induzierte Dipole schwache zwischenmolekulare Kräfte (EvdW ~ 1/100 Ekov) nehmen mit steigender Polarisierbarkeit zu ++ He (g) ++ ++ He (fl) Ursache fuer die Verfluessigung von He ! 29 2.9 Das Bändermodell für Halbleiter E Leitungsband Bandlücke > 3 eV Bandlücke 0.2 – 2.5 eV Valenzband Leiter Leitfähigkeit ~ 1/T Halbleiter Leitfähigkeit ~ T Nichtleiter 2.9.1 „Halbleiterbindung“ und Atombindung E Leitungsband 1σ∗ σ∗ 1s 1s 1σ σ Valenzband 30 2.9.2 Halbleiter Dotierung negative Ladung n – Dotierung positive Ladung p - Dotierung 2.9.3 Bändermodell – dotiert E E Leitungsband E Leitungsband Leitungsband Valenzband Valenzband < 3 eV Valenzband n - type p - type 31 2.9.4 Die Bandlücke • Eigenleitung (ohne Dotierung) nur bei höheren Temperaturen • Störstellenleitung – n Dotierung (5 / 4), Elektronenleitung, Donatoren – p Dotierung (3 / 4), Löcherleitung, Akzeptoren • Bandlücken: – Si – Ge 1,12 eV 0,72 eV 2.9.5 Mikroelektronik • • • • Integrierte Schaltung – Miniaturisierung von elektronischen Bauteilen – Signalprozessoren, Mikroprozessoren Wafer Photolithographische Verfahren Weitere Miniaturisierung: Nanoelektronik – Bauelemente durch wenige Atome oder Moleküle realisiert 32 2.9.6 Der pn-Übergang ohne äußeren Stromfluss P n Stromfluss bis Ferminiveaus von p- und n-Leiter ausgeglichen Ferminiveau gibt an, bis zu welcher Energie alle Zustände (am absoluten Nullpunkt, null Kelvin) besetzt sind. Es liegt in der Bandlücke 2.9.7 Der pn-Übergang äußerer Strom - Sperrrichtung - + P n Sperrbereich, kein Stromfluss Diode: griech.: dis zweifach; hodos Weg einfachstes Halbleiterbauelement 33 2.9.8 Der pn-Übergang äußerer Strom - Durchlassrichtung + P n Stromfluss für Gleichstrom Anwendung Diode: Gleichrichter, Wechselströme in Gleichströme umwandeln 2.9.9 Dioden Foto einer Auswahl von Dioden, ganz links: Brückengleichrichter speziellen Halbleiterdioden für unterschiedliche Einsatzzwecke: LED , Laserdiode , Zener-Dioden , Photodioden / Solarzellen Schottky-Dioden , Kapazitätsdioden oder Varaktoren Tunnel-Dioden , Supressordioden , Vierschichtdiode Thyristor , Avalanchediode , Lawinenphotodiode 34 3 Kristalline Festkörper < 5 % amorph – Gläser – Keramik – Kunststoffe > 95 % kristallin – Monokristalle – Polykristalle Nahordnung, hohe Viskosität Fernordnung 3.1 Kristalline Substanzen Elektronenkonfiguration • • • Bindungsart Festkörpertyp Metallkristalle (z.B. Au, Ag) - Metallbindung Salzkristalle (z.B. NaCl) - Ionenbindung Nichtmetallkristalle /Molekülkristalle - Atombindung (z.B. Si, C ) - Elektrostatische Kräfte (z.B. S8) - Elektrostatische Kräfte (z.B. H2O 35 3.2 Kristallmodelle Räumlich wiederkehrende Atomanordnung Darstellbar durch Elementarzellen Hantelmodell Kugelmodell 3.2.1.1 Kristalliner Schwefel Schwefelkristalle Inter - molekular Intra - molekular 36 3.2.1.8 NaCl Kristall Ionenkristall • Symmetrie • Gitterebenen • Ebenen höchster Atomdichte bestimmen die Kristallflächen NaCl fcc 3.2.1.9 Ionengitter von Kochsalz ClNa+ 37 3.3 7 Kristallsysteme 1. 2. 3. 4. 5. 6. 7. Kubisch Tetragonal Hexagonal Trigonal Orthorohombisch Monoklin Triklin 1 2 3 4 5 6 7 3.3.1 14 Bravaisgitter 38 Übungsfragen 1 1. 2. 3. 4. Welche Aggregatzustände kennen Sie ? Was versteht man unter Sublimation, bzw. Resublimation ? Nennen Sie ein Beispiel für ein homogenes Mehrphasensystem ! Welche Teilchenwechselwirkungen bezeichnet man als chemische Wechselwirkungen ? Erläutern Sie diese ! 5. Welche Teilchenwechselwirkungen bezeichnet man als physikalische Wechselwirkungen ? Erläutern Sie diese ! 6. Geben Sie in der Elektronenstrichschreibweise die Formeln für molekularen Stickstoff, Sauerstoff und Wasserstoff an ! 7. Welche räumlichen Strukturen haben H2O, CH4 und SF6 ? Übungsfragen 2 8. 9. 10. 11. 12. 13. 14. Was ist ein Dipol ? Erklären Sie die Dipolnatur des Wassermoleküls ! Erläutern Sie den Unterschied zwischen einem temporären und einem permanenten Dipol ! Beispiele ! Was versteht man unter Van-der-Waals Kräften ? Was für Arten von kristallinen Festkörperstrukturen kennen Sie ? Erläutern Sie die Strukturen vom Diamantkristall und vom Graphit Welches unterschiedlichen Eigenschaften resultieren daraus ? Was ist ein Fulleren ? Wie kann man sich Doppel- bzw. Dreifachbindungen erklären ? Geben Sie Beispiele ! 39 Übungsfragen 3 15. 16. 17. 18. Erläutern Sie die Charakteristika der Ionenbindung ! Was versteht man unter einer Komplexbindung ? Erläutern Sie die Charakteristika der Metallbindung ! Was ist ein Valenz-, bzw. Leitungsband ? Was versteht man unter dem Fermieniveau ? 19. Zeichnen Sie das Bändermodell für einen typischen Halbleiter. Wie groß ist die Bandlücke etwa ? 20. Warum leiten Metalle mit zunehmender Temperatur immer schlechter den elektrischen Strom ? Literatur • • • • J. Hoinkins; E. Lindner; Chemie für Ingenieure; Verlag: Wiley-VCH Verlag GmbH & Co. KGaA, 2007 P.W. Attkins; L. Jobnes; Chemie – einfach alles; Verlag: Wiley-VCH Verlag GmbH & Co. KGaA, 2006 Römpp‘s Chemie Lexikon DTV-Atlas zur Chemie 40 Web Links Nachchlagen: http://www.chemgapedia.de/vsengine/topics/de/vlu/index.html http://jmol.sourceforge.net/ Halbleiterchemie: http://www.ioffe.rssi.ru/SVA/NSM/ http://www.engr.sjsu.edu/WofMatE/Semiconductors.htm http://www.engr.sjsu.edu/WofMatE/Metals&Alloys.htm http://www.foresight.org/Conferences/MNT05/Papers/Gillett1/index.html http://www.si2.org/ 41