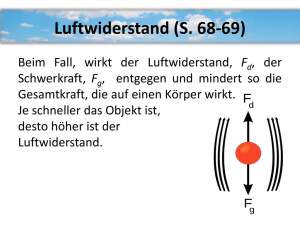
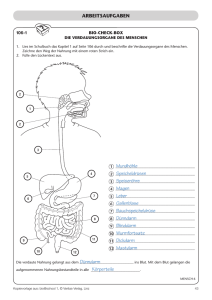
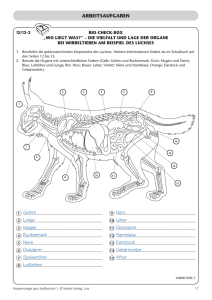
(a) Bestimmen
Werbung

Anorganische Chemie I Prof. Dr. A. Mezzetti Fragenkatalog II HS 2011 Aufgabe 1 Na2[Fe(CO)4] ist diamagnetisch. (a) Bestimmen Sie die Oxidationszahl und die Elektronenkonfiguration vom Eisen und die Elektronenzahl im Komplex (VE). [Fe(CO)4]2–: Fe(–2) d10 4 Liganden: 18 VE (b) Bestimmen Sie die Struktur des Komplexes anhand der Valenzstruktur-Theorie! 2– CO L L L L OC OC s p3 (c) Zu welcher Punktgruppe gehört der Komplex? Fe CO Td Aufgabe 2 Der Komplex [Co(CH3)(PMe3)3] ist diamagnetisch. (a) Bestimmen Sie die Oxidationszahl und die Elektronenkonfiguration vom Cobalt und die Elektronenzahl im Komplex (VE). [Co(CH3)(PMe3)3]: Co(I) d8 4 Liganden: 16 VE (b) Bestimmen Sie die Struktur des Komplexes anhand der Valenzstruktur-Theorie! L L L L Me3P Me3P d s p2 (c) Zu welcher Punktgruppe gehört der Komplex? Co PMe3 CH3 C2v Aufgabe 3 Der Komplex [CoCl2(PPh3)2] besitzt 3 ungepaarte Elektronen. (a) Bestimmen Sie die Oxidationszahl und die Elektronenkonfiguration vom Cobalt und die Elektronenzahl im Komplex (VE). [CoCl2(PPh3)2]: Co(II) d7 4 Liganden: 15 VE (b) Bestimmen Sie die Struktur des Komplexes anhand der Valenzstruktur-Theorie! Cl L L L L s p3 (c) Zu welcher Punktgruppe gehört der Komplex? tetraedrisch Ph3P Ph3P Co Cl C2v (Wenn die Konformation der Phenylresten vernachlässigt wird) Aufgabe 4 (a) Bestimmen Sie die Punktgruppe folgender Komplexe! Die Konformation der Phenylreste soll vernachlässigt werden. (b) Bestimmen Sie die Oxidationszahl und die Elektronenkonfiguration des Metalls und die Elektronenzahl im Komplex (VE). PPh3 Ph3P PPh3 Ru H H PPh3 C2v Ru(II), d6, 18 VE PPh3 Ph3P H Ir Ph3P H PPh3 PPh3 D4h Ir(III), d6, 18 VE H PPh3 H Ir PPh3 H C2v Ir(III), d6, 18 VE H Ph3P Ph3P Ph3P Cl Co PPh3 Cl Pd Cl 2– Cl Cl D3h Co(II), d7, 17 VE D4h Pd(II), d8, 16 VE PPh3 PPh3 C3v Co(I), d8, 18 VE Cl Ph3P Co H Cl Ph3P Ir PPh3 Ph3P CO Ph3P C2v Ir(I), d8, 16 VE Ru PPh3 PPh3 C4v Ru(II), d6, 16 VE