Der Feinbau des Atoms - Digitale Schule Bayern
Werbung

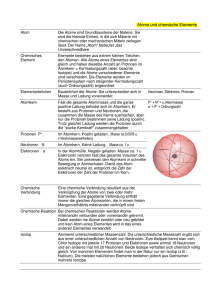
Der Feinbau des Atoms 1. Schalte den Computer an und öffne den Internet Explorer. Für die heutige Stunde benötigen wir den Inhalt der Seite: http://www.uni-bonn.de/iap/P2K/waves_particles/wavpart2.html Einen Teil der Bausteine eines Atoms haben wir bereits kennen gelernt: die Träger der negativen Ladung. Es sind dies beinahe masselose Teilchen, die einfach negativ geladen sind, die sogenannten Elektronen (e-). Wir wissen zudem, dass der Atomkern positiv geladen ist und dass Teilchen gegensätzlicher elektrischer Ladung sich anziehen. Warum fällt nun das Elektron nicht in den Atomkern? Löse dieses Rätsel mithilfe des interaktiven Elements auf der angegebenen Internetseite! Lösung: __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________________________________ 2. Lies Dir den beigelegten Text über den Atombau durch und beantworte die folgenden Fragen! a) Was sind Nukleonen? __________________________________________________________________________________ b) Warum stoßen sich die Protonen im Atomkern nicht ab, obwohl sie die gleiche Ladung tragen? __________________________________________________________________________________ __________________________________________________________________________________ b) Welche Elementarteilchen geben eine Auskunft darüber, um welches Element es sich handelt? __________________________________________________________________________________ c) Was ist ein Isotop? __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________________________________ d) Warum kann man Isotope nur sehr schwer voneinander unterscheiden? __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________________________________ e) Gib Beispiele für Isotope an! __________________________________________________________________________________ 3. Entwirf in Partnerarbeit ein Memory-Spiel zum Thema Atombau und Isotope. Zeichnet hierzu auf mindestens 16 Kärtchen ein Atom nach dem Rutherford’schen Modell mit der jeweiligen Anzahl Protonen, Neutronen und Elektronen. Gebt auf einem zugehörigen MemoryKärtchen das jeweilige Elementsymbol mit Nukleonen- und Kernladungszahl an. Klebt die Kärtchen anschließend auf Karton und schneidet sie aus. Der Atombau Nahezu die gesamte Masse eines Atoms konzentriert sich im sogenannten Atomkern, der positiv geladen ist. Dabei beträgt der Durchmesser eines Atomkerns etwa 10-15 m, also nur etwa 1/100000 des gesamten Atomdurchmessers! Der restliche Teil des Atoms, die annähernd masselose Atomhülle, enthält negativ geladene Elektronen, die den Atomkern umkreisen, so dass das gesamte Atom nach außen hin elektrisch neutral ist. Der Atomkern besteht – wie seit 1932 bekannt – aus zweierlei Elementarteilchen: es sind dies positiv geladene Protonen (Symbol: p+) und ungeladene Neutronen (Symbol: n). Letztere sorgen für eine Stabilität des Atomkerns, indem sie sich zwischen den Protonen befinden und damit die Ladungen der Protonen voreinander „abschirmen“. So verhindern die Neutronen, dass sich die Protonen trotz ihrer gleichen Ladung gegenseitig abstoßen, obwohl sie sich im Atomkern sehr nahe beieinander befinden. Beide Elementarteilchen werden unter dem Überbegriff Nukleonen (= „Kernteilchen“) zusammengefasst. In der Atomhülle befindet sich nur eine Sorte Elementarteilchen: die Elektronen (Symbol: e-). Die Ladung eines Elektrons entspricht der eines Protons, allerdings tragen beide Elementarteilchen natürlich entgegengesetzte Ladungen, sprich, die Ladungen unterscheiden sich durch das mathematische Vorzeichen. Die Ladung eines Elektrons beträgt etwa -1,6 · 10-19 C. Diesen Wert bezeichnet man als die Elementarladung eines Elektrons. Die Protonenzahl bestimmt die Ladung des Kerns (= „Kernladungszahl“). Damit ein Atom also nach außen hin elektrisch neutral ist, muss die Anzahl der Elektronen in der Atomhülle gleich der Anzahl der Protonen im Kern sein. Die KERNLADUNGSZAHL Z findet man im Periodensystem (Vorderseite) als tiefgestellte Zahl vor dem Elementsymbol. So besitzen Wasserstoffatome ein Proton, Heliumatome zwei Protonen und Lithium drei Protonen im Kern etc. Man könnte also auch folgende Schreibweise für diese Beispielselemente wählen: … 1H 2He 3Li 92U etc. Die Massen der Elementarteilchen betragen: m(n) = 1,009 u; m(p+) = 1,007 u; m(e-) = 0,00055 u Da die Masse eines Elektrons verschwindend gering ist, ergibt sich die Masse eines Atoms aus der Zahl der Kernteilchen, also der NUKLEONENZAHL A. Diese wird im Periodensystem (Vorderseite) als hochgestellte Zahl vor dem Elementsymbol angegeben. So gibt 126C an, dass sich im Kern des Kohlenstoffatoms 6 Protonen (Z = 6) und 6 Neutronen (A – Z = 6) befinden. Rundet man die Masse eines Kernteilchens auf 1u, so beträgt die Atommasse von 12 6C folglich annähernd 12u. Nun kommen aber im natürlichen Kohlenstoff – wenngleich sehr selten – unter anderem auch Kohlenstoff-Atome vor, die etwa 13u oder gar 14u wiegen, also etwas schwerer sind. Trotz dieser unterschiedlichen Massen wird den Atomarten das gleiche Elementsymbol zugeordnet, da sie in ihrem chemischen Verhalten nahezu gleich sind. Die unterschiedlichen Atomarten desselben Elements werden als ISOTOPE dieses Elements bezeichnet, das Phänomen an sich wird ISOTOPIE genannt. Der Massenunterschied entsteht durch zusätzliche Neutronen im Atomkern. Isotope werden durch die Nukleonenzahl eindeutig gekennzeichnet, so zum Beispiel: 126C, 136C und 146C. Nur 22 Elemente besitzen keine natürlichen Isotope und kommen als sogenannte Reinelemente vor, die nur eine einzige Atomart besitzen. Zu ihnen zählen zum Beispiel Aluminium und Gold. Die Mehrzahl der Elemente besteht jedoch als sogenannte Mischelemente aus mehreren Atomarten (Isotopen). So kennt man neben 73Li auch 63Li. Auch Wasserstoff besitzt Isotope: 11H, 21H (auch 21D für Deuterium) und 31H (auch 31T für Tritium). Beim Kohlenstoff kennt man isotope Kohlenstoffatome mit Nukleonenzahlen zwischen 9 und 16. Von diesen sind nur die Isotope 126C und 136C stabil, die anderen sind radioaktiv. Die Isotopie des Kohlenstoffs ist auch der Grund dafür, warum die Atommasseneinheit u nicht auf „den Kohlenstoff“ sondern auf das Isotop 126C oder C-12 bezogen wird. Memory-Kärtchen (Vorlage): …