26. Januar 2006
Werbung

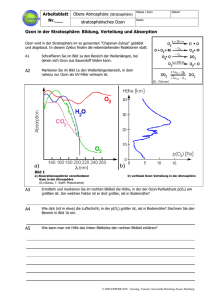
Gliederung der Vorlesung 1. Chemische Zusammensetzung der Atmosphäre 2. Auswirkungen auf physikalische Prozesse der Erdatmosphäre 2.1 Fluchtgeschwindigkeit 2.2 Vertikalprofil der Temperatur 2.3 Treibhauseffekt 2.4 Einfluss der Dynamik auf Verteilung von Spurenstoffen 3. Chemische Grundlagen 3.1 Allgemeine Grundlagen 3.2 Photochemie 3.2.1 Photodissoziation 3.2.2 Photoionisation 3.3 Reaktionskinetik 4. Chemie der Stratosphäre 4.1 Sauerstoffchemie 4.2 Katalytische Abbauzyklen 4.3 Antarktisches Ozonloch 4.4 Ozontrends 4.5 Ozonmessungen? 5. Chemie der Troposphäre 4.1 Bedeutung des OH-Radikals 4.2 Photosmog und Ozon 4.3 Saurer Regen 6. Umweltchemische Modelle Lerninhalte 9. Vorlesung Was ist der Chapmann-Zyklus? Was bedeutet die ungrade Sauerstofffamilie? Welche Lebensdauer haben O3 und O in der Stratosphäre? Welche katalytischen Abbauzyklen des Ozons gibt es? Wo hat Ozon sein Maximum? Was ist ein Dobson-unit? Wie ist Wasserdampf in der Stratosphäre verteilt? Was sind die Reservoirgase? Wie ist die Temperaturabhängigkeit von Reaktionen 2. und 3.ter Ordnung? In welcher Höhe ist der Chlorzyklus besonders bedeutsam? Temperaturabhängigkeit NO + O3 → NO2 + O2 O + O2 + M → O3 + M NOx = 2.0 x109 Molek./cm3. 21. März am Äquator (Zenit p= 2 hPa (~40 km) Vertikale Variation des katalytischer Ozonabbau Katalytischer Ozonabbau nach Brasseur Quellgase Radikale Reservoirgase 4.3 Antarktisches Ozonloch Polares Ozon Antarktis vs Arktis Woher resultiert das Ozonloch? Ozonabbau findet in der Antarktis zwischen 10-25 km statt Flugzeugmessungen (ER-2) zeigen stark erhöhte ClO Konzentration in polarer Stratosphäre Würde der Ozonabbau durch den ClOx Zyklus bewirkt, würde der Abbau vorallem in den mittleren und niedrigen Breiten und in Höhen zwischen 35 und 45 km auftreten Für den ClOx Zyklus werden O Atome benötigt, aber in der polaren Stratosphäre ist die Elevation der Sonne so niedrig, dass im wesentlichen keine Photodissoziation von O2 stattfindet. ClOx Abbaumechanismus erklärt Ozonloch nicht! Korrelation Ozonabbau/Chlormonoxid Polare stratosphärische Wolken (PSC) Abbau des Ozons beschränkt sich auf Höhen von 12-25 km Korrelation des Ozonabbaus mit Auftreten von PSC Polare Stratosphärische Wolken Ozonabbau nach Molina&Molina[87] Rapider Ozonabbau 2(Cl + O3 → ClO + O2 ) ClO + ClO + M → Cl2O2 + M katalytischer ClO-Dimer Mechanismus nach Molina&Molina [1987] Cl2O2 + hν → Cl + OClO OClO + M → Cl + O2 + M netto : 2O3 + hν → 3O2 Cl + O3 → ClO + O2 Br + O3 → BrO + O2 BrO + ClO → Br + OClO OClO + M → Cl + O2 + M netto : 2O3 + hν → 3O2 keine Sauerstoffatome nötig verursacht ca. 75 % des rapiden Ozonabbaus im Ozonloch Kopplung von Chlor- und Bromzyklus Mc Elroy et al. [1986] und Tung et al. [1986] verursacht ca. 20 % des rapiden Ozonabbaus im Ozonloch Woher kommt das freie Chlor? Heterogene Chemie Reaktion zwischen Stoffen verschiedener Phase Reaktionen an der Oberfläche polarer stratosphärischer Wolken Heterogene Reaktionen N 2O5 ( g ) + H 2O( f ) → 2 HNO3 ( f ) N O ( g ) + H O( f ) → 2 HNO ( f ) 2 5 (g) + H 2 O ( f ) → HNO (3 f ) + HOCl ( g ) ClONO 2 2 3 HOCl ( g ) + HCl ( f ) → H 2O( f ) + Cl2 ( g ) ClONO2 ( g ) + HCl ( f ) → HNO3 ( f ) + Cl ( g ) N 2O5 ( g ) + HCl ( f ) → HNO3 ( f ) + ClNO2 ( g ) Wie wird ClO-Dimer Zyklus gestoppt? Eispartikel schmelzen, so daß HNO3 wieder gasförmig vorliegt HNO3 + hν → OH + NO2 NO2 + ClO → ClONO2 g – gas f – fest Besondere Bedingungen Während der Polarnacht erreicht kein Sonnenlicht den Pol. In der unteren und mittleren Stratophäre entwickelt sich eine starke zirkumpolare Strömung – der Polarwirbel (polar vortex) Im Winter und Anfang des Frühjahrs ist der Polarwirbel extrem stabil und separiert die Luft innerhalb des Wirbels von den mittleren Breiten Als Resultat kann die Luft innerhalb des Wirbels in 15-20 km Höhe kälter als 183 K (-93oC) werden, so daß polare stratosphärische Wolken (reine Eiswolken) gebildet werden können Die Stratosphäre enthält zwischen 12 und 30 km eine natürliche Aerosolschicht. Bildung von PSC's Wenn die Temperatur unter 193 K fällt, bilden sich PSC Typ I, die aus Salpetersäure-Trihydrat bestehen (HNO3·3H2O). Nitric acid trihydrate (NAT) Bei Temperaturen unter ca. 183 K können Eiswolken entstehen (PSC Typ II), in denen Salpetersäure gelöst ist. PSC beschleunigen den ClO-Zyklus durch Denitrifikation: gasförmiger Stickstoff (auch aus Reservoiren) wird in PSC gebunden. Werden PSC größer, können sie sedimentieren und Stickstoff irreversibel aus Stratosphäre entfernen Beobachtungen 17. September 1992 UARS Upper Atmospheric Research Satellite Θ=460 K Microwave Limb Sounder (MLS) Cryogenic Limb Array Etalon Spectrometer (CLAES) Ozonloch-Schema zeitliche Entwicklung 4.4 Ozon in der Arktis Temperaturen SH/NH Ozonverluste in der Arktis Durch unterschiedliche Land/Meerverteilung und Orographie gibt es mehr Wellenstörungen auf der Nordhalbkugel, die zu einem wärmeren, weniger symmetrischen Polarwirbel führen. Gleichzeitiges Auftreten von kalten Temperaturen und Sonnenlicht ist in der Arktis viel seltener und Ozonabbau findet nur in einzelnen Episoden statt. Ozon in der Arktis Potentielle Vorticity (PV) 4.5 Ozontrends Ozon nimmt nicht nur in den polaren Breiten ab. WMO 60S - 60N 1979-1995 Ozontrend in der Schweiz Ozon nimmt nicht nur in den polaren Breiten ab. Natürliche Einflüsse aufs Ozon Variation der solaren Einstrahlung beeinflusst Photochemie - 11,5 jähriger Sonnenfleckenzyklus - einzelne Ausbrüche Quasi-biennalle Oszilation (QBO) Vulkanausbrüche 27-tägige Rotationsperiode der Sonne Sonnenfleckenzyklus Sonnenfleckenmaxima → viele dunkle Flecken → aktive Sonne höherer UV Output der Sonne (8 % Anstieg bei 200 nm; 0.2 % bei 300 nm) Strahlung mit Wellenlängen <240 nm bestimmen O2 Photolyse; Strahlung mit Wellenlängen zwischen 240 und 320 nm bestimmen O3 Photolyse Höhere Produktion von Ozon über O2+O → O3 als Verluste durch vermehrte Ozon-Photolyse durch vermehrte UV Strahlung Bei vermehrter Sonnenfleckenzahl gibt es vermehrt Ozon in der oberen Stratosphäre. Aerosolgehalt der Stratosphäre Modellierung des Ozontrends Modelle zur Vorhersage der Ozonkonzentration enthalten: Strahlungsroutinen externes Forcing für Photochemie, langwellige Austrahlung Gasphasenchemie Emissionen (Szenarien) der verschiedenen Quellgase, Konversion zu Reservoirgasen, Aktivierung von Radikale Heterogene Chemie Betrachtung von Aerosolen; Bildung von PSC atmosphärische Dynamik Transporte und Vermischung der verschiedenen Gase (unterschiedliche Lebenszeiten); Temperaturverteilung kritisch für Reaktionsraten Kopplung der Problematik des Treibhauseffekts und des Ozonabbaus durch Umstellung von Zirkulationen und Temperaturverteilung Modellierung des Ozontrends ( ) ( ) r r ∂X dX r r = − v ⋅ ∇ X = ∑ Pi − ∑ Li − v ⋅ ∇ X ∂t dT i i Produktion P Ox Verluste L Transporte τtrans > τchem Ox τtrans ~ τchem Ox τtrans > τchem Ox Verschiedene Modelle Boxmodelle isolierte Luftmasse in einer abgeschlossenen Box Modellierer bestimmt Anzahl der Gase und der Reaktionen Berechnung des photochemisches Gleichgewicht bei gegebener solarer Einstrahlung innerhalb der Box (Konzentration der Gase ist konstant) Berechnung der zeitliche Entwicklung der verschiedenen Komponenten Sensivitätsstudien bzgl. Störungen der Anfangsbedingungen Boxmodell Boxmodelle mit Tagesgang solare Einstrahlung variiert entsprechend einer vorgebenen geographischen Breite, Tageszeit und Datum Nachteil: Da Boxmodelle keine Advektion und Vermischung mit anderen Luftmassen enthalten sind sie nur für die Betrachtung kürzerer Zeiträume oder für prinzipielle Gleichgewichtsstudien relevant Boxmodelle werden vornehmlich zur Interpretation von Beobachtungen genutzt Beispiel: Boxmodelle Genauigkeit der Photolyseraten kann überprüft werden Beispiel: Boxmodelle Verschiedene Modelle Trajektorienmodelle Boxmodell, bei dem sich das Luftpaket entlang eines realistischen Weg (Trajektorie) durch die Atmosphäre bewegt Informationen über den Weg des Pakets (Zeit, Position) können aus meteorologischen Vorhersagemodellen abgeleitet werden zusätzlich können zu jedem Zeitpunkt andere äußere Gegebenheiten (Temperatur, Druck) berücksichtigt werden Nachteil: Auch im Trajektorienmodell wird keine Vermischung mit anderen Luftmassen berücksichtigt. Nutzung nur für wenige Tage möglichh Trajektorienmodelle werden genutzt - um die Historie einer Luftmasse zu untersuchen - um Beobachtungen an verschiedenen Orten zu kombinieren Beispiel: Trajektorienmodell Verschiedene Modelle 2D Modelle Plot 12.07 Höhe Breite Annahme zonal symmetrischer Strömungen, Abhängigkeit von der geographischen Länge wird vernachlässigt enthält Strahlungs- und Chemiemodul, die Berechnungen für jeden Gitterpunkt durchführen Dynamik advehiert Luftmassen in der Vertikalen und in der Breite Diffussive Transporte durch die Residuumszirkulation Nachteil: Nur 3D-Modelle erlauben umfassende Vergleiche. Diese sind sehr Rechenzeitintensiv. 2D-Modelle werden genutzt - um Verständnis der vertikalen und zonalen Verteilung von Spurengasen zu testen - um die Wirkung anthropogener und natürlicher Störungen zu testen Beispiel: 2D-Modelle Beispiel: 2D-Modelle