Behandlungsstrategie bei Lymphomen im höheren Alter
Werbung

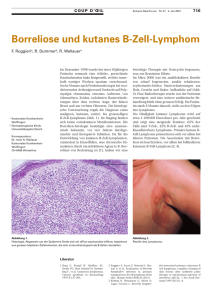
CME cm e. mg o -f ac h v erl a ge e .d Behandlungsstrategie bei Lymphomen im höheren Alter K. Hohloch, F. Zettl Hämatologie und Onkologie, Kantonsspital Graubünden Chur, Chur Hämatologie/Onkologie und Palliativmedizin, Klinikum Traunstein, Traunstein Lymphome – ältere Patienten – Diagnose – Therapie internistische praxis 56, 483–501 (2016) Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG internistische praxis 2016 Band 56 / 3 Einleitung Die Lebenserwartung in Deutschland ist in den letzten Jahrzehnten deutlich gestiegen, laut statistischem Bundesamt liegt für 2015 die Lebenserwartung neugeborener Jungen bei 77 Jahren und 9 Monaten, für neugeborene Mädchen bei 82 Jahren und 10 Monaten. Nach einer Schätzung der International Agency for Research on Cancer (IARC) wird mit einer deutlichen Zunahme der Krebserkrankungen, insbesondere der Menschen über 65 Jahre gerechnet. Zur Zeit sind 62 % aller neu an Krebs erkrankten Patienten über 65 Jahre, in der Zukunft werden laut Schätzung über 73 % der neu an Krebs erkrankten Patienten über 65 Jahre sein [1]. Daher ist mit einem starken Anstieg von insbesondere älteren Patienten mit Krebserkrankungen und Lymphomen zu rechnen. Inzidenz und Epidemiologie Lymphome treten mit einer Inzidenz von 19,7 pro 100.000 Einwohner pro Jahr auf, Männer erkranken etwas häufiger als Frauen, das Erkrankungsrisiko steigt mit zunehmendem Alter. Der Erkrankungsgipfel liegt bei 65 – 74 Jahren, das mediane Alter bei Diagnosestellung beträgt 66 Jahre ( Abb. 1). Ursachen dafür sind die mit dem Lebensalter kumulierenden chromosomalen Veränderungen bzw. Mutationen. Diese Mutationen führen entweder zum Verlust von Tumorsupressorgenen und/oder zur Aktivierung von Onkogenen, somit können die Zellen zum Beispiel einen Wachstumsvorteil bekommen und ungehemmt proliferieren, oder durch Hemmung der Apoptose (= Zelltod) dem an sich vorgesehenen aktiven Zelltod entkommen. Die Reparaturmechanismen für diese Mutationen werden im Alter ineffizienter mit daraus resultierender altersbedingter Zunahme der Lymphominzidenz. Klassifikation Lymphome stellen eine heterogene Gruppe von Erkrankungen dar, die sowohl aus B- wie auch aus 483 Prozentanzahl neue Erkrankungen Abb. 1 | Lymphom-Inzidenz abhängig vom Alter (SEER Database 2006 – 2010) 30 25 22,8 % 20,4 % 20 15 22,4 % 13,5 % 9,2 % 10 6,3 % 5 0 1,7 % 20 3,8 % 20 – 34 35 – 44 45 – 54 55 – 64 Alter 65 – 74 75 – 84 84 PMLBCL Diffuse large B-cell 37 % Follicular 29 % MALT lymphoma 9 % CLL/SLL DLBCL MCL Mantle cell lymphoma 7 % CLL/SLL 12 % Primary med large B-cell 3 % High Grade B, NOS 2,5 % Abb. 2 | B-NHL Häufigkeits­ verteilung (WHO Classification of Tumours of ­Haematopoetic and Lymphoid Tissues, 4th Edition, 2008) MALT Burkitt 0,8 % FOLLICULAR LYMPHOMA T-Zellen hervorgehen können. Die B-Zell-Lymphome sind mit 85 % die am häufigsten auftretenden Non-Hodgkin-Lymphome (NHL), wohingegen die T-Zell-Lymphome nur einen kleinen Teil ausmachen (15 %). Die B-Zell-Lymphome zählen damit zu den 6 häufigsten Tumoren in der Welt und den am häufigsten vorkommenden hämatologischen Tumoren [2]. Lymphome werden in »indolente« bzw. »niedrigmaligne« und »aggressive« bzw. »hochmaligne« Lymphome in Abhängigkeit von ihrem klinischen Verhalten und morphologischen Charakteristika eingeteilt. Die aktuell geltende WHO-Klassifikation 484 Splenic marginal zone 0,9 % Nodal marginal zone 2 % Lymphoplasmacytic 1,4 % wurde zuletzt 2008 erneuert [3]. Im Erwachsenenalter kommen die DLBCL (Diffuse large B-cell) mit 37 % am häufigsten vor, gefolgt von den follikulären Lymphomen (FL) mit 29 %. Die restlichen Prozentpunkte verteilen sich auf die MALT (9 %), Mantelzelllymphome (7 %), CLL/SLL (12 %), primäre mediastinale Lymphome (3 %), aggressive B-Zell-Lymphome »not otherwise specified« (2,5 %), Burkitt-Lympome (0,8 %), splenische Marginalzonenlymphome (0,9 %), nodale Marginalzonenlymphome (2 %) und die lymphoplasmozytische Lymphome mit 1,4 % [4] ( Abb. 2). 2016 Band 56 / 3 internistische praxis Klinik Stadieneinteilung und Prognosefaktoren Die klinische Manifestation variiert aufgrund der Heterogenität der Lymphome stark und ist abhängig vom histologischen Subtyp. Während die indolenten Lymphome häufig einen asymptomatischen Verlauf nehmen und lange unentdeckt bleiben können, zeigen die aggressiven Lymphome einen rasch progredienten Krankheitsverlauf mit zum Teil ausgeprägten Begleitsymptomen. Die ersten Symptome sind – bis auf die Lymphknotenschwellung, die meistens nicht schmerzhaft ist – oft unspezifisch. B-Symptome (Fieber, Gewichtsverlust, Nachtschweiß) treten nur in ca. 20 % aller Fälle auf. Weitere Symptome sind Müdigkeit, Abgeschlagenheit, Appetitlosigkeit, Übelkeit und Infektanfälligkeit. Eine Infiltration (Befall) der Haut ist bei Non-Hodgkin-Lymphomen möglich, auch Leber und Milz sind häufiger betroffen. Im Fall einer Knochenmarkinfiltration des Lymphoms mit Verdrängung der normalen Hämatopoese kann es zu Blutbildveränderungen mit der Ausbildung einer Anämie mit konsekutiver Müdigkeit, einer Thrombozytopenie mit Blutungsneigung und einer Leukopenie mit Infektneigung kommen. Die Stadieneinteilung erfolgt in vier Stadien (I – IV) anhand der Ann-Arbor-Klassifikation [5]. Dabei werden die vier Stadien abhängig vom Befallsmuster der Lymphknoten und ihrer Lage zum Zwerchfell unterschieden. Zusätzlich wird ein extranodaler Befall (E), ein Milzbefall (S) und das Vorliegen (B) bzw. das Fehlen von B-Symptomen (A) (Fieber 38 °C an 3 aufeinanderfolgenden Tagen, Gewichtsverlust 10 % des Körpergewichtes in den letzten 6 Monaten, Nachtschweiß) in die Stadieneinteilung aufgenommen [6] ( Tab. 1). Bei Vorliegen eines Lymphknoten- bzw. Lymphombefalls 7,5 cm spricht man von einem Bulk. Prognosefaktoren lassen sich in patientenabhängige Faktoren (Alter, Begleiterkrankungen), Faktoren die durch das Lymphom bedingt sind (Stadium, Proliferationsindex, Tumorlast, extranodale Beteiligung) sowie in Faktoren, welche die Aggressivität des Tumors widerspiegeln (LDH), unterteilen. Prognosescores wurden zunächst für die aggressiven Lymphome anhand von fünf einfach zu erhebenden klinischen Para­metern entwickelt: Stadium Befallsmuster der Lymphknoten I Befall von nur einer Lymphknotenregion II1 Befall von zwei benachbarten Lymphknotenregionen auf nur einer Seite des Zwerchfells, also entweder oberhalb oder unterhalb II2 Befall von zwei nicht benachbarten oder mehr als zwei benachbarten Lymphknotenregionen ­entweder oberhalb oder unterhalb des Zwerchfells III Befall von Lymphknotenregionen oberhalb und unterhalb des Zwerchfells IV diffuser oder disseminierter Befall von Lymphknoten und extralymphatischen Geweben E S A/B Für den Befall extralymphatischer Organe Für den Milzbefall (A) keine B-Symptome, (B) B-Symptome (Fieber, Gewichtsverlust, Nachtschweiß) Tab. 1 | Ann-Arbor-Stadien internistische praxis 2016 Band 56 / 3 485 Alter Stadium Allgemeinzustand Anzahl der Extranodalbefälle Erhöhte Lactatdehydrogenase (LDH) 1 1 1 1 1 Punkt Punkt Punkt Punkt Punkt Für jeden zutreffenden Parameter wird 1 Punkt vergeben, anhand der Punktezahl werden vier Risikogruppen definiert ( Abb. 3). Der sogenannte International Prognostic Index (IPI) ist bezüglich der Vorhersage des Überlebens exakter als die Ann-Arbor-Stadien und trennt die Prognosegruppen besser [7]. Der kürzlich publizierte NCCN-IPI [8] verleiht den Risikofaktoren Alter (Alter 40 – 60 Jahre: 1 Punkt, 60 – 75 Jahre: 2 Punkte, 75 Jahre: 3 Punkte) und LDH ( 1 – 3 fach erhöht: 1 Punkt, 3 Fach erhöht: 2 Punkte) mehr Gewicht. Dabei konnte der Stellenwert des Risikofaktors »Alter« als einer der wichtigsten prognostischen Faktoren bei Patienten mit aggressiven Lymphomen durch eine bessere Differenzierung der Prognosegruppen bestätigt werden ( Abb. 3). Bei den Patienten 65 Jahren gibt es bisher keine allgemein akzeptierte Definition von Patienten mit günstiger Prognose; die DSHNHL (Deutsche Studiengruppe hochmaligne Non-Hodgkin-Lymphome) teilt die Patienten in: • Ältere Patienten ( 60 Jahre, alle IPI, mit und ohne Bulk) • Ältere Patienten, non-fit (Gebrechliche Patienten) ein. Therapiestrategien Da es sich, wie bereits oben erwähnt, bei den Lymphomen um eine sehr heterogene Gruppe von Erkrankungen handelt, gibt es keinen einheitlichen Therapiestandard. Die Therapie richtet sich nach der Histologie, dem Stadium, dem Allgemeinzustand und dem Alter des Patienten sowie den Prognosefaktoren. Häufig werden auch unterschiedliche Therapieprinzipien kombiniert um ein optimales Ansprechen zu erreichen (z. B. Chemotherapie und Antikörper- oder Strahlentherapie). Grundsätzlich muss in der Therapie zwischen aggressiven und indolenten 486 Lymphomen unterschieden werden. Aggressive Lymphome sind heilbare Erkrankungen, daher ist das Therapieziel auch bei älteren Patienten grundsätzlich kurativ, wenn dies aufgrund der Komorbiditäten möglich ist. Die indolenten Lymphome sind in der Regel, außer in den sehr frühen Stadien (I + II), nicht heilbar. In fortgeschrittenen Stadien III + IV ist die Wahl der Therapie daher abhängig von der klinischen Symptomatik. Häufig kann bei Beschwerdefreiheit abgewartet werden (sogenannte watch & wait Strategie). Tritt eine Therapiebedürftigkeit ein, ist bei der Auswahl der Therapie eine Nutzen-Risiko-Analyse zwischen dem zu erreichenden Therapieerfolg und den Nebenwirkungen der Therapie notwendig. Besonderheiten bei älteren Patienten Bei älteren Patienten, insbesondere mit aggressiven Lymphomen, ist die Prognose häufig schlechter als bei jüngeren Patienten im selben Krankheitsstadium. Die Ursache dafür ist die geringere hämatopoetische Reserve älterer Patienten mit erhöhter Myelotoxizität der Chemotherapie. Eine im Alter veränderte Pharmakokinetik (Resorption, Verteilung, Metabolisierung und Elimination der Chemotherapie) wird häufig für die höhere Toxizität der Chemotherapie älterer Patienten verantwortlich gemacht. In mehreren Metaanalysen konnte gezeigt werden, dass diese Unterschiede in der Pharmakokinetik klinisch nicht signifikant bzw. relevant sind und die höhere Toxizität vielmehr durch den Performance- und funktionellen Status des Patienten, die Komorbiditäten und Interaktionen zwischen der »Haus«- bzw. »Dauer«-Medikation und der Chemotherapie bedingt ist [9, 10]. Ein sicher belegter Unterschied in der Pharmakokinetik bei älteren Patienten konnte für den monoklonalen Antikörper Rituximab gezeigt werden. Interessanterweise zeigt der Antiköper bei älteren Frauen eine langsamere Clearance und damit längere und höhere Serumspiegel als bei älteren Männern. Das heißt, dass ältere Männer von der zusätzlichen Rituximabgabe zum CHOP-Schema signifikant weniger profi- 2016 Band 56 / 3 internistische praxis Survival (%) 1,0 (L) (L-I) 0,75 (H-I) 0,5 Abb. 3 | NCCN-IPI im Vergleich zum IPI beim aggressiven Lymphom. Bessere Trennung der Prognosegruppen im NCCN-IPI (H) 0,25 NCCN-IPI 0 0 1 2 3 4 Follow-up (Years) Low (L) Low-Intermediate (L-I) High-Intermediate (H-I) 5 High (L) 1,0 (L) (L-I) 0,75 (H-I) (H) 0,5 0,25 IPI 0 0 1 2 3 4 Follow-up (Years) Low (L) Low-Intermediate (L-I) High-Intermediate (H-I) 5 High (L) Risikogruppen NCCN-IPI IPI Niedriges Risiko 0,1 0,1 Niedrig intermediäres Risiko 2,3 2 Hohes intermediäres Risiko 4,5 3 Hohes Risiko 5 4,5 tieren als ältere Frauen. Dieser Unterschied zeigt sich nur bei den älteren Patienten [11]. Aktuell wird in Studien untersucht, ob eine höhere Dosierung des Antikörpers diesen Effekt ausgleichen kann. Die Komorbiditäten nehmen mit steigendem Alter stark zu. So konnte in einer französi- internistische praxis 2016 Band 56 / 3 schen Studie gezeigt werden, dass Patienten 70 Jahre in 61 %, Patienten 80 Jahre in 85 %, junge Patienten aber nur in 20 % der Fälle Komorbiditäten aufwiesen [12]. Auch die Morbidität unter einer R-CHOP-14 Immun/ Chemotherapie (s. u.) steigt bei Patienten mit aggressiven Lymphomen mit zunehmendem Al- 487 ter. Bei Patienten zwischen 60 und 65 Jahre liegt diese bei 4 %, bei Patienten über 76 Jahre bereits bei 20 % (Der Onkologe, Hohloch et al. 2015). Dazu passend ist auch das schlechtere 5-Jahres-Überleben von ca. 40 % bei Patienten zwischen 70 und 80 Jahre mit aggressiven Lymphomen im Vergleich zu 96 % bei 20-jährigen Patienten. Hinzu kommt, dass ältere Patienten in Studien deutlich unterrepräsentiert sind. So sind in mehreren Analysen nur ca. 30 % der Studienpatienten über 65 Jahre, betrachtete man aber das gesamte Patientenkollektiv sind 60 – 65 % aller Patienten über 65 Jahre [13]. Das heißt valide Daten aus randomisierten Studien zu bestimmten Behandlungsformen und Therapien existieren für Patienten über 65 Jahre oft nicht, bei noch älteren Patienten 70 oder 80 Jahre ist die Datenlage aus Studien noch spärlicher. Das führt häufig dazu, dass ältere oder sehr alte Patienten aus Sorge vor Toxizität gar nicht oder nur unzureichend therapiert werden. Ein weiteres Problem bei Patienten im höheren Lebensalter ist die ausgeprägte Heterogenität dieser Population. Das chronologische Alter entspricht nicht immer dem biologischen Alter. Alleine die Frage, wann ein Patient »alt« bzw. nicht mehr »therapierbar« ist, kann zu einer Herausforderung für den behandelnden Arzt werden. Eine auf den jeweiligen Patienten ausgerichtete Therapie verlangt daher neben den üblichen klinischen Stadien- und Prognoseeinteilungen eine individuelle Vorhersage über den funktionellen gerontologischen Status des Patienten. Geriatrisches Assessment In den letzten Jahren sind daher zunehmend geriatrische Assessments entwickelt worden. Diese sollen helfen, Veränderungen und Defizite bei älteren Patienten zu entdecken, welche durch die routinemäßige Anamneseerhebung und körperliche Untersuchung dem Arzt entgehen können. In Studien konnte gezeigt werden, dass das geriatrische Assessment prädiktiv für 488 das Auftreten schwerer Toxizitäten und für das Überleben ist. Empfohlen wird ein geriatrisches Assessment mit folgenden Parametern [14]: Parameter: Beispiel für ­Testinstrument: Funktioneller Status ADL = Activity of Daily Living, IADL = Instrumental Activities of Daily Living Komorbiditäten CIRS = Cumulative Illness Rating Scale Kognitive Funktion MMS = Mini-Mental-Status Mentaler gesundheitlicher Status GDA = Geriatric Depression Scale Ernährungssituation MNA = Mini Nutritional Assessment Performance Status KPS = Karnofsky Performance Status Soziale Situation und Unterstützung Ein geriatrisches Assessment ist zeitaufwendig und nimmt ca. zwischen 45 Minuten bis 1 Stunde in Anspruch wenn alle einzelnen Tests durchgeführt werden. Problematisch ist auch, dass für die verschiedenen Parameter unterschiedliche Tests zur Verfügung stehen und diese in Studien nicht einheitlich angewendet werden [15]. Die EORTC schreibt inzwischen für Studien mit Patienten 70 Jahre die obligate Anwendung des G8-Fragebogens vor ( Abb. 4). Die SIOG (International Society of Geriatric Oncology) empfiehlt als minimale Variante ein Screening mittels G8-Fragebogen [16] und je nach G8-Score ein erweitertes geriatrisches Assessment [17]. Bei Lymphomen sind bisher sehr wenige Studien durchgeführt worden welche ein geriatrisches Assessment als Entscheidungshilfe für die Therapie verwendet haben [18 – 20]. In diesen Studien erfolgte eine Einteilung der Patienten anhand des geriatrischen Assessments häufig in »Fit«, »unfit« und »gebrechlich« wobei die Parameter und die Cutoffs für diese Einteilung über die Studien hinweg nicht einheitlich waren. Eine Anwendung im klinischen Alltag ist daher bisher problematisch. Hier müssen weitere Studien mit pros- 2016 Band 56 / 3 internistische praxis pektiv einheitlichen geriatrischen Assessments und Festlegung von einheitlichen geriatrischen »Prognosegruppen« erfolgen. Die erste Studiengruppe in Deutschland, welche eine Therapiestratifizierung der Patienten in »fit« und »unfit« über den CIRS-Score ( 6 entspricht »unfit«) und nicht nur über das Alter eingeführt hat, ist die DCLLSG (Deutsche CLL G8-Fragebogen Studiengruppe). Spezifisch für die CLL konnte gezeigt werden, dass das Ausmaß der mittels CIRS-Score ermittelten Komorbidität mit dem Überleben korreliert [21, 22]. Daher werden die Patienten bei den Studien der DCLLSG mittels CIRS-Score stratifiziert und therapeutische Gruppen und spezielle Studienkonzepte für »unfit« Patienten entwickelt. Score: Gesamtsumme der erreichten Punkte Cut-off: 14 Punkte = auffälliges Screening Frage Mögliche Antworten A Hat die Nahrungsaufnahme in den letzten 3 Monaten aufgrund von Appetitverlust, Verdauungsproblemen, Kau- oder Schluck­ problemen abgenommen? 0: S chwere Einschränkung der Nahrungsaufnahme 1: Mäßige Einschränkung der Nahrungs­ aufnahme 2: Normale Nahrungsaufnahme B Gewichtsverlust in den letzten 3 Monaten? 0: 1: 2: 3: C Mobilität 0: Bett oder Stuhl 1: Kann aus Bett/Stuhl aufstehen aber geht nicht hinaus 2: Geht hinaus E Neuropsychologische Probleme 0: Schwere Demenz oder Depression 1: Milde Demenz oder Depression 2: Keine psychologischen Probleme F Body-Mass-Index (Gewicht in kg/Größe in m2) 0: 1: 2: 3: H Nimmt 3 Medikamente ein 0: Ja 1: Nein P Verglichen mit Gleichaltrigen, wie schätzt der Patient seinen Zustand ein? 0: Nicht so gut 0,5: Weiß nicht 1: Gleichgut 2: Besser Alter 0: 85 1: 80 – 85 2: 80 Score Gewichtsverlust 3kg Unbekannt Gewichtsverlust zwischen 1 und 3 kg Kein Gewichtsverlust BMI BMI BMI BMI 19 19 bis 21 21 23 23 Total score (0 – 17) Abb. 4 | G8-Fragebogen [64] internistische praxis 2016 Band 56 / 3 489 Autor, Gruppe, Jahr Therapie Patientenzahl Alter (Median) CR (%) OAS (%) n. Therapie (Jahre) Meyer, Ontario, 1995 CHOP 19 75 68 74* 2 CHOPweekly 19 71 74 51 Peyrade, GELA, 2011 R-miniCHOP 150 83 62 59 2 Luminari, EURO-18, 2010* R-ComppegDoxo 75 72 57 72 3 R-Comp14 41 73 68 67 4 R-CHOP split 30 NA ORR 87 60 3 Corazelli, 2011* Kreher, 2014 *kardiale Toxizität 3-4°, 4 % (Luminari) und 17 % Corazelli, hier aber Einschluss von Pat. mit „lebensbedrohlicher“ kardialer Komorbidität Tab. 2 | Modifikation des CHOP-Schemas Wirkstoff Handelsname Wirkmechanismus Zulassung Ibrutinib Imbruvica Hemmt das Enzym Bruton-Tyrosinkinase, dieses spielt eine wichtige Rolle für das Wachstum und die Vermehrung der B-Zelle Mantelzelllymphom, CLL im Rezidiv o. CLL bei p53-Mutation Idelalisib Zydelig Blockiert das Enzym Phos-Phoinositol-3-Kinase-delta (PI3kδ), dieses Enzym ist wichtig für das Wachstum und Überleben der B-Zelle CLL; FL im Rezidiv CLL bei p53-Mutation ABT-199 Venetoclax Hemmt das bcl-2, die B-Zelle geht dadurch in Apoptose (= Zelltod) Noch keine Zulassung Tab. 3 | Neue Medikamente »Small Molecules« Aggressive Lymphome Die schlechtere Prognose aggressiver Lymphome bei älteren Patienten im Vergleich zu Patienten 65 Jahre ist durch die zunehmenden Komorbiditäten und die eingeschränkte hämatopoetische Reserve bedingt. Hinzu kommt, dass mit zunehmendem Alter Lymphome mit ungünstigen Prognosefaktoren (ABC-Subtyp, lymphoblastische Subdifferenzierung, EBV-assoziiertes Lymphom des Älteren) gehäuft auftreten. Auch bei älteren Patienten gilt grundsätzlich ein kurativer Therapieansatz. Ob ein alter Pa- 490 tient therapiefähig ist oder nicht, sollte immer erst nach einer Vorphasetherapie mit Prednison (100 mg über 7 Tage) entschieden werden. Die Vorphasetherapie führt insbesondere bei älteren Patienten zu einer Verbesserung des Allgemeinzustandes, mildert die besonders nach dem ersten Zyklus auftretende Myelosuppression und senkt die nach dem ersten Kurs auftretende erhöhte therapieassoziierte Mortalität (»first cycle effect«) [23]. Das CHOP-Schema (C = Cyclophosphamid, H = Hydroxydaunorubicin (Doxorubicin), O= Vincristin, P = Prednison) ist auch bei älteren 2016 Band 56 / 3 internistische praxis Patienten nach wie vor Standard bei kurativ intendierter Therapie. In den letzten Jahren konnte durch mehrere randomisierte Studien eine schrittweise Verbesserung durch Intervallverkürzung des CHOP-Schemas von 3 auf 2 Wochen [24], Hinzunahme von Rituximab [25, 26] oder modifizierter Rituximabgabe [11, 27] bei älteren Patienten gezeigt werden. Die Intervallverkürzung hat in der Prä-Rituximab-Ära zu einem Vorteil bei älteren Patienten geführt. Dieser Effekt scheint bei der zusätzlichen Gabe von Rituximab zu verschwinden, wie kürzlich eine britische Studie gezeigt hat [28]. Die nach Leitlinie empfohlene Standardtherapie bei älteren Patienten ist daher: 8x R-CHOP-21 oder 6x R-CHOP-14 +2x R. Bei älteren Patienten gibt es bisher keine allgemein akzeptierte Definition von Patienten mit günstiger Prognose. Gewöhnlich spricht man von günstiger Prognose wenn die Patienten ein limitiertes Stadium (I oder II), keine bulky disease und keinen IPI Risikofaktor außer dem »Alter« haben [23]. Dies ist möglicherweise die einzige Patientengruppe bei der eine Reduktion der Zyklenzahl möglich ist. Eine kleine Registerstudie aus Kanada konnte zeigen, dass in diesem Patientenkollektiv eine Zyklenzahl von 4x R-CHOP-21 ausreicht wenn die Patienten nach 3 Zyklen ein negatives PET hatten [29]. Eine aktuelle Studie der DSHNHL prüft daher, ob in dieser Patientengruppe, welche ausschließlich den Risikofaktor »Alter« nach IPI haben, eine Reduktion der Zyklenzahl auf 4, bei negativem PET nach 3 Kursen, möglich ist (OPTIMAL-Studie). Zusätzlich wird in dieser Studie geprüft, ob sich durch den Einsatz von liposomalem Vincristin die Rate an Polyneuropathien reduzieren lässt. Um die Toxizität des CHOP-Schemas zu reduzieren, insbesondere die am meisten gefürchtete kardiale Toxizität durch das Anthrazyklin Doxorubicin, sind in der Vergangenheit immer wieder Versuche unternommen worden durch Änderungen des CHOP-Schemas oder Verzicht auf das Anthrazyklin die Toxizität und ins- internistische praxis 2016 Band 56 / 3 besondere die Kardiotoxizität zu reduzieren. Dabei zeigte sich, dass eine Therapie ohne Anthrazyklin beim aggressiven Lymphom kein kuratives Potential hat und Modifikationen des CHOP-Schemas mit schlechteren Ansprechraten und Gesamtüberleben einhergehen ( Tab. 2). Alte Patienten, welche auch nach einer Vorphasentherapie – aufgrund von Komorbiditäten des geriatrischen Assessments oder aufgrund des sehr hohen Alters ( 80 Jahre) – nicht mit R-CHOP-14 behandelt werden können, stellen einen großen und wachsenden Teil der Patienten mit aggressiven Lymphomen dar (»gebrechlich«). Die wenigsten dieser Patienten werden in Studien behandelt, sodass für dieses Patientenkollektiv keine allgemein etablierten Therapiestandards existieren. Ist die Gabe von R-CHOP-14 oder R-CHOP-21 nicht möglich, besteht keine kurative Therapieoption. Mögliche therapeutische Alternativen können für diese Patientengruppe ein R-miniCHOP-21 Schema sein mit einem 2-Jahres-Überleben von 58,4 % bei über 80-jährigen Patienten [30], anthrazyklinfreie Schemata wie z. B. R-Bendamustin [31], eine Rituximab- oder Steroid-Monotherapie, oder abhängig von der Lokalisation eine lokale Radiatio sein. Mit zunehmenden Erkenntnissen über die Biologie und molekulare Veränderungen, die zur Entartung von lymphatischen Zellen führen, wurden in den letzten Jahren mehrere neue Medikamente entwickelt, die auf unterschiedlichen Wirkprinzipien beruhen. Neben den neueren Antikörpern (Ofatumomab, Obinutuzumab) zählen dazu insbesondere die »Small Molecules« ( Tab. 3): • Bruton-Tyrosinkinase-Inhibitoren (BTK-Inhibitoren), Ibrutinib; Imbruvica • PI3kδ-Inhibitoren, Idelalisib; Zydelig • Bcl-2-Inhibitoren, ABT-199; Venetoclax Ibrutinib und Idelalisib sind zum Teil bereits für die CLL, indolente Lymphome sowie für das Mantelzelllymphom zugelassen ( Tab. 3). Der Bcl-2-Inhibitor ABT-199 ist noch nicht zugelassen und wird zurzeit in Studien geprüft. Beim 491 Diagnose DLBCL 65 Jahre CGA – CIRS – ADL – IADL – PS – MNA Staging, IPI Ausführliche Untersuchung Anamnese ECHO LuFu Gespräch mit Patient Aufklärung ggf. Gespräch mit Angehörigen Einteilung CIRS 6 MNA? FEV1 50 %, Diff. Kap 50 % EF 50 %, CIRS 6 Kurative Therapie Vorphasentherapie Stratifizierung nach IPI! Unklar Palliative Therapie Vorphasentherapie dann Reevaluation 6 – 8 x R-CHOP-21 6 x R-CHOP-14 + 8 x R Wenn möglich i. R. von Studien OPTIMAL-Studie R-Bendamustin (BRENDA-Studie) R-miniCHOP Neue Substanzen (Ibrutinib, Revlimid, i. R. von Studien) palliativ supportives Vorgehen lokalisierte Radiatio Abb. 5 | Algorithmus zur Therapieentscheidung bei älteren Patienten mit aggressiven Lymphomen aggressiven Lymphom wird die Wirksamkeit dieser Substanzen aktuell im Rahmen von Studien untersucht. Aufgrund des günstigen Nebenwirkungsprofils dieser Substanzen wären diese auch für die Therapie älterer Patienten geeignet, sodass in den nächsten Jahren für die Therapie aggressiver Lymphome wahrscheinlich eine Reihe neuer therapeutischer Alternativen zur Verfügung stehen. Ein Vorschlag für einen Algorithmus zur Therapieentscheidung bei älteren Patienten ist in Abb. 5 (nach [32]) dargestellt. Indolente Lymphome Grundsätzlich unterscheiden sich die Therapiestrategien der indolenten von den aggressiven Lymphomen. Zu den indolenten Lymphomen zählt man heute das follikuläre Lymphom (FL), 492 das Marginalzonenlymphom (MALT = Mukosa assoziierte Marginalzonenlymphom, nodales und extranodales Marginalzonenlymphom) sowie das Small Lymphocytic Lymphoma (SLL), die sich sehr unterschiedlich verhalten können und häufig auch asymptomatisch verlaufen. Die Erstdiagnose erfolgt dann oft erst im Stadium III oder IV. Das Therapieziel älterer Patienten mit indolentem Lymphom ist daher – im Gegensatz zu den aggressiven Lymphomen – nicht das Erreichen einer kompletten Remission, sondern eine nebenwirkungsarme Therapie mit langen Überlebenszeiten bei guter Lebensqualität der Patienten. Die dazu notwendige Therapie kann viel besser als beim aggressiven Lymphom an den individuellen Patienten mit seinen Komorbiditäten angepasst werden. 2016 Band 56 / 3 internistische praxis Follikuläre und Marginalzonenlymphome In frühen Ann-Arbor-Stadien I+II wird ein kuratives Konzept verfolgt. Durch eine Strahlentherapie kann bei Patienten mit FL ein rezidiv freies Überleben nach 10 Jahren von 43 – 51 % erreicht werden mit einem 10-Jahres-Gesamtüberleben von 61 – 79 % [33]. In fortgeschrittenen Stadien III+IV ist die Wahl der Therapie abhängig von der klinischen Symptomatik. Eine kurative Therapie ist nicht möglich, sodass bei der Wahl der Therapie eine Nutzen-Risiko-Analyse zwischen dem zu erreichenden Therapierfolg und den Nebenwirkungen der Therapie notwendig ist. Mehrere Studien konnten in der Prä-Rituximab-Ära klar belegen, dass bei asymptomatischen Patienten ein früher Therapiebeginn keine Vorteile hinsichtlich des Gesamtüberlebens ergibt [34 – 36] und hier eine watch & wait Strategie die »Therapie der Wahl« ist. Verschiedene Kriterien, wann eine Therapie initiiert werden sollte, wurden entwickelt. Am häufigsten werden die der französischen Arbeitsgruppe (GELF Kriterien) verwendet, welche allerdings 1998 in der Prä-Rituximab-Ära etabliert wurden ( Tab. 4) [37]. Die aktuellen ESMO Empfehlungen weichen hiervon geringfügig ab [33]. Ob dieses Vorgehen auch im Rituximab-Zeitalter seine Gültigkeit behält oder ob eine »frü- he« Therapie mit Rituximab-Mono oder einer Immun-Chemotherapie Vorteile hinsichtlich des Gesamt- und Rezidivfreien Überlebens bringt, ist aktuell Gegenstand klinischer Studien und wissenschaftlicher Diskussionen [38]. Werden die Therapiekriterien erfüllt, stehen mehrere Möglichkeiten zur Verfügung. Nach Einführung des monoklonalen Antikörpers Rituximab in die Therapie der B-NHL konnten mehrere Studien klar belegen, dass die Kombination hinsichtlich des Ansprechens des PFS und des OAS einer alleinigen Chemotherapie überlegen ist [39 – 43] und daher bei Fehlen von Kontraindikationen eine kombinierte Immun-Chemotherapie als Standard gilt. Eine kürzlich publizierte Studie konnte bei verlängertem PFS und geringerer Toxizität die nicht-Unterlegenheit von R-Bendamustin im Vergleich zu R-CHOP in der Erstlinientherapie bei indolenten Lymphomen im R-Bendamustin-Arm [42, 44] zeigen, die Bright Studie hat diese Ergebnisse bestätigt [45]. Daraus resultiert, dass diese Kombination aktuell in Deutschland am häufigsten für die Erstlinientherapie der indolenten Lymphome eingesetzt wird. Kommt eine Chemotherapie oder eine Immun-Chemotherapie insbesondere bei älteren Patienten nicht infrage, kann mit einer Rituximab-Monotherapie und nachfolgender Erhaltungstherapie ein Ansprechen um 70 % GELF Kriterien (Eins zutreffend) ESMO Kriterien Läsion 7 cm B-Symptome 3 LK Areale 3 cm Bedrohliche Organbeteiligung Splenomegalie Rascher Progress Kompression (ureteral, epidural) Signifikante Ergüsse Signifikante Ergüsse Zytopenie Zytopenie Rel: LDH↑, bulk 7 cm, 3 LK Areale 3 cm Rel: relative Therapieindikation, LDH : Lactatdehydrogenase, LK: Lymphknoten Tab. 4 | Indolente NHL, Therapiekriterien internistische praxis 2016 Band 56 / 3 493 Stadium Lymphozytose ( 4 × 103/μl) Anzahl befallener (palpabler) lymphatischer Regionen (Hals, Achsel, Leiste, Milz, Leber) Hämoglobin Thrombozyten A ja 3 Regionen befallen 10 g/dl 100 × 103/μl B ja 3 Regionen befallen 10 g/dl 100 × 103/μl C ja irrelevant 10 g/dl oder 100 × 103/μl Tab. 5 | Stadieneinteilung nach Binet Stadium Lymphozytose ( 15 × 103/μl) Lymphadenopathie oder Splenomegalie Hepato­ megalie Hämoglobin Thrombozyten 0 ja nein nein 11 g/dl 100 × 103/μl I ja ja nein 11 g/dl 100 × 103/μl II ja irrelevant ja 11 g/dl 100 × 103/μl III ja irrelevant irrelevant 11 g/dl 100 × 103/μl IV ja irrelevant irrelevant irrelevant 100 × 103/μl Tab. 6 | Stadieneinteilung nach Rai erreicht werden, mit einer medianen Dauer des Ansprechens von 2 – 4 Jahren [46]. Auch eine alleinige Radioimmuntherapie mit Yttrium-90, oder 131I gekoppelten AK als Erstlinientherapie, zeigt in Studien vielversprechende Ergebnisse hinsichtlich des Gesamtüberlebens und der progressionsfreien Zeit [47, 48] bei einem günstigen Nebenwirkungsprofil (Haupttoxizität ist die Hämatoxizität) beim follikulären Lymphom. Mit guten Ansprechraten in Studien geprüft wird eine chemotherapiefreie Kombination von Rituximab und Revlimid als Erstlinientherapie bei indolenten Lymphomen; Revlimid ist dafür in Deutschland noch nicht zugelassen [49, 50]. Die progressionsfreie Zeit kann nach Erstlinientherapie [51] und im Rezidiv [52] durch eine Rituximaberhaltungstherapie, welche als Therapiestandard etabliert ist, oder durch eine Kon- 494 solidierung mittels Radioimmuntherapie [53] verlängert werden, diese Daten wurden jedoch ausschließlich für das follikuläre Lymphom erhoben. Auch bei den indolenten Lymphomen werden in Zukunft die neu entwickelten »Small Molecules« ( Tab. 3) eine zunehmende Rolle auch in der Erstlinientherapie spielen, bislang zugelassen ist Idelalisib beim rezidivierten follikulären Lymphom [54, 55]. Bei Patienten mit rezidiviertem follikulärem Lymphom zeigen sich unter Idelalisib ein Gesamtansprechen von 54 % und eine mediane Dauer des Ansprechens, welche bisher nicht erreicht war, bei einer mittleren Nachbeobachtungszeit von 8,1 Monaten. Die häufigsten unter Idelalisib auftretenden Nebenwirkungen sind febrile Neutropenie, Pneumonie, Diarrhoen, Hepatotoxizität und Pneumo- 2016 Band 56 / 3 internistische praxis nitiden. Bislang gibt es nur Daten aus kleineren Phase-I- und -II-Studien, die Ergebnisse der Phase-III-Studien sollten abgewartet werden. CLL Patienten mit CLL sind zum Zeitpunkt der Diagnose im Mittel ca. 70 Jahre alt, aufgrund des demographischen Wandels ist in den nächsten Jahren daher mit einer deutlichen Zunahme von Patienten mit CLL zu rechnen. Diagnose und Stadieneinteilung nach Binet oder Rai ( Tab. 5 und Tab. 6) unterscheiden nicht zwischen älteren und jüngeren Patienten. Im Alter scheinen aber die Risikofaktoren ZAP70 und CD38 ihre prognostische Bedeutung zu verlieren, wohingegen eine 17p-Deletion bzw. eine p53-Mutation auch im Alter mit einem schlechteren Therapieansprechen auf eine konventionelle Immun-Chemotherapie und kürzerer Überlebenszeit assoziiert ist [21]. Alte Patienten mit CLL ohne krankheitsspezifische Symptome im Stadium Binet A oder B sind nicht therapiebedürftig. Die Lebenserwartung von Patienten 75 Jahre mit CLL in einem frühen Stadium unterscheidet sich nicht von gesunden Menschen über 75 Jahre [56]. Liegt ein Stadium Binet C vor oder bestehen CLL spezifische Symptome (B-Symptome, Fatigue, schmerzhafte Lymphknotenschwellung, Organomegalie oder Autoimmunhämolytische Anämie etc.), besteht eine Therapieindikation. Wie oben erwähnt korreliert das Ausmaß der Komorbiditäten (mittels CIRS-Score bestimmt) mit dem Überleben. Eine Vorhersage zur Durchführbarkeit einer Therapie bzw. Therapievertäglichkeit kann aber auch bei der CLL mittels geriatrischem Assessment bisher nicht sicher belegt werden [22]. Die Auswahl der Therapie richtet sich daher nach der Fitness bzw. dem Allgemeinzustand des Patienten, dem p53und 17p-Status und nach den Komorbiditäten. Für die Erstlinientherapie bei älteren Patienten stehen mehrere Therapieoptionen zur Verfügung. Bei fitten Patienten mit wenig oder fehlenden Komorbiditäten und ohne das Vorliegen einer p53-Mutation kommt eine Immun-Chemotherapie mit Rituximab-Ben- internistische praxis 2016 Band 56 / 3 Abb. 6 | Wirkweise der „Small Molecules“ damustin infrage. Bei über 65-jährigen Patienten zeigt sich hier kein Unterschied im progressionsfreien Überleben im Vergleich zu einer Kombination aus R-FC (Rituximab, Fludarabin, Cyclophosphamid; die Therapie der Wahl bei jungen Patienten ohne Komorbidität und p53-Mutation), bei deutlich günstigerem Nebenwirkungsprofil mit weniger Hämatotoxizität und Infektionen. Bei Patienten mit mehreren oder schwerwiegenden Komorbiditäten (CIRS 6) kann eine Kombination aus einem monoklonalen Antikörper gegen CD20 (Rituximab, Ofatumumab oder Obinutuzumab) in Kombination mit Chlorambucil eingesetzt werden. Dabei konnte in einer aktuellen Studie gezeigt werden, dass Obinutuzumab in Kombination mit Chlorambucil eine Überlegenheit hinsichtlich der Remissionsqualität und -dauer gegenüber Rituximab aufweist [57]. Bei älteren Patienten mit 17p-Deletion sollte eine Erstlinientherapie mit einem Kinasein- 495 hibitor ( Abb. 6) erfolgen. Zugelassen sind dafür Ibrutinib sowie die Kombination von Idelalisib und Rituximab. Ibrutinib (Imbruvica) ist ein oraler selektiver Inhibitor der Bruton-Tyrosinkinase. In einer Phase-I-Studie bei Patienten mit mehrfach vorbehandelter CLL mit Ibrutinib als Monotherapie zeigte sich ein EFS von 75 % mit einem Gesamtüberleben von 85 % nach 2 Jahren. Im randomisierten Vergleich mit Ofatumumab konnte eine statistisch signifikante Verlängerung des PFS sowie des OS (HR 0,43, p 0,005) für die mit Ibrutinib behandelten Patienten gezeigt werden [58]. Diese Ergebnisse waren in beiden Studien unabhängig von klinischen und genetischen Risikofaktoren [58, 59]. Das Nebenwirkungsprofil ist günstig, die häufigsten Grad 3 Nebenwirkungen sind Durchfälle (4 %), Müdigkeit (2 %), Thrombozytopenie (6 %) und Neutropenie (16 %). In den ersten Wochen einer Therapie mit Ibrutinib kann eine ausgeprägte Lymphozytose auftreten, diese wird als »Umverteilung« gewertet da es zeitgleich zu einem Rückgang der LK-Schwellungen und Milzgröße kommt. Bei fast 80 % der Patienten kommt es im Verlauf der Behandlung wieder zu einer Normalisierung der Lymphozytenzahlen [59]. In einer kleineren Studie wurde der Einsatz bei älteren Patienten geprüft [60]. Unter Ibrutinib besteht ein erhöhtes Blutungsrisiko, daher ist die Kombination mit Phenprocoumon kontraindiziert. Bei Patienten mit kardiovaskulären Risikofaktoren besteht ein erhöhtes Risiko für Vorhofflimmern [58]. Idelalisib (Zydelig) hemmt die Phosphoinositol-3-Kinase-delta (PI3kδ), die bei vielen Lymphomen eine hohe Aktivität aufweist. Durch die Hemmung wird die Aktivierung, Proliferation und das Überleben der Zelle beeinträchtigt. Bei älteren komorbiden Patienten (CIRS 8) ist die Kombination Rituximab/Idelalisib einer Monotherapie mit Rituximab bei der rezidivierten CLL überlegen (Ansprechrate 81 % vs. 31 %, OS nach 12 Monaten 92 % vs. 80 %) [61]. Auch bei Idelalisib ist das Ansprechen unabhängig von klinischen und genetischen Risikofaktoren. Hauptnebenwirkungen (Grad 3) von Idelalisib sind Neutropenie (27 %), Diarrhoe (13 %), welche im Mittel nach 6 Monaten 496 auftritt, Transaminasenerhöhungen (13 %) und Pneumonie (7 %). Insbesondere die spät auftretende Diarrhoe kann für den älteren Patienten eine schwere Beeinträchtigung mit der Gefahr der Dehydratation sein. Chlorambucil alleine kann nach wie vor bei sehr alten, komorbiden Patienten mit Kontraindikation gegen monoklonale CD20-Antikörper eingesetzt werden. Weder Fludarabin noch Bendamustin als Monotherapie konnte das Gesamtüberleben bei alten Patienten im Vergleich mit Chlorambucil verbessern [62, 63]. Fazit für die Praxis • Lymphome sind durch eine klinische und biologische Heterogenität gekennzeichnet. Das klinische Bild reicht vom asymptomatischen bis zum schwer kranken Patienten mit ausgeprägter B-Symptomatik (Fieber, Gewichtsverlust, Nachtschweiß). • Bei aggressiven Lymphomen ist das Therapieziel auch bei älteren Patienten grundsätzlich kurativ. Erst nach Durchführung einer Vorphasentherapie (100 mg Prednison über 7 Tage) darf eine definitive Therapieentscheidung getroffen werden. • Ein geriatrisches Screening kann bei der Therapieentscheidung helfen, ein geeignetes Instrument ist der G8-Fragebogen. • Beim aggressiven Lymphom ist das klassische R-CHOP-Schema der Therapiestandart, altersadaptierte oder anthrazyklinfreie Schemata haben schlechtere Ansprech- und Heilungsraten. • Beim indolenten Lymphom im fortgeschrittenen Stadium ist das Therapieziel ein möglichst langes Überleben bei guter Lebensqualität und nebenwirkungsarmer Therapie zu erreichen. • Neuere nebenwirkungsärmere Therapieoptionen (Bcl-2-, PI3kδ-, BTK-Inhibitoren), im Vergleich zu der »klassischen« Chemothera- 2016 Band 56 / 3 internistische praxis pie, stehen bereits für die Zweitlinientherapie zur Verfügung. • Bei der CLL richtet sich die Auswahl der Therapie nach der Fitness des Patienten und den Risikofaktoren (p53-Mutation, 17p-Deletion). Zusammenfassung Lymphome treten gehäuft im höheren Lebensalter auf, der Erkrankungsgipfel liegt bei 64 – 75 Jahren. Lymphome stellen eine sehr heterogene Gruppe von Erkrankungen dar, die sowohl aus B- wie auch aus T-Zellen hervorgehen können. Die B-Zell-Lymphome sind mit 85 % die am häufigsten auftretenden Non-Hodgkin-Lymphome, die T-Zell-Lymphome machen nur einen kleinen Teil aus (15 %). Die B-Zell-Lymphome zählen damit zu den 6 häufigsten Tumoren in der Welt und den am häufigsten vorkommenden hämatologischen Tumoren. Lymphome werden in »indolente« bzw. »niedrigmaligne« und »aggressive« bzw. »hochmaligne« Lymphome in Abhängigkeit von ihrem klinischen Verhalten und morphologischen Charakteristika eingeteilt. Klinisch führend ist oft die Lymphknotenschwellung, zum Teil sind die ersten Symptome oft unspezifisch mit Müdigkeit, Abgeschlagenheit und Inappetenz oder es tritt eine klassische B-Symptomatik auf (Fieber, Gewichtsverlust, Nachtschweiß). Aufgrund der Heterogenität der Lymphome gibt es keinen einheitlichen Therapiestandard. Die Therapie richtet sich nach der Histologie, dem Stadium, dem Allgemeinzustand und dem Alter des Patienten und den Prognosefaktoren. Häufig werden unterschiedliche Therapieprinzipien kombiniert um ein optimales Ansprechen zu erreichen (z. B. Chemotherapie und Antikörper- oder Strahlentherapie). Grundsätzlich muss in der Therapie zwischen aggressiven und indolenten Lymphomen unterschieden werden. Die B-CLL nimmt eine Sonderstellung ein, da hier bereits mehrere Antikörper und Kinaseinhibitoren für die Therapie zur Verfügung stehen. Die Auswahl der Behandlungsart ist daher vom Nebenwirkungsspektrum der einzelnen Subs- internistische praxis 2016 Band 56 / 3 tanzen und dem Allgemeinzustand abhängig. Bei älteren Patienten mit aggressivem Lymphom ist das Therapieziel grundsätzlich kurativ während indolente Lymphome nur bei Symptomen therapiert werden. Gleichzeitig müssen Komorbiditäten und soziale Faktoren sowie Einschränkungen im täglichen Leben in diesem Patientenkollektiv bei der Therapieentscheidung berücksichtigt werden. Eine Entscheidungshilfe können sogenannte geriatrische Assessments liefern, die Entscheidung liegt jedoch beim behandelnden Arzt und muss individuell für und mit dem jeweiligen Patienten getroffen werden. Hohloch K, Zettl F: Treatment concepts for lymphoma in the elderly Summary: Lymphomas in elderly patients are frequent with a peak between 64-75 years. Lymphomas are a very heterogeneous group of diseases deriving from B- or T-cells. Most lymphomas are B-cell lymphomas (85 %), T-cell lymphomas are very rare accounting for only 15 % of all lymphomas. B-cell lymphomas are the 6 most frequent disease in the world and the most frequent hematologic tumor. Lymphomas are distinguished in “indolent” or “low-grade” and “aggressive” or “high-grade” lymphomas due to their clinical course and the morphological characteristics. Lymphadenopathy may be a leading symptom but often fatigue, lassitude and anorexia are unspecific symptoms of lymphoma disease or the classical B-symptoms (fever, loss of weight, night sweats) occur. Due to the heterogeneous character of the lymphomas, there is no consistent standard of therapy. Therapy will be adjusted to histology, stage of the disease, age, comorbidities, general condition and prognostic factors. For optimal treatment results, therapy modalities are often combined (chemotherapy and antibodies, radiotherapy). Therapy for indolent and aggressive lymphoma is generally different. For 497 elderly patients therapy for aggressive lymphoma should be considered curative, whereas indolent lymphomas are only treated when symptoms occur. In addition, comorbidities, social factors and limitations in daily routine must be incorporated in the treatment decision in this special group of elderly patients. A decision making support may be the geriatric assessments, but the treating physician should make the treatment decision together with the elderly patient. 9. Lichtman SM, Boparai MK. Anticancer drug therapy in the older cancer patient: pharmacology and polypharmacy. Curr Treat Options Oncol 2008; 9: 191 – 203. 10.Singh JC, Lichtman SM. Effect of age on drug metabolism in women with breast cancer. Expert Opin Drug Metab Toxicol 2015; 11: 757 – 766. 11.Pfreundschuh M, Muller C, Zeynalova S, Kuhnt E, Wiesen MH, Held G, et al. Suboptimal dosing of rituximab in male and female patients with DLBCL. Blood 2014; 123: 640 – 646. 12.Sarkozy C, Salles G, Falandry C. The biology of aging and lymphoma: a complex interplay. Curr Oncol Rep 2015; Keywords: Lymphomas – elderly patients – ­diagnosis – therapy 17: 32. 13.Hurria A, Levit LA, Dale W, Mohile SG, Muss HB, Fehrenbacher L, et al. Improving the Evidence Base for Treating Older Adults With Cancer: American Society Literatur of Clinical Oncology Statement. J Clin Oncol 2015; 33: 3826 – 3833. 1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers 14.Puts MT, Santos B, Hardt J, Monette J, Girre V, Atena- C, Rebelo M, et al. Cancer incidence and mortality world- fu EG, et al. An update on a systematic review of the use wide: sources, methods and major patterns in GLOBOCAN of geriatric assessment for older adults in oncology. Ann 2012. Int J Cancer 2015; 136: E359 – 386. Oncol 2014; 25: 307 – 315. 2. Swerdlow AJ. Epidemiology of Hodgkin‘s disease and 15.Wildiers H, Heeren P, Puts M, Topinkova E, Jans- non-Hodgkin‘s lymphoma. Eur J Nucl Med Mol Imaging sen-Heijnen ML, Extermann M, et al. International Soci- 2003; 30 Suppl 1: S3 – 12. ety of Geriatric Oncology consensus on geriatric assess- 3. Swerdlow SH. Lymphoma classification and the tools ment in older patients with cancer. J Clin Oncol 2014; of our trade: an introduction to the 2012 USCAP Long 32: 2595 – 2603. Course. Mod Pathol 2013; 26 Suppl 1: S1 – 14. 16.Bellera CA, Rainfray M, Mathoulin-Pelissier S, Mer- 4. A clinical evaluation of the International Lymphoma tens C, Delva F, Fonck M, et al. Screening older cancer Study Group classification of non-Hodgkin‘s lymphoma. patients: first evaluation of the G-8 geriatric screening The Non-Hodgkin‘s Lymphoma Classification Project. tool. Ann Oncol 2012; 23: 2166 – 2172. Blood 1997; 89: 3909 – 3918. 17. Decoster L, Van Puyvelde K, Mohile S, Wedding U, 5. Lister TA, Crowther D, Sutcliffe SB, Glatstein E, Ca- Basso U, Colloca G, et al. Screening tools for multidimen- nellos GP, Young RC, et al. Report of a committee con- sional health problems warranting a geriatric assessment vened to discuss the evaluation and staging of patients in older cancer patients: an update on SIOG recommenda- with Hodgkin‘s disease: Cotswolds meeting. J Clin Oncol tionsdagger. Ann Oncol 2015; 26: 288 – 300. 1989; 7: 1630 – 1636. 18.Spina M, Balzarotti M, Uziel L, Ferreri AJ, Fratino L, 6. Carbone PP, Kaplan HS, Musshoff K, Smithers DW, Tu- Magagnoli M, et al. Modulated chemotherapy according biana M. Report of the Committee on Hodgkin‘s Disease to modified comprehensive geriatric assessment in 100 Staging Classification. Cancer Res 1971; 31: 1860 – 1861. consecutive elderly patients with diffuse large B-cell 7. A predictive model for aggressive non-Hodgkin‘s lymphoma. Oncologist 2012; 17: 838 – 846. lymphoma. The International Non-Hodgkin‘s Lympho- 19. Tucci A, Ferrari S, Bottelli C, Borlenghi E, Drera M, ma Prognostic Factors Project. N Engl J Med 1993; 329: Rossi G. A comprehensive geriatric assessment is more 987 – 994. effective than clinical judgment to identify elderly diffu- 8. Zhou Z, Sehn LH, Rademaker AW, Gordon LI, Lacasce se large cell lymphoma patients who benefit from aggres- AS, Crosby-Thompson A, et al. An enhanced Internatio- sive therapy. Cancer 2009; 115: 4547 – 4553. nal Prognostic Index (NCCN-IPI) for patients with diffu- 20.Merli F, Luminari S, Rossi G, Mammi C, Marcheselli se large B-cell lymphoma treated in the rituximab era. L, Ferrari A, et al. Outcome of frail elderly patients with Blood 2014; 123: 837 – 842. diffuse large B-cell lymphoma prospectively identified 498 2016 Band 56 / 3 internistische praxis by Comprehensive Geriatric Assessment: results from a treated with abbreviated chemoimmunotherapy alone. study of the Fondazione Italiana Linfomi. Leukemia & Blood 2007; 110: 242a. lymphoma 2014; 55: 38 – 43. 30.Peyrade F, Jardin F, Thieblemont C, Thyss A, Emile JF, 21.Baumann T, Delgado J, Santacruz R, Martinez-Trillos Castaigne S, et al. Attenuated immunochemotherapy regi- A, Royo C, Navarro A, et al. Chronic lymphocytic leukemia men (R-miniCHOP) in elderly patients older than 80 years in the elderly: clinico-biological features, outcomes, and with diffuse large B-cell lymphoma: a multicentre, sing- proposal of a prognostic model. Haematologica 2014; 99: le-arm, phase 2 trial. Lancet Oncol 2011; 12: 460 – 468. 1599 – 1604. 31.Weidmann E, Neumann A, Fauth F, Atmaca A, Al-Bat- 22.Goede V, Cramer P, Busch R, Bergmann M, Stauch M, ran SE, Pauligk C, et al. Phase II study of bendamustine Hopfinger G, et al. Interactions between comorbidity and in combination with rituximab as first-line treatment in treatment of chronic lymphocytic leukemia: results of patients 80 years or older with aggressive B-cell lympho- German Chronic Lymphocytic Leukemia Study Group tri- mas. Ann Oncol 2011; 22: 1839 – 1844. als. Haematologica 2014; 99: 1095 – 1100. 32.Fields PA, Linch DC. Treatment of the elderly patient 23.Pfreundschuh M. How I treat elderly patients with diffuse large B cell lymphoma. Br J Haematol 2012; with diffuse large B-cell lymphoma. Blood 2010; 116: 157: 159 – 170. 5103 – 5110. 33.Ghielmini M, Vitolo U, Kimby E, Montoto S, Walews- 24.Pfreundschuh M, Trumper L, Kloess M, Schmits R, Fel- ki J, Pfreundschuh M, et al. ESMO Guidelines consensus ler AC, Rube C, et al. Two-weekly or 3-weekly CHOP chemo- conference on malignant lymphoma 2011 part 1: diffuse therapy with or without etoposide for the treatment of el- large B-cell lymphoma (DLBCL), follicular lymphoma (FL) derly patients with aggressive lymphomas: results of the and chronic lymphocytic leukemia (CLL). Ann Oncol 2013; NHL-B2 trial of the DSHNHL. Blood 2004; 104: 634 – 641. 24: 561 – 576. 25.Feugier P, Van HA, Sebban C, Solal-Celigny P, Bouab- 34.Ardeshna KM, Smith P, Norton A, Hancock BW, Hoskin dallah R, Ferme C, et al. Long-term results of the R-CHOP PJ, MacLennan KA, et al. Long-term effect of a watch study in the treatment of elderly patients with diffuse and wait policy versus immediate systemic treatment for large B-cell lymphoma: a study by the Groupe d‘Etude des asymptomatic advanced-stage non-Hodgkin lymphoma: a Lymphomes de l‘Adulte. J Clin Oncol 2005; 23: 4117 – 4126. randomised controlled trial. Lancet 2003; 362: 516 – 522. 26.Pfreundschuh M, Trümper L, Gill D, Österborg A, Loeff- 35.Brice P, Bastion Y, Lepage E, Brousse N, Haioun C, ler M. First Analysis of the Completed Mabthera Internati- Moreau P, et al. Comparison in low-tumor-burden follicu- onal (MInT) Trial in Young Patients with Low-Risk Diffuse lar lymphomas between an initial no-treatment policy, Large B-Cell Lymphoma (DLBCL): Addition of Rituximab to prednimustine, or interferon alfa: a randomized study a CHOP-Like Regimen Significantly Improves Outcome of from the Groupe d‘Etude des Lymphomes Folliculaires. All Patients with the Identification of a Very Favorable Groupe d‘Etude des Lymphomes de l‘Adulte. J Clin Oncol Subgroup with IPI=O and No Bulky Disease. Blood 2004; 1997; 15: 1110 – 1117. 104: 48a – a. 36.Young RC, Longo DL, Glatstein E, Ihde DC, Jaffe ES, 27. Pfreundschuh M, Poeschel V, Zeynalova S, Hanel M, DeVita VT, Jr. The treatment of indolent lymphomas: Held G, Schmitz N, et al. Optimization of rituximab for the watchful waiting v aggressive combined modality treat- treatment of diffuse large B-cell lymphoma (II): extended ment. Semin Hematol 1988; 25 (Suppl 2): 11 – 16. rituximab exposure time in the SMARTE-R-CHOP-14 trial 37. Solal-Celigny P, Lepage E, Brousse N, Tendler CL, of the german high-grade non-Hodgkin lymphoma study Brice P, Haioun C, et al. Doxorubicin-containing regimen group. J Clin Oncol 2014; 32: 4127 – 4133. with or without interferon alfa-2b for advanced follicular 28.Cunningham D, Smith P, Mouncey P, Qian W, Jack AS, lymphomas: final analysis of survival and toxicity in the Pocock C, Ardeshna K, Radford JA, Davies AJ, McMillan A, Groupe d‘Etude des Lymphomes Folliculaires 86 Trial. J Linch MD. R-CHOP14 versus R-CHOP21: Result of a rando- Clin Oncol 1998; 16: 2332 – 2338. mized phase III trial for the treatment of patients with 38.Lowry L, Ardeshna KM. Has single-agent rituximab newly diagnosed diffuse large B-cell non-Hodgkin lym- replaced watch-and-wait for a patient with asympto- phoma. J Clin Oncol. 2011; 29. matic low-grade follicular lymphoma? Cancer J 2012; 18: 29.Sehn L, Savage KJ, Hoskins P, et al. Limited-stage dif- 390 – 395. fuse large B cell lymphoma patients with a negative PET 39.Salles G, Mounier N, de GS, Morschhauser F, Doyen C, scan following three cycles of R-CHOP can be effectively Rossi JF, et al. Rituximab combined with chemotherapy internistische praxis 2016 Band 56 / 3 499 and interferon in follicular lymphoma patients: results 48.Scholz CW, Pinto A, Linkesch W, Linden O, Viardot of the GELA-GOELAMS FL2000 study. Blood 2008; 112: A, Keller U, et al. (90)Yttrium-ibritumomab-tiuxetan as 4824 – 4831. first-line treatment for follicular lymphoma: 30 months 40.Herold M, Haas A, Srock S, Neser S, Al-Ali KH, Neu- of follow-up data from an international multicenter bauer A, et al. Rituximab added to first-line mitoxan- phase II clinical trial. J Clin Oncol 2013; 31: 308 – 313. trone, chlorambucil, and prednisolone chemotherapy 49. Witzig TE, Nowakowski GS, Habermann TM, Goy A, followed by interferon maintenance prolongs survival in Hernandez-Ilizaliturri FJ, Chiappella A, et al. A com- patients with advanced follicular lymphoma: an East Ger- prehensive review of lenalidomide therapy for B-cell man Study Group Hematology and Oncology Study. J Clin non-Hodgkin lymphoma. Ann Oncol 2015; 26: 1667 – 1677. Oncol 2007; 25: 1986 – 1992. 50.Tuscano JM, Dutia M, Chee K, Brunson A, Reed-Pea- 41.Hiddemann W, Kneba M, Dreyling M, Schmitz N, se C, Abedi M, et al. Lenalidomide plus rituximab can Lengfelder E, Schmits R, et al. Frontline therapy with produce durable clinical responses in patients with re- rituximab added to the combination of cyclophospha- lapsed or refractory, indolent non-Hodgkin lymphoma. mide, doxorubicin, vincristine, and prednisone (CHOP) Br J Haematol 2014; 165: 375 – 381. significantly improves the outcome for patients with ad- 51.Salles G, Seymour JF, Offner F, Lopez-Guillermo A, vanced-stage follicular lymphoma compared with therapy Belada D, Xerri L, et al. Rituximab maintenance for 2 with CHOP alone: results of a prospective randomized years in patients with high tumour burden follicular study of the German Low-Grade Lymphoma Study Group. lymphoma responding to rituximab plus chemotherapy Blood 2005; 106: 3725 – 3732. (PRIMA): a phase 3, randomised controlled trial. Lancet 42.Marcus R, Imrie K, Solal-Celigny P, Catalano JV, Dmos- 2011; 377: 42 – 51. zynska A, Raposo JC, et al. Phase III study of R-CVP com- 52.Vidal L, Gafter-Gvili A, Leibovici L, Dreyling M, Ghiel- pared with cyclophosphamide, vincristine, and predniso- mini M, Hsu Schmitz SF, et al. Rituximab maintenance for ne alone in patients with previously untreated advanced the treatment of patients with follicular lymphoma: sys- follicular lymphoma. J Clin Oncol 2008; 26: 4579 – 4586. tematic review and meta-analysis of randomized trials. J 43.Schulz H, Bohlius JF, Trelle S, Skoetz N, Reiser M, Natl Cancer Inst 2009; 101: 248 – 255. Kober T, et al. Immunochemotherapy with rituximab 53.Morschhauser F, Radford J, Van HA, Vitolo U, Sou- and overall survival in patients with indolent or mantle beyran P, Tilly H, et al. Phase III trial of consolidation cell lymphoma: a systematic review and meta-analysis. therapy with yttrium-90-ibritumomab tiuxetan compa- J Natl Cancer Inst 2007; 99: 706 – 714. red with no additional therapy after first remission in 44.Rummel MJ, Niederle N, Maschmeyer G, Banat GA, advanced follicular lymphoma. J Clin Oncol 2008; 26: von GU, Losem C, et al. Bendamustine plus rituximab 5156 – 5164. versus CHOP plus rituximab as first-line treatment for 54.Miller BW, Przepiorka D, de Claro RA, Lee K, Nie L, patients with indolent and mantle-cell lymphomas: an Simpson N, et al. FDA approval: idelalisib monotherapy open-label, multicentre, randomised, phase 3 non-infe- for the treatment of patients with follicular lymphoma riority trial. Lancet 2013; 381: 1203 – 1210. and small lymphocytic lymphoma. Clin Cancer Res 2015; 45.Flinn IW, van der Jagt R, Kahl BS, Wood P, Hawkins 21: 1525 – 1529. TE, Macdonald D, et al. Randomized trial of bendamus- 55.Reagan PM, Friedberg JW. Follicular lymphoma: first- tine-rituximab or R-CHOP/R-CVP in first-line treatment line treatment without chemotherapy for follicular lym- of indolent NHL or MCL: the BRIGHT study. Blood 2014; phoma. Curr Treat Options Oncol 2015; 16: 32. 123: 2944 – 2952. 56.Shanafelt TD, Rabe KG, Kay NE, Zent CS, Jelinek DF, 46.Martinelli G, Schmitz SF, Utiger U, Cerny T, Hess Reinalda MS, et al. Age at diagnosis and the utility of U, Bassi S, et al. Long-term follow-up of patients with prognostic testing in patients with chronic lymphocytic follicular lymphoma receiving single-agent rituximab at leukemia. Cancer 2010; 116: 4777 – 4787. two different schedules in trial SAKK 35/98. J Clin Oncol 57.Goede V, Fischer K, Busch R, Engelke A, Eichhorst B, 2010; 28: 4480 – 4484. Wendtner CM, et al. Obinutuzumab plus chlorambucil in 47.Kaminski MS, Tuck M, Estes J, Kolstad A, Ross CW, patients with CLL and coexisting conditions. N Engl J Zasadny K, et al. 131I-tositumomab therapy as initial Med 2014; 370: 1101 – 1110. treatment for follicular lymphoma. N Engl J Med 2005; 58.Byrd JC, Brown JR, O‘Brien S, Barrientos JC, Kay NE, 352: 441 – 449. Reddy NM, et al. Ibrutinib versus ofatumumab in previ- 500 2016 Band 56 / 3 internistische praxis ously treated chronic lymphoid leukemia. N Engl J Med 2014; 371: 213 – 223. 59.Byrd JC, O‘Brien S, James DF. Ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013; 369: 1278 – 1279. 60.O‘Brien S, Furman RR, Coutre SE, Sharman JP, Burger JA, Blum KA, et al. Ibrutinib as initial therapy for Interessenkonflikt: Frau PD Dr. Hohloch erklärt, dass Verbindungen zu den Firmen Gilead (Idelalisib) und Roche (GA-101; Obinutuzumab) durch Advisory Board bestehen. Herr Dr. Zettl erklärt, dass Verbindungen zur Firma Roche (Mabthera, Gazyvaro) durch Unterstützung bei Kongressbesuchen bestehen. elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol 2014; 15: 48 – 58. 61.Furman RR, Sharman JP, Coutre SE, Cheson BD, Pagel JM, Hillmen P, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370: 997 – 1007. 62.Eichhorst BF, Busch R, Stilgenbauer S, Stauch M, Bergmann MA, Ritgen M, et al. First-line therapy with fludarabine compared with chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia. Blood 2009; 114: 3382 – 3391. 63.Knauf WU, Lissichkov T, Aldaoud A, Liberati A, Loscertales J, Herbrecht R, et al. Phase III randomized study of bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic Priv.-Doz. Dr. Karin Hohloch Abteilung Hämatologie und Onkologie Kantonsspital Graubünden Chur Loëstrasse 170 Ch-7000 Chur leukemia. J Clin Oncol 2009; 27: 4378 – 4384. 64.Soubeyran P, Bellera CA, Gregoire F, et al. Validation of a screening test for elderly patients in oncology. J Clin [email protected] [email protected] Oncol 2008; 26: 15S. internistische praxis 2016 Band 56 / 3 501 CME cm e. mg o -f ac h v erl a ge .d e Zertifizierung und Teilnahmebedingungen Behandlungsstrategie bei Lymphomen im höheren Alter CME-Board Auer J, Braunau Beuers U, Amsterdam Borkhardt A, Düsseldorf Diener HC, Essen Möhrle W, Gräfeling Pankow W, Berlin Pfeifer M, Bad Pyrmont Ritter MM, Berlin (Schriftleiter) Römer W von, München Schäfer H, Völklingen Schmeling-Kludas C, Rosengarten Wahrburg U, Münster Wesiack W, Hamburg Zachoval R, München K. Hohloch, F. Zettl Diese Fortbildungseinheit wird von der Bayerischen Landesärztekammer für die zertifizierte Fortbildung in der Kategorie I (Tutoriell unterstützte Online-Fortbildungsmaßnahme) anerkannt. Bei richtiger Beantwortung von mindestens 70 % der Fragen erhalten Sie bis zu 4 Fortbildungspunkte. CME-Punkte werden im Rahmen von Äquivalenzregelungen auch von den anderen Landesärztekammern und der Österreichischen Ärztekammer anerkannt. CME-Online-Teilnahme Für die Teilnahme an den CME-Fortbildungseinheiten müssen Sie sich einmalig im CME-Online-Portal der Mediengruppe Oberfranken Fachverlage registrieren: cme.mgo-fachverlage.de Nach Freischaltung können Sie auf diese Fortbildungseinheit sowie auf alle anderen im CME-Online-Portal zur Verfügung gestellten Fortbildungsmodule zugreifen und zusätzliche Fortbildungspunkte erwerben. Diese zertifizierte Fortbildung ist 12 Monate auf cme.mgo-fachverlage.de verfügbar. Dort erfahren Sie auch den genauen Teilnahmeschluss. internistische praxis 56/3, 483–501 (2016) Ihr Testergebnis und die Teilnahmebescheinigung erhalten Sie sofort nach Absenden des Tests. Die zuerkannten CMEPunkte werden automatisch an die für Sie zuständige Landesärztekammer weitergeleitet. cme.mgo-fachverlage.de Eine Übermittlung von Testbögen auf dem Postweg ist nicht mehr möglich!