1 Grundwissen Chemie 9. Klasse Stoffe und Reaktionen Reinstoffe
Werbung

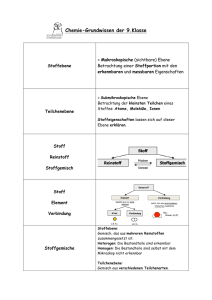
1 Grundwissen Chemie 9. Klasse Stoffe und Reaktionen Reinstoffe: Besteht eine Stoffportion nur aus einer einzigen Stoffart, so sprechen wir von einem Reinstoff. Er kann mit physikalischen Trennmethoden nicht weiter zerlegt werden. Gemische: Ist die Stoffportion aus mehreren Stoffarten zusammengesetzt, so liegt ein Stoffgemisch vor. Es kann heterogen (uneinheitlich) od. homogen (einheitlich) sein. Synthese: Aus zwei od. mehreren Edukten entsteht ein Produkt. Analyse: Aus einem Edukt entstehen mehrere Produkte. Chemische Verbindung: Reinstoffe, die sich in andere Reinstoffe zersetzen lassen, nennt man Verbindungen. Chemisches Element: Elemente sind Reinstoffe, die sich nicht weiter in andere Reinstoffe zersetzen lassen. Aggregatzustände: fest- flüssig- gasförmig Vorgänge: Kondensieren, Verdampfen, Erstarren, Schmelzen, Sublimieren, Resublimieren. Gesetz von der Erhaltung der Masse: Bei einer chemischen Reaktion ändert sich die Gesamtmasse der Reaktionspartner nicht. Die Summe der Massen der Edukte ist gleich der Summe der Massen der Produkte. Chemische Symbole: z.B. für Wasserstoff H, für Sauerstoff O, für Kohlenstoff C, für Stickstoff N, für Schwefel S, für Chlor Cl, Brom Br, Iod I, weitere Symbole Al, Fe, Ag, Na, K, Ca, Mg. Kleinste Teilchen: Atome, Moleküle (bestehen aus zwei oder mehreren Atomen) oder Ionen (geladene Atome oder Moleküle). Chemische Formeln: z.B. für Wasser H2O, für Kohlenstoffdioxid CO2, für Sauerstoff O2. Nur mit Index 2 kommen vor: F2, Cl2, Br2, I2, O2, N2, H2. Index: Tiefgestellte Zahl, die die Anzahl der Atome eines Elements in einem Molekül angibt. Koeffizient: Vorangestellte Zahl, die die Anzahl der Teilchen angibt. Chemische Reaktionsgleichungen werden nur durch Veränderung der Koeffizienten richtig gestellt. Exotherme Reaktionen: Sie setzen Energie frei. Dabei wird innere Energie der Edukte in Wärme, Licht- od. elektrische Energie umgewandelt. Endotherme Reaktionen: Sie speichern Energie. Dabei wird Wärme, Licht- od. elektrische Energie von außen zugeführt und in innere Energie der Produkte umgewandelt. Aktivierungsenergie: Energie, die zur Auslösung einer Reaktion zugeführt werden muss. Katalysator: Er setzt die Aktivierungsenergie herab und beschleunigt eine chemische Reaktion. Enzyme sind Biokatalysatoren. Atombau und Periodensystem der Elemente (PSE) Aufbau eines Atoms aus Elementarteilchen: Protonen, Neutronen und Elektronen. Elektronenkonfiguration: Besetzung der Hauptschalen mit Elektronen nach Formel 2 n2. 2 Ionisierungsenergie: Die für die Abspaltung von Elektronen notwendige Energie. Valenzelektronen: Elektronen auf der äußersten Schale (Valenzschale). Ordnung im PSE: Von links nach rechts: Hauptgruppen (HG) I – VIII (gibt die Zahl der Valenzelektronen an). Von oben nach unten: Perioden 1-7 (gibt die Zahl der Hauptschalen an) . HG I Alkalimetalle, HG II Erdalkalimetalle, HG VII Halogene, HG VIII Edelgase. Oktettregel: Die Atome streben nach acht Valenzelektronen auf der äußersten Schale. Sie sind damit besonders stabil und erreichen Edelgaskonfiguration (Elektronenoktett). Metallatome: Sie geben Valenzelektronen ab. Nichtmetallatome: Sie nehmen Valenzelektronen auf. Chemische Bindung Salze (Ionenbindung): -Ion: die positiv geladenen Ionen werden Kationen, die negativ geladenen Anionen genannt. -Ionenwertigkeit: Sie entspricht der Ladung der Ionen und gibt an, wie viele Elektronen aufgenommen bzw. abgegeben wurden. -Ionengitter : entsteht durch elektrostatische Anziehung zwischen Kationen und Anionen . -Salze bestehen aus Metallkationen und Nichtmetallanionen. -Salze sind spröde und hart, elektrisch leitfähig in Lösungen und Schmelzen, bilden Kristalle. Metalle (Metallbindung): -Elektronengas aus Valenzelektronen hält die positiven Atomrümpfe zusammen (Metallbindung). Es entsteht ein Metallgitter. -Metalle sind elektrisch leitfähig, wärmeleitfähig und verformbar. Molekular gebaute Stoffe (Elektronenpaarbindung oder Atombindung): -Moleküle sind kleinste Teilchen aus Nichtmetallatomen. -Bei einer Elektronenpaarbindung gehört das bindende Elektronenpaar beiden Partnern zu gleichen Teilen. Jeder Partner strebt nach der Edelgaskonfiguration. -Einfachbindungen, Doppelbindungen und Dreifachbindungen sind möglich. -Valenzstrich-Schreibweise (Lewis-Formeln): bindende und nichtbindende Elektronenpaare werden als Striche geschrieben. Quantitative Aspekte chemischer Reaktionen Relative Atommasse: Sie gibt an, wie groß die Masse eines Atoms im Vergleich zur Masse des Kohlenstoffisotops 12C ist. Atomare Masseneinheit u: Sie beträgt 1/12 der Atommasse des Kohlenstoffisotops 12C . Stoffmenge n: 1 Mol ist die Stoffmenge eines Stoffes, die aus 6,022 x 1023 Teilchen besteht. (Avogadro- Konstante). Molare Masse M: Masse eines Mols in g/mol. Molares Volumen Vm : Volumen eines Mols, entspricht 22,4 l/mol. Es gilt die Beziehung n = m/M, wobei m die Masse einer bestimmten Stoffportion in Gramm ist. Fachschaft B/C, MWG Bayreuth 11/2012