Alles im Fluss
Werbung

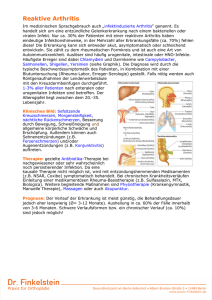
Rheumatoide Arthritis cme-fortbildung Alles im Fluss CME-Fortbildung zur Basistherapie der Rheumatoiden Arthritis Die vom griechischen ´εω – Fließen – hergeleitete Bezeichnung rheumatischer Erkrankungen stammt aus der Zeit des Rheumatischen Fiebers. Das Rheumatische Fieber trat in Folge von Streptokokkeninfektionen auf. Es ist gekennzeichnet durch von Gelenk zu Gelenk wandernde (fließende) Schmerzen und Schwellungen. Das Rheumatische Fieber ist in den entwickelten Ländern selten geworden. Bei der heute wichtigeren Rheumatoiden Arthritis (RA) ist der Gelenkbefall vergleichsweise stabil. Im Fluss sind eher die Kriterien der Diagnose und Klassifikation sowie die Behandlungsempfehlungen. Die Behandlungsmöglichkeiten der RA wurden in den letzten 12 Jahren durch die Einführung der TNF-Alpha-Inhibitoren erweitert. Später kamen weitere monoklonale Antikörperpräparate hinzu. Sie werden aufgrund der biosynthetischen Herstellungsverfahren mit den TNF-Alpha-Inhibitoren unter dem Oberbegriff „Biologika“ zusammengefasst. Mit dem in den USA bereits zugelassenen Tyrosinkinase(JAK)-Inhibitor Tofacitinib steht eine weitere Wirkstoffgruppe vor der Tür. Im ersten Halbjahr 2012 waren 3 der überwiegend in der Basistherapie der RA eingesetzten TNF-Alpha-Inhibitoren auf den Positionen 1, 2 und 14 der 30 umsatzstärksten Fertigarzneimittel in Niedersachsen1. Bundesweit haben sich die Verordnungen der antirheumatischen Basistherapeutika oder „Remissionsinduktoren“ in definierten Tagesdosen (DDD) von 2002 bis 2011 mehr als verdoppelt. Der Verordnungsanstieg erfolgte in den letzten Jahren ausschließlich bei den kostenintensiven Biologika2. Dieser Fortbildungsartikel soll helfen, die aktuellen Konzepte in der Diagnose und Therapie der RA zu verstehen und zu beurteilen. Dabei werden insbesondere die Konzepte einer frühzeitigen Diagnosestellung und der Remission als Therapieziel erörtert. Soweit möglich wird die Eignung verschiedener Therapiestrategien bzw. Wirkstoffe zu Erreichung der bestmöglichen Therapieergebnisse verglichen. Die RA wird zu den Autoimmunerkrankungen gezählt und betrifft etwa 0,5 bis 1 Prozent der Erwachsenen in den entwickelten Ländern. Die Prävalenz steigt mit dem Alter und ist bei Frauen etwa zwei- bis dreimal so hoch wie bei Männern3,4. Der Verlauf ist variabel. Anfangs stehen schmerz- hafte Gelenkentzündungen mit einer reversiblen Funktionsbeeinträchtigung im Vordergrund. In fortgeschrittenen Stadien werden bleibende Behinderungen durch deformierte und versteifte Gelenke befürchtet5. Auf die extraartikulären und systemischen Manifestationen sowie differentialdiagnostische Aspekte kann hier nicht eingegangen werden. Therapieziele Durch die Therapie sollen Schmerzen reduziert oder beseitigt werden. Die Gelenkentzündung soll unterdrückt werden. Zur Besserung der entzündungsbedingten Beschwerden werden die nichtsteroidalen Antirheumatika (NSAR), physikalische Therapien sowie lokal injizierte und systemische Glucocorticoide eingesetzt. Bereits dadurch kann im frühen Stadium die Gelenkfunktion gebessert oder wiederhergestellt werden. Die Gelenkdestruktion soll durch die sogenannte Basistherapie mit den DMARD (disease modifying antirheumatic drugs) aufgehalten werden. Historisch haben sich die DMARD daraus entwickelt, dass die Unterdrückung der Entzündung durch systemisch verabreichte Glucocorticoide auf lange Sicht gefährliche Nebenwirkungen hervorbringt. Es wurde eine Kortisoneinsparung oder -vermeidung angestrebt6. Durch zahlreiche Studien wurde der längerfristig günstige Einfluss der DMARD auf den destruierenden Verlauf der RA belegt7. Das Therapieziel, die aus einer RA resultierenden Behinderungen und die Notwendigkeit rekonstruktiver chirurgischer Eingriffe zu reduzieren oder zu vermeiden, wird somit greifbar. Es entwickelte sich das Konzept, durch eine weitestgehende Unterdrückung der Entzündung auch das Fortschreiten der Gelenkdestruktion aufzuhalten. Wesentliche Eckpfeiler der Rheumabasistherapie sind8 1| der frühe Beginn (die Chance, eine Gelenkdestruktion zu verhindern, ist am größten, bevor sie begonnen hat), 2| ein entzündungsfreier Zustand oder Remission als Behandlungsziel, gegebenenfalls durch Einsatz von Wirkstoffkombinationen, 3| und die Eskalation der Therapie mit Einbeziehung der Biologika bei unzureichendem Effekt. 4 | 2013 niedersächsisches ärzteblatt A9 cme-fortbildung Rheumatoide Arthritis Aus diesen Eckpunkten ergeben sich die wesentlichen Problemfelder: > Welche diagnostischen Kriterien ermöglichen eine frühe Diagnose mit zuverlässiger prognostischer Einschätzung? > Welche Mittel werden in welcher Reihenfolge und in welchen Kombinationen eingesetzt? > Wie wird die Remission der RA definiert (klinisch, labormedizinisch, mit bildgebenden Verfahren)? Ist als Ziel eine geringe Krankheitsaktivität ausreichend? > Wo sind Grenzen der Eskalation in zunächst therapierefraktären Fällen zu setzen (Nebenwirkungen, Akzeptanz der Patienten)? > Ist eine dauerhafte Remission, die eine Therapiereduzierung oder -beendigung ermöglicht, erreichbar? Die Sensitivität der ARA 1987-Kriterien für die Erfassung einer RA im Frühstadium wird als zu gering angesehen. Zwei der 7 Kriterien (Rheumaknoten und radiologische Veränderungen) sind in frühen Stadien der RA nicht zu erwarten. Die Entstehung radiologisch nachweisbarer Erosionen soll durch einen frühen Therapiebeginn vermieden werden. Erosionen waren bei etwa 75 Prozent der RA-Patienten der Kohorte, aus der die Kriterien abgeleitet wurden, bereits vorhanden9. Für diese Patienten ist das Zeitfenster für die Induktion einer Remission möglicherweise bereits abgelaufen. In einer aktuellen kanadischen Kohorte von 1187 Patienten mit Früharthritis (Symptomdauer zwischen 6 Wochen und einem Jahr) hatten 26,5 Prozent der Patienten mit einer nach ARA 1987 als RA zu diagnostizierenden Erkrankung bereits Erosionen10. Frühdiagnose 2010 wurden vom American College of Rheumatology (ACR) und der Europäischen Rheumaliga (EULAR) neue besonders auf die Erfassung der RA im Frühstadium abzielende Kriterien für die „Klassifikation“ der RA formuliert11. Die neuen Kriterien sind im Anhang der online-Version dieses Artikels wiedergegeben. Der neue serologische Marker, ACPA (Antikörper gegen citrulliniertes Protein = Anti-CCPAk), wurde einbezogen. Laborwerte und die Zahl der betroffenen Gelenke erhalten ein größeres Gewicht. Die Symptomdauer spielt eine geringere Rolle. Die Validierung der neuen Kriterien an einer Kohorte von 2.258 Patienten mit „Früharthritis“ von weniger als 2 Jahren Dauer (Leiden Early Arthritis Clinic Cohort) ergab gegenüber den ARA 1987 Kriterien eine von 53 auf 71 Prozent verbesserte Sensiti- Die neuen Therapiekonzepte haben dazu beigetragen, dass die 1987 von der Amerikanischen Rheuma Gesellschaft (ARA, jetzt American College of Rheumatology – ACR) formulierten diagnostischen Kriterien der RA9 in Frage gestellt wurden. Die ARA 1987-Kriterien waren ihrerseits das Ergebnis einer Reihe aufeinanderfolgender Modifikationen der 1956 entwickelten Klassifikation. Da eine Unterteilung in „wahrscheinliche“, „mögliche“, „sichere“ und „klassische RA“ seit 1987 nicht mehr vorgesehen ist, handelt es sich genaugenommen nicht mehr um eine Klassifikation, sondern um diagnostische Kriterien. Die ARA 1987 Kriterien sind im Kasten dargestellt. ARA 1987 Kriterien für die Diagnose einer Rheumatoiden Arthritis: 1| Morgensteifigkeit mindestens eine Stunde 2| Entzündung (Erguss oder Weichteilschwellung) in mindestens 3 von 14 Gelenkarealen (proximale Interphalangealgelenke, Metacarpophalangealgelenke, Handgelenk, Ellbogen, Knie, Sprunggelenk oder Metatarsophalangealgelenke, jeweils rechts oder links), 3| Entzündung von Gelenken der Hand, 4| Symmetrische Arthritis (mindestens eine Gelenkregion beidseits betroffen, beidseitiger Befall von proximalen Interphalangealgelenken, Metacarpophalangealgelenken oder Metatarsophalangealgelenken ausreichend), A10 niedersächsisches ärzteblatt 4 | 2013 5| Rheumaknoten, 6| Rheumafaktor über der 95. Perzentile der Normalbevölkerung, 7| Radiologische Veränderungen (Erosionen oder gelenknahe Entkalkung), Kriterien 1 bis 4 müssen mindestens 6 Wochen bestehen. Bei Vorliegen von 4 der 7 Kriterien wird eine Rheumatoide Arthritis diagnostiziert9. Rheumatoide Arthritis vität für die Vorhersage einer nach 5 Jahren fortbestehenden Erkrankung. Die Spezifität war mit 65 Prozent gegenüber 75 Prozent etwas schlechter12. Eine schematische Anwendung der neuen Kriterien erhöht das Risiko einer Übertherapie13. Ein großer Teil der durch die neuen Kriterien zusätzlich als RA klassifizierten Patienten der erwähnten kanadischen Früharthritis-Kohorte zeigte eine geringere Krankheitsaktivität als die auch die ARA 1987-Kriterien erfüllenden Patienten10. Es gibt keine sichere Evidenz, dass alle nach den neuen Kriterien diagnostizierten RA-Patienten von einer Basistherapie profitieren14. Zur Vermeidung einer Überbehandlung sind diagnostische Kriterien mit höherer Spezifität von Vorteil, zumal die Therapie auch mit Risiken assoziiert ist. Letztlich sind individuelle Therapieentscheidungen unausweichlich. Zur Unterstützung wurde in Leiden ein Algorithmus entwickelt15 und validiert16, der helfen soll, den weiteren Verlauf einer frühen undifferenzierten Arthritis vorherzusagen und die 40 – 50 Prozent der Patienten zu identifizieren, die eine gute Chance haben, spontan zu remittieren und daher von einer Basistherapie nicht profitieren können. Der prädiktive Algorithmus ist im Anhang der online-Version dieses Artikels dargestellt. Zusätzlich zur prognostischen Einschätzung sollte die Krankheitsaktivität vor Therapiebeginn als Ausgangspunkt für Verlaufskontrollen quantifiziert werden. Es gibt sechs Skalen, die vom ACR als praktikabel und zuverlässig für die Unterscheidung niedriger, mäßiger und hoher Krankheitsaktivität angesehen werden17. Dazu gehört der „Disease Activity Score“ (DAS). Die Erhebung des DAS ist für Rheumatologen und Orthopäden nach dem EBM abrechenbar. Am häufigsten wird die Variante mit einer Berücksichtigung der Schwellung und Druckdolenz von 28 Gelenken (DAS28) angewandt18. Die Untersuchung der Fußgelenke wird nicht eingerechnet. Eine detaillierte Anleitung und ein Kalkulator sind online verfügbar (www.das28.nl). Frühe Therapie mit Methotrexat Nicht bei jedem Patienten mit RA kann medikamentös eine Remission induziert werden. Die Chancen einer Remission sind um so höher, je kürzer die Symptome vor Therapiebeginn bestanden haben19. Sobald ausreichende diagnostische und prognostische Klarheit besteht, wird die Einleitung einer Basistherapie empfohlen. Diese komplexe Entscheidung liegt in der Regel in der Hand eines Rheumatologen. Sie setzt die frühzeitige gezielte Überweisung an diesen voraus. Eine symptomatische Therapie (NSAID) sollte vom Erstbehandler begonnen werden. Die Übermittlung kli- cme-fortbildung nischer und gegebenenfalls laborchemischer und radiologischer Vorbefunde hilft bei der Sicherung der Diagnose. In einer systematischen Übersicht direkter Vergleichsstudien verschiedener synthetischer DMARD gegeneinander fand sich keine überlegene Wirksamkeit oder Sicherheit einzelner Wirkstoffe. Für Methotrexat, Leflunomid und Sulfasalazin gibt es etwa gleichwertige Wirksamkeitsbelege7. Als Mittel der Wahl für die Basistherapie hat sich Methotrexat durchgesetzt20,8. Die Behandlung wird laut Fachinformation mit 7,5 bis 15 mg einmal wöchentlich per os begonnen und je nach Verträglichkeit schrittweise auf maximal 20 – 30 mg einmal wöchentlich gesteigert21. Bei unzureichender Wirkung ist die Umstellung auf die etwa fünfmal teurere parenterale Darreichungsform möglich. Zur Abschwächung der Nebenwirkungen von Methotrexat soll parallel Folsäure, mindestens 5 mg pro Woche, eingenommen werden22. Bei der Methotrexat-Therapie muss sichergestellt werden, dass nicht irrtümlich eine tägliche Einnahme erfolgt. Eine anfangs sehr engmaschige Überwachung des Blutbildes, der Leberwerte und der Nierenfunktion ist erforderlich. Von den zahlreichen potentiellen Arzneimittelinteraktionen wird besonders auf die additive Suppression der Blutbildung durch Cotrimoxazol hingewiesen. Die Fachinformation enthält weitere wichtige Hinweise. Laut Fachinformation ist der Erstlinieneinsatz von Methotrexat nur für besonders aggressiv verlaufende Fälle einer RA vorgesehen (siehe Tabelle 2 im online-Anhang). Der Nutzen für die Behandlung einer frühen, diagnostisch nicht eindeutig zugeordneten Arthritis ist nicht gesichert. In der aktuell publizierten PROMPT-Studie wurden Patienten mit einer „wahrscheinlichen RA“ nach den ARA 1958-Kriterien mit Methotrexat behandelt. Knapp die Hälfte der Patienten hatte bei Behandlungsbeginn eine RA nach den 2010 Kriterien. Weder in dieser retrospektiv definierten Subgruppe noch im Gesamtkollektiv wurde die Ausbildung einer manifesten RA (nach ARA 1987-Kriterien) innerhalb von 5 Jahren durch Methotrexat im Vergleich zu Placebo verhindert oder nennenswert verzögert. 25 Prozent der Subgruppe (RA nach 2010 Kriterien) erreichten spontan eine medikamentenfreie Remission23. 4 | 2013 niedersächsisches ärzteblatt A11 cme-fortbildung Rheumatoide Arthritis Glucocorticoide et al. Die Einbeziehung eines systemischen Glucocorticoids in niedriger Dosierung (7,5 oder 10 mg Prednison pro Tag) in die Basistherapie beschleunigt nicht nur die Besserung der Symptome, sondern beeinflusst auch den Verlauf günstig und reduziert die Ausbildung von radiologischen Gelenkschäden und Behinderungen im Verlauf von 2 Jahren24,25. Initial höher dosiertes Prednison (60 mg pro Tag) wurde in der 4-armigen BeSt-Studie (Erkrankungsdauer zu Behandlungsbeginn unter 2 Jahren) in den ersten Wochen auf 7,5 mg pro Tag reduziert und bei erreichter Remission nach 28 Wochen ausgeschlichen. Bei diesem Vorgehen kam es zu einer Verbesserung des Ansprechens auf eine Kombination von Methotrexat und Sulfasalazin26. Von der Mayo Clinic wird eine Fortsetzung mit 5 mg pro Tag bis zu einem Jahr und ein sehr langsames Ausschleichen (Reduzierung um 1 mg alle 2 bis 4 Wochen) befürwortet27. Es gibt jedoch keine Studien, die ein komplettes Absetzen des Glucocorticoids mit der dauerhaften Gabe einer Dosis unterhalb der Cushing-Schwelle verglichen haben28. Gegebenenfalls sind lokale Glucocorticoidinjektionen in einzelne besonders stark oder anhaltend entzündete Gelenke angezeigt27. Bei Kontraindikationen gegen Methotrexat oder Unverträglichkeit empfiehlt die europäische Leitlinie als Alternativen Leflunomid, Sulfasalzin oder eine parenterale Goldtherapie (Natriumaurothiomalat)29. Bei Anwendung von Leflunomid ist die Teratogenität des aktiven Metaboliten und die extrem lange Eliminationshalbwertszeit (3 Wochen) zu beachten. Frauen im gebärfähigen Alter müssen eine sichere Empfängnisverhütung praktizieren. Weitere synthetische DMARD sind Hydroxychloroquin, Chloroquin, Penicillamin, Auranofin, Azathioprin und Ciclosporin. Eine Tabelle mit den zugelassenen Indikationen und Therapiekosten findet sich im Anhang der online-Version dieses Artikels. Bezüglich der Kontraindikationen, potentieller Arzneimittelinteraktionen und dem erforderlichen Monitoring unerwünschter Effekte (Laborkontrollen) wird auf die Fachinformationen der einzelnen Präparate verwiesen. Der initiale Einsatz von DMARD-Kombinationen wurde in verschiedenen Studien untersucht, zeigt jedoch keine durchgängig günstige Beeinflussung des mittelfristigen Verlaufs im Vergleich zu einer bedarfsweisen Therapiesteigerung auf der Grundlage einer engmaschigen Verlaufsbeobachtung30,31. Der primäre Einsatz von TNF-Alpha-Inhibitoren bei Patienten mit besonders ausgeprägter entzündlicher Aktivität und Hinweisen auf rasche Krankheitsprogression hat keine nachgewiesenen Wirksamkeitsvorteile gegenüber A12 niedersächsisches ärzteblatt 4 | 2013 einer Basistherapie mit synthetischen DMARD, die die höheren Kosten rechtfertigen könnten32. Insgesamt ist die Wirksamkeit der Biologika eher in späteren Stadien der RA belegt4. Am Ziel? Die Auswirkung einer Basistherapie sollte spätestens nach 3 Monaten kontrolliert werden. Dabei sollte neben einer Überprüfung der Verträglichkeit die Krankheitsaktivität erneut quantifiziert werden. Die klassischen ACR-Kriterien des Therapieerfolges (ACR20, ACR50, ACR70) geben eine relative Verbesserung gegenüber dem Ausgangsbefund wieder. Heute wird jedoch zumindest bei frühem Behandlungsbeginn eine Unterschreitung von definierten Schwellenwerten der Krankheitsaktivität angestrebt33. Als Therapieziel gilt eine Remission, die beispielsweise als DAS28 < 2,6 definiert wird, oder eine niedrige Krankheitsaktivität (DAS28 < 3,2)8. Remissionskriterien sind als Surrogatparameter für die langfristige Verhinderung fortschreitender Gelenkschäden und daraus resultierender Behinderungen anzusehen. Sie müssen mit diesen patientenbezogenen Endpunkten validiert werden. Als intermediäre Surrogatparameter werden radiologische Scores verwendet. Da eine komplette Unterdrückung der Entzündung bei den wenigsten Patienten erreichbar ist, wird unter Remission ein Grad von Krankheitsaktivität verstanden, der den Patienten nicht beeinträchtigt und mit einer günstigen Prognose assoziiert ist34. Bei der Beobachtung einer Kohorte von im Frühstadium der RA behandelten Patienten über 5 Jahre zeigten sich nur geringe Unterschiede zwischen 9 verschiedenen Scores zur Erfassung einer Remission bezüglich ihrer Korrelation mit funktionellen Beeinträchtigungen (erfasst mit dem Health Assessment Questionaire – HAQ) und der radiologischen Progression35. Patienten mit einer Symptomdauer von weniger als 2 Jahren zu Behandlungsbeginn und einer minimalen radiologischen Progression in den ersten 2 Behandlungsjahren (höchstens 1 Einheit pro Jahr auf der von 0 bis 200 reichenden Larson-Skala – in dieser Studie als radiologische Remission bezeichnet) haben auch nach 15 Jahren einen deutlich niedrigeren Larson-Score als Patienten, bei denen keine oder nur eine kurzfristige Remission erreicht werden konnte36. Patienten, die unter 20 bis 30 mg Methotrexat einmal pro Woche oder in der maximal tolerierten oralen oder subkutanen Dosierung in Kombination mit einem Glucocorticoid in niedriger oder mittlerer (initiale 6 Wochen) Dosierung nach 3 Monaten eine niedrige Krankheitsaktivität oder Re- Rheumatoide Arthritis cme-fortbildung Abbildung 1: Differentialdiagnostisch wichtig: Befall der distalen Interphalangealgelenke und Nagelveränderungen bei Psoriasisarthritis (links), Hautveränderungen bei Jo-1-Syndrom (rechts). Fotos: Dr. Michael Schwarz-Eywill, Evangelisches Krankenhaus Oldenburg mission erreichen, sind zu 75 Prozent auch nach einem Jahr in Remission. Sollte dieses Ziel jedoch nicht erreicht werden, ist eine Therapieänderung bereits bei der 3-MonatsKontrolle angezeigt27. Bei Patienten mit einer eher günstigen Prognose ist der Wechsel zu einem anderen synthetischen DMARD möglich37. Therapieeskalation Bei einer Verschlechterung unter Methotrexat oder ungünstigen prognostischen Faktoren wird eine Kombination synthetischer DMARDs oder der Einsatz eines TNF-Alpha-Inhibitors (oder Abatacept oder Rituximab) in Kombination mit Methotrexat empfohlen37. Rituximab ist jedoch nur in der zweiten (oder dritten) Linie nach erfolgloser TNFAlpha-Inhibitor-Therapie zugelassen. In den meisten Studien wurde die Kombination aus einem TNF-Alpha-Blocker und Methotrexat mit einer Methotrexat-Monotherapie verglichen. Dabei konnte eine Überlegenheit der Kombination im Hinblick auf klinische und radiologische Parameter gezeigt werden38,39. Ein direkter Vergleich der Kombinationen von Methotrexat und einem TNF-Alpha-Inhibitor mit Kombinationen von 2 oder mehr synthetischen DMARD erfolgte nur in 3 randomisierten kontrollierten Studien26,30,40. In diesen Studien zeigte sich ein etwas schnellerer Rückgang der Aktivitätsscores nach 24 Wochen bzw. 1 Jahr bei Einsatz des TNF-Alpha-Blockers. Die Unterschiede waren nach 2 Jahren jedoch weitestgehend nivelliert41,30,42, insbesondere in Bezug auf die klinischen Parameter. Bei den synthetischen DMARD wird die Kombination von Leflunomid mit Methotrexat wegen der additiven Lebertoxizität nicht empfohlen43. Am ehesten gesichert ist die Empfehlung für den Einsatz eines TNF-Alpha-Blockers, wenn trotz der Behandlung mit mindestens zwei adäquat dosierten synthetischen DMARD in sequentieller Monotherapie oder in Kombination eine mittlere oder hohe Krankheitsaktivität persistiert43. Für die Auswahl unter den fünf verfügbaren TNF-Alpha-Inhibitoren ergeben sich aus diversen Metaanalysen keine eindeutigen Kriterien, da es kaum direkte Vergleichsstudien gibt. Die Ergebnisse indirekter Vergleiche hängen stark von der Auswahl der eingeschlossenen Originalstudien und den angewandten statistischen Methoden ab44. Es gibt allenfalls Hinweise für eine bessere Verträglichkeit von Etanercept im Vergleich zu anderen TNF-Alpha-Antagonisten45. Die relative Inzidenz sowohl schwerwiegender Infektionen46 als auch von Malignomen47 waren in Metaanalysen der randomisierten Studien unter Etanercept geringer als unter Adalimumab und Infliximab. Für die neueren TNF-AlphaInhibitoren (Certolizumabpegol und Golimumab) liegen noch keine ausreichenden Daten für eine vergleichende Bewertung dieser Risiken vor48. Die Therapie mit TNF-Alpha-Inhibitoren und anderen biologischen DMARDs (Abatacept, Anakinra, Tocilizumab und Rituximab) gehört in die Hand von Ärzten, die über ausreichende Kenntnisse und Erfahrungen in der Rheumatologie und der Therapie mit diesen Wirkstoffen verfügen. Vor Einleitung einer Biologika-Therapie sollten Infektionen ausgeschlossen werden, die unter der Therapie aktiviert werden könnten, z. B. Tuberkulose, Hepatitis B oder C. Zu den Kontraindikationen der TNF-Alpha-Blocker gehören die Herzinsuffizienz und anamnestische Malignome (relativ) sowie bei Etanercept eine alkoholbedingte Hepatitis37. Be4 | 2013 niedersächsisches ärzteblatt A13 cme-fortbildung Rheumatoide Arthritis züglich weiterer Kontraindikationen, der im Verlauf erforderlichen Kontrolluntersuchungen sowie der während der Applikation erforderlichen Überwachung wird auf die jeweiligen Fachinformationen verwiesen. Methotrexat ist bisher das einzige synthetische DMARD, das mit TNF-Alpha-Inhibitoren im Rahmen des zugelassenen Anwendungsgebietes (laut Fachinformation) kombiniert werden darf. Bei Unverträglichkeit von Methotrexat ist eine Monotherapie mit Etanercept, Adalimumab oder Certolizumabpegol (sowie Tocilizumab) möglich. Für Certolizumabpegol, Golimumab und die nicht über den TNFAlpha Mechanismus wirkenden biologischen DMARD sind die Belege des Langzeitnutzens (Verhinderung von Gelenkdestruktionen und Behinderungen) noch unsicher49. Anakinra ist den TNF-Alpha-Blockern eher unterlegen49. Bei mangelhaftem Ansprechen auf den zuerst eingesetzten TNF-Alpha-Inhibitor oder Unverträglichkeit kann auf einen anderen TNF-Alpha-Inhibitor oder auf Abatacept, Tocilizumab oder Rituximab gewechselt werden. Von Kombinationen mehrerer Biologika wird wegen additiver Nebenwirkungen abgeraten7. Nach Versagen mehrerer Biologika nimmt die Wahrscheinlichkeit des Ansprechens auf ein anderes Biologikum ab50. In diesen Fällen kann auch auf ein bei dem jeweiligen Patienten noch nicht erfolglos angewandtes synthetisches DMARD zurückgegriffen werden43. Ist eine Remission nicht erreichbar, so sollte eine Therapie angestrebt werden, bei der die Reduktion der Krankheitsaktivität in einem für den Patienten akzeptablem Verhältnis zu dem mit der Behandlung verbundenen Aufwand und Nebenwirkungsrisiko steht. Lebenslang? Eine der aktuell wichtigsten Fragen in der Rheumabasistherapie ist die nach den Möglichkeiten und Kriterien für eine Reduktion einer eskalierten Basistherapie nach Erreichen einer Remission. Studiendaten zu dieser Fragestellung sind nur begrenzt verfügbar. Wegen der erheblichen Nebenwirkungen in der Langzeitbehandlung sollte gegebenenfalls als erstes das systemische Glucocorticoid langsam (!) ausschleichend abgesetzt werden27. Bei einer ein Jahr anhaltenden Remission (ohne NSAID) können TNF-AlphaBlocker unter engmaschiger Beobachtung schrittweise in der Dosis reduziert und gegebenenfalls abgesetzt werden29. Mit einer Reaktivierung der RA muss gerechnet werden. Patienten mit einer früh begonnenen Basistherapie bleiben häufiger nach Absetzen des TNF-Alpha-Blockers in Remission als Patienten mit verzögertem Beginn der Basistherapie51. Nach dem Absetzen synthetischer DMARDs blieben in 2 Studien, in denen keine Biologika eingesetzt worden waren, 10 bis 15 Prozent der Patienten mit frühem Behandlungsbeginn mindestens 1 Jahr lang in Remission52. A14 niedersächsisches ärzteblatt 4 | 2013 Abbildung 2: Rö-Aufnahme mit Erosionen an den Köpfchen der Metacarpalia 1 bis 5; Erosionen und Sekundärarthrose des proximalen Interphalangealgelenkes 5; Ankylose des distalen Interphalangealgelenkes 5; Erosionen, Sekundärarthrose und Rheumaknoten des distalen Interphalangealgelenkes 3; Erosionen an der Basis des MHK 5 und am Processus styloideus ulnae; Gelenkspaltverschmälerung Metacarpophalangealgelenk 4; Rheumaknoten am Metakarpophalangialgelenk des 5. Strahles. Foto: Institut für Radiologie und Neuroradiologie des Evangelischen Krankenhauses Oldenburg Bei Nachweis des Rheumafaktors oder von ACPA (Anti-CCPAk) war eine anhaltende medikamentenfreie Remission weniger wahrscheinlich52. In der aktuell publizierten PRESERVE-Studie wurden Patienten mit einer mittleren Krankeitsdauer von 6,4 bis 7,3 Jahren, die zuvor keinen TNF-Alpha-Blocker erhalten hatten, mit der Kombination aus Methotrexat und Etanercept behandelt. Die Patienten, die von Woche 12 bis Woche 36 eine anhaltend niedrige Krankheitsaktivität hatten, wurden randomisiert den drei Studienarmen zugeteilt: Beendigung von Etanercept oder Fortführung in voller bzw. halbierter Dosis. Nach dem Absetzen von Etanercept kam es im Laufe eines Jahres häufiger zu einer Reaktivierung der RA. Zwischen den beiden Etanercept-Dosierungen ergaben sich keine Unterschiede in den klinischen und radiologischen Ergebnissen53. Rheumatoide Arthritis Das Risiko eines Wiederaufflammens der Erkrankung ist unter fortgesetzter Therapie geringer als nach Reduzierung oder Absetzen. Das Risiko muss gegenüber den aufgetretenen und potentiellen Nebenwirkungen (die bei langjähriger Anwendung noch weitgehend unbekannt sind), der Beeinträchtigung durch die Therapie und den Kosten abgewogen und mit dem Patienten erörtert werden. Eine engmaschige Verlaufskontrolle ermöglicht die rechtzeitige Feststellung der Reaktivierung. Bei Wiederaufnahme der unterbrochenen Therapie zeigt sich überwiegend ein gutes Ansprechen ohne nennenswerte radiologische Progression54. Komorbidität Die Behandlung der RA ist wirksamer geworden, aber auch komplexer. Es muss nicht nur die RA behandelt werden, sondern der ganze Patient. Dazu gehören die häufig bestehenden Begleiterkrankungen. Entsprechend der Altersstruktur der RA-Patienten kommen alle häufigen chronischen Erkrankungen vor, vom Hypertonus bis zur Depression und chronisch obstruktiven Atemwegserkrankung. Zu den speziell mit der RA assoziierten Erkrankungen wird die Atherosklerose gezählt. Die systemische entzündliche Aktivität scheint das Fortschreiten atherosklerotischer Prozesse und ihre akuten thrombotischen Manifestationen zu begünstigen4. Aus den Begleiterkrankungen können sich wichtige Gesichtspunkte für die Auswahl der antirheumatischen Wirkstoffe ergeben. Die wegen interkurrenter akuter oder der begleitenden chronischen Erkrankungen gegebenenfalls erforderlichen Medikamente müssen im Hinblick auf Interaktionsmöglichkeiten mit der Rheumatherapie abgestimmt werden. Die immunsupprimierende Wirkung eines Teils der synthetischen DMARD und der Biologika muss bei interkurrenten Infekten berücksichtigt werden. Bei schweren Infekten kann eine Unterbrechung der Basistherapie angebracht sein. Dem erhöhten Risiko kardiovaskulärer Ereignisse sollte nach Möglichkeit durch Beeinflussung der „normalen“ Risikofaktoren begegnet werden4. Durch eine Nikotinkarenz scheint auch die Wirkung von Methotrexat und TNFAlpha-Inhibitoren verbessert zu werden55. cme-fortbildung Fazit Die RA ist eine Erkrankung, an der sich exemplarisch die Notwendigkeit der Zusammenarbeit der Ärzte verschiedener Fachgebiete bei der Betreuung des Patienten zeigt. Im Mittelpunkt steht der Hausarzt, der über den jeweiligen Stand der rheumatischen Erkrankung und der antirheumatischen Therapie informiert und durch die Übernahme eines Teils der erforderlichen klinischen und Laborkontrollen in die Behandlung eingebunden sein sollte. Durch die Zusammenarbeit der Fachgruppen ist es in den letzten Jahren gelungen, mehr Rheumapatienten rechtzeitig einer adäquaten Diagnostik und Therapie zuzuführen. Die mittleren Aktivitätsscores sukzessiver Patientenkohorten sind rückläufig56. Es gibt weniger stationär behandlungsbedürftige Patienten und weniger Gelenkersatzeingriffe bei RA4, so dass auch Grund zur Hoffnung besteht, dass die schweren verkrüppelnden Endstadien der RA in Zukunft seltener beobachtet werden. Diese Erfolge waren bereits vor dem Einsatz der Biologika zu verzeichnen4. Sie sind zumindest teilweise der Versorgungsqualität geschuldet, die durch eine konstruktive Zusammenarbeit der Fachgruppen und Versorgungsbereiche erzielt werden konnte. Dr. med. Rainer Burkhardt Beratender Arzt der KVN Bezirksstelle Oldenburg Ein ergänzender Anhang mit diagnostischen und prädiktiven Kriterien sowie Kostenvergleichstabellen findet sich in der online-Version dieser Fortbildung unter www.kvn.de in der Rubrik Praxis/Fortbildung und unter www.aekn.de/fortbildung/aktuelle-themen/cme-online. < Auf der folgenden Seite finden Sie die für die Teilnahme an der Fortbildung zu beantwortenden Fragen. Teilnehmer mit mindestens neun richtigen Antworten bekommen drei Fortbildungspunkte, Teilnehmer mit sieben oder acht richtigen Antworten bekommen zwei Fortbildungspunkte. Die Teilnahme ist auch online möglich. Einsendeschluss ist der 31. Mai 2013. Eine Gutschrift der Fortbildungspunkte durch die KVN erfolgt bei korrekter und lesbarer Angabe der EFN nach Einsendeschluss. Die richtigen Antworten werden unter den genannten online-Adressen und im niedersächsischen ärzteblatt veröffentlicht. 4 | 2013 niedersächsisches ärzteblatt A15 cme-fortbildung Rheumatoide Arthritis Antwortbogen Absender: Name Vorname Straße Kassenärztliche Vereinigung Niedersachsen Bezirksstelle Oldenburg z. Hd. Fr. Erichsen Huntestr. 14 26135 Oldenburg Fax Nr. (04 41) 21 00 62 51 11 Ort Bitte EFN eintragen. Bei Postversand Barcode verwenden. Fortbildungspunkte: 1 a b c d e Was trifft zu? Die Rheumatoide Arthritis tritt vor allem bei jungen Männern auf ist eine chronische Infektion ist eine Autoimmunerkrankung ist eine parainfektiöse Erkrankung zählt zu den Allergien 2 Das Ziel der antirheumatischen Basistherapie ist die Beschwerdelinderung durch nichtmedikamentöse Maßnahmen die Beschwerdelinderung durch Analgetika die Beschwerdelinderung durch nichtsteroidale Antirheumatika die Verhinderung von destruierenden Gelenkveränderungen der prothetische Gelenkersatz a b c d e 3 a b c d e Eine frühzeitige diagnostische Zuordnung von entzündlichen Gelenkerkrankungen ermöglicht bei Anhaltspunkten für eine ungünstige Prognose den unverzüglichen Beginn einer Basistherapie sollte immer Anlass für eine kombinierte immunsuppressive Therapie sein hat keine therapeutischen Konsequenzen ist immer ohne Risiko von Überdiagnostik und Übertherapie möglich ist immer mit über 95-prozentiger Sensitivität und Spezifität möglich 4 a b c d e 5 a b c d e 6 a b c d e 7 a b c d e A16 niedersächsisches ärzteblatt 4 | 2013 Welcher der folgenden Parameter wird bei den 1987 von der ARA aufgestellten diagnostischen Kriterien der Rheumatoiden Arthritis nicht berücksichtigt? Antikörper gegen citrulliniertes Protein = Anti-CCP-Ak Rheumafaktor Morgensteifigkeit Rheumaknoten Radiologisch nachgewiesene Erosionen 8 Die folgenden Wirkstoffe gehören zu den synthetischen DMARD Ampicillin, Sulfamethoxazol und Clarithromycin Sulfasalazin, Natriumaurothiomalat und Leflunomid Metamizol, Acemetacin und Tramadol Metronidazol, Clotrimazol und Ciclopirox Metformin, Gliclazid und Sitagliptin a b c Welcher Wirkstoff wird in aktuellen Leitlinien für den Beginn der antirheumatischen Basistherapie empfohlen? Chloroquin Methotrexat Azathioprin Auranofin Ciclosporin Bei Verwendung von Methotrexat als DMARD ist der Einnahme- oder Verabreichungsrhythmus zweimal täglich täglich wöchentlich 14-tägig monatlich a b c d e 9 d e Welches der folgenden Biologika ist zur Behandlung der Rheumatoiden Arthritis zugelassen? Bevacizumab Trastuzumab Belimumab Natalizumab Etanercept Eine mit der Rheumatoiden Arthritis einhergehende Komorbidität spielt keine Rolle für die Auswahl der DMARD ist durch präventive Therapie zu vermeiden sollte durch eine Kooperation der an der Behandlung beteiligten Fachgruppen angegangen werden kommt selten vor ist nur stationär behandelbar 10 Glucocorticoide a dürfen nur zur Überbrückung bis zum Wirkungseintritt der NSAR gegeben werden b können zur reduzierten Progression radiologischer Veränderungen beitragen c sind frei von gravierenden Nebenwirkungen d sind bei Rheumatoider Arthritis kontraindiziert e sollten bei Rheumatoider Arthritis nur intraarticulär gegeben werden CME-Fortbildung zum Thema: Neuroleptika – Pharmakotherapie der Schizophrenie, Januar 2013. Die richtigen Antworten waren: 1d, 2c, 3b, 4a, 5e, 6b, 7c, 8e, 9a, 10c. Literaturangaben 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. GAmSi GKV-Arzneimittel-Schnellinformation für die KV Niedersachsen Januar bis Juni 2012. (2013) <www.gkv-gamsi.de> Böger, R. H. & Schmidt, G. Antirheumatika und Antiphlogistika. In: Schwabe, U. & Paffrath, D. Arzneiverordnungsreport 2012. 447–468 (Heidelberg 2012). Humphreys, J. H. et al. The incidence of rheumatoid arthritis in the UK: comparisons using the 2010 ACR/EULAR classification criteria and the 1987 ACR classification criteria. Results from the Norfolk Arthritis Register. Ann Rheum Dis online (2012). Scott, D. L. , Wolfe, F. & Huizinga, T. W. Rheumatoid arthritis. Lancet 376, 1094–1108 (2010). McCarty, D. J. Clinical picture of rheumatoid arthritis. In: McCarty, D. J. & Koopman, W. J. Arthritis and Allied Conditions. 781–809 (Philadelphia 1993). McCarty, D. J. Treatment of rheumatoid arthrits. In: McCarty, D. J. & Koopman, W. J. Arthritis and Allied Conditions. 877–886 (Philadelphia 1993). Donahue, K. et al. Drug Therapy for Rheumatoid Arthritis. AHRQ Comp Eff Rev 55, (2012). Krüger, K. et al. Handlungsempfehlungen zur sequentiellen medikamentösen Therapie der rheumatoiden Arthritis 2012: adaptierte EULAR Empfehlungen und aktualisierter Therapiealgorithmus. (2012) <www.awmf.org> Arnett, F. C. et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthr Rheum 31, 315–324 (1988). Bykerk, V. P. et al. The Canadian Early Arthritis Cohort (CATCH): Patients with newonset synovitis meeting the 2010 ACR/EULAR classification criteria but not the 1987 ACR classification criteria present with less severe disease activity. J Rheum 39, 2071– 2080 (2012). Aletaha, D. et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 69, 1580–1588 (2010). Linden, M. P. M. van der et al. Classification of rheumatoid arthritis: Comparison of the 1987 American College of Rheumatology criteria and the 2010 American College of Rheumatology/European League Against Rheumatism criteria. Arthr Rheum 63, 37–42 (2011). Zeidler, H. The need to better classify and diagnose early and very early rheumatoid arthritis. J Rheum 39, 212–217 (2012). Huizinga, T. W. J. & Helm-van Mil, A. van der. A quantitative approach to early rheumatoid arthritis. Bull NYU Hosp Joint Dis 69, 116–121 (2011). Helm-van Mil, A. H. M. van der et al. A prediction rule for disease outcome in patients with recent-onset undifferentiated arthritis: How to guide individual treatment decisions. Arthr Rheum 56, 433–440 (2007). Helm-van Mil, A. H. M. van der et al. Validation of a prediction rule for disease outcome in patients with recent-onset undifferentiated arthritis: Moving toward individualized treatment decision-making. Arthr Rheum 58, 2241–2247 (2008). Anderson, J. et al. Rheumatoid arthritis disease activity measures: American College of Rheumatology recommendations for use in clinical practice. Arthr Care Res 64, 640–647 (2012). Prevoo, M. L. L. et al. Modified disease activity scores that include twenty-eight-joint counts development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthr Rheum 38, 44–48 (1995). Gremese, E. et al. Very early rheumatoid arthritis as a predictor of remission: a multicentre real life prospective study. Ann Rheum Dis online (2012). Gaujoux-Viala, C. et al. Current evidence for the management of rheumatoid arthritis with synthetic disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 69, 1004–1009 (2010). 21. Visser, K. & Heijde, D. van der. Optimal dosage and route of administration of methotrexate in rheumatoid arthritis: a systematic review of the literature. Ann Rheum Dis 68, 1094–1099 (2009). 22. Visser, K. et al. Multinational evidence-based recommendations for the use of methotrexate in rheumatic disorders with a focus on rheumatoid arthritis: integrating systematic literature research and expert opinion of a broad international panel of rheumatologists in the 3E Initiative. Ann Rheum Dis 68, 1086–1093 (2009). 23. Aken, J. van et al. Five-year outcomes of probable rheumatoid arthritis treated with methotrexate or placebo during the first year (the PROMPT study). Ann Rheum Dis online (2013). 24. Bakker, M. F. et al. Low-dose prednisone inclusion in a methotrexate-based, tight control strategy for early rheumatoid arthritisa randomized trial. Ann Int Med 156, 329– 339 (2012). 25. Kirwan, J. R. The Effect of Glucocorticoids on Joint Destruction in Rheumatoid Arthritis. NEJM 333, 142–147 (1995). 26. Goekoop-Ruiterman, Y. P. M. et al. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): a randomized, controlled trial. Arth Rheum 52, 3381–3390 (2005). 27. Davis, J. M. & Matteson, E. L. My treatment approach to rheumatoid arthritis. Mayo Clin Proc 87, 659–673 (2012). 28. Gorter, S. L. et al. Current evidence for the management of rheumatoid arthritis with glucocorticoids: a systematic literature review informing the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 69, 1010–1014 (2010). 29. Smolen, J. S. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 69, 964–975 (2010). 30. Moreland, L. W. et al. A randomized comparative effectiveness study of oral triple therapy versus etanercept plus methotrexate in early aggressive rheumatoid arthritis: The Treatment of Early Aggressive Rheumatoid Arthritis trial. Arthr Rheum 64, 2824– 2835 (2012). 31. Saunders, S. A. et al. Triple therapy in early active rheumatoid arthritis: A randomized, single-blind, controlled trial comparing step-up and parallel treatment strategies. Arthr Rheum 58, 1310–1317 (2008). 32. Singh, J. A., Furst, D. & Saag, K. G. 2012 update of the 2008 ACR recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of RA: Reply to letter by Graudal et al. Arthr Care Res online (2012). 33. Klareskog, L., Catrina, A. I. & Paget, S. Rheumatoid arthritis. Lancet 373, 659–672 (2009). 34. Felson, D. Defining remission in rheumatoid arthritis. Ann Rheum Dis 71, i86–i88 (2012). 35. Klarenbeek, N. B. et al. Association with joint damage and physical functioning of nine composite indices and the 2011 ACR/EULAR remission criteria in rheumatoid arthritis. Ann Rheum Dis 70, 1815–1821 (2011). 36. Tiippana-Kinnunen, T. et al. Impact of early radiographic remission on the 15-year radiographic outcome in patients with rheumatoid arthritis. Scand J Rheum 40, 263–268 (2011). 37. Singh, J. A. et al. 2012 Update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthr Care Res 64, 625–639 (2012). 38. Graudal, N. & Jürgens, G. Similar effects of disease-modifying antirheumatic drugs, glucocorticoids, and biologic agents on radiographic progression in rheumatoid arthritis: Meta-analysis of 70 randomized placebo-controlled or drug-controlled studies, including 112 comparisons. Arthritis Rheum 62, 2852–2863 (2010). 39. Ma, M. H. Y., Kingsley, G. H. & Scott, D. L. A systematic comparison of combination DMARD therapy and tumour necrosis inhibitor therapy with methotrexate in patients with early rheumatoid arthritis. Rheumatol 49, 91–98 (2010). 40. Vollenhoven, R. van et al. Addition of infliximab compared with addition of sulfasalazine and hydroxychloroquine to methotrexate in patients with early rheumatoid arthritis (Swefot trial): 1-year results of a randomised trial. Lancet 374, 459–466 (2009). 41. Goekoop-Ruiterman, Y. P. M. et al. DAS-driven therapy versus routine care in patients with recent-onset active rheumatoid arthritis. Ann Rheum Dis 69, 65–69 (2010). 42. Vollenhoven, R. F. van et al. Conventional combination treatment versus biological treatment in methotrexate-refractory early rheumatoid arthritis: 2 year follow-up of the randomised, non-blinded, parallel-group Swefot trial. Lancet 379, 1712–1720 (2012). 43. Bykerk, V. P. et al. Canadian Rheumatology Association Recommendations for Pharmacological Management of Rheumatoid Arthritis with Traditional and Biologic Disease-modifying Antirheumatic Drugs. J Rheum 39, 1559–1582 (2012). 44. Thorlund, K. et al. Why the findings of published multiple treatment comparison metaanalyses of biologic treatments for rheumatoid arthritis are different: an overview of recurrent methodological shortcomings. Ann Rheum Dis online (2012). 45. Aaltonen, K. J. et al. Systematic review and meta-analysis of the efficacy and safety of existing tnf blocking agents in treatment of rheumatoid arthritis. PLoS One 7, e30275 (2012). 46. Dartel, S. A. A. van et al. Difference in the risk of serious infections in patients with rheumatoid arthritis treated with adalimumab, infliximab and etanercept: results from the Dutch Rheumatoid Arthritis Monitoring (DREAM) registry. Ann Rheum Dis online (2012). 47. Askling, J. et al. Cancer risk with tumor necrosis factor alpha (TNF) inhibitors: metaanalysis of randomized controlled trials of adalimumab, etanercept, and infliximab using patient level data. Pharmacoepidemiol Drug Saf 20, 119–130 (2011). 48. Le Blay, P. et al. Short-term risk of total malignancy and nonmelanoma skin cancers with certolizumab and golimumab in patients with rheumatoid arthritis: metaanalysis of randomized controlled trials. J Rheum 39, 712–715 (2012). 49. Atzeni, F. et al. Different effects of biological drugs in rheumatoid arthritis. Autoimmun Rev 12, 575-579 (2013). 50. Rendas-Baum, R. et al. Evaluating the efficacy of sequential biologic therapies for rheumatoid arthritis patients with an inadequate response to tumor necrosis factor-alpha inhibitors. Arthr Res Ther 13, R25 (2011). 51. Chatzidionysiou, K. & Vollenhoven, R. F. van When to initiate and discontinue biologic treatments for rheumatoid arthritis? J Int Med 269, 614–625 (2011). 52. Woude, D. van der et al. Sustained drug-free remission in rheumatoid arthritis after DAS-driven or non-DAS-driven therapy: a comparison of two cohort studies. Rheumatol 51, 1120–1128 (2012). 53. Smolen, J. S. et al. Maintenance, reduction, or withdrawal of etanercept after treatment with etanercept and methotrexate in patients with moderate rheumatoid arthritis (PRESERVE): a randomised controlled trial. Lancet 381, 918-929 (2013). 54. Klarenbeek, N. B. et al. Discontinuing treatment in patients with rheumatoid arthritis in sustained clinical remission: exploratory analyses from the BeSt study. Ann Rheum Dis 70, 315–319 (2011). 55. Saevarsdottir, S. et al. Patients with early rheumatoid arthritis who smoke are less likely to respond to treatment with methotrexate and tumor necrosis factor inhibitors: Observations from the Epidemiological Investigation of Rheumatoid Arthritis and the Swedish Rheumatology Register cohorts. Arthr Rheum 63, 26–36 (2011). 56. Welsing, P. M. J. et al. Is the disease course of rheumatoid arthritis becoming milder?: Time trends since 1985 in an inception cohort of early rheumatoid arthritis. Arthr Rheum 52, 2616–2624 (2005). Anhang I. ACR/EULAR 2010 Kriterien für die Diagnose einer Rheumatoiden Arthritis: Die in der Tabelle 1 dargestellten Kriterien sind nur bei Patienten mit mindestens einem klinisch entzündeten (geschwollenem) Gelenk anwendbar, bei denen keine Hinweise für eine alternative Ursache vorliegen. Auf die distalen Interphalangealgelenke, das Daumensattelgelenk oder das Großzehengrundgelenk beschränkte Schwellungen reichen nicht aus11. Kategorie Kriterium 1 großes Gelenk 2 ‐ 10 große Gelenke beteiligte 1 ‐ 3 kleine Gelenke Gelenke 4 ‐ 10 kleine Gelenke > 10 Gelenke, davon mind. 1 kl. RF und ACPA negativ Serologie RF oder ACPA niedrig positiv RF oder ACPA hoch positiv akute Phase CRP und BSG normal Reaktion CRP oder BSG erhöht Symptome < 6 Wochen Dauer Symptome ≥ 6 Wochen Punkte 0 1 2 3 5 0 2 3 0 1 0 1 Tabelle 1: ACR/EULAR 2010 Diagnosekriterien der RA. Die jeweils höchsten Punktwerte jeder Kategorie werden addiert. Bei einer Summe von 6 der maximal 10 Punkte liegt eine RA vor, ebenso bei Patienten mit RA-typischen Gelenkerosionen oder mit einer aktuell inaktiven Erkrankung, die retrospektiv im Verlauf die Kriterien erfüllt haben. Bei der Serologie und der akute Phase Reaktion ist die Durchführung je eines Tests ausreichend11. Hoch positiv sind Werte oberhalb des Dreifachen der oberen Normgrenze. RF = Rheumafaktor, ACPA = Antikörper gegen citrulliniertes Protein = Anti-CCP-Ak. II. Prognostischer Algorithmus („prediction rule“) der Früharthritis Parameter 1. Alter 2. Geschlecht 3. Verteilung der betroffenen Gelenke 4. Morgensteifigkeit (100 mm visuelle Analogskala) 5. Zahl der druckempfindlichen Gelenke 6. Zahl der geschwollenen Gelenke 7. CRP 8. Rheumafaktor 9. Anti-CCP-Ak (ACPA) Ausprägung Punkte Jahre männlich weiblich kleine Hand-/Fußgelenke 0,02/Jahr 0 1 0,5 _____ _____ _____ _____ symmetrisch 0bere Extremität obere und untere Extremität 0,5 1 1,5 _____ _____ _____ 26 - 90 mm > 90 mm 4 - 10 11 oder mehr 4 - 10 11 oder mehr 5 - 50 mg/l über 50 mg/l negativ positiv negativ positiv 1 2 0,5 1 0,5 1 0,5 1 0 1 0 2 _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ Summe _____ Anzuwenden bei Patienten mit undifferenzierter Früharthritis, die nicht die ARA 1987 Kriterien der RA erfüllen. Jedem Parameter wird eine Punktzahl für die Ausprägung zugeordnet15. Der Maximalwert ist 14. Ein Score von 8 oder größer hat einen positiven Vorhersagewert von 97 Prozent für die Entwicklung einer RA. Ein Score von 6 oder kleiner hat einen negativen Vorhersagewert von 83 Prozent16. III. Synthetische DMARDs Tabelle 2: Zugelassene Indikationen (nur bezogen auf die Rheumatoide Arthritis) und Dosierungen der synthetischen Basistherapeutika (DMARD) laut Fachinformation, Jahrestherapiekosten auf Grundlage der Lauer-Liste, Stand 15. 2. 2013, jeweils günstigstes Präparat (Generikum oder Original), keine Berücksichtigung von Reimporten (außer Auranofin) ; * orale Darreichungsform. Wirkstoff Handelsname Lantarel®, Methotrexat Generika Indikation schwere Formen der aktiven Rheumatoiden Arthritis, primär nur bei besonders aggressivem Verlauf Sulfasalazin aktive Rheumatoide Arthritis Azulfidine nach unzureichendem RA®, Pleon Ansprechen auf NSAID und RA®, Generika lokale Glucocorticoidinjektionen Leflunomid Arava®, Generika aktive Rheumatoide Arthritis Chloroquin Resochin® Chronische Polyarthritis Hydroxy‐ chloroquin Quensyl® Rheumatoide Arthritis Penicillamin Metalcaptase® Chronische Polyarthritis Natriumauro‐ Tauredon® thiomalat Auranofin Ridaura® (nur Reimporte) Azathioprin Imurek®, Zytrim®, Generika Ciclosporin Chronische Polyarthritis Progrediente chronische Polyarthritis schwere Rheumatoide Arthritis, steroidrefraktäre, ‐ abhängige oder unverträgliche Fälle schwere aktive Rheumatoide Sandimmun®, Arthritis, mindestens ein Generika Basistherapeutikum als ungeeignet erwiesen Dosierung oral: 7,5 ‐ 20 mg einmal/Woche sc, im oder iv: 7,5 ‐ 20 mg einmal/Woche einschleichend, ab 4. Woche 2 x 1000 mg/Tag Kosten/Jahr 45,93 ‐ 110,79 € 632,32 ‐ 1.197,73 € 280,47 € 10 ‐ 20 mg/Tag (initial Aufsättigung: 925,79 ‐ 1333,53 € 3 Tage 100 mg/Tag) 250 mg/Tag 141,55 € 200 ‐ 400 mg/Tag (initial bis 600 105,08 ‐ 210,17 € mg/Tag einschleichend, ab 7. bzw. 21. Woche: 600 384,64 ‐ 576,96 € ‐ 900 mg/Tag Aufsättigung bis Aufsättigung: wirksam oder 1600 971,04 € mg (18 Wochen), Erhaltungstherapie: dann 100 mg/Monat 646,34 € 6 mg/Tag 734,16 € 1 ‐ 3 mg/kg/Tag (50 ‐ 127,96 ‐ 483,77 €* 200 mg/Tag) 2,5 ‐ 4 mg/kg/Tag (175 ‐ 300 mg/Tag) 2079,99 ‐ 3514,84 € IV. Biologika Tabelle 3: Zugelassene Indikationen (nur bezogen auf die Rheumatoide Arthritis) und Dosierungen der Biologika laut Fachinformation, Jahrestherapiekosten auf Grundlage der Lauer-Liste, Stand 1. 3. 2013; * für 70 - 100 Kg Körpergewicht, * und ** ohne Berücksichtigung der initialen Aufdosierung, *** bei Maximaldosis, **** ohne Berücksichtigung der Prämedikation, für 2 Zyklen pro Jahr Andere TNF‐Alpha‐Antagonisten Wirkstoff Handelsname Indikation (Kombination mit MTX) Etanercept Enbrel® Adalimumab Humira® Infliximab Remicade® Golimumab Simponi® Certolizu‐ mabpegol Cimzia® Abatacept Orencia® Anakinra Kineret® Tocilizumab RoActemra® Rituximab Mabthera® Monotherapie Dosierung Kosten/Jahr unzureichendes Ansprechen auf Basistherapie bei MTX‐Unverträglichkeit incl. MTX, bei schwerer aktiver und progressiver oder Unmöglichkeit der Rh. A. auch primär Fortführung von MTX 50 mg/Woche 22.668,40 € unzureichendes Ansprechen auf Basistherapie bei MTX‐Unverträglichkeit incl. MTX, bei schwerer aktiver und progressiver oder Unmöglichkeit der Rh. A. auch primär Fortführung von MTX 40 mg/2 Wochen 22.668,40 € 3 mg/kg/8 Wochen, initial Woche 0, 2 und 6 17.965,51 €* 50 mg/Monat 20.924,68 € unzureichendes Ansprechen auf Basistherapie incl. MTX, bei schwerer aktiver und progressiver nein Rh. A. auch primär unzureichendes Ansprechen auf Basistherapie incl. MTX, bei schwerer aktiver und progressiver nein Rh. A. auch primär bei MTX‐Unverträglichkeit unzureichendes Ansprechen auf Basistherapie oder Unangemessenheit der incl. MTX Fortführung von MTX unzureichendes Ansprechen auf ein oder mehrere DMARDs einschließlich MTX oder TNF‐ nein Inhibitoren unzureichendes Ansprechen auf MTX alleine nein unzureichendes Ansprechen bei MTX‐Unverträglichkeit auf/Unverträglichkeit von einem oder mehreren oder Unangemessenheit der DMARDs oder TNF‐Inhibitoren Fortführung von MTX ungenügendes Ansprechen auf DMARDs einschließlich einer oder mehrerer Anti‐TNF‐ nein Therapien 200 mg/2 Wochen, initial 2x200 mg Woche 0, 2 und 4 bei 60 ‐ 100 kg KG 750 mg/4 Wochen, initial Woche 0, 2 und 4 100 mg/Tag 19.977,79 €** 21.722,09 €** 13.733,78 € 8 mg/kg/4 Wochen, max. 800 mg/4 Wochen 30.781,60 € *** 1000 mg Woche 0 und 2, ggfs. wieder Woche 27 und 29 16.354,40 €****