Als PDF - medicinebook.de
Werbung

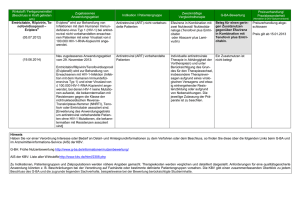
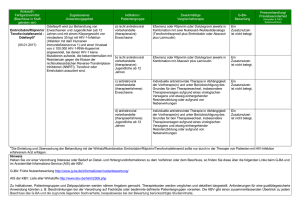
Emtricitabin (EmtrivaTM): Produkteigenschaften und Daten im Überblick Indikation: ·EmtrivaTM (FTC, Emtricitabin) ist in Kombination mit anderen antiretroviralen Substanzen zur Behandlung von HIV-1-infizierten Erwachsenen und Kindern ab vier Monaten zugelassen. ·Die Zulassung für diese Indikation beruht auf den Ergebnissen für HIV-RNA-Viruslast und CD4-Zellzahl in zwei pädiatrischen Studien und drei Phase-III-Studien mit erwachsenen Patienten. Die Phase-III-Studien haben die Wirksamkeit und Sicherheit einer Behandlung mit Emtricitabin über 48 Wochen belegt und zwar bei antiretroviral nicht-vorbehandelten Patienten sowie vorbehandelten Patienten mit vorheriger, virologisch stabiler HIV-Therapie. ·Bei vorbehandelten Patienten kann Emtricitabin eingesetzt werden, wenn die genotypische oder phänotypische Resistenztestung ergibt, dass die Viren gegen dieses Medikament empfindlich sind. ·Emtricitabin wurde bisher nicht untersucht bei vorbehandelten Patienten, deren Therapie versagt hat. Bei der Entscheidung über ein neues Behandlungsschema mit Emtricitabin für diese Patientengruppe müssen die Mutationsmuster der verschiedenen Arzneimittel und vorangegangene Therapien beim einzelnen Patienten sorgfältig berücksichtigt werden. Wirkmechanismus ·Emtricitabin gehört zur Wirkstoffklasse der Nukleosidanaloga (NRTI, nukleosidale Reverse Transkriptase-Inhibitoren). NRTI hemmen die Funktion der viralen Reversen Transkriptase. Dieses Enzym ist für das Umschreiben der HIV-RNA in HIV-DNA verantwortlich. Da die NRTI den natürlichen Nukleotiden ähneln, erkennt die Reverse Transkriptase sie als Substrat und baut sie in die virale DNA ein. Dadurch können keine weiteren Nukleotide angereiht werden, es kommt zum Kettenabbruch der DNA und die Virusreplikation ist unterbrochen. Status ·Am 24. Oktober 2003 erteilte die europäische Zulassungsbehörde EMEA (European Agency for the Evaluation of Medicinal Products) in allen 15 Mitgliedsstaaten der EU die Zulassung für Emtricitabin. ·Am 2. Juli 2002 hat die US-amerikanische Food and Drug Administration Emtricitabin bereits in den USA zugelassen. ·In klinischen Prüfungen der Phase I, II und III wurden bisher mehr als 2.000 HIV-Patienten mit Emtricitabin über einen Zeitraum von 10 Tagen bis zu 200 Wochen behandelt. Zur Zeit wird die Wirksamkeit und Sicherheit von Emtricitabin bei der Behandlung der chronischen Hepatitis B in Studien untersucht. Produkteigenschaften Dosierung ·Eine Kapsel am Tag (200 mg), unabhängig von den Mahlzeiten ·Voraussichtlich ab Mitte 2004 ist Emtricitabin auch als Lösung zum Einnehmen (10mg/ml) erhältlich. ·Die intrazelluläre Halbwertszeit des aktiven Triphosphats von FTC beträgt 39 Stunden. Die Plasmaspiegel liegen im Steady State 84 Stunden über der IC90, so dass die antiretrovirale Wirkung auch bei nicht exakter Medikamenten-Einnahme erhalten bleibt. Wegen der extrem langen Plasma- und intrazellulären Halbwertszeit kann Emtricitabin einmal am Tag eingenommen werden. Wirksamkeit (siehe auch Übersicht klinische Daten) ·In klinischen Studien reduzierte Emtricitabin in Kombination mit anderen Medikamenten die Viruslast anhaltend über 24 und 48 Wochen. ·Ein Emtricitabin-haltiges Therapie-Regime ist hinsichtlich Wirksamkeit der Kombinations-Therapie mit dem NRTI Stavudin (d4T) überlegen (bei nicht vorbehandelten Patienten). ·Eine Kombination mit Emtricitabin ist vergleichbar wirksam wie eine Kombination mit Lamivudin (3TC) (bei vorbehandelten Patienten). Nebenwirkungen ·Das Nebenwirkungsprofil basiert auf Sicherheitsdaten von 1479 Erwachsenen und 114 Kindern. Insgesamt 1039 bisher nicht behandelte und 440 vorbehandelte Erwachsene erhielten 48 Wochen lang Emtricitabin (n=814) oder ein Vergleichsmedikament in Kombination mit anderen antiretroviralen Medikamenten. In den pädiatrischen Studien 1/3 erhielten 83 bisher nicht vorbehandelte und 31 vorbehandelte Kinder zwischen vier Monaten und 18 Jahren eine Emtricitabin-haltige Kombination. ·Die häufigsten unerwünschten Ereignisse unter Emtricitabin waren Kopfschmerzen, Diarrhö, Übelkeit und Hautausschlag. Der Schweregrad war meistens leicht bis mäßig schwer. Weniger als ein Prozent der Patienten brach die klinischen Studien wegen der Nebenwirkungen ab. ·Mit Ausnahme von Verfärbungen der Haut (2% vs. 0% in der Kontrollgruppe) traten alle Nebenwirkungen gleich häufig mit Emtricitabin und in den Kontrollgruppen auf. Die milden bis mäßig schweren Verfärbungen manifestierten sich als Hyperpigmentierungen vor allem an Handflächen und Fußsohlen der Patienten. ·Bei Koinfektion mit einer chronischen Hepatitis B kann es nach Absetzen von Emtricitabin zu einer Exazerbation der Hepatitis kommen. ·Bei der Behandlung mit Nukleosidanaloga (alleine oder in Kombination mit anderen antiretroviralen Wirkstoffen) wurde über Laktatazidosen und schwere Hepatomegalien mit Todesfällen berichtet. Resistenzentwicklung ·Emtricitabin selektiert die Mutation M184V im Reverse-Transkriptase-Gen. ·Emtricitabin-resistente Isolate sind ebenfalls resistent gegen die NRTI 3TC und ddC, bleiben aber sensitiv gegenüber anderen NRTI. Übersicht klinische Daten Phase-III-Studie 301 A mit antiretroviral nicht vorbehandelten Patienten ·Die randomisierte, doppelblinde Studie 301A untersuchte die Wirksamkeit und Sicherheit von Emtricitabin in Kombination mit anderen antiretroviralen Wirkstoffen bei 571 nicht vorbehandelten Patienten. ·286 Patienten erhielten Emtricitabin (FTC), Didanosin (ddI) und Efavirenz (EFV) und 285 Patienten Stavudin (d4T), ddI und EFV. ·Eine Zwischenauswertung der Studienergebnisse von 24 Wochen führte zur Empfehlung, den Arm mit d4T wegen signifikant schlechterer Ergebnisse abzubrechen. Den Patienten wurde der Einschluss in den FTC-Arm angeboten. ·Nach 48 Wochen lag bei 81% der Patienten, die mit FTC behandelt wurden, die Viruslast unter 400 Kopien/ml Blut und bei 78% unter 50 Kopien/ml – im Vergleich zu nur 68% und 59% in der d4T-Gruppe (p=0,001 für < 400 Kopien, p="0,0001" für < 50 Kopien). ·In beiden Studienarmen erhöhte sich die mittlere CD4-Zellzahl: Mit FTC stieg diese Zahl um durchschnittlich 168 Zellen/mm3 und mit d4T um 134 Zellen/mm3 (mittlerer Ausgangswert: 318 Zellen/mm3). ·Signifikant weniger Patienten, die mit FTC behandelt wurden, brachen die Studie ab als Patienten, die mit d4T behandelt wurden (17% vs. 27%; p < 0,05). Phase-III-Studie 303 mit antiretroviral vorbehandelten Patienten ·Die offene, randomisierte Studie 303 untersuchte die Wirksamkeit und Sicherheit von Emtricitabin in Kombination mit anderen antiretroviralen Wirkstoffen bei 440 vorbehandelten Patienten. ·Patienten, die in die Studie aufgenommen wurden, hatten seit mindestens zwölf Wochen eine 3TC-haltige Kombinationstherapie erhalten und eine Viruslast unter 400 Kopien/ml. Die Patienten erhielten in der Studie entweder FTC (n=294) oder 3TC (n=146), jeweils in Kombination mit d4T oder AZT und einem Protease-Inhibitor oder einem nicht-nukleosidischen Reverse Transkriptase-Inhibitor (NNRTI). ·Nach 48 Wochen war die Wirksamkeit von Emtricitabin hinsichtlich Senkung der Viruslast und Steigerung der CD4-Zellzahl mit der von 3TC vergleichbar. Insgesamt 77% der Patienten erreichten mit FTC eine Viruslast unter 400 Kopien/ml und 67% unter 50 Kopien/ml im Vergleich zu 82% und 72% im 3TC-Arm. Die CD4-Zellzahl erhöhte sich der Emtricitabin-Gruppe um 29 Zellen/mm3 im Vergleich zu 61 Zellen/mm3 in der 3TC-Gruppe (Ausgangswert 527 Zellen/mm3). ·Die Rate der Studienabbrüche wegen Nebenwirkungen war mit beiden Behandlungen niedrig (4% mit FTC vs. 1% mit 3TC). Phase-III-Studie ANRS 099-ALIZE: einmal tägliche versus PI-haltige Kombination ·Diese offene und randomisierte Studie verglich die Wirksamkeit der einmal täglichen Kombination FTC/ddI/EFV mit 2/3 einer zweimal täglich einzunehmen-den Proteaseinhibitor(PI)-haltigen Kombination. ·In die Studie aufgenommen wurden Patienten, die mit einer PI-haltigen Kombinationstherapie behandelt wurden und deren Viruslast unter 400 Kopien/ml lag. ·Insgesamt 177 Patienten führten ihre PI-haltige Therapie fort und 178 Patienten wurden auf die Kombination FTC/ddI/EFV umgestellt. ·Nach 48 Wochen war die Wirksamkeit der Emtricitabin-haltigen Kombination hinsichtlich Senkung der Viruslast und Anstieg der CD4-Zellzahl so wirksam wie die PI-haltige Kombination. Insgesamt 95% der mit FTC/ddI/EFV behandelten Patienten hatten eine Viruslast unter 400 Kopien/ml im Vergleich zu 87% der Patienten mit der PI-haltigen Kombination. Mit FTC stieg die CD4-Zellzahl um 21 Zellen/mm³ und mit dem PI um 13 Zellen/ mm³. ·Das nüchtern gemessene HDL-Cholesterin verbesserte sich signifikant mit FTC/ddI/EFV und stieg um 7,7 mg/dl im Vergleich zu keiner Änderung mit der PI-haltigen Therapie (p (c) by 'medicinebook.de' URL : http://www.medicinebook.de Das Impressum finden Sie hier 3/3