druck und zusammensetzung
Werbung
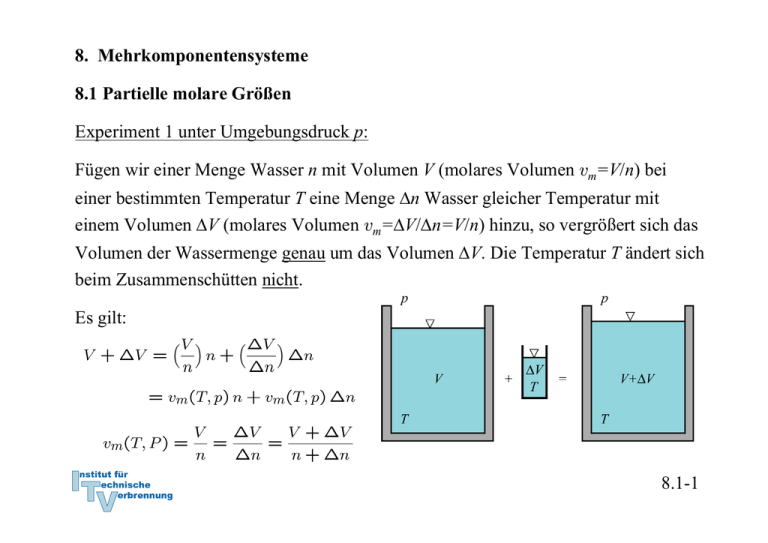
8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen vm=V/n) bei einer bestimmten Temperatur T eine Menge Δn Wasser gleicher Temperatur mit einem Volumen ΔV (molares Volumen vm=ΔV/Δn=V/n) hinzu, so vergrößert sich das Volumen der Wassermenge genau um das Volumen ΔV. Die Temperatur T ändert sich beim Zusammenschütten nicht. Es gilt: 8.1-1 Experiment 2 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen vm,w=V/n) bei einer bestimmten Temperatur T eine Menge Δn Alkohol gleicher Temperatur mit einem Volumen ΔV (molares Volumen vm,A=ΔV/Δn) hinzu, so ergibt sich ein Gesamtvolumen Vges das kleiner ist als die Summe der Teilvolumina Vges < Vw + ΔV Außerdem ändert sich die Temperatur. Es ergibt sich: Pech! Bem.: Mit Index * sollen i. F. die Stoffgrößen reiner Komponenten bezeichnet werden. 8.1-2 Anschauliche Erklärung: Das negative Exzessvolumen Vex kann man sich dadurch erklären, dass die kleineren Wassermoleküle Zwischenräume zwischen den größeren Alkoholmolekülen ausnutzen können. Die Mischung wird so kompakter. Diese rein geometrische Erklärung ist allerdings nicht vollständig, da auch Kräfte zwischen den Molekülen Einfluss haben. Eventuelle Abstoßung zwischen den Molekülen weist in Richtung Volumenvergrößerung. Verallgemeinerung: Wir folgern für das Volumen V eines beliebigen Gemisches, dass es nicht nur von der Temperatur T und dem Druck p, sondern auch von der Zusammensetzung abhängt! Bei k Komponenten und den Molmengen n1, n2,…nk im Gemisch ergibt sich der funktionale Zusammenhang 8.1-3 Von der Funktion bilden wir das vollständige Differential Wenn wir die Mischung bei konstanter Temperatur und konstantem Druck durchführen, ergibt sich bei Veränderung der Mischung eine Volumenänderung Wir definieren die partiellen molaren Volumen einer Komponente i 8.1-4 Anschauliche Deutung: Das partielle molare Volumen der Komponente i gibt an, wie sich das Volumen V ändert (→ dV ), wenn eine infinitesimale Menge der Komponente i zu einem Gemisch gegebener Zusammensetzung hinzugefügt wird, während wir dafür sorgen, dass Temperatur und Druck konstant bleiben. 8.1-5 Bemerkung: Eine Mischung kann statt durch Angabe der Molzahlen der Komponenten auch durch die Angabe der Molenbrüche Xi vollständig charakterisiert werden. Wir schreiben deshalb auch statt üblicherweise für die partielle molaren Volumina auch die Funktion Auf, wobei noch zusätzlich gilt 8.1-6 Bedeutung der partiellen molaren Volumina Das Volumen V einer Mischung bei bekannter Temperatur T und bekanntem Druck p kann aus der Kenntnis aller partiellen molaren Volumina vi,m der Komponenten der Mischung durch oder kurz berechnet werden. 8.1-7 Um die Gültigkeit von zu zeigen, wollen wir zwei Mischungen genau gleicher Zusammensetzung zusammenbringen. Es gilt dabei folgender Zusammenhang (V ist homogen vom Grade 1): Wir untersuchen die Variation von λ durch Ableitung der Identität nach λ: Dies gilt für alle λ, also auch für λ = 1: 8.1-8 Berechnung von Exzessvolumina Bringen wir zwei verschiedene Reinstoffe oder zwei Mischungen unterschiedlicher Zusammensetzung bei konstanter Temperatur und konstantem Druck zusammen, so gilt für das Gesamtvolumen, wenn keine chemischen Reaktionen stattfinden: mit Die Abweichung Vex wird Exzessvolumen genannt. Sie ist mit den partiellen molaren Volumina der Mischungen a,b und c gegeben durch: 8.1-9 Ein Exzessvolumen nach Formel tritt insbesondere dann nicht auf, wenn sich die partiellen molaren Volumina nicht von den molaren Volumina der reinen Komponenten unterscheiden: Reine Komponenten sollen wegen der besseren Lesbarkeit stets durch einen Index * hervorgehoben werden. Man kann sich denken, dass dies zum Beispiel für ideale Gase, bei denen die Moleküle keine Ausdehnung und keine Interaktion untereinander besitzen, der Fall ist. Die theoretische Bestimmung der partiellen molaren Größen realer Gemische ist eine schwierige Aufgabe. In der Vergangenheit wurden diese im Allg. durch Experimente ermittelt (siehe nachfolgendes Beispiel). 8.1-10 Beispiel Wasser-Ethanol-Gemisch Bei Umgebungstemperatur und -druck werden 0,3 Liter Ethanol und 0,7 Liter Wasser miteinander gemischt. Welches Gesamtvolumen hat die Mischung? Das Diagramm experimentell ermittelter partieller molarer Volumina für das Wasser-EthanolGemisch sei gegeben. Lösung: Wir bestimmen die Molmengen von Wasser und Ethanol: 8.1-11 Aus dem Diagram werden die partiellen molaren Volumina abgelesen. Um also tatsächlich ein Liter Schnapps mit 30 Vol % zu erhalten, müsste man eine größere Menge Alkohol und Wasser zusammenschütten. 8.1-12 Führt man die Auswertung für viele Mengenverhältnisse durch oder misst man das Exzessvolumen erhält man folgendes Diagramm. 8.1-13 Es sei speziell darauf hingewiesen, dass das berechnete Exzessvolumen Vex nicht mit dem Volumen δV der Folie 8.1-2 identisch ist. Der Vorgang dort wurde zwar bei konstantem Druck aber nicht bei konstanter Temperatur durchgeführt: keine Wärmebad → Wärmetönung (vergl. Folie 8.1-5)! Wegen der Wärmetönung bei der Vermischung verschiedener Substanzen muss im Allgemeinen gekühlt oder erwärmt werden. Solche Exzessgrößen treten also nicht nicht nur für das Volumen, sondern auch für energetische und entropische Größen wie innere Energie, Enthalpie und Entropie auf. Die Wärmetönung ist wegen des konstanten Druckes eine Folge des Exzesses der Freien Enthalpie. Analog zum Volumen müssen wir passende partielle molare Größen definieren, um solche Zusammenhänge rechnerisch erfassen zu können. 8.1-14 Partielle molare Zustandsgrößen Bei einem Mehrkomponentengemisch hängen alle Zustandsgrößen Z von der Zusammensetzung des Gemisches ab. Es gilt also stets Mit dem vollständiges Differential nach: Darin ist die partielle molare Zustandsgröße definiert durch: 8.1-15 Die Interpretation der partiellen Ableitung folgt derjenigen der partiellen molaren Volumina. Die partielle Ableitung gibt wieder an, wie sich die Zustandsgröße des Gemisches bei konstanter Temperatur und konstantem Druck durch Hinzufügen einer infinitesimalen Menge einer Komponente i ändert. Ebenso gilt wieder bei konstanter Temperatur und konstantem Druck und beim Zusammenfügen verschiedener Mischung werden Exzessgrößen beobachtet: 8.1-16 Beispiel: Die partielle molare Freie Enthalpie Besonders wichtig ist die partielle molare Freie Enthalpie G, da deren natürliche Variablen die thermischen variablen T und p sind, die in Experimenten leicht kontrolliert werden können. Definition der Freien Enthalpie: Bei einem Mehrkomponentengemisch hängt die Freie Enthalpie von der Zusammensetzung des Gemisches ab: Ihr vollständiges Differential lautet: 8.1-17 Die partielle Ableitung gibt wieder an, wie sich die Zustandsgröße des Gemisches bei konstanter Temperatur und konstantem konstantem Druck durch Hinzufügen einer infinitesimalen Menge einer Komponente i ändert. Die partielle molare Freie Enthalpie wir Chemisches Potential μi=gi,m genannt. Ebenso gilt wieder bei konstanter Temperatur und konstantem Druck und beim Zusammenfügen verschiedener Mischung wird ein Freie Mischungsenthalpie beobachtet : 8.1-18 Die Freie Mischungsentalpie ΔGM enthält zwei Anteile, nämlich die Mischungsenthalpie der idealen Mischung, Index id, und eine Exzessenthalpie als Abweichung zur idealen Mischung, Index ex : Erstere ergibt sich aus der Mischungsentropie der idealen Mischung (siehe Abb.) Die treibende Kraft für die (ideale) Mischung ist die Entropiezunahme bei diesem Vorgang. Reale Mischungen besitzen eine zusätzliche Freie Mischungsenthalpie Gex, die Exzessenthalpie. Diese kann negativ, aber auch positiv sein (siehe 8.2, Mischungslücke). 8.1-19 Zusammenfassung Partielle molare Größen sind stets bei konstantem Druck und konstanter Temperatur durch die partielle Ableitung definiert. Der Wert der extensiven Zustandsgröße Z in einer Mischung wird aus berechnet. Partielle molare Zustandsgrößen unterscheiden sich im Allgemeinen von den molaren Zustandsgrößen reiner Komponenten: Um die funktionale Abh’ngigkeit nicht ausschreiben zu müssen sollen im Folgenden die molaren Größen reiner Komponenten mit einem Index * gekennzeichnet werden: 8.1-19 8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren können chemische Reaktionen beim Mischen von verschiedenen Stoffen eintreten, so dass im Gleichgewicht auch neue Komponenten auftreten ← Massenwirkungsgesetz. 8.2-2 Das Chemische Potential Hier: Chemisches Potentials eines reinen Stoff Ausgangspunkt: Freie Enthalpie oder Gibbssche Enthalpie G des Systems Definition der Freien Enthalpie: Fundamentalgleichung der molaren Freien Enthalpie eines reinen Stoffes: 8.2-3 Die Fundamentalgleichung der molaren Gibbsschen Enthalpie legt es nahe, die intensiven Zustandsgrößen Temperatur T und Druck p als natürliche Variablen zur Darstellung der molaren Gibbsschen Enthalpie anzusehen: Da wir in diesem Kapitel Mehrkomponentensysteme und Stoffmengenänderungen betrachten werden, wollen wir die Abhängigkeit der extensiven Zustandsgrößen von der Stoffmenge nun grundsätzlich notieren. 8.2-4 Mit lauten die vollständigen Differentiale: Vergleich mit der Fundamentalgleichung liefert und 8.2-5 Das Chemische Potential zunächst: Chemisches Potentials eines reinen Stoff Die molare Freie Enthalpie gm eines reinen Stoffes wird als das Chemische Potential μ des Stoffes bezeichnet. Für die bessere Unterscheidung des Chemischen Potentials eines reinen Stoffes von dem Chemischen Potential μi des in einem Mehrkomponentensystem wird das Chemische Potential des reinen Stoffes mit einem * gekennzeichnet werden: 8.2-6 Mehrkomponentengemisch und Chemisches Potential Bei einem Mehrkomponentengemisch hängt die Freie Enthalpie von der Zusammensetzung des Gemisches ab: Es gilt weiterhin die Definition: Schreibt man wieder das vollständige Differential auf so folgt die Fundamentalgleichung der Freien Enthalpie für ein Gemisch: 8.2-7 gi,m heißt partielle molare Freie Enthalpie der Komponente i im Gemisch. Wie alle partiellen Größen ist gi,m bei festgehaltenem Temperatur T und festgehaltenem Druck p und definiert. Die partielle molare Freie Enthalpie wird als Chemisches Potential μi der Komponente i bezeichnet. Wegen der Definition gilt auch die Verknüpfung mit der partiellen molaren Enthapie und der partiellen molaren Entropie: Die Fundamentalgleichung lässt sich schreiben: 8.2-8 Das Chemische Potential lässt sich auch durch die Innere Energie definieren. Wegen der Definitionen G=H-TS und H=U+pV ist und Die Fundamentalgleichung der Inneren Energie eines Gemisches lautet also: 8.2-9 Aus dieser Darstellung des Differentials der Inneren Energie kann abgeleitet werden, dass die natürlichen Zustandsvariablen der Inneren Energie neben den Stoffmengen, Volumen V und Entropie S sind: Das totale Differential lautet dann: Bem.: In ähnlicher Weise findet man aus den Fundamentalgleichungen die natürlichen Variablen anderer Zustandsgrößen wie der Freien Energie, der Enthalpie usw. 8.2-10 Der Vergleich zwischen Zustandsgleichung und totalem Differential liefert sowie offensichtlich für das Chemische Potential die alternative Darstellung: statt Ferner gilt: 8.2-11 Übung: Zeigen Sie, dass das Chemischen Potential alternativ durch die Ausdrücke oder dargestellt werden kann, wobei H die Enthalpie und A die Freie Energie sein sollen. 8.2-12 8.2.1 Temperatur- und Druckabhängigkeit des Chemischen Potentials Wir nutzen die Definition Für einen reinen Stoff sind die Temperatur- und Druckabhängigkeiten identisch mit den Abhängigkeiten der molaren Freien Enthalpie von Temperatur und Druck Diese Abhängigkeiten sind uns aus der Definition der Freien Enthalpie aus früheren Kapiteln vertraut. 8.2-12 Beispiel ideale Flüssigkeit Das Chemische Potential der idealen Flüssigkeit erhalten wir aus der Definition Bei einer idealen Flüssigkeit haben wir inkompressibles Verhalten vm = const angenommen. Mit folgt, dass die Innere Energie nur von der Temperatur abhängt die Enthalpie wegen h = u + pv und Entropie durch gegeben ist. Das Chemische Potential der idealen Flüssigkeit ist dann: 8.2-13 Für ein Stoffgemisch gelten entsprechende Beziehungen, wenn wir alle molaren Größen konsequent durch die partiellen molaren Größen ersetzen. Es gilt zum Beispiel wegen der Vertauschbarkeit der Reihenfolge der Ableitungen und wegen Eine analoge Betrachtung liefert mit für die Druckabhängigkeit: 8.2-13 Zusammenfassend: Reiner Stoff Stoffgemisch Integrale solcher Gleichungen liefern zum Beispiel: Das Chemische Potential einer Komponente bei konstantem Druck lässt sich also berechnen, wenn uns das Chemische Potential bei Standardbedingungen, Index o, bekannt (Tabellenwerke) und die Funktion si,m(T,p,n1,…,nk) gegeben ist. 8.2-14 Beispiel: Bestimmen Sie die Druckabhängigkeit des Chemischen Potentials für ein reales Gas mit der Zustandsgleichung ! B ist darin ein temperaturabhängiger Virialkoeffizient. Lösung: Das Integral lässt sich mit der angegebenen Zustandsgleichung auswerten: Diese Formel beinhaltet für B = 0 den Druckabhängigkeit des Chemischen Potential beim idealen Gas 8.2-15 Fugazität Der Unterschied zwischen dem realen Gas und dem idealen Gas kann durch Einführung eines korrigierten Druckes, die Fugazität f, auf eine formal mit dem idealen Gas übereinstimmende Formel gebracht werden: Der Fugazitätsfaktor ϕ errechnet sich aus: 8.2-16 8.2.2 Die Abhängigkeit des Chemischen Potentials von der Zusammensetzung des Gemisches Wir betrachten zunächst den einfachen Fall einer Mischung idealer Gase aus kKomponenten. Nützlich ist ein Gedankenexperiment, bei dem wir entsprechend der k-Komponenten das Volumen unseres Systems in k Teilvolumina mit reinen Komponenten zerfallen lassen, in denen die Temperatur und der Druck des Gesamtsystems herrschen sollen. Die Teilvolumina verhalten sich zum Gesamtvolumen bei idealen Gasen dann wie die Partialdrücke der Mischung zum Gesamtdruck: 8.2-17 Die Trennwände zwischen den Volumina seien ohne Arbeitsaufwand herausnehmbar. Wenn das Gesamtsystem adiabat ist, wird sich die Temperatur nicht ändern, da die Innere Energie des Systems konstant bleiben muss und nicht vom Druck abhängt. Die Gase vermischen sich in einem irreversiblen Prozess, bei dem sich der Gesamtdruck nicht ändert, jede einzelne Komponente verhält sich so, als ob die anderen Komponenten nicht anwesend wären, und nimmt im Gesamtvolumen ihren Partialdruck an. Wir erwarten einen Anstieg der Entropie im System (← irreversibler Prozess) und wegen eine Abnahme des Chemischen Potentials. 8.2-18 Die Änderung des Chemischen Potentials können wir aus dessen Definition berechnen: Für die reine Komponente i im Volumen Vi: Für die Komponente i in der Mischung: Änderung: Entropieänderung bei isothermer Zustandsänderung: Das Chemische Potential jeder Komponente verringert sich demnach in der Mischung, da die Entropie anwächst: 8.2-19


