Chemie-Referat – E
Werbung

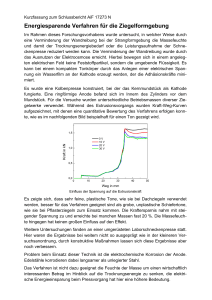
Chemie-Referat – E-Chemie Elektrodenpotentiale / Zellspannungen Christian, Jannik, Stefan Gewinnung von Standardelektrodenpotentialen Man kann eine Halbzelle erstellen, indem man eine Metallelektrode in die dazugehörige Metalllösung gibt. Es + bildet sich ein Elektronendruck, der Elektronen in den Draht drückt. Wenn man zwei Halbzellen verbindet, ergibt sich eine Z+ Me2 (aq) Spannung zwischen ihnen, welche auf die unterschiedlichen Elektronenpotentiale zurückzuführen ist. Z+ Me1 (aq) Wenn Strom fließt, oxidiert die Anode: die Metallatome Me2(s) werden ionisiert und gehen in der Donatorhalbzelle in Lösung, Me1(s) Kathode Anode die Ionen der Kathodenlösung (Akzeptorhalbzelle) werden reduziert und scheiden sich an der Kathode ab. Man kann nun Spannungsreihen aufnehmen, in welchen die Spannung von einer Metallhalbzelle zur anderen aufgeführt ist. Da es aber sehr viele mögliche Spannungsreihen gibt, hat man sich auf eine Bezugshalbzelle geeinigt, die Normalwasserstoffelektrode. Verbraucher Normalwasserstoffelektrode (NHE) Aufbau Zur Ermittlung von Elektrodenpotentialen werden weltweit Normalwasserstoffelektroden als Bezugshalbzelle verwendet. Ihr Potential ist per Definition 0V. Ein platiniertes Platinblech wird in einer sauren Lösung ( c H 3O 1 mol ) bei einem Luftdruck von 1013 hPa mit l StandardWasserstoffelektrode 1 - Platinelektrode 2 - Wasserstoffeinstrom 3 - Lösung mit Säure (c(H+) = 1 mol/l) Funktion Wasserstoff umspült. Der Wasserstoff lagert sich zum Teil an der Platinelektrode an. Hierbei stellt sich folgendes Gleichgewicht ein: Durch den Elektronenaustausch an der Oberfläche des Platins erhält die Elektrode ein bestimmtes Potential. Je nachdem ob die zu vermessende Halbzelle gegenüber der NHE als Donator- oder als Akzeptorhalbzelle wirkt, erhält sie ein negatives bzw. positives Vorzeichen. Berechnung von Zellspannungen (am Beispiel einer Zink-Kupfer Halbzelle) - - - Aufschreiben und feststellen der Elektrodenpotentiale: o Zink: 𝑍𝑛 ↔ 𝑍𝑛 2+ + 2𝑒 − | − 0,76𝑉 Oxidation (Donator) o Kupfer: 𝐶𝑢 2+ + 2𝑒 − ↔ 𝐶𝑢 | + 0,35𝑉 Reduktion (Akzeptor) o Redoxreaktion: 𝐶𝑢2+ + Zn ↔ 𝑍𝑛 2+ + 𝐶𝑢 Donator // Akzeptor Schreibweise o 𝑍𝑛 /𝑍𝑛 2+// Cu2+/𝐶u Berechnung des Redoxpotentials mit: o ∆𝐸° = 𝐸° 𝐴𝐾𝑍𝐸𝑃𝑇𝑂𝑅 − 𝐸° 𝐷𝑂𝑁𝐴𝑇𝑂𝑅 o ∆𝐸° = 𝐸° 𝐾𝑢𝑝𝑓𝑒𝑟 − 𝐸° Zink o ∆𝐸° = 0,35𝑉 − −0,76𝑉 o ∆𝐸° = 1,11 𝑉 Der errechnete Wert ist als Spannung über ein Voltmeter zu messen.