434e Angeborene Erkrankungen des Aminosäurestoffwechsels
Werbung
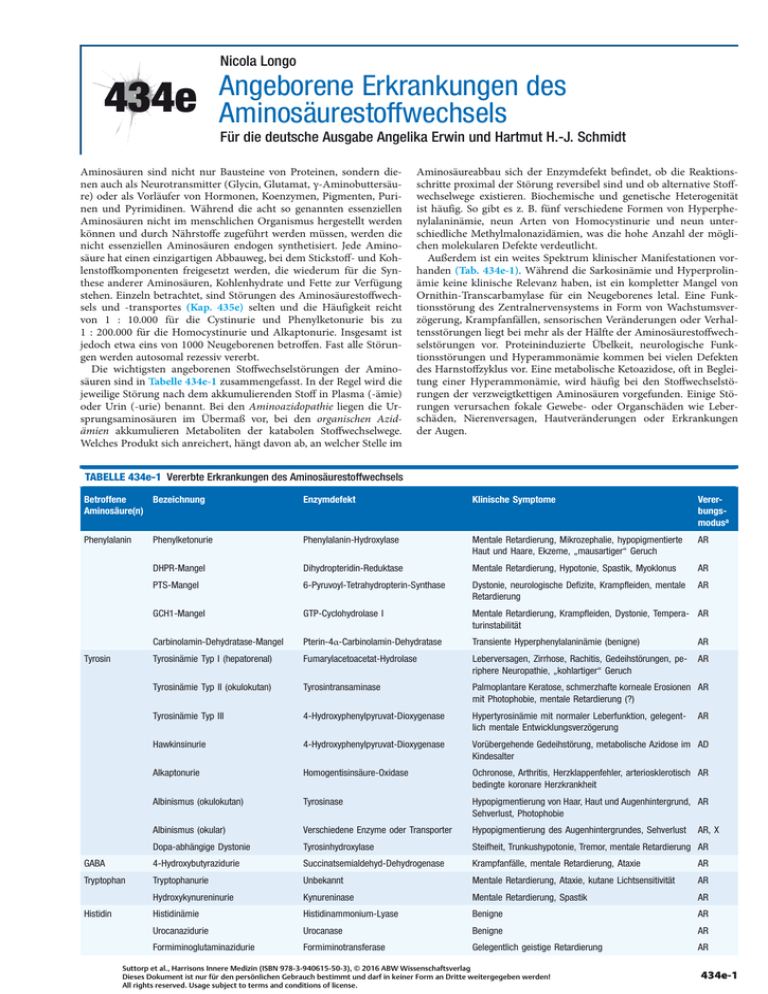
Nicola Longo 434e Angeborene Erkrankungen des Aminosäurestoffwechsels Für die deutsche Ausgabe Angelika Erwin und Hartmut H.-J. Schmidt Aminosäuren sind nicht nur Bausteine von Proteinen, sondern dienen auch als Neurotransmitter (Glycin, Glutamat, γ-Aminobuttersäure) oder als Vorläufer von Hormonen, Koenzymen, Pigmenten, Purinen und Pyrimidinen. Während die acht so genannten essenziellen Aminosäuren nicht im menschlichen Organismus hergestellt werden können und durch Nährstoffe zugeführt werden müssen, werden die nicht essenziellen Aminosäuren endogen synthetisiert. Jede Aminosäure hat einen einzigartigen Abbauweg, bei dem Stickstoff- und Kohlenstoffkomponenten freigesetzt werden, die wiederum für die Synthese anderer Aminosäuren, Kohlenhydrate und Fette zur Verfügung stehen. Einzeln betrachtet, sind Störungen des Aminosäurestoffwechsels und -transportes (Kap. 435e) selten und die Häufigkeit reicht von 1 : 10.000 für die Cystinurie und Phenylketonurie bis zu 1 : 200.000 für die Homocystinurie und Alkaptonurie. Insgesamt ist jedoch etwa eins von 1000 Neugeborenen betroffen. Fast alle Störungen werden autosomal rezessiv vererbt. Die wichtigsten angeborenen Stoffwechselstörungen der Aminosäuren sind in Tabelle 434e-1 zusammengefasst. In der Regel wird die jeweilige Störung nach dem akkumulierenden Stoff in Plasma (-ämie) oder Urin (-urie) benannt. Bei den Aminoazidopathie liegen die Ursprungsaminosäuren im Übermaß vor, bei den organischen Azidämien akkumulieren Metaboliten der katabolen Stoffwechselwege. Welches Produkt sich anreichert, hängt davon ab, an welcher Stelle im Aminosäureabbau sich der Enzymdefekt befindet, ob die Reaktionsschritte proximal der Störung reversibel sind und ob alternative Stoffwechselwege existieren. Biochemische und genetische Heterogenität ist häufig. So gibt es z. B. fünf verschiedene Formen von Hyperphenylalaninämie, neun Arten von Homocystinurie und neun unterschiedliche Methylmalonazidämien, was die hohe Anzahl der möglichen molekularen Defekte verdeutlicht. Außerdem ist ein weites Spektrum klinischer Manifestationen vorhanden (Tab. 434e-1). Während die Sarkosinämie und Hyperprolinämie keine klinische Relevanz haben, ist ein kompletter Mangel von Ornithin-Transcarbamylase für ein Neugeborenes letal. Eine Funktionsstörung des Zentralnervensystems in Form von Wachstumsverzögerung, Krampfanfällen, sensorischen Veränderungen oder Verhaltensstörungen liegt bei mehr als der Hälfte der Aminosäurestoffwechselstörungen vor. Proteininduzierte Übelkeit, neurologische Funktionsstörungen und Hyperammonämie kommen bei vielen Defekten des Harnstoffzyklus vor. Eine metabolische Ketoazidose, oft in Begleitung einer Hyperammonämie, wird häufig bei den Stoffwechselstörungen der verzweigtkettigen Aminosäuren vorgefunden. Einige Störungen verursachen fokale Gewebe- oder Organschäden wie Leberschäden, Nierenversagen, Hautveränderungen oder Erkrankungen der Augen. TABELLE 434e-1 Vererbte Erkrankungen des Aminosäurestoffwechsels Betroffene Bezeichnung Aminosäure(n) Enzymdefekt Klinische Symptome Vererbungsmodusa Phenylalanin Phenylketonurie Phenylalanin-Hydroxylase Mentale Retardierung, Mikrozephalie, hypopigmentierte Haut und Haare, Ekzeme, „mausartiger“ Geruch AR DHPR-Mangel Dihydropteridin-Reduktase Mentale Retardierung, Hypotonie, Spastik, Myoklonus AR PTS-Mangel 6-Pyruvoyl-Tetrahydropterin-Synthase Dystonie, neurologische Defizite, Krampfleiden, mentale Retardierung AR GCH1-Mangel GTP-Cyclohydrolase I Mentale Retardierung, Krampfleiden, Dystonie, Tempera- AR turinstabilität Carbinolamin-Dehydratase-Mangel Pterin-4α-Carbinolamin-Dehydratase Transiente Hyperphenylalaninämie (benigne) AR Tyrosinämie Typ I (hepatorenal) Fumarylacetoacetat-Hydrolase Leberversagen, Zirrhose, Rachitis, Gedeihstörungen, periphere Neuropathie, „kohlartiger“ Geruch AR Tyrosinämie Typ II (okulokutan) Tyrosintransaminase Palmoplantare Keratose, schmerzhafte korneale Erosionen AR mit Photophobie, mentale Retardierung (?) Tyrosinämie Typ III 4-Hydroxyphenylpyruvat-Dioxygenase Hypertyrosinämie mit normaler Leberfunktion, gelegentlich mentale Entwicklungsverzögerung Hawkinsinurie 4-Hydroxyphenylpyruvat-Dioxygenase Vorübergehende Gedeihstörung, metabolische Azidose im AD Kindesalter Alkaptonurie Homogentisinsäure-Oxidase Ochronose, Arthritis, Herzklappenfehler, arteriosklerotisch AR bedingte koronare Herzkrankheit Albinismus (okulokutan) Tyrosinase Hypopigmentierung von Haar, Haut und Augenhintergrund, AR Sehverlust, Photophobie Albinismus (okular) Verschiedene Enzyme oder Transporter Hypopigmentierung des Augenhintergrundes, Sehverlust Tyrosin AR AR, X Dopa-abhängige Dystonie Tyrosinhydroxylase Steifheit, Trunkushypotonie, Tremor, mentale Retardierung AR GABA 4-Hydroxybutyrazidurie Succinatsemialdehyd-Dehydrogenase Krampfanfälle, mentale Retardierung, Ataxie AR Tryptophan Tryptophanurie Unbekannt Mentale Retardierung, Ataxie, kutane Lichtsensitivität AR Hydroxykynureninurie Kynureninase Mentale Retardierung, Spastik AR Histidinämie Histidinammonium-Lyase Benigne AR Urocanazidurie Urocanase Benigne AR Formiminoglutaminazidurie Formiminotransferase Gelegentlich geistige Retardierung AR Histidin Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license. 434e-1 Teil 16 Endokrinologie und Stoffwechsel Tabelle 434e-1 (Fortsetzung) Betroffene Bezeichnung Aminosäure(n) Enzymdefekt Klinische Symptome Vererbungsmodusa Glycin Glycin-Enzephalopathie Glycinspaltung (4 verschiedene Enzyme) Frühkindliches Krampfleiden, Lethargie, Apnoe, starke geistige Retardierung AR Sarkosinämie Sarkosindehydrogenase Benigne AR Hyperoxalurie Typ I Alanin-Glyoxylat-Aminotransferase Nephrolithiasis (Kalziumoxalatsteine), Nierenversagen AR Hyperoxalurie Typ II D-Glycerat-Dehydrogenase/Glyoxylat-Reduktase Nephrolithiasis (Kalziumoxalatsteine), Nierenversagen AR Serin Phosphoglycerat-DehydrogenaseMangel Phosphoglycerat-Dehydrogenase Krampfanfälle, Mikrozephalie, mentale Retardierung AR Prolin Hyperprolinämie Typ I Prolinoxidase Benigne AR Hyperprolinämie Typ II Δ1-Pyrrolin-5-carboxylat-Dehydrogenase Fieberkrämpfe, mentale Retardierung AR Hyperhydroxyprolinämie Hydroxyprolin-Oxidase Benigne AR Methionin Prolidase-Mangel Prolidase Leichte mentale Retardierung, chronische Dermatitis AR Hypermethioninämie Methionin-Adenosyltransferase Meist benigne AR S-Adenosylhomocystein-HydrolaseMangel S-Adenosylhomocystein-Hydrolase Hypotonie, mentale Retardierung, fehlende Sehnenreflexe, AR verspätete Myelinisierung Glycin-N-Methyltransferase-Mangel Glycin-N-Methyltransferase Erhöhte Transaminasenwerte AR Homocystinurie Cystathionin-β-Synthetase Dislokation der Augenlinse, thrombotische Gefäßerkrankung, mentale Retardierung, Osteoporose AR Homocystinurie 5,10-Methylentetrahydrofolat-Reduktase Mentale Retardierung, Gangabnormalität, psychische Abnormalität, rezidivierende Schlaganfälle AR Homocystinurie Methioninsynthase (CblE, -G) Mentale Retardierung, Hypotonie, Krampfanfälle, megaloblastische Anämie AR Homocystinurie und Methylmalonazidämie Metabolismus von Vitamin B12 und dessen Mentale Retardierung, Lethargie, Gedeihstörungen, HyEfflux aus Lysosomen (CblC, -D, -F) potonie, Krampfanfälle, megaloblastische Anämie AR Cystathionin Cystathioninurie β-Cystathionase Benigne AR Cystein Cystinose Cystinosin CTNS (lysosomaler Efflux) Renales Fanconi-Syndrom, Rachitis, Photophobie, Hypotonie, Nierenversagen AR S-Sulfo-L-Cystein Sulfocysteinurie Sulfatoxidase oder Molybdän-KofaktorMangel Krampfanfälle, mentale Retardierung, Dislokation der Augenlinse AR Lysin Hyperlysinämie, Saccharopinurie α-Aminoadipin-Semialdehyd-Synthase Benigne AR Pyridoxinabhängige Epilepsie L-Δ1-Piperidin-6-carboxylat-Dehydrogena- Krampfanfälle AR Homocystein se Lysin, Tryptophan α-Ketoadipat-Azidämie α-Ketoadipat-Dehydrogenase Benigne ? Glutarazidämie Typ I Glutaryl-CoA-Dehydrogenase Progressive schwere Dystonie und Athetose, motorische Entwicklungsverzögerung AR Glutarazidämie Typ II Elektronentransfer-Flavoprotein (ETF), ETF- Hypoglykämie, metabolische Azidose, „Schweißfuß“-Ge- AR Ubiquinon-Oxidoreduktase ruch, Hypotonie, Kardiomyopathie Ornithin Chorioretinale Atrophie (Gyratatrophie) Ornithin-δ-Aminotransferase Myopie, Nachtblindheit, Verlust des peripheren Gesichts- AR feldes, Katarakt, chorioretinale Degeneration Harnstoffzyklus Carbamylphosphat-Synthetase-IMangel Lethargie bis hin zum Koma, Abneigung gegen Proteine, AR mentale Retardierung, Hyperammonämie 434e-2 Carbamylphosphat-Synthetase I N-Acetylglutamat-Synthetase-Mangel N-Acetylglutamat-Synthetase Lethargie bis hin zum Koma, Abneigung gegen Proteine, AR mentale Retardierung, Hyperammonämie Ornithin-Transcarbamylase-Mangel Ornithin-Transcarbamylase Lethargie bis hin zum Koma, Abneigung gegen Proteine, X mentale Retardierung, Hyperammonämie Citrullinämie Typ I Argininosuccinat-Synthetase Lethargie bis hin zum Koma, Abneigung gegen Proteine, AR mentale Retardierung, Hyperammonämie Argininosuccinat-Azidämie Argininosuccinat-Lyase Lethargie bis hin zum Koma, Abneigung gegen Proteine, AR mentale Retardierung, Hyperammonämie Arginase-Mangel Arginase Spastische Tetraparese, mentale Retardierung, leichte Hyperammonämmie Hyperammonämie-Hyperornithinämie-Homocitrullinurie(HHH)-Syndrom Mitochondrialer Ornithin-Carrier ORNT1 Erbrechen, Lethargie, Gedeihstörung, mentale Retardie- AR rung, episodische geistige Verwirrung, Hyperammonämie, Proteinintoleranz Citrullinämie Typ II Mitochondrialer Aspartat/Glutamat-Carrier CTLN2 Neugeborene: intrahepatische Cholestase; Erwachsene: Verhaltensänderungen und Stupor, Koma, Hyperammonämie Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license. AR AR Angeborene Erkrankungen des Aminosäurestoffwechsels 434e Tabelle 434e-1 (Fortsetzung) Betroffene Bezeichnung Aminosäure(n) Klinische Symptome Vererbungsmodusa Prolin, Ornithin, L-Δ1-Pyrrolin-5-carboxylat-Synthase- L-Δ1-Pyrrolin-5-carboxylat-Synthase Arginin Mangel Hypotonie, Krampfanfälle, Neurodegeneration, periphere Neuropathie, Gelenklaxität, hyperelastische Haut, subkapsuläre Katarakte, Hyperammonämie AR Glutamin Glutamin-Synthetase-Mangel Glutamin-Synthetase Fehlbildungen des Gehirns, Pachygyrie, Krampfanfälle, dysmorphe Züge Valin Hypervalinämie Valinaminotransferase Erbrechen, Fieber, Gedeihstörung, Hypotonie AR Isobutyryl-CoA-Dehydrogenase-Mangel Isobutyryl-CoA-Dehydrogenase Gedeihstörung, Anämie, dilatative Kardiomyopathie (?) AR Leucin-Isoleucin-Aminotransferase Krampfanfälle, Gedeihstörung, mentale Retardierung Leucine, Isoleu- Hyperleucin-Isoleucinämie cine Enzymdefekt Valin, Leucin, Isoleucin Ahornsirup-Krankheit (Defekte der Verzweigtkettige α-Ketosäuren-DehydroUntereinheiten E1α, E1β, E2 oder E3) genase (Mangel von E1α, E1β, E2, E3) Lethargie, Erbrechen, Enzephalopathie, Krampfanfälle, AR mentale Retardierung, „Ahornsirup“-Geruch, Proteinintoleranz Leucin Isovalerianazidämie Isovaleryl-CoA-Dehydrogenase Azidose, Ketose, Erbrechen, Koma, Hyperammonämie, „Schweißfuß“-Geruch, Proteinintoleranz 3-Methylcrotonylglycinurie 3-Methylcrotonyl-CoA-Carboxylase Stressinduzierte metabolische Azidose, Hypotonie, Hypo- AR glykämie, „Katzenurin“-Geruch 3-Methylglutaconazidurie Typ I 3-Methylglutaconyl-CoA-Hydratase-Mangel Stressinduzierte Azidose, Leukodystrophie, Hypotonie, Hepatomegalie AR 3-Hydroxy-3-Methylglutarazidurie 3-Hydroxy-3-methylglutaryl-CoA-Lyase Stressinduzierte hypoketotische Hypoglykämie und Azidose, Enzephalopathie, Hyperammonämie AR 2-Methylbutyryl-Glycinurie 2-Methylbutyryl-CoA-Dehydrogenase Fasteninduzierte Azidose und Hypoglykämie AR 2-Methyl-3-hydroxybutyryl-CoA-Dehydrogenase-Mangel 2-Methyl-3-hydroxybutyryl-CoA-Dehydrogenase Entwicklungsverzögerung, Krampfanfälle, Rigor (kann durch Infekte getriggert werden) X 3-Oxothiolase-Mangel 3-Oxothiolase Fasteninduzierte Azidose und Ketose, Erbrechen, Lethar- AR gie Propionyl-CoA-Carboxylase (pcc) Metabolische Ketoazidose, Hyperammonämie, Hypotonie, AR Lethargie, Koma, Proteinintoleranz, mentale Retardierung, Hyperglycinämie Isoleucin Valin, Isoleucin, Propionazidämie (pccA, -B, -C) Methionin, Threonin Multipler Carboxylase-Mangel/Biotini- Holocarboxylase-Synthetase/Biotinidase dase-Mangel Metabolische Ketoazidose, diffuser Hautausschlag, Alopezie, Krampfanfälle, mentale Retardierung AR AR Methylmalonylazidämie (Mutase, Ra- Methylmalonyl-CoA-Mutase/Racemase Metabolische Ketoazidose, Hyperammonämie, Hypertonie, AR cemase, CblA, -B) oder Cobalamin-Reduktase/Adenosyltrans- Lethargie, Koma, Proteinintoleranz, mentale Retardierung, ferase Hyperglycinämie a AD = autosomal dominant; AR = autosomal rezessiv; X = X-chromosomal. Abkürzungen: Cbl = Cobalamin; DOPA = Dihydroxyphenylalanin; GABA = γ-Aminobutyrat; GTP = Guanosin-5’-triphosphat. Die Diagnosestellung dieser Erkrankungen sowie Kontrolluntersuchungen erfolgen meist mittels einer Analyse der Aminosäuren im Plasma (via Ionenaustauschchromatografie), der Bestimmung von organischen Säuren im Urin (via Gaschromatografie/Massenspektrometrie) und Bestimmung der Acylcarnitine im Plasma (Tandemmassenspektrometrie). Die Diagnose wird dann durch Enzymassays in Zellen oder Gewebeproben des Patienten bestätigt. Alternativ kann eine DNS-Analyse durchgeführt werden. Die klinische Manifestation kann durch frühzeitige Diagnosestellung und entsprechende Therapie wie Protein- oder Aminosäurenrestriktion sowie Vitaminsupplementierung verhindert oder abgeschwächt werden. Daher werden Neugeborene routinemäßig auf einige der Störungen des Aminosäurestoffwechsels untersucht. Bei Säuglingen mit positivem Testergebnis müssen weitere Untersuchungen des Stoffwechsels vorgenommen werden, um die Diagnose zu bestätigen oder auszuschließen. Falls sich die Verdachtsdiagnose bewahrheitet, sollte der Patient in ein Zentrum für Stoffwechselerkrankungen überwiesen werden, um dort mit der Therapie zu beginnen. Die Eltern müssen über das Risiko aufgeklärt werden, bei einer erneuten Schwangerschaft ein Kind mit demselben Stoffwechseldefekt zu bekommen. In manchen Fällen sollte außerdem eine Untersuchung der Eltern erfolgen, um entweder metabolische Veränderungen zu detektieren, die bei Anlageträgern einiger dieser Stoffwechselerkrankungen auftreten (wie bei manchen Formen der Homocystinurie), oder um auszuschließen, dass ein Elternteil selbst an der Erkrankung leidet (z. B. an Glutarazidämie Typ 1, Methylcro- tonyl-CoA-Carboxylase-Mangel oder einer Störung der Fettsäureoxidation). Einige dieser Stoffwechselerkrankungen können bis zum Erwachsenenalter asymptomatisch bleiben und manifestieren sich nur dann, wenn Fasten oder Stress die volle Aktivität des Stoffwechselweges zur Energiebereitstellung erforderlich machen. In diesem Kapitel werden ausgewählte Erkrankungen besprochen, welche die Grundlagen und Eigenschaften von Störungen des Aminosäurestoffwechsels darlegen und die mit diesen Erkrankungen einhergehenden Probleme verdeutlichen. HYPERPHENYLALANINÄMIEN Die Hyperphenylalaninämien (Tab. 434e-1) sind Folge einer gestörten Umwandlung von Phenylalanin zu Tyrosin. Die häufigste und klinisch wichtigste Form ist die Phenylketonurie (Häufigkeit 1 : 10.000), eine autosomal rezessiv vererbte Erkrankung, welche durch eine erhöhte Konzentration von Phenylalanin und dessen Nebenprodukten in Körperflüssigkeiten charakterisiert ist. Falls diese Störung während der Kindheit unbehandelt bleibt, tritt eine schwere mentale Retardierung auf. Die Phenylketonurie ist durch eine reduzierte PhenylalaninHydroxylase-Aktivität bedingt. Die Anhäufung von Phenylalanin hemmt den Transport von anderen Aminosäuren, welche für die Synthese von Proteinen und Neurotransmittern notwendig sind. Dies resultiert in einer unzureichenden Bildung von Noradrenalin und Serotonin. Außerdem wird die Myelinsynthese gehemmt und gleichzeitig deren Abbau gefördert. Ein Überschuss an Phenylalanin führt zur Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license. 434e-3 Teil 16 Endokrinologie und Stoffwechsel Hypopigmentierung von Haaren und Haut, da Phenylalanin als kompetitiver Hemmer der Tyrosinase, einem Schlüsselenzym der Melaninsynthese, wirkt. Unbehandelte Kinder mit einer klassischen Phenylketonurie erscheinen bei der Geburt normal, fallen jedoch bald mit frühkindlicher Entwicklungsverzögerung, Mikrozephalie und fortschreitender Beeinträchtigung ihrer Gehirnfunktion auf. Hyperaktivität, Krampfanfälle und geistige Behinderung führen zu schwerwiegenden Problemen im späteren Leben. Elektroenzephalografische Veränderungen, ein typischer „mäuseartiger“ Geruch von Haut, Haar und Urin (aufgrund der Phenylacetatanhäufung) und eine Neigung zu Hypopigmentierung und Ekzemen komplettieren das verheerende klinische Bild. Im Gegensatz dazu zeigen Kinder, welche bei Geburt diagnostiziert und behandelt wurden, keine dieser Symptome. BEHANDLUNG: PHENYLKETONURIE Um geistige Schäden zu verhindern, muss die Diagnose vor Vollendung der dritten Lebenswoche gestellt und mit entsprechenden Ernährungseinschränkungen begonnen werden. Daher wird bei den meisten Neugeborenen in Nordamerika, Australien und Europa der Blutspiegel von Phenylalanin bestimmt. Anormale Werte werden anhand einer quantitativen Analyse der Plasmaaminosäuren bestätigt. Mit einer Phenylalaninrestriktion wird normalerweise bei einer Phenylalaninkonzentration von > 360 μmol/l (> 5 mg/ dl) begonnen. Die Behandlung besteht aus einer speziellen phenylalaninarmen Diät, die durch Tyrosin ergänzt wird, da Tyrosin bei Phenylalanin-Hydroxylase-Mangel zu einer essenziellen Aminosäure wird. Die Phenylalaninkonzentration sollte unter Therapie zwischen 120 und 360 μmol/l (1–6 mg/dl) gehalten werden. Es wird empfohlen, die Diätvorschriften lebenslang fortzuführen und zu überwachen. Manche Patienten mit einer leichteren Form (Phenylalanin < 1200 μm bei Erstvorstellung) haben eine erhöhte Toleranz gegenüber Nahrungsproteinen und können metabolisch besser kontrolliert werden, wenn sie mit Tetrahydrobiopterin (20 mg/ kg/d), einem wichtigen Kofaktor der Phenylalanin-Hydroxylase, behandelt werden. Einige der Frauen mit Phenylketonurie, die seit früher Kindheit behandelt wurden, erreichen das fertile Alter. Wenn die Phenylalaninkonzentration vor und während der Schwangerschaft nicht streng kontrolliert wird, besteht für das Neugeborene das Risiko von angeborenen Defekten und Mikrozephalie (mütterliche Phenylketonurie). Nach der Geburt weisen diese Kinder schwere neu- MethioninsynthaseReduktase (CblE) Remethylierung rologische Defizite und Wachstumsstörungen auf. Die Schwangerschaftsrisiken können durch eine lebenslange Einhaltung der phenylalaninarmen Ernährung und eine absolute Restriktion von Phenylalanin mindestens zwei Monate vor der Empfängnis und während der gesamten Schwangerschaft minimiert werden. HOMOCYSTINURIEN (HYPERHOMOCYSTEINÄMIEN) Die Homocystinurie umfasst neun biochemisch sowie klinisch unterschiedliche Störungen (Tab. 434e-1). Jede von ihnen ist durch die erhöhte Konzentration von Homocystein, einer schwefelhaltigen Aminosäure, in Plasma und Urin charakterisiert. Die klassische Homocystinurie als häufigste Form (Häufigkeit 1 : 200.000) entsteht durch eine verminderte Aktivität der Cystathionin-β-Synthetase (Abb. 434e-1), einem Pyridoxalphosphat-abhängigen Enzym, welches die Verbindung von Homocystein und Serin zu Cystathionin katalysiert. Die meisten Patienten werden im Alter zwischen 3 und 5 Jahren diagnostiziert und weisen dislozierte Augenlinsen sowie in etwa der Hälfte der Fälle eine mentale Retardierung auf. Einige Patienten entwickeln einen marfanoiden Habitus und röntgenologisch nachweisbare Osteoporose. Lebensbedrohliche Gefäßkomplikationen (z. B. von Koronar-, Nieren- und Zerebralarterien) können während der ersten 10 Lebensjahre auftreten und sind der Hauptgrund für Morbidität und Mortalität. Die klassische Homocystinurie kann mithilfe einer Analyse der Plasmaaminosäuren, welche einen erhöhten Methioningehalt und das Vorhandensein von freiem Homocystein aufzeigt, diagnostiziert werden. Außerdem ist die Gesamt-Homocystein-Konzentration im Plasma stark erhöht (meist > 100 μm). Die Behandlung besteht in einer speziellen Diät mit Protein- und Methioninrestriktion sowie mit Cystin-Supplementierung. Bei etwa der Hälfte der Patienten senkt orales Pyridoxin (25–500 mg/d) die Plasmamethionin- und die Plasmahomocysteinkonzentration. Ein Folsäure- und Vitamin-B12-Mangel sollte durch entsprechende Nahrungsergänzung verhindert werden. Betain wirkt ebenfalls reduzierend auf den Homocysteinspiegel und kann bei Patienten eingesetzt werden, die auf Pyridoxin nicht ansprechen. Die anderen Formen der Homocystinurie sind das Ergebnis einer beeinträchtigten Remethylierung von Homocystein zu Methionin. Dies kann durch eine defekte Methionin-Synthase oder eine reduzierte Verfügbarkeit der zwei essenziellen Kofaktoren 5-Methyltetrahydrofolat und Methylcobalamin (methyliertes Vitamin B12) verursacht werden. Methylgruppen-Transfer NH CH3 – S(CH2)2 – CH – COOH Serin Glycin Tetrahydrofolat (THF) Cobalamin (B12) cbl C, D, F, J, X 5,10-MethylenTHF ATP MethioninSynthase (CblG) Dimethylglycin Methyl-Cobalamin MethioninAdenosyltransferase (MAT) Methionin Methionin S-Adenosylmethionin Methyltransferasen Betain-HomocyysteinBetain-HomocysteinMethyltransferasse Methyltransferase Betain Glycin-N-Methyltransferase CH3 S-Adenosylhomocystein N5-MethylTHF S-AdenosylhomocysteinHydrolase Hom mocystein Homocystein MethylentetrahydrofolatReduktase (MTHFR) N-Methylglycin (Sarkosin) Kreatin Adenosin Serin Cystathionin-β Synthetase (B6) Glycin Ad denosinAdenosinkinase Guanoacidinoacetatmethyltransferase Cysttathionin Cystathionin Cystathionase (B6) Homoserin AMP Cystein Transsulfuration Abbildung 434e-1 Wichtige Stoffwechselwege, Enzyme und Koenzyme im Rahmen der Homocystinurie. Methionin gibt bei der Umwandlung zu Homocystein eine Methylgruppe ab. Defekte des Methylgruppen-Transfers oder der anschließenden Verstoffwechselung von Homocystein durch die Pyridoxalphosphat(Vitamin B6)-abhängige Cystathionin-βSynthetase führen zu einem Anstieg von Methionin im Plasma. Homocystein wird durch die Methionin-Synthase zu Methionin remethyliert, wofür Methylcobalamin und Folsäure benötigt werden. Ein Mangel dieses Enzyms oder der Kofaktoren ist mit niedrigen oder normalen Methioninspiegeln assoziiert. Alternativ kann eine Remethylierung von Homocystein auch über die Betain-Homocystein-Methyltransferase erfolgen. 434e-4 Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license. Angeborene Erkrankungen des Aminosäurestoffwechsels Der Begriff Hyperhomocysteinämie bezeichnet eine erhöhte Gesamtplasmakonzentration von Homocystein mit oder ohne Anstieg von freiem Homocystein (Disulfidform). Hyperhomocysteinämie ohne signifikante Homocystinurie wird bei Patienten beobachtet, die heterozygot für die oben genannten genetischen Defekte oder homozygot für mildere Formen der Erkrankung sind. Außerdem sind Veränderungen der Homocysteinkonzentration im fortgeschrittenen Alter, bei Rauchern, postmenopausalen Frauen, Patienten mit Nierenversagen, Hypothyreose, Leukämie, chronisch entzündlichen Darmerkrankungen und Psoriasis sowie unter Therapie mit Methotrexat, Lachgas, Isoniazid und einigen Antiepileptika vorzufinden. Homocystein wirkt atherogen und thrombophil. Erhöhte Homocysteinkonzentrationen im Plasma sind ein Risiko für koronare, zerebrovaskuläre und periphere arterielle Gefäßverschlüsse sowie für tiefe Venenthrombosen (Kap. 291e). Homocystein wirkt synergistisch zu Tabakkonsum und arterieller Hypertonie und hat einen additiven Effekt im Hinblick auf andere Risikofaktoren, die für eine periphere arterielle Verschlusskrankheit prädisponieren. Außerdem wurden Hyperhomocysteinämie, Folsäure- und Vitamin-B12-Mangel während der Schwangerschaft mit vermehrten Neuralrohrdefekten in Verbindung gebracht. Vitaminergänzungen sind in diesen Fällen hilfreich, um die Konzentration des Plasmahomocysteins zu verringern, obwohl die Studienlage zur kardiovaskulären Risikoreduktion widersprüchlich ist. ALKAPTONURIE Die Alkaptonurie ist eine seltene Störung des Tyrosinabbaus (Häufigkeit 1 : 200.000), bei welcher ein Mangel an Homogentisat-1,2-dioxygenase (auch bekannt als Homogentisinsäure-Oxidase) zu einer Ausscheidung großer Mengen von Homogentisinsäure im Urin und zu einer Anhäufung von oxidiertem Homogentisinsäurepigment im Bindegewebe führt (Ochronose). Die Alkaptonurie kann bis zum Auftreten degenerativer Gelenkerkrankungen im mittleren Lebensalter unentdeckt bleiben. Bereits zuvor wird bei etwa der Hälfte der Patienten „dunkler Urin“ festgestellt. Nach dem 30. Lebensjahr entwickeln sich normalerweise Stellen von graubraunem skleralem Pigment und eine generelle Dunkelfärbung der Concha auriculae, der Anthelix und letztendlich der Ohrmuschelhelix selbst. Zwischen dem 30. und 40. Lebensjahr setzen dann leichte Rückenschmerzen ein. Die ochronotische Arthritis wird von Schmerzen, Steifheit und einer eingeschränkten Beweglichkeit von Hüfte, Knien und Schultern begleitet. Die akute Arthritis kann einer rheumatischen Arthritis gleichen, jedoch sind kleinere Gelenke meist nicht betroffen. Es treten Verfärbungen von Herzklappen, Larynx, Trommelfell und Haut auf. Gelegentlich bilden Patienten renale Pigmentsteine und Prostatasteine aus. Aufgrund von Pigmentablagerungen in Herz und Blutgefäßen, die zur Aortenklappenstenose führen, muss oft jenseits des 60. Lebensjahres ein Klappenersatz durchgeführt werden. Bei Patienten, deren Urin sich fast schwarz verfärbt, sollte die Verdachtsdiagnose einer Alkaptonurie gestellt werden. Homogentisinsäure im Urin wird durch eine Untersuchung auf organische Säuren oder durch einen spezifischen kolorimetrischen Test festgestellt. Die ochronotische Arthritis wird symptomatisch mit Analgetika, Wirbelsäulenchirurgie und Arthroplastik behandelt (Kap. 394). Die Restriktion von Ascorbinsäure und Protein reicht nicht aus, um die Homogentisinsäureproduktion zu reduzieren. Die Gabe von Nitisinon [2-(2-Nitro-4-Trifluoromethylbenzoyl)-1,3-Cyclohexanedion], einem Medikament zur Behandlung der Tyrosinämie Typ 1, reduziert hingegen die Ausscheidung von Homogentisinsäure im Urin und kann in Verbindung mit einer eiweißarmen Ernährung den Langzeitkomplikationen der Alkaptonurie vorbeugen. DEFEKTE DES HARNSTOFFZYKLUS Überschüssiges Ammoniak, das aus in Proteinen enthaltenem Stickstoff entsteht, wird durch den Harnstoffzyklus beseitigt. Der Harnstoffzyklus ist ein Stoffwechselprozess, an dem mehrere Enzyme und Transporter beteiligt sind (Tab. 434e-1). Ein kompletter Mangel eines dieser Enzyme ruft bei Neugeborenen meist eine schwere Hyper- 434e ammonämie hervor, wohingegen diese bei Erwachsenen milder ausgeprägt sein kann. Die Akkumulation von Ammoniak und Glutamin führt zur Entwicklung eines zerebralen Ödems und einer direkten neuronalen Toxizität. Der Mangel jedes einzelnen am Harnstoffzyklus beteiligten Enzyms ist selten, doch fasst man alle zusammen, so beträgt die Häufigkeit der Enzymdefekte 1 : 25.000. Abgesehen vom Ornithin-Transcarbamylase-Mangel, der X-chromosomal vererbt wird, unterliegen alle Enzymdefekte einem autosomal-rezessiven Erbgang. Aufgrund des willkürlichen X-Inaktivierungsmusters exprimieren die Hepatozyten von Frauen mit Ornithin-Transcarbamylase-Mangel entweder das normale oder das mutierte Allel. Falls die mutierten Proteinformen überwiegen, resultiert dies in einer eingeschränkten Ammoniakentgiftung. Neugeborene mit klassischen Defekten des Harnstoffzyklus fallen zwischen dem ersten und vierten Lebenstag mit Nahrungsverweigerung und Lethargie bis hin zu Koma und Tod auf. Mildere Varianten von Enzymmangel manifestieren sich mit Proteinabneigung, rezidivierendem Erbrechen, Migräne, Stimmungsschwankungen, chronischer Müdigkeit, Reizbarkeit und Verwirrtheit bis hin zum Koma. Frauen mit Ornithin-Transcarbamylase-Mangel fallen möglicherweise erstmals bei einer Entbindung auf, da unfreiwilliges Fasten und Stress zu Katabolismus und damit zu einer konsekutiven Hyperammonämie führen. Für die Diagnosestellung müssen sowohl Ammoniak- als auch Aminosäurespiegel im Plasma gemessen werden. Um einen OrnithinTranscarbamylase-Mangel von einem Carbamylphosphat-Synthetase1- sowie einem N-Acetylglutamat-Synthetase-Mangel unterscheiden zu können, ist die Bestimmung von Orotsäure im Urin hilfreich. Eine Hyperammonämie kann außerdem durch jede Art von Lebererkrankung, organischen Azidämien sowie durch Fettsäurenoxidationsstörungen verursacht werden. Organische Azidämien und Defekte der Fettsäurenoxidation können durch Analyse von organischen Säuren im Urin und durch Messung von Acylcarnitinen im Plasma ausgeschlossen werden. BEHANDLUNG: DEFEKTE DES HARNSTOFFZYKLUS Durch die Therapiemaßnahmen, die in einer adäquaten Kalorienzufuhr (bei komatösen Patienten durch Glukose- und Lipidinfusion) und gegebenenfalls Insulingabe bestehen, soll eine katabole Stoffwechsellage verhindert und somit die Produktion von Ammoniak reduziert werden. Überschüssiger Stickstoff wird durch intravenöse Gabe von Phenylacetat und Benzoat (initiale Bolusinjektion von 0,25 g/kg und danach Dauerinfusion über 24 Stunden) aus dem Kreislauf entfernt. Dabei verbinden sich diese Substanzen mit Glutamin bzw. Glycin und bilden Phenylacetylglutamin und Hippursäure, die dann als wasserlösliche Moleküle renal ausgeschieden werden. Da Arginin (außer im Falle eines Arginase-Mangels) zu einer essenziellen Aminosäure wird, muss es zur Aufrechterhaltung der Proteinbiosynthese intravenös substituiert werden (200 mg/kg/d). Falls diese Maßnahmen nicht ausreichen, um den Ammoniakspiegel zu senken, muss unverzüglich mit einer Hämodialyse begonnen werden. Zur Langzeittherapie gehören eine proteinarme Ernährung und, abhängig von der exakten Diagnose, die Einnahme von Phenylbutyrat, Glycerolphenylbutyrat (eine flüssige Zubereitung, die von den meisten Patienten besser vertragen wird) und von Arginin- oder Zitrullinpräparaten. Bei Patienten mit schweren Störungen des Harnstoffzyklus, die medikamentös schlecht einstellbar sind, sollte eine Lebertransplantation in Erwägung gezogen werden. Auch gibt es erste Hinweise, dass eine Leberzelltransplantation über Monate bis wenige Jahre den Stoffwechsel erfolgreich stabilisieren kann. Bei Patienten, die sich einer Organtransplantation unterzogen haben, die aufgrund einer malignen Erkrankung mit Chemotherapeutika behandelt werden, oder die unter einer Leberzirrhose leiden, kann durch einen funktionellen Mangel an Glutaminsynthase eine Hyperammonämie entstehen. In einigen dieser Fälle konnte das oben beschriebene Protokoll zur Bekämpfung der Hyperammonämie erfolgreich angewendet werden. Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license. 434e-5











