Das Periodensystem Die Frage nach den Bausteinen von Stoffen
Werbung

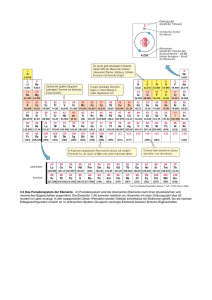
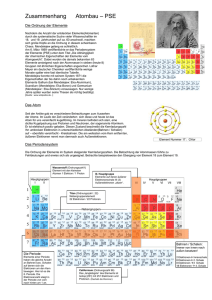
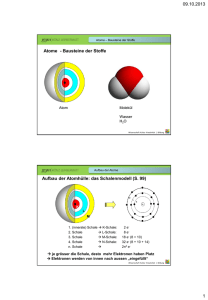
file:///D|/Refs/_To%20Do/13_01_06/Tag%201/DasPeriodensystem.html Das Periodensystem Die Frage nach den Bausteinen von Stoffen war sozusagen der Auslöser für die Erforschung der chemischen Elemente. Jedoch nahm die Suche nach Elementen erst im 19. Jhd. ihren Anfang und die Zahl der bekannten Elemente stieg. Den Chemikern Mendelejew und Meyer gelang es, unabhängig voneinander, im Jahre 1868/69 ein System zu entwickeln, welches die Elemente in Perioden gliedert, sodass Elemente, die im Periodensystem übereinander stehen, ähnliche Eigenschaften aufweisen und in Gruppen angeordnet werden können. Eine sinnvolle Anordnung war wegen der guten Kenntnisse der Eigenschaften der Elemente möglich, jedoch mussten somit auch Lücken gelassen werden für noch nicht bekannte Elemente. Mit Hilfe der Ähnlichkeiten der Eigenschaften und ihrer strukturierten Veränderung (die Atommasse war ausschlaggebend) konnten die unbekannten Elemente verblüffend genau beschrieben werden. 1913 wurde klar, dass die Kernladungszahl (Anzahl Protonen) der entscheidende Faktor für die Ordnung der Elemente war. Das Periodensystem beinhaltet 7 Perioden, welche horizontal geordnet sind und insgesamt 18 Gruppen, welche in 8 Hauptgruppen und 8 Nebengruppen aufgeteilt sind. Alle Nebengruppenelemente sind Metalle. Das Periodensystem als Atombau-Auskunft Das Besondere am Periodensystem ist, dass man an der Stellung eines Elements im Periodensystem deren Atombau ablesen kann. Die Unterteilung in Perioden und Gruppen erfolgt nach der Bestückung mit Elektronen in den verschiedenen Schalen des Atoms. Mit jeder weiteren Periode nimmt die Zahl der mit Elektronen ausgestatteten Schale eines Atoms zu. Die Besetzung der verschieden Schalen mit Elektronen ist aber begrenzt. Die erste Schale (K-Schale), dem Atomkern am nächsten, kann 2 Elektronen aufnehmen, die zweite Schale (L-Schale) 8 Elektronen, die dritte Schale (M-Schale) 8 Elektronen, die vierte Schale (N-Schale) 18 Elektronen usw. bis zur siebten Schale (Q-Schale), welche 32 Elektronen aufnehmen kann. Die sich ändernde Elektronenanzahl der Perioden hängt mit den unterschiedlichen Energiezuständen der Elektronen in denselben Schalen zusammen. Womöglich auf die grösser werdende Entfernung der Schalen vom Kern zurückzuführen. Bei den Nebengruppenelementen werden, bevor sie die äussersten Schalen fertig mit Elektronen besetzt haben, die Inneren besetzt. Das Periodensystem zeigt uns die Verteilung der Elektronen. Aussenelektronen und ihre Bedeutung In einer Hauptgruppe sich befindende Elemente haben zudem die gleiche Anzahl Elektronen in der äussersten Schale ihrer Atome. Die ähnlichen chemischen Eigenschaften der Elemente der gleichen Gruppe stehen somit in Zusammenhang mit der Anzahl der Aussenelektronen. Diese Anzahl beträgt nie mehr als acht und steht für die Hauptgruppennummer. Die Anzahl Aussenelektronen ist wichtig, da an ihr zahlenmässig die Ladung des Atomrumpfs abgelesen werden kann. Atom = Atomrumpf + Aussenelektronen file:///D|/Refs/_To%20Do/13_01_06/Tag%201/DasPeriodensystem.html (1 von 2)03.03.2006 09:38:44 file:///D|/Refs/_To%20Do/13_01_06/Tag%201/DasPeriodensystem.html Atomrumpf = Atomkern + alle Elektronen, ohne Aussenelektronen Anzahl Aussenelektronen = Ladung Atomrumpf (immer positiv) file:///D|/Refs/_To%20Do/13_01_06/Tag%201/DasPeriodensystem.html (2 von 2)03.03.2006 09:38:44