Die chemische Bindung - doc
Werbung

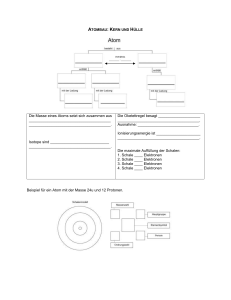
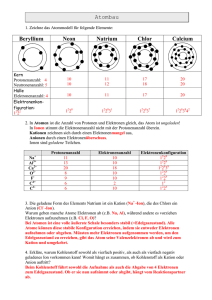
Die chemische Bindung Chemische Bindungen entstehen durch Wechselwirkung von Elektronen mit den Protonen der Atomkerne mindestens zweier Bindungspartner. Ziel: Erreichen eines stabileren Zustands des Systems Beob.: Die Elemente der 8. Hauptgruppe des PSE (Edelgase) sind chemisch weit gehend inert, d. h. sie reagieren chemisch praktisch nicht. Es sind He, Ne, Ar, Kr, Xe, Rn. (Die „s“- und „p“-Orbitale der äußersten Schale dieser Edelgase sind vollständig mit Elektronen aufgefüllt.) 1916 Kossel formuliert die Oktett-Regel: Elemente sind bestrebt in ihrer Elektronenschale „Edelgaszustand“ zu erreichen (voll besetzte „s“- und „p“-Orbitale): 8 Elektronen. Die Oktett-Regel gilt nur streng für Elemente der 1. und 2. Achterperiode. (Grund: ab der 3. Schale existieren „d“-Orbitale, so dass mehr als acht Elektronen Platz finden.) Diese Regel darf allerdings nur als „Faust-Regel“ aufgefasst und angewendet werden, da das Erreichen der voll besetzten „äußeren Schale“ nicht wirklich der eigentliche Grund für die Stabilität ist. Hier spielen Energie-Umsätze beim Aufbau einer chemischen Bindung die eigentlich wichtige Rolle. Im wesentlichen sind drei Bindungsarten bekannt: Arbeitsblatt Nr. Dr. Hans Herrmann Ionenbindung Arbeitsblatt Nr. Atombindung Metallische Bindung Dr. Hans Herrmann