KIT: Wie Pflanzen ihre Gestalt ändern
Werbung

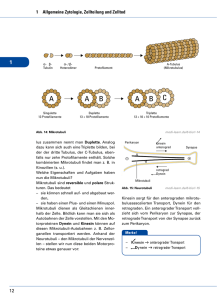
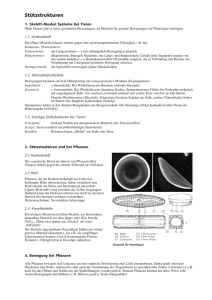
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/kit-wie-pflanzen-ihre-gestaltaendern/ KIT: Wie Pflanzen ihre Gestalt ändern Wegrennen oder Anpassen. Diese zwei Möglichkeiten haben Lebewesen, wenn ihre Umwelt unwirtlich wird. Weil Pflanzen keine Beine haben, müssen sie sich schnell an instabile Umweltbedingungen anpassen können. Die hohe Flexibilität der pflanzlichen Gestalt wird unter anderem durch das Zytoskelett von Pflanzenzellen ermöglicht. Die Forschungsgruppe von Prof. Dr. Peter Nick am Karlsruher Institut für Technologie (KIT) untersucht, mit welchen molekularen Mechanismen die Pflanzenzelle dieses Gerüst aus spezialisierten Filamenten dynamisch umbauen kann. Wofür haben Pflanzen zum Beispiel ein Protein, das bei Tieren der Muskelkontraktion dient? Jede Zelle muss sich in Form halten. Bei Pflanzen ist dafür, anders als bei Tieren, die Zellwand zuständig, ein relativ starres äußeres Korsett aus Zellulose. Im Inneren der Zelle gibt es aber auch ein dynamisches formgebendes Gerüst aus Proteinpolymeren, das Zytoskelett. Diese Proteinpolymere finden sich auch in tierischen Zellen: Aus dem Protein Tubulin werden winzige Röhren, die Mikrotubuli, aufgebaut, aus Aktin die zugfesten Aktinfilamente. Sowohl Tubulin als auch Aktin sind in der Evolution stark konserviert, bei Tier und Pflanze also fast identisch. Aber die Aufgaben der Polymere, zu denen sie sich zusammenlagern, unterscheiden sich zum Teil grundlegend. „Für mich ist es faszinierend, wie flexibel die Morphologie der Pflanzen auf die Umwelt reagiert“, sagt Prof. Dr. Peter Nick vom Institut für Botanik des Karlsruher Instituts für Technologie (KIT). „Pflanzen müssen ganz anderen Herausforderungen trotzen als Tiere, die einfach wegrennen können, wenn Fressfeinde kommen oder die Sonne zu stark scheint.“ „Eine Pflanze hinterfragt ständig, wo oben und wo unten ist.“ Teilung einer Tabakzelle. Die Tochterkerne (blau) sind schon verteilt, die Mikrotubuli (gelb) sind dabei, die neue Zellwand zu bilden. © Prof. Dr. Peter Nick 1 Nick leitet die Arbeitsgruppe für Molekulare Zellbiologie. Zusammen mit rund dreißig Mitarbeitern untersucht er die Aufgaben der verschiedenen Skelettkomponenten in Pflanzenzellen sowie die Mechanismen, die dahinter stehen. Vor allem das Signalgeschehen rund um das Zytoskelett von Reis, Weizen und anderen Grünlingen ist für die Forscher interessant. Unter Verwendung der Mikrotubuli baut die Zelle nach einer Teilung die Zellwände der zwei Tochterzellen auf. Aber sie reguliert mit ihrer Hilfe zum Beispiel auch die Richtung des Wachstums, nachdem sie den Einfall des Lichts, Richtung der Schwerkraft oder Befall mit Krankheitserregern wahrgenommen hat. Aktinfilamente sind in spezialisierten Zellen wie dem Pollenschlauch oder den Wurzelhaaren bei der Formgebung beteiligt. Aber auch sie haben in normalen pflanzlichen Zellen, anders als in tierischen, eine ausgeprägte sensorische Funktion. „Pflanzen müssen ständig wissen, woher die Sonne kommt oder in welche Richtung sie gerade wachsen“, sagt Nick. „Eine Pflanze hinterfragt ständig, wo oben und wo unten ist.“ Nick und sein Team konnten bereits einige spezielle Funktionen des pflanzlichen Zytoskeletts aufklären. In einem Projekt mit chinesischen Forschungspartnern untersuchen sie zum Beispiel, wie man mithilfe der Mikrotubuli die Architektur von Reis verändern kann. Die Pflanzenzelle kann die Richtung der Mikrotubuli abhängig von Licht und anderen Reizen regulieren. Über winzige molekulare Motoren, sogenannte Kinesine, werden dann die Zellulose herstellenden Enzyme an den Mikrotubuli entlang gezogen. Je nachdem, in welcher Richtung dies geschieht, ändert sich die Richtung des Wachstums. Manipuliert man dieses System, dann ändern Reispflanzen ihre Blattstellung. Wenn die Blätter sich in einem spitzeren Winkel an die Pflanze anschmiegen, dann können die Reispflanzen enger gesät werden, ohne sich gegenseitig in den Schatten zu stellen; der Ertrag steigt. Eine lebensrettende Errungenschaft Ein anderes Beispiel für die Bedeutung von Mikrotubuli stellt der Winterweizen dar. Die Kultivierung dieser Weizenlinie war für die industrielle Revolution möglicherweise noch wichtiger als die gern zitierte Dampfmaschine, denn diese Weizensorten sind anders als ihre sommerlichen Verwandten in der Lage, Temperaturen bis minus sieben Grad auszuhalten. Landwirte können sie damit schon im späten Winter aussähen und im Frühjahr ernten, bevor der Sommerweizen Früchte trägt. Damit war es möglich, für die zahlreichen Arbeitskräfte die zuvor unvermeidliche Hungerzeit im April zu überbrücken. „Weil Mikrotubuli mechanisch an die Zellmembran gekoppelt sind, können sie wahrnehmen, wenn sich die Membran bei Abkühlung versteift“, sagt Nick. „Damit sind sie so etwas wie das Thermometer der Pflanzenzelle.“ Das Karlsruher Team verglich extrem winterharten sibirischen Winterweizen mit empfindsameren Sorten. Die Forscher lösten in den Zellen der „Weicheier“ durch Zugabe bestimmter Hemmstoffe die Mikrotubuli für eine kurze Zeit in ihre Bestandteile auf und schalteten damit das „Thermometer“ an. Damit konnten sie auch die Kälteresistenz aktivieren. Genau der gleiche Prozess läuft in den Zellen des Winterweizens im Laufe der herbstlichen Abkühlung ab. Aber Mikrotubuli nehmen nicht nur abiotischen Stress wahr. In dem jüngsten Projekt untersuchte das Nick-Labor zusammen mit Partnern vom Weinbauinstitut in Freiburg, warum sich manche wilden Weinarten besser an Schädlinge wie Pilze angepasst haben als unsere Kulturreben. Es stellte sich heraus, dass auch hier das Gerüst aus Mikrotubuli eine zentrale Rolle spielt. Die Hypothese von Nick: „Mikrotubuli stehen mit Ionenkanälen in der Membran einer Pflanzenzelle in Verbindung und können gleichzeitig über Hilfsproteine wahrnehmen, 2 wenn zum Beispiel ein Angriff durch den Falschen Mehltau erfolgt. Entsprechend regulieren sie den Öffnungsgrad der Kanäle, woraufhin Signalkaskaden in Gang kommen, die Abwehrgene im Zellinneren einschalten.“ Wie eine Spinne im Netz Die Anforderungen der Evolution haben spezielle Anpassungen des pflanzlichen Zellskeletts begünstigt. Aber wie kann das Gerüst andere Funktionen ausüben als bei tierischen Zellen, wenn doch die Filamente selbst fast identisch sind? Seine besonderen Aufgaben erfüllt das pflanzliche Zytoskelett, weil es mit ganz anderen Hilfsproteinen interagiert als sein tierisches Pendant. Nick und seine Mitarbeiter entdeckten zum Beispiel jüngst ein Motorprotein aus der Familie der Kinesine, das Aktinfilamente und Mikrotubuli in Pflanzenzellen verknüpft und eine besondere Rolle bei der Zellteilung spielt. Motorproteine sind in der Lage, sich an den Filamenten entlang zu bewegen und dadurch Frachten zu transportieren oder ein Filament gegen ein anderes zu verschieben (das ist die Grundlage der Kontraktion in einer Muskelzelle). Das bisher unbekannte Kinesin verspannt den Zellkern in ein Netz aus Aktinfilamenten und Mikrotobuli. Wie die Spinne im Spinnennetz kann der Zellkern die Kräfteverteilung in der Zelle messen und so feststellen, wo genau die Mitte der Zelle liegt, was für die Zellteilung unabdingbar ist. Mithilfe eines chemischen Trojanischen Pferds gelang es den Forschern um Prof. Dr. Peter Nick vom Karlsruher Institut für Technologie (KIT), die „Muskeln“ der Pflanzenzelle sichtbar zu machen, ohne dafür Gentechnik einsetzen zu müssen. © Prof. Dr. Peter Nick Die Erforschung des pflanzlichen Zytoskeletts ist heute, auch im Hinblick auf die Anwendungen im landwirtschaftlichen Bereich, ohne enge interdisziplinäre Kooperationen nicht mehr möglich. Die Zellbiologen um Nick arbeiten mit Chemikern, Ingenieuren oder Materialwissenschaftlern aus aller Welt zusammen. In den letzten Jahren sind auch immer engere Kooperationen mit Nanowissenschaftlern aus Freiburg und Karlsruhe gewachsen. Jüngst experimentierten die Karlsruher Forscher zum Beispiel an sogenannten Trojanischen Peptoiden und Zellpermeations-Peptiden und sind damit mitten drin im Gebiet des Chemical Engineering. Bei den neuen Versuchsobjekten handelt es sich um kleine Polymere aus Aminosäuren, die sich in eine Zelle einschleusen können. Man kann sie so umbauen, dass sie in der Zelle bestimmte Ziele, zum Beispiel die Aktinfilamente, den Zellkern oder die Mitochondrien binden. Koppelt man sie mit leuchtenden Markern, dann lässt sich das Zytoskelett im Fluoreszenzmikroskop in seiner dynamischen Umstrukturierung beobachten. „Unser nächster Schritt wird es sein, die Peptide mit selektiven Hemmstoffen zu beladen, die bestimmte 3 Orientierungen des Skeletts verhindern“, sagt Nick. Damit wären Manipulationen möglich, wie sie bisher nur auf genetischer Ebene zu bewerkstelligen waren. Und die komplexen molekularen Vorgänge rund um das pflanzliche Zytoskelett würden vielleicht noch genauer verstanden werden. Fachbeitrag 20.06.2011 mn (08.06.11) BioRegion Freiburg © BIOPRO Baden-Württemberg GmbH Weitere Informationen Prof. Dr. Peter Nick Molekulare Zellbiologie Botanisches Institut Kaiserstr. 2, Gbd. 10.40 76128 Karlsruhe Tel.: +49 721/ 608 - 42144 oder Tel.: +49 721/ 608 - 42142 (Sekretariat) E-Mail: peter.nick(at)bio.uni-karlsruhe.de 4