Elektronen
Werbung

Slide 1
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
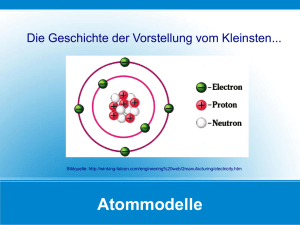
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 2
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 3
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 4
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 5
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 6
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 7
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 8
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 9
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 10
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 11
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 12
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 13
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 14
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 15
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 16
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 17
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 18
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 19
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 20
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 21
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 22
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 23
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 24
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 25
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 26
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 27
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 28
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 29
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 30
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 31
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 32
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 33
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 34
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 35
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 36
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 37
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 38
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 39
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 40
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 41
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 42
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 43
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 44
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 45
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 46
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 47
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 48
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 49
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 2
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 3
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 4
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 5
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 6
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 7
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 8
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 9
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 10
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 11
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 12
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 13
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 14
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 15
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 16
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 17
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 18
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 19
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 20
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 21
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 22
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 23
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 24
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 25
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 26
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 27
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 28
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 29
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 30
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 31
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 32
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 33
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 34
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 35
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 36
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 37
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 38
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 39
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 40
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 41
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 42
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 43
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 44
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 45
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 46
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 47
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 48
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen
Slide 49
Dem Atom auf der Spur
Die Welt des ganz Kleinen
Atom – Was ist das?
Demokrit
(* 460 v. Chr. † 371 v. Chr.)
Beruf: Philosoph
Gedankenexperimente...
• Der griechische Philosoph Demokrit überlegte
sich: Wenn ich eine Stoffprobe halbiere und
dann wieder halbiere und wieder halbiere und
so fort, so gelange ich zu einem kleinsten,
nicht mehr teilbaren Teilchen. Alle Stoffe
müssen aus solchen unteilbaren Atomen
bestehen... und das vor fast 2400 Jahren!
Es gibt kleinste
unteilbare
Teilchen
= Atome
griechisch:
atomos
John Dalton (1766-1844)
John Dalton‘s Entdeckung...
• Dalton, John (1766-1844), britischer Chemiker
und Physiker, entwickelte die Atomtheorie, auf
der die moderne physikalische Wissenschaft beruht.
Dalton wurde 1766 in Eaglesfield als Sohn eines Webers
geboren. Unterricht erhielt er von seinem Vater.
• Dalton stellte sich die Atome als kleinste
Kugeln verschiedener Grösse vor. Je nach
Atomgewicht gehören diese Kugeln
verschiedenen Elementen an. Elemente
sind die Grundbaustoffe, aus denen alle
Materie besteht:
John Dalton`s Atommodell – 4 Kernaussagen:
1. Jedes Element besteht aus kleinsten, nicht weiter
teilbaren Teilchen, den Atomen.
2. Alle Atome eines Elements haben die gleiche
Grösse und die gleiche Masse. Die Atome
unterschiedlicher Elemente unterscheiden sich in
ihrer Masse.
3. Atome sind unzerstörbar. Sie können durch
chemische Vorgänge weder vernichtet noch
erzeugt werden.
4. Bei chemischen Reaktionen werden die Atome
der Ausgangsstoffe neu angeordnet und in
bestimmten Anzahlverhältnissen miteinander
verknüpft.
Atome
sindsind
Atome
kleinste
unteilbare
kleinste
unteilbare
Teilchen
Teilchen
Versuch mit Papier- und Folienstreifen
Papier
Folie
Papier
Folie
Papier
Papier
Folie
Papier
Folie
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome sind kleinste
unteilbare Teilchen?
Papier
besteht aus positiv und negativ geladenen
Atombausteinen.
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen
aus geladenen
Bausteinen
Atome bestehen aus geladenen
Bausteinen
Thomsonsches Atommodell:
Ein Atom besteht aus gleichmässig
verteilter Masse und positiver Ladung, in
denen sich die negativ geladenen
Elektronen bewegen.
Diese Model wurde 1903 von Joseph
John Thomson entwickelt und wird auch
als Plumpudding- oder
Rosinenkuchenmodell aufgrund der
Anordnung der Elektronen in der Masse,
vergleichbar mit Rosinen in einem
Kuchen, bezeichnet.
Rutherford dringt ins Innere ein...
• Rutherford, Ernest, Lord of Nelson and
Cambridge (1871-1937), britischer Physiker, der für seine
bahnbrechende Arbeit in der Kernphysik und für seine Theorie
zur Atomstruktur den Nobelpreis erhielt.
• Anhand von Strahlungsuntersuchungen stellte Rutherford
seine Theorie der Atomstruktur
auf, in der das Atom erstmalig
als dichter Kern mit ihn
umkreisenden Elektronen
beschrieben
wurde.
Der Streuversuch
Der Streuversuch wurde in Manchester von den Physikern
Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906
mit dem Versuch und benötigten sieben Jahre um das Geheimnis
des Aufbaus der Atome vorerst zu lösen.
Klick dich in den
Streuversuch
ein. Los geht‘s!
• Vorüberlegungen
• Versuchsaufbau
• animierte Versuchsaufbau
• Durchführung
• Beobachtung
• Schlussfolgerung
Rutherford, Ernest
Rutherford wurde am 30.8.1871 in Neuseeland
geboren. Sein Studium schloss er in
Cambridge (England) ab. Von da ging er an
die Universität Montreal in Kanada. 1907
kehrte er nach England zurück und erhielt
1908 für sein Kern-Hülle-Modell
den
Nobelpreis.
Das Radium für seine Forschungsarbeit
bekam er von der Wiener Akademie der
Wissenschaften. Nach dem 1. Weltkrieg wollte
die englische Regierung das Radium als
Eigentum des Feindes beschlagnahmen.
Rutherford liess es sich gut bezahlen und
unterstützte mit diesem Geld die Wiener
Akademie.
In sein Familienwappen liess er die Zerfallsund Wachstumskurve radioaktiver Substanzen
einarbeiten. Zum Streuversuch von Rutherford
Rutherford starb am 19.10.1937.
Streuversuch - Vorüberlegungen
Rutherford ging mit seinen Überlegungen vom Rosinenkuchen-Modell aus.
Danach sei das Atom eine Kugel, in der sich positive Ladungen diffus
aufhalten, wobei dann die Elektronen wie Rosinen in einem Kuchen
eingelagert sind. Dieses Atom wäre ausserdem undurchlässig für Teilchen
aller Art, egal welche Bewegungsenergie sie auch besitzen würden.
Nachdem Philipp Lenard eine Aluminiumfolie mit Elektronen beschoss,
kam er zu dem Ergebnis, dass das Atom für Elektronen durchlässig ist.
Ausserdem erkannte er, dass bei steigender Bewegungsenergie der
negativen Ladungsträger mehr Elektronen die Folie durchdringen.
Rutherford wiederholte dieses Experiment auf ähnliche Weise; er beschoss
eine Goldfolie mit Alpha-Strahlung, und stellte die Vermutung auf, dass
diese Heliumkerne durch die gleichmässig verteilten positiven Ladungen
nur wenig in ihrer Flugrichtung beeinflusst und nur in einem Winkel von null
bis maximal einem Grad abgelenkt werden.
Zum Versuchsaufbau
Streuversuch - Aufbau
Zinksulfidschirm
Goldfolie
Mit jeden Klick auf die n-Taste
kannst du dir den Aufbau des
Streuversuchs von Rutherford
animieren lassen!
Bleiblock
Du kannst dir aber auch
den kompletten Versuch hier
ansehen!
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Aufbau
Goldfolie
Zinksulfidschirm
abgelenktes
a-Teilchen
a-Teilchen
Bleiblock
Lochblende
radioaktives Radium
Zur Versuchsdurchführung
Streuversuch - Durchführung
Von einem Präparat geht Alpha-Strahlung, so genannte AlphaTeilchen aus. Der Bleiblock blendet ein schmales Teilchenbündel
aus. Die Alpha-Teilchen treffen auf eine extrem dünne Goldfolie
(etwa 100 Atomschichten stark). Hinter der Folie befindet sich ein
Leuchtschirm als Nachweisgerät, der um die Folie herum bewegt
werden kann.
Trifft ein Alpha-Teilchen auf diesen Schirm, erzeugt es einen
kleinen Lichtblitz, der durch ein Mikroskop beobachtet und gezählt
wird. Der Versuch findet im Vakuum ab.
Zur Versuchs-Animation
Streuversuch - Animation
Goldfolie
Bleiblock
mit Radium
Animation-Start
Zinksulfidschirm
Streuversuch - Animation
Goldfolie
abgelenktes
a-Teilchen
Bleiblock
mit Radium
a-Teilchen
Animation-Start
Zur Beobachtung
Zinksulfidschirm
Streuversuch - Beobachtung
Fast alle Alpha-Teilchen durchdringen ungestreut die Folie. Kleine
Ablenkwinkel kommen häufiger, grosse ausserordentlich selten
vor.
Messungen ergaben, dass bei einem Beschuss der Goldfolie mit
132.500 Heliumkernen 132.000 einen Streuwinkel von weniger als
15°, 477 zwischen 15° und 60° und lediglich 33 Alpha-Teilchen
zwischen 60° und 150° hatten.
Verwendet man Folien unterschiedlichen Materials, so zeigt der
Versuch der Messreihen, dass die Wahrscheinlichkeit für die
Ablenkung eines Alpha-Teilchens um einen bestimmten Winkel
proportional zum Quadrat der Ordnungszahl der Atome des
Streumaterials ist.
Zur Schlussfolgerung
Streuversuch - Folgerung
Da Rutherford in seinem Streuversuch auch Ablenkungen um 180° beobachtete,
schlussfolgerte er, dass die Alpha-Teilchen mit Teilchen zusammengestossen sein
müssen, deren Massen grösser als die des Alpha-Teilchens sind. Bei kleinerer Masse
würde das Alpha-Teilchen keine Richtungsumkehr erfahren, bei gleicher würde es zum
Stillstand kommen. Deswegen, so erkannte Rutherford, scheiden Elektronen als
Streuzentren aus.
Für die Ablenkung der Alpha-Teilchen machte Rutherford die Coulombkraft des Kerns
verantwortlich; und da diese umgekehrt proportional zum Quadrat der Entfernung r ist,
wird ein Grossteil der Alpha-Strahlung nur gering abgelenkt und abgebremst.
Rutherford schlussfolgerte daher, dass der Raum zwischen dem Kern und
der Atomhülle leer sein muss.
Des Weiteren überlegte er sich, dass bei einem Auftreffen eines Alpha-Teilchens auf den
positiv geladenen Kern (Streuzentrum), die kinetische Energie, in dem Moment, in dem
das Alpha-Teilchen die grösstmögliche Annäherung an das Streuzentrum erlangt hat,
vollständig in potentielle Energie umgewandelt wird. Demnach kann man für diesen
Moment die Energien gleichsetzen. Daraus kann man dann die maximale Grösse eines
Atomkerns bestimmen.
Zur Rutherfordschen Atomhypothese
Rutherfordsche Atommodell
Aus dem Rutherfordschen Streuversuch leitet sich das Rutherfordsche Atommodell ab:
1. Atome haben einen Durchmesser von ca. 10 -10 m. (=1/1010 m)
2. Nahezu 99,9% der gesamten Masse ist jedoch im Atomkern konzentriert.
3. Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
4.
Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den
Atomkern.
5. Dieser Raum wird als Atomhülle bezeichnet.
6. Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
7. Diese Bahnen bestimmen die Grösse des Atoms.
8. Zwischen den Elektronen ist leerer Raum.
9. Die Kraft zwischen den Elektronen und dem Kern ist die elektrostatische Anziehungskraft.
Man bezeichnet das Rutherforsche Atommodell auch als Kern-Hülle-Modell
Das Kern-Hülle-Modell
Das Kern-Hülle-Modell von Rutherford beinhaltet, dass die Atome aus noch
kleineren Teilchen aufgebaut sind.
Nach diesem Modell sind Atome aus einem Kern und einer Hülle aufgebaut.
Der Atomkern (Nuklid) enthält eine bestimmte Anzahl positiver Ladungen, die
man Protonen nennt. Die Gesamtheit aller Protonen im Kern ergibt die Kernladungszahl (Z), die der Ordnungszahl entspricht. Neben Protonen enthält der
Kern elektrisch neutrale Neutronen
. Protonen und Neutronen werden als
Nukleonen bezeichnet. Die Anzahl der Nukleonen ergeben die Massenzahl (A)
des Atoms.
Die Atomhülle besteht aus negativ geladenen Elektronen . Die Anzahl der
Elektronen in der Hülle entspricht der Anzahl der Protonen im Kern. Dadurch ist
das Atom nach aussen elektrisch neutral.
Radioaktive Strahlungsarten
Instabile Kerne, welche zerfallen, tun dies nicht willkürlich, sondern sie befolgen
bestimmte Gesetzmässigkeiten: Es sind die drei klassischen Arten der radioaktiven
Strahlung:
alpha-Strahlung: Aussendung eines 42 He-Kerns (alpha-Teilchen) aus dem instabilen
Kern. Es wird ein ganzes Paket 2 Protonen und 2 Neutronen gleichzeitig aus dem Kern
gesandt.
Bsp: 21084 Po 20682 Pb + 42He
beta-Strahlung: Umwandlung eines Neutrons in ein Proton und ein Elektron. Das
Elektron entsteht direkt im Kern und wird sogleich emittiert (ausgesandt). Es entsteht
zusätzlich ein Neutrino.
Bsp: 146 C 147 N + e-
gamma-Strahlung: Aussendung hochenergetischer Strahlung (gamma-Quanten
Röntgenstrahlung) aus dem instabilen Kern. Die gamma-Strahlung ist meist
Begleitstrahlung und verändert weder die Massenzahl noch die Ordnungszahl.
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron
-1
Proton
+1
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Elektron -1
Proton
+1
Masse
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
Proton
+1
1u
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung
Masse
Elektron -1
0,0005 u
Proton
1u
+1
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Atome bestehen aus geladenen
Bausteinen
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
1898
1 u = 1,66 · 10−24 g
1 u = 0,000 000 000 000 000 000 000 001 660 g
Name
Ladung Masse
Jahreszahl der
Entdeckung
Elektron-1
0,0005 u 1891
Proton +1
1u
Neutron
1898
1930
Atome bestehen aus
Elementarbausteinen
Name
Ladung
Masse
Jahreszahl der
Entdeckung
Elektron -1
0,0005 u
1891
Proton
1u
1898
1u
1930
+1
Neutron 0
Vor allem für Physiker interessant
… es geht noch kleiner …
Die Elektronen sind nach heutigem Wissen
unteilbar.
Protonen und Neutronen aber bestehen aus
„Quarks“.
In Neutronen und Protonen befinden sich je zwei
Arten von Quarks, die
up-Quarks und die
down-Quarks.
Zwischenhalt:
Vorstellungen über den Bau der Materie
• Demokrit denkt sich das Unteilbare, das Atom
• Dalton entwirft ein Atommodell
• Rutherford formuliert das Kern-Hüllenmodell
Bohr spricht von Elektronenschalen
Kimball postuliert Elektronenwolken
Schrödinger und Heisenberg entdecken Orbitale ...
• Jedes Modell erklärt auf seine Weise
Naturerscheinungen, aber noch niemand
hat je ein Atom sehen können!
Bohr gliedert die Hülle in
Schalen...
• Niels Bohr (1885-1962), dänischer
Physiker und Nobelpreisträger, lieferte wichtige und
grundlegende Beiträge zur Kernphysik sowie zum
Verständnis des atomaren Aufbaus.
• Nach Bohr umlaufen die Elektronen den
Kern in verschieden grossen Bahnen.
• Diese nennt er Elektronenschalen und gibt
ihnen den Namen K-Schale, L-Schale,
M-Schale, N-Schale usw.
Bohr‘sches Atommodell...
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Atomhülle
Bohr‘sches Atommodell...
K-Schale
Neutronen
elektrisch
neutral
Protonen
positiv
geladen
Atomkern
Elektronen
negativ geladen
L-Schale
M-Schale
Atomhülle
Bohr‘sches Atommodell...
Merke dir folgende Begriffe rund um das Atommodell:
Atomhülle
Proton
Neutron
Symbol
Nukleonen
Atomkern
Name
Ladung
positiv
neutral
Name d. Schale Anordnung
Machen fast das gesamte
Gewicht des Atoms aus!
Elektron
negativ K-Schale
max. 2
Elektron
negativ L-Schale
max. 8
Elektron
negativ M-Schale
max.18
Bohr‘sches Atommodell...
• Jede Schale kann nur eine ganz bestimmte, höchste
Anzahl Elektronen aufnehmen.
• Diese Elektronenzahl lässt sich sehr einfach berechnen:
Maximale E-Zahl = 2 * (Schalennummer) 2
Schale Schalennummer
K
1. Schale
L
2. Schale
M
3. Schale
N
4. Schale
O
5. Schale
P
6. Schale
Q
7. Schale
Formel
= 2 * 12
= 2 * 22
= 2 * 32
= 2 * 42
= 2 * 52
= 2 * 62
= 2 * 72
max. Elektronenzahl
= 2 Elektronen
= 8 Elektronen
= 18 Elektronen
= 32 Elektronen
= 50 Elektronen
= 72 Elektronen
= 98 Elektronen