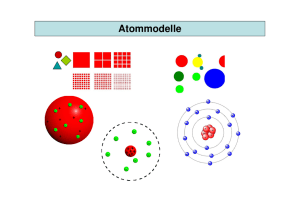
1_13_Atommodelle
Werbung

Struktur der Materie Aufbau der Natur aus „Ur-Elementen“: Wasser, Luft, Feuer, Erde Leukipp und Demokrit (500-400 v. Chr.): Aufbau aus wenigen „kleinsten, unteilbaren Urteilchen“ (α-θομοs, vgl. „Tomographie“) Durch das ganze Mittelalter hindurch: Bronze (Legierung aus Kupfer und Zink) Eisen aus Erz und Kohle Quecksilber aus Zinnober (HgS) Gold aus … ? Lomonossov (1756), Lavoisier (1774): „Gesetz von der Erhaltung der Masse bei chemischer Reaktion“ 1 Struktur der Materie Lavoisier (1774): Zerlegung von Quecksilberoxid (HgO) in seine Bestandteile bei 400 °C. Rückreaktion bei 300 °C. („Traite elementaire de Chimie“: 33 Elemente, von denen aber nur 23 wirkliche Elemente im heutigen Sinn waren) 2 Struktur der Materie Dalton (1808): Element ist der kleinste, aus Atomen, chemisch darstellbare Baustein eines Stoffs (erstes „Periodensystem“ sortiert nach Atommassen) Periodensystem der Elemente (1869 Mendelejew / Mayer): Einteilung in acht Gruppen (senkrechte Spalten nebeneinander, waagerechte Perioden untereinander) Verbindungen von Elementen: - kovalente Bindung (Heitler 1927): gemeinsame Elektronenpaare (Wasserstoffmolekül H2 ) - metallische Bindung (Bloch 1928) - Ionenbindung (polare Bindung, Pauling 1932) 3 Struktur der Atome Goldstein (1876): Leuchterscheinungen in Glasgefäßen (Gasentladungen) „Kathodenstrahlen“ : Ablenkung durch magnetisches Feld Ablenkung durch elektrisches Feld Unabhängig vom Kathodenmaterial Leuchterscheinung weiter ausgedehnt als mittlere freie Weglänge der Gasteilchen Lennard (1894): Kathodenstrahlen auch außerhalb des Glasgefäßes (Nobelpreis 1905) Röntgen (1895): abgebremste Kathodenstr. erzeugen X-Strahlen (erster Nobelpreis 1901) Thomson und Lennard (1899): Kathodenstrahlen bestehen aus Elektronen (ca. 2000mal leichter als Wasserstoff) 4 Struktur der Atome Becquerel (1896): „Uranstrahlen“ schwärzen eine Photoplatte durch Papier (wie Röntgenstrahlen, 1895) Ehepaar Curie (1898): aus Uranpechblende Polonium und Radium isoliert Wird Radium in einem geschlossenen Gefäß aufbewahrt, so kann man vorher nicht vorhandenes Helium nachweisen. Rutherford (1897): „Uranstrahlen“ zeigen a- und b-Strahlen Villard (1900): Radium zeigt a- und g-Strahlung 5 Struktur der Atome Rutherford (1903-1913): Beschuß von Metallfolien mit a-Strahlung Beobachtungen: - es wird unter allen Winkeln gestreut - die meisten Teilchen fliegen unabgelenkt durch die Goldfolie - rückgestreute Teilchen haben fast den gleichen Impuls wie beim Einfall Ernest Rutherford (1871-1938) „... es war beinahe so unglaublich, als wenn man mit einer 15-Zoll-Granate auf ein Stück Seidenpapier schießt und die Granate zurückkommt und einen selber trifft.“ (E. Rutherford nach seinem Goldfolienexperiment) 6 Struktur der Atome Atommodell nach Rutherford - fast die gesamte Masse der Atome ist in einem Atomkern konzentriert. - Atomkernradius ca. 10-15 m entspricht 1 / 50.000 des Atomradius („Kirschkern im Eifelturm“) - die Kernladung ist ein ganzzahliges Vielfaches einer positiven Elementarladung - Anzahl der im Kern enthaltenen Elementarladungen ist die Kernladungszahl ( = Elektronenzahl, Ordnungszahl im Periodensystem) „Planetensystem“: Elektronen umkreisen den Atomkern 7 Struktur der Atome Schwachstelle des Planetenbahnenmodells: - kreisende Elektronen müssten fortlaufend Energie abstrahlen, somit langsamer werden und binnen kurzer Zeit in den Kern stürzen und dort mit einem Proton verschmelzen - kontinuierliche Energieänderung widerspricht diskreten Linienspektren Atommodell nach Bohr (1913) Überwindung der Schwachstellen durch Forderungen („Postulaten“): 1. Elektronen bewegen sich ohne Strahlungsverlust auf ihren Bahnen 2. Wechsel von Bahnen geht mit portioniertem Energieübertrag einher (gequantelt) 8 Struktur der Atome Erfolg des Bohr‘schen Atommodells f Die Abfolge der Linien im optischen Spektrum von Wasserstoff war qualitativ und quantitativ erklärt ! E = - Ry / n2 (Ry Rydbergkonstante, n Hauptquantenzahl) 9 Struktur der Atome Quantenmechanik: Elektronen werden als Welle und Teilchen beschrieben werden Einstein (1905): Licht, bisher als Welle, kann auch als Teilchen („Photon“) gesehen werden (einfache Erklärung des photoelektrischen Effekts von Hallwachs 1888). Davisson und Germer (1923-1927): Beugung von Kathodenstrahlen an Kupfer-Einkristall. de Broglie (1924): Elektronen lassen sich sowohl als Teilchen als auch als Wellen beschreiben („Materiewellen“) Heisenberg (1925) und Schrödinger (1926): Quantenmechanik begründet Welle-Teilchen-Dualismus von Materie 10 Struktur der Atome Dirac (1928): Aus der Kombination von Quantenmechanik und Relativitätstheorie folgt die Existenz von „Antimaterie“ Magnetfeld Anderson (1932): Entdeckung des Positrons (Elektron mit positiver Elementarladung) Die Bahnen von Elektron und Positron laufen in einer Nebelkammer auseinander: Bleifolie gleiche Radien gleiche Massen entgegengesetzte Krümmungen entgegengesetzte Ladungen g - Strahlung 11