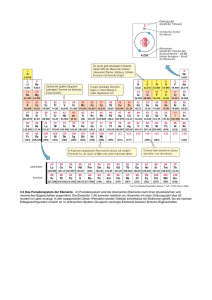
GESCHICHTE DES PERIODENSYSTEMS
Werbung

GESCHICHTE DES PERIODENSYSTEMS • • • • • Die ersten, noch ziemlich ungenauen Datierungen über die Entdeckung der Elemente fand man bereits in der Antike.Erst ab dem 18. Jahrhundert wurden sichere Datierungen möglich. Den Grundstein des PSE legte Lavoisier 1789 mit folgender Aussage: „Nichts wird bei den Reaktionen künstlicher oder natürlicher Art geschaffen, und es kann als Axiom (= Grundsatz) angesehen werden, dass bei jeder Reaktion eine gleiche Quantität Materie vor und nach der Reaktion existiert.“ Mit anderen Worten, die Qualität und Quantität von Stoffen verändert sich nicht sondern lagert sich nur um während einer chemischen Reaktion. 1808 entwickelte Dalton dank Lavoisiers Erkenntnissen das erste Atommodell. „Jedes Element besteht aus kleinsten, nicht weiter zerlegbaren Atomen. Die Atome eines Elements sind stets gleicher Masse. Damit sind die Anzahl der Atome und der Elemente identisch. Diese Atome sind unzerstörbar, und können durch keinen chemischen Vorgang neu erzeugt oder vernichtet werden. In chemischen Reaktionen reagieren die Atome der Stoffe untereinander in bestimmten (stets ganzzahligen) Verhältnissen miteinander.“ Diese Erkenntnis ist eine der wichtigsten Grundlagen in der Chemie überhaupt. Berzelius begründete 1818 die Symbolschreibweise der Elemente. Durch die gewonnene Erkenntnis, dass jedes chemische Element eine spezifische Masse hat, die einer bestimmten Anzahl kleinster Teilchen entspricht, veröffentlichte er eine Atomgewichtstabelle, die auf den Erkenntnissen der Chemiker vor ihm aufbauten. 1829 fassteDöbereiner30 (der damals 53 bekannten) Elemente in Dreierblöcken zusammen, die sich chemisch jeweils besonders ähnlich waren, und erkannte einen Zusammenhang in den Atomgewichten: Das Atomgewicht des mittleren entsprach ungefähr dem Mittelwert der Atomgewichte des leichtesten und des schwersten der drei Elemente. Diese Beobachtung lieferte wichtige Grundlagen für das spätere Periodensystem der Elemente. Der Durchbruch zu einer echten Ordnung gelang 1869 Mendelejew und Meyer, welche in weiser Voraussicht freie Plätze für die noch nicht entdeckten Elemente freiliessen, welche tatsächlich auch in den nächsten Jahren entdeckt wurden. Dieses Periodensystem war die erste zusammenhängende Präsentation über die Ähnlichkeit zwischen den Elementen. Sie bemerkten, dass in der Klassifizierung der Elemente nach ihrer Atommasse eine Periodizität in gleichartigen Eigenschaften gesehen werden könnte. Noch heute benutzen wird dieses Periodensystem. Die Elementsymbole des Periodensystems der Elemente Ac Actinium 89 Ag Silber (Argentum) 47 Al Aluminium 13 Am Americium 95 Ar Argon 18 As Arsen 33 At Astat (Astatine) 85 Au Gold(Aurum) 79 B Bor 5 Ba Barium 56 Be Beryllium 4 Bh Bohrium 107 Bi Bismut (Wismut) 83 Bk Berkelium 97 Was sagen die Massen – und die Ordnungszahl aus? Elektrische Ladung • • • Protonenzahl = Kernladungszahl = Ordnungszahl Protonenzahl + Neutronenzahl = Massenzahl Man bezeichnet diese Zahl als Kernladungszahl des Atoms. Sobald ein Element negativ geladen ist, hat es mehr Elektronen wie Protonen. ELEMENTARTEILCHEN • • • • Proton Neutron Elektron Diese drei Elementarteilchen lassen sich durch ihre Masse und ihre elektrische Ladung charakterisieren. TEILCHEN MODELLE • Dalton (1803): • -Kugelförmige Teilchen • -Teilchen sind nicht weiter Teilbar • Thompson (1903): • -Rosinenkuchenmodell • -positiv geladene Kugel mit • -negativ geladene bewegliche Teilchen auf der Kugel ANORDNUNG DER ELEMENTE • Die Ordnungszahl steigt nach rechts im Periodensystem immer um eins • Die Ordnungszahl gibt die Anzahl Elektronen bzw. Protonen an