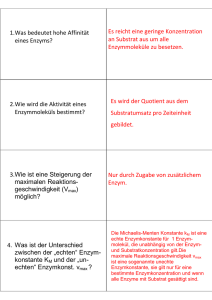
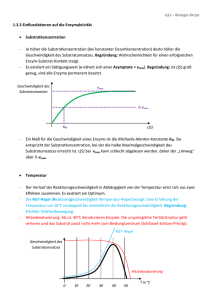
K - Unibas Chemie
Werbung

Die Kinetik zusammengesetzter Reaktionen o Beispiele von zusammengesetzter Reaktionen o Homogene Catalyse: Merkmale homogen-catalysierter Reaktionen o Enzymcatalysierte Reaktionen P. Atkins, J. de Paula, “Physikalische Chemie”, Wiley-VCH Verlag GmbH& Co, 2006, 23.3. G. Wedler, H-J. Freund, „Lehrbuch der Physikalischen Chemie“, Wiley-VCH Verlag GmbH& Co, 2010, 6.7.2 Bilder in Skripts: von P. Atkins, J. de Paula, “Physikalische Chemie”, Wiley-VCH Verlag GmbH& Co, 2006, 23.3 Beispiele von zusammengesetzter Reaktionen Kettenreaktionen ( Gasphasenreaktionen) Polymerisationen (Kettenreaktionan in flüssiger Phase) Homogene Catalyse Photochemische Reaktionen Kettenreaktionen = bei einer Reaktion ensteht in einem Schritt ein Zwischenprodukt, welches weiterreagiert, und so weiter. zu einem nächsten Zwischenprodukt Wird in PC-II erklärt Catalyse = chemische Reaktion mit Hilfe von Katalysatoren ausgeführt -Homogene Catalyse - Heterogene Catalyse Katalysatoren Katalysator eine Reaktion beschleunigt, ohne dass sie (Netto)reaktion eingeht. setz die Aktivierungenergie einer Reaktion herab selbst Die Wirkungsweise eines Katalysators beruht auf seiner Möglichkeit, den Mechanismus einer chemischen Reaktion derart zu verändern: Einen alternativen Reaktionweg → umgeht den langsamen, geschwindigkeitsbestimmenden Schritt der unkatalisierten Reaktion. Homogener Katalyator = befindet sich in der gleichen Phase wie die Reaktionsmischung Heterogener Katalysator = befindet sich in einer anderen Phase wie die Reaktionsmischung (z.B. fester Katalysator in Gasphasenreaktion : Hydrierung von Ethen → Ethan - man verwendet Pt, Ni, Pd) Katalysatoren: Beispiele (1 & 2) Beispiel 1: Enzyme: biologische Katalisatoren → hochspezifisch → können die Geschwindigkeit der Reaktion dramatisch steigen die Aktivierungsenergie der Zersetzung von H2O2 in Lösung → 76 KJmol-1 die Aktivierungsenergie der Zersetzung von H2O2 durch I- → 57 KJmol-1 ↓ 2000 x schneller ! die Aktivierungsenergie der Zersetzung von H2O2 durch Ensyme → 8 KJmol-1 Beispiel 2: ↓ 1015 x schneller (295ºK) ! die Aktivierungsenergie der Zersetzung von Rohrzucker (Hydrolyse) → 107 kJ/mol die Aktivierungsenergie der Zersetzung von Rohrzucker durch Saccharase → 36 KJmol-1 ↓ 1012 x schneller (310ºK) ! Katalysatoren: Beispiele (3) Mettale: Platin, Rhodium, Palladium, Braunstein katalysieren die Hydrierung und Dehydrierung von Ethanol. Mettaloxiden katalysieren ie Oxidation von Kohlenstoffmonoxid zu Kohlenstoffdioxid bei T =25 C. Fahrzeugkatalysator: Aufgabe des Fahrzeugkatalysators ist die chemische Umwandlung der Verbrennungsschadstoffe Kohlenwasserstoffe (CmHn), Kohlenstoffmonixid (CO), und Stickoxide (NO2) ) in Wasser (H2O) und Stzickstoff (N2) durch Oxidation beziehungweise Reduktion. Der Fahrzeugkatalysator = besteht meistens aus mehreren Komponenten. Die Kinetik zusammengesetzter Reaktionen Katalisyerte Reaktion: - Reaktanten A und B - eines oder mehrerer Produkte P k1 A+B+K k1‘ k2 A·K + B A·B·K P+K k2‘ Der Katalysator fällt aus der summarische Reaktionsgleicheung heraus → ∆Gº : identisch für die nichtkatalysierte und katalisyerte Reaktion ∆Gºkat = ∆Gºnichtkat Das Thermodynanische Gleichgewicht Das TD Gleichgewicht zwischen A und B und P (Ps) kann nicht beeinflusst werden durch die Verwendung eines Katalysators - eine TD nicht mögliche Reaktion kann durch die Anwendung eines Katalysators nicht erzwungen werden !!! Ein Katalysator hat nur Einfluss auf die Reaktionsgeschwindigkeit (V) ! Selektivität des Katalysators → der eine oder der andere Reaktionsweg durch einen speziellen Katalysator begünstig (stark beschleunigt) wird Merkmale homogen-katalysierter Reaktionen Funktionsprinzip eines homogenen Katalysators: z.Beispiel: Br-Katalysierten Zersetzung von H2O2 2 H2O2 (aq) → 2 H2O (aq) + O2 - das folgende Gleichgewicht: (a) H3O+ + H2O2 H3O2+ + H2O Aktivität H2O → 1 HO K H O H O 3 2 2 2 3 TD Eigenschaften der anderen beteiligten Substanzen → Ideal (b) H3O2+ + Br- → HOBr + H2O Ist geschwindigkeitsbestimmend (c) HOBr + H2O2 → H3O+ + O2 + Br- v k H 3O2 Br (schnell) Br-katalysierten Zersetzung von H2O2 Funktionsprinzip eines homogenen Katalysators: - Geschwindigkeit der Gesamtreaktion → Geschwindigkeit des Schrittes (b) - Konzentration des H3O2+ = f(Geschwindigkeitskonstante , Ausgangstoffe) d O2 K eff H 2O2 H 3O Br dt v k H 3O2 Br v k H 3O2 Br kKH 2O2 H 3O Br Geschwindigkeitsgesetz ~ experimental f(Br-Konzentration, pH-Wert der Lösung) Homogene Katalyse: Beispiele Sauerkatalyse → Ubertragung eines Proton → Substrat: X + HA → HX+ + AHX+ → Produkte Primar Prozess: - Solvolyse von Estern - Keto-Enol-Tautomerie Basenkatalyse → Ubertragung eines Proton (vom Substrat) → Base XH + B → X- + HB X→ Produkte Erste Schritt: - Isomerisierung organischen Verbindungen - Halogenierung ... - Claisen- und Aldolkondensation Enzymkatalysierte Reaktionen Enzyme: homogene Biokatalysatoren → aktive Zentrum Bindung → Substrate Synthese → Produkte - bleiben unverändern (nach Beendigung der Reaktion) züruck → (meistens) proteine → (manche) aktiven Zentrum: enthalten anorganische/organische Cofaktoren → (bestimmte) RNA-Moleküle: bilden Rybosyme → katalitische Aktivität Substrat: der Ausgangstoffe der Reaktion Aufbau der aktiven Position → auf katalysierte Reaktion abgestimmt Gruppen des Substrats + Gruppen des Enzyms Wechselwirkungen (Wasserstoffbrücke, Elektrostatisch, van der Waals) Molekülardurchmesen ≈ 10 – 100 nm → Makromolekülen Enzymkatalysierte Reaktionen: Beispiele NADH-quinone oxidoreductase Oxidoreduktasen = sie katalysieren Redoxreaktionen. Transferasen = sie übertragen funktinelle Gruppen von einem Substrat auf ein anderes. RNA- Polymerase Hydrolasen = sie spalten die Bindungen unter Einsatz von Wasser. Isomerasen = sie beschleunigen die die Umwandlung von chemischen Isomeren. Ligasen = sie katalysieren die Additionsreaktion mithilfe vn ATP. Schlüssel-Schloss Prinzip Dreidimensionalen Strukturen von Schlüssel-Schloss Prinzip Substrat ↔ activer Position → perfekt ineinander passen → ohne wesentliche Verschibungen von Atomen oder Bindungen Experimentelle Untersuchungen → Induced-fit-Modell Induced-fit-Modell Die Bindung des Substrat ↔ geeignete Konformationsänderung des aktiven Zentrum → perfekt ineinander passen → passt das Substrat optimal an die Bindungsstelle Enzymkatalysierte Reaktionen Störungsanfällig Möleküle → gehemmt worden: Produktbildung verhindern (spezifische Bindungen) Therapieansätz → ständigen Verabreichung eines Inhibitors ↓ ein Enzym hemmt ↓ kann nicht eine Protein aufbauen Beispiel: Immunschwächekrankenheit AIDS → die Hüllenprotein umgibt das genetische Material des Virus das Virus kann sich nicht vermehren Der Michaelis-Menten-Modell (1) Die Reaktion Untersuchung → die Anfangsgeschwindigkeit der Produktbildung in eine Lösung (sehr geringe Konzentrationen des Enzyms) Die Reaktion → beschleunigt [S] >> [Enzym] ([S] > 103 [Enzym] ) Grundlegende Merkmale - Produktbildung: 1. Die Anfangsgeschwindigkeit ~ [E]0 (Gesamtkonzentration des Enzyms) – bei gegebenen [S]0 (Anfangskonzentration des Substrats) 2. Die Geschwindigkeit ~ [S]0 – bei gegebenen [E]0 + ↓ [S]0 3. Die Geschwindigkeit ≠ [S]0 – bei gegebenen [E]0 + ↑ [S]0 (Sättigung) 4. Die Geschwindigkeit – ein Maximal Vmax – bei gegebenen [E]0 + ↑ [S]0 1. Schritt → Michaelis-Menten Mechanismus – Zwischenverbindung Enzym ↔ Substrat 2. Schritt → Enzym freigesetzt: Unverändert / nach einer Modifikation Der Michaelis-Menten-Modell (2) Reaktion: ka E+S ES t0 = 0 → [E]0 , [S]0 E+P t ka‘ kb ES → [E]0 , [P] Wichtig: kb‘ << kb → Rückreaktion – nicht berüchsichtigt kb E 0 v KM 1 [ S ]0 Michaelis-Menten Gleichung k a' kb KM ka Michaelis-Menten Konstante Gleichgewicht: 1. v ~ [S]0 ← [S]0 << KM 2. v ≠ f([S]0) ← [S]0 >> KM Begrundung der Michaelis-Menten-Modell (1) v kb • die Gerschwindigkeit der Produktbildung • die Konzentration des Enzym-Substrat Komplexes: ES d ES ka E S ka' ES kb ES dt In dem pro Zeiteinheit → ebenso viele ES Komplexes: gebildet ≡ zerfallt d[I ] 0 dt Quasistationaritätprinzip: • die Konzentration der Intermediate (per Induktionsperioden)von null aus zunimmt • im Verlauf der Reaktion → kaum ändert ES ' ka E S k a kb [E] → Konzentration des freien Enzyms [S] →Konzentration des freien Substrats Begrundung der Michaelis-Menten-Modell (2) • die Michaelis-Menton Konstante • Einheit für KM → molare Konzentration einheit E 0 E ES S S 0 ← [S] >> [E] 1 ES E 0 ES S KM 1 ES 1 S 1 E 0 S KM KM ES K M S E 0 S k a' kb E S KM ES ka ES 1 E S KM ES E 0 S 0 K M S 0 E 0 KM 1 S 0 Begrundung der Michaelis-Menten-Modell (3) Die Konzentration an Zwischenverbindungen in quasistationären Zustand → f([S]0) Die Geschwindigkeit der Produktbildung: v k ES b v kb E 0 K 1 M S 0 Michaelis-Menton Gleichung Die Abhängigkeit der Geschwindigkeit einer enzymkatalisierte Reaktion → f([S]) ES EK0 1 M S 0 Der Michaelis-Menten-Modell: Eigenschaften [S]0 << [KM] Die Reaktionsgeschwindigkeit ~ [S]0 KM 1 S 0 ES 1 E 0 S 0 S KM v kb E 0 S 0 KM [S]0 >> [KM] Die Geschwindigkeit erreicht einen Maximal Wert VMax ≠ f([S]0) KM 0 S 0 ES E 0 v kb E 0 Das Lineweaver-Burk Diagram Die Geschwindigkeit einer enzymkatalysierte Reaktion 1 v 1 f S 0 v vMax K 1 M S 0 Linear Regression ↓ Lineweaver-Burk Diagram Die Auftragung 1 f 1 ist eine Gerade mit: v S 0 KM • → die Steigerung der Gerade vMax 1 • → der y-Achsenabschnitt vMax 1 • K M → der x-Achsenabschnitt 1 • → kb berechnen: vMax • ka und ka‘ → sind nicht zugänglich 1 1 K 1 M v vMax S 0 vMax Enzymkatalysierte Reaktionen: Beispiele 1. Carboanhydrase CO2 + H2O → HCO3- + H+ KM = 8 mM kcat = 6*105 s-1 2. Superoxid dismutase: O2- + 2H + → H2 O2 + O2 Aktuelle Anwendung (2008): SOD im Nanoreaktoren: Decay of Superoxide at pH 8, measured photometrically @ 280 nm 70 kcat / KM = 1*109 M-1 s-1 Blank 60 125 nM SOD SOD+Dye in A10B100A10 Vessicles 50 40 relative Absorption M(n+1)+-SOD + O2− → Mn+-SOD + O2 Mn+-SOD + O2− + 2H+ → M(n+1)+-SOD + H2O2. 30 20 10 0 -10 0 10 20 30 40 -10 Time [ms] F. Axthelm, O. Casse, W. Koppenol, T. Nauser, W. Meier, C.G. Palivan, C.G; J.Chem.Phys.B, 2008, 112(28), 8211. 50 60 70 Die katalytische Effizienz Die Wechselzahl (Katalysenkonstante) eines Enzyms Kcat → Anzahl der Katalysenzyklen (an K cat K b einer aktiven Position) in einem bestimmten Zeitinterval ablaufen / die Länge des Intervalls Katalytische Effizienz ε → das Verhaltnis ↓ ε ↑ - effiziente Enzym vmax E 0 K cat kk 'b a K M k a kb Wenn kb >> ka’ → ε ≈ ka’ ka → die Geschwindigkeitskonstante für die Bildung eines Komplexes aus 2 Einheiten : ε ↔ maximalen Diffusionsgeschwindigkeit von E und S (in der Lösung) ε = 4∙108 dm3mol-1s-1 Catalase ↓ die Geschwindigkeit der Reaktion → durch die Diffusion bestimmt z.Beispiel : Die katalytische Effizienz von Carboanhydrase Carboanhydrase: [E0] = 2.3x10-9 mol dm-1 CO2 + H2O → HCO3- + H+ Lineweaver-Burk Diagramm: vmax = 0.250 mmol dm-3 s-1 KM = Steigung/(y Achsenabschnitt) = 10 mmol dm-3 kcat = vmax / [E0] = 1.1 x105 s-1 ε = 1.1 x∙107 dm3mol-1s-1 Mechanismen der Enzymhemmung (1) Enzymhemmung: ein Inhibitor setzt die Geschwindigkeit der Produktbildung am Substrat herab, indem er selbst an das Enzym, den Enzym-Substrat-Komplex oder beide gleichzeitig bindet. Allgemeine kinetische Schema für die Hemmung: Reaktion: ka E+S ES t0 = 0 → [E]0 , [S]0 ka‘ ES EI ESI kb KI KI‘ E+P E+I ES + I E I KI EI KI & KI ' ES I ESI KI‘ Effiziente Inhibitoren Mechanismen der Enzymhemmung (2) Die Geschwindigkeit der Produktbildung: v kb ES Die Reaktionsgeschwindigkeit in Anwesenheit eines Inhibitors: mit: I 1 KI I ' 1 v vmax KM ' S 0 K I' Die Ausdruck kann mithilfe eines Lineweaver-Bruck-Diagramms ausgewartet werden: 1 ' K M 1 v vmax vmax S 0 Mechanismen der Enzymhemmung (3) a) Kompetitive Hemmung = I bindet lediglich an die aktive Position des Enzyms: > 1 und ’ = 1 b) Unkompetitiven Hemmung = der Inhibitor bindet an das Emzym, aber nicht an dessen aktive Position: = 1 und ’ > 1 c) Nicht kompetitive Hemmung = der Inhibitor bindet an einer anderen als der aktiven Position und seine Anwesenheit das S daran hindert: > 1 und ’ > 1 Substrat Enzym nicht-kompetitiver Inhibitor Die Kinetik zusammengesetzter Reaktionen: Lernziele Beispiele von zusammengesetzter Reaktionen Homogene Catalyse: Merkmale homogen-catalysierter Reaktionen Enzymcatalysierte Reaktionen P. Atkins, J. de Paula, “Physikalische Chemie”, Wiley-VCH Verlag GmbH& Co, 2006, 23.3. G. Wedler, H-J. Freund, „Lehrbuch der Physikalischen Chemie“, Wiley-VCH Verlag GmbH& Co, 2010, 6.7.2 Prüfung Vorbemerkungen: Von den 6 Aufgaben sind 6 zu lösen. Tragen Sie Ihre Endergebnisse in die vorgesehenen Felder ein. Achten Sie auf die Einheiten! Lösungen ohne Herleitung oder Begründung sind ungültig. Geben Sie die verwendeten Formeln an und schreiben Sie Ihre Rechenschritte auf. Eine A4 Handschriftseite mit Formeln