Einführung in die Biochemie Enzymaktivität
Werbung

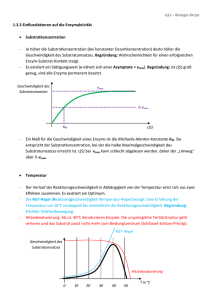
Einführung in die Biochemie Enzymaktivität Die Aktivität eines Enzyms, d. h. die Wirksamkeit als Katalysator, wird durch die konkreten Bedingungen der biochemischen Reaktion beeinflusst. Da Enzyme bei Reaktionen nicht verbraucht werden, kann bei der Wirksamkeit von Enzymen nicht die Reaktionsgeschwindigkeit gemessen werden. Man bestimmt die Menge des pro Zeiteinheit umgesetzten Substrats. Einige Umgebungsbedingungen haben einen starken Einfluss auf die Effektivität der enzymatischen Wirkung. Dazu zählen Temperatur, pH-Wert und Substratkonzentration sowie Mineralstoffe und Spurenelemente. Temperatur: Steigende Temperaturen beeinflussen die Reaktionsgeschwindigkeit positiv, weil sich die Enzym- Substratmoleküle schneller bewegen. Bis ca. 30 °C folgt die Aktivitätszunahme der Reaktionsgeschwindigkeit-Temperatur-Regel (RGT-Regel) Dabei erreicht die Aktivität ein Maximum. Bei weiter zunehmender Temperatur denaturieren die Enzyme jedoch wie alle Proteine, so dass jedes Enzym ein Temperaturoptimum besitzt. Bei dieser Denaturierung (Gerinnung) werden die Sekundär- und Tertiärstrukturen der Proteine und somit auch der Funktionsmechanismus zerstört. 11 Einführung in die Biochemie Enzymaktivität pH - Wert: Jedes Enzym ist bei einem bestimmten pH – Wert am aktivsten. Bei den meisten liegt der optimale Wert im neutralen Bereich zwischen 6 und 8. Pepsin allerdings zeigt sein Optimum im sauren Bereich bei pH 2. Der räumliche Bau ist von der Aminosäuresequenz und den Wechselwirkungen zwischen den verschiedenen ionischen Gruppen der Aminosäuren vorgegeben. Aminosäuren haben auch in der Peptidverknüpfung saure und basische Reste. Die Veränderung des pH-Wertes führt zu einer Änderung der Raumstruktur – Substrate können nicht mehr oder nicht mehr optimal gebunden werden. Temperaturoptimum für ein thermophiles Bakterienenzym Temperaturoptimum für ein Enzym beim Menschen 0 20 pH-Wertoptimum von Pepsin und Trypsin Reaktionsgeschwindigkeit Reaktionsgeschwindigkeit Temperaturoptimum von Enzymen 40 60 80 100 Temperatur [°C] optimaler pH-Wert von Pepsinn 0 2 optimaler pH-Wert von Trypsin 4 6 8 pH 12 10 Einführung in die Biochemie Enzymaktivität Vmax Konzentration des Enzyms: Reaktionsgeschwindigkeit Ermittelt man Sättigungskurven für verschiedene Konzentrationen desselben Enzyms, so erhält man eine Schar von Kurven, deren Vmax zur Enzymkonzentration proportional ist. Dies bedeutet, dass die Michaelis-Konstante KM für alle Enzymkonzentrationen gleich ist. Mineralstoffe und Spurenelemente [E]C Vmax [E]B Vmax/2 Vmax/2 Vmax [E]A Vmax/2 KM Konzentration des Substrats Weitere Einflussgrößen aus der chemischen Umgebung auf die Enzymaktivität sind insbesondere anorganische Ionen, hauptsächlich Mg2+ und Ca2+. Für diese Mineralstoffe gibt es Optimumskurven der Konzentrationen, die denen des pHWertes im Prinzip vergleichbar sind. 15