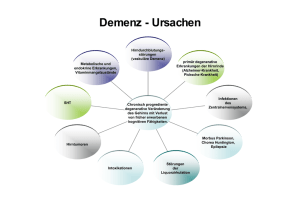
Validierung des Uhrenlesetests, eines neuen
Werbung

Aus dem Zentrum für Geriatrie und Gerontologie Freiburg der Albert-LudwidgsUniversität Freiburg i. Br. Validierung des Uhrenlesetests, eines neuen Untersuchungsverfahrens für Demenzerkrankungen und visuell-räumliche Störungen INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i.Br. Vorgelegt 2004 von Susanne Olbrich geboren in Filderstadt Dekan: Prof. Dr. med. Ch. Peters 1. Gutachter: Prof. Dr. med. K. Schmidtke 2. Gutachter: PD Dr. M. Hüll Jahr der Promotion: 2005 Danksagungen Herrn Prof. Dr. med. K. Schmidtke danke ich für die Überlassung des Themas und seine hervorragende Betreuung. Besonders danken möchte ich Herrn Prof. Dr. C.H. Lücking, Herrn Prof. Dr. J. Zentner und Herrn Prof. Dr. G. Nikkhah sowie den Stationsärztinnen und –ärzten des Neurozentrums des Universitätsklinikums Freiburg für die Unterstützung bei der Rekrutierung von Probanden. Herrn Prof. Dr. J. Schulte-Mönting danke ich für die Betreuung in statistischen Fragestellungen. Herr Tobias Speck half mir mit der elektronischen Datenverarbeitung und bei der Korrektur der Arbeit, wofür ich sehr danke. I 1. Einleitung ........................................................................................................................... 1 1.1. Demenzerkrankungen ..................................................................................................... 1 1.1.1. Alzheimer-Demenz.................................................................................................. 1 1.1.2. Vaskuläre Demenz .................................................................................................. 2 1.1.3. Mischdemenz........................................................................................................... 2 1.1.4. Frontotemporale Demenz ........................................................................................ 3 1.1.5. Lewy-Körperchen-Demenz ..................................................................................... 3 1.1.6. Leichte Kognitive Störung ...................................................................................... 4 1.2. Visuell-räumliche Störungen .......................................................................................... 4 1.2.1. Definition visuell-räumlicher Störungen................................................................. 4 1.2.2. Untersuchung visuell-räumlicher Fähigkeiten ........................................................ 5 1.2.3. Visuell-räumliche Störungen bei Demenzerkrankungen......................................... 6 1.3. Bisherige Forschungsergebnisse zu Uhrentests.............................................................. 6 1.3.1. Uhrenzeichnen......................................................................................................... 6 1.3.2. Uhrenlesen............................................................................................................... 9 1.4. Der Uhrenlesetest ......................................................................................................... 11 1.5. Fragestellung der vorliegenden Arbeit ......................................................................... 12 2. Untersuchungskollektiv und Methoden ........................................................................... 13 2.1. Untersuchungsinstrumente ........................................................................................... 13 2.1.1. Uhrenlesetest ......................................................................................................... 13 2.1.2. Uhrentest (Uhrenzeichentest) ................................................................................ 13 2.1.3. Neuropsychologische Testserie des CERAD ........................................................ 14 2.1.4. Abzeichnen der Rey-Figur .................................................................................... 17 2.1.5. Aachener Aphasie Test.......................................................................................... 17 2.1.6. Linienhalbieren...................................................................................................... 17 2.2. Untersuchungskollektiv ................................................................................................ 18 2.2.1. Patienten mit dementiellen Erkrankungen oder leichter kognitiver Störung ........ 18 2.2.2. Kontrollgruppe ...................................................................................................... 19 2.2.3. Patienten mit parietalen Läsionen ......................................................................... 19 2.3. Statistische Methoden................................................................................................... 29 2.3.1. Deskriptive Statistik und Vergleich der Mittelwerte............................................. 29 2.3.2. Einfluß demografischer Variablen und Reliabilität............................................... 29 2.3.3. Prüfung der Validität ............................................................................................. 29 2.3.4. Untersuchung der Trennschärfe und Bestimmung eines Trenn-Punktwertes ....... 31 3. Ergebnisse ........................................................................................................................ 33 3.1. Deskriptive Statistik der Testergebnisse....................................................................... 33 3.2. Abhängigkeit des Uhrenlesetests von demografischen Variablen................................ 35 II 3.3. Reliabilität .................................................................................................................... 36 3.4. Vergleich der Testleistungen im Uhrenlesetest ............................................................ 37 3.5. Korrelation des Uhrenlesetests mit anderen neuropsychologischen Tests ................... 39 3.5.1. Patienten mit dementiellen Erkrankungen............................................................. 39 3.5.2. Patienten mit parietalen Läsionen ......................................................................... 45 3.6. Regressionsanalyse der Testleistungen im Uhrenlesetest............................................. 46 3.7. Uhrenlesetest und parietale Läsionen ........................................................................... 48 3.8. Trennschärfe des Uhrenlesetests................................................................................... 49 3.9. Praktische Erfahrungen mit dem Uhrenlesetest............................................................ 52 4. Diskussion ........................................................................................................................ 53 4.1. Kritische Betrachtung der Methoden............................................................................ 53 4.2. Uhrenlesen als Maß visuell-räumlicher Verarbeitung .................................................. 54 4.3. Uhrenlesen als Funktion des Parietallappens ............................................................... 57 4.4. Der Uhrenlesetest als Test für Demenzerkrankungen .................................................. 58 4.5. Anwendung des Uhrenlesetests in der Demenzdiagnostik ........................................... 59 5. Zusammenfassung............................................................................................................ 61 6. Literaturverzeichnis.......................................................................................................... 62 7. Anhang ............................................................................................................................. 70 7.1. Uhrenlesetest ................................................................................................................ 70 7.2. Uhrentest....................................................................................................................... 71 7.3. Rey-Figur...................................................................................................................... 72 7.4. CERAD-Figurenzeichnen............................................................................................. 73 1 1. Einleitung In den letzten Jahrzehnten hat der Anteil der älteren Menschen an der Gesamtbevölkerung deutlich zugenommen, ein Trend, der sich auch in Zukunft fortsetzen wird. Damit geht eine Zunahme der altersspezifischen Erkrankungen einher. Nach einer Schätzung aus dem Jahr 2000 (Bickel) litten in diesem Jahr über 900 000 Menschen in Deutschland an einer dementiellen Erkrankung, und es ist mit rund 200 000 Neurerkrankungen pro Jahr zu rechnen. Diese Entwicklung macht die Weiterentwicklung der Diagnostik und Therapie dementieller Erkrankungen dringlich. In der Diagnostik dementieller Erkrankungen spielt die neuropsychologische Untersuchung neben laborchemischen und bildgebenden Verfahren eine wichtige Rolle. Dabei ist die Erfassung von Defiziten verschiedener kognitiver Funktionen erforderlich, insbesondere in den Bereichen Gedächtnis, Sprache, Exekutivfunktionen, Aufmerksamkeit, Verarbeitungs-geschwindigkeit und visuell-räumliche Verarbeitung. 1.1. Demenzerkrankungen Zu den wichtigsten dementiellen Erkrankungen gehören die Alzheimer-Demenz, die vaskuläre Demenz, die Mischdemenz, die fronto-temporale Demenz und die LewyKörperchen-Demenz. Eine Vorstufe von Demenzerkrankungen ist die Leichte Kognitive Störung. Im Folgenden sollen diese Erkrankungen kurz charakterisiert werden. 1.1.1. Alzheimer-Demenz Die Alzheimer-Demenz ist bei weitem die häufigste Demenzerkrankung. Es handelt sich um eine neurodegenerative Erkrankung, die histopathologisch durch das Auftreten neurofibrillärer Tangles und seniler Plaques gekennzeichnet ist. Makroskopisch zeichnet sie sich durch eine ausgeprägte Hirnatrophie, insbesondere der Hippokampusformation und des temporalen, parietalen und frontalen Kortex, aus. Der klinische Verlauf ist durch einen schleichenden Beginn und eine kontinuierliche Verschlechterung der kognitiven Funktionen charakterisiert. Im späten Verlauf treten Beeinträchtigungen bei der Verrichtung alltäglicher Aufgaben sowie Persönlichkeitsveränderungen auf. Neuropsychologisch imponieren meist als erstes Gedächtnisstörungen. Besonders das episodische Gedächtnis ist früh vermindert, später auch das semantische Gedächtnis. Altgedächtnis und nicht-deklaratives Gedächtnis sind zunächst 2 relativ besser erhalten. Neben dem Gedächtnis sind die Sprache, insbesondere die semantischen Aspekte der Sprache, die visuell-räumliche Verarbeitung, die Aufmerksamkeit und die Exekutivfunktionen beeinträchtigt. Dagegen sind sensorische und motorische Fähigkeiten über lange Zeit hin noch intakt (Almkvist 2002). 1.1.2. Vaskuläre Demenz Der Begriff „vaskuläre Demenz“ umfasst Demenzen, die hervorgerufen werden durch 1. einen einzelnen, großen Schlaganfall, 2. mehrere kleinere Infarkte, 3. zerebrale Mikroangiopathie, 4. generelle Durchblutungsstörungen (z.B. im Rahmen eines Herzstillstands) oder 5. zerebrale, subdurale oder subarachnoidale Blutungen (Almkvist 2002) sowie sonstige seltene Ursachen. Voraussetzung für die Diagnosestellung ist das Vorliegen einer Demenz in Kombination mit zerebrovaskulären Läsionen und ein plausibler zeitlicher Zusammenhang zwischen den beiden (Roman 2002). Da die klinischen und neuropsychologischen Symptome von der Größe und der Lokalisation der Läsionen abhängen, ist die Gruppe dieser Patienten diesbezüglich sehr inhomogen. Die vorliegende Untersuchung beschränkt sich auf Patienten mit vaskulärer Demenz aufgrund einer zerebralen Mikroangiopathie. Sie wird durch eine Verdickung der Wände kleinerer Arterien und Arteriolen hervorgerufen und betrifft vor allem die weiße Substanz und die Basalganglien. Sie führt zum Bild einer subkortikalen Demenz mit kognitiver Verlangsamung, Störung der Aufmerksamkeit und Verminderung der Exekutivfunktionen. Auch depressive Verstimmung, Persönlichkeitsveränderungen und Störungen des Gangs und der Blasenkontrolle können auftreten (Roman 2002). 1.1.3. Mischdemenz Die Koexistenz von vaskulärer Pathologie und Alzheimer-Pathologie ist häufig. Das Vorliegen zusätzlicher vaskulärer Pathologie trägt zum früheren Auftreten klinischer Symptome bei der Alzheimer-Demenz bei (Gertz und Wolf 2000). Kommen Alzheimer- und vaskuläre Pathologie gleichzeitig vor, so geht dies mit einem schnelleren Verlust kognitiver Funktionen einher. Vermutlich existiert ein Kontinuum, an dessen einem Ende die reine Alzheimer-Demenz und an dessen 3 anderem Ende die reine vaskuläre Demenz steht (Roman 2002). Wenn Alzheimer- und vaskuläre Pathologie gleichzeitig vorliegen, entsteht klinisch ein Mischbild, zu dem beide Krankheiten beitragen. 1.1.4. Frontotemporale Demenz Die frontotemporale Demenz gehört zu den fokal beginnenden kortikalen Demenzen mit degenerativer Pathogenese. Histopathologisch finden sich verschiedene Formen (Förstl 2000). Zu Beginn ist meist der Frontallappen betroffen, später breitet sich die Krankheit auch auf den vorderen Temporallappen aus. Typische Symptome sind Persönlichkeitsveränderungen und Veränderungen des Sozialverhaltens mit emotionaler Abstumpfung und Verlust der Krankheitseinsicht. Neuropsychologisch imponieren vor allem die verminderten Exekutivfunktionen. Verbale, räumliche und mnestische Fähigkeiten sind im Verlauf der Krankheit ebenfalls betroffen, jedoch nicht in so großem Ausmaß wie bei der Alzheimer-Demenz. Sensorische und motorische Funktionen sind intakt (Almkvist 2002). Sonderformen mit führender temporaler Pathologie kommen vor. 1.1.5. Lewy-Körperchen-Demenz Es ist noch umstritten, inwieweit die Lewy-Körperchen-Demenz eine eigenständige Erkrankung oder eine Variante der Alzheimer-Demenz ist (Wilcock 2002). Histopathologisch zeichnet sie sich durch „Lewy-Körperchen“ genannte zytoplasmatische Einschlusskörperchen aus, die im Hirnstamm, den Basalganglien und auch im Kortex vorkommen. Zusätzlich weisen viele Patienten auch Alzheimer-typische Pathologie auf, in erster Linie jedoch Plaques und weniger Fibrillenbündel (Förstl 2000). Neben einem fortschreitenden Rückgang kognitiver Fähigkeiten sind fluktuierende kognitive Störungen, visuelle Halluzinationen und extrapyramidale Symptome charakteristisch. Neuropsychologisch sind im frühen Stadium nicht notwendigerweise schwere Gedächtnisstörungen zu beobachten. Dagegen können die Defizite in visuell-räumlichen Fähigkeiten, Aufmerksamkeit und Exekutivfunktionen relativ schwerer als bei der AlzheimerDemenz sein. Im späten Stadium geht dieses typische Muster verloren, und es ergibt sich häufig eine Überlappung mit den Symptomen der Alzheimer-Demenz (McKeith et al. 1996). 4 1.1.6. Leichte Kognitive Störung Das Krankheitsbild der Leichten Kognitiven Störung gehört nicht zu den Demenzen, es handelt sich jedoch in vielen Fällen um eine Vorstufe. Patienten mit Leichter Kognitiver Störung haben Gedächtnisdefizite, manchmal auch Defizite in anderen kognitiven Bereichen, die nicht durch eine gleichzeitig bestehende andere neurologische oder psychiatrische Erkrankung erklärt werden können. Jedoch sind diese Defizite nicht so ausgeprägt wie bei den Demenzen und beeinträchtigen den Patienten im täglichen Leben nicht oder nur wenig. Verschiedene Autoren definieren unterschiedliche Kriterien für die Diagnose der leichten kognitiven Störung. Dadurch sind auch Unterschiede in Bezug auf die Angaben zur Prävalenz und Prognose dieser Krankheit bedingt (Collie und Maruff, 2002). 1.2. Visuell-räumliche Störungen Das Vorkommen visuell-räumlicher Störungen unterschiedlicher Ausprägung bei allen Demenzerkrankungen macht ihre Untersuchung in der Demenzdiagnostik erforderlich. Visuell-räumliche Störungen werden zwar selten das einzige Symptom einer Demenzerkrankung sein, ihr Vorkommen und ihre Ausprägung gibt aber im Zusammenhang mit anderen kognitiven Defiziten wichtige differentialdiagnostische Hinweise. Darüber hinaus können visuell-räumliche Defizite den Patienten in vielerlei Alltagssituationen beeinträchtigen. Z.B. konnten Henderson et al. (1989) zeigen, dass visuell-räumliche Aufgaben zusammen mit Gedächtnistests aus einer Gruppe von Alzheimer-Patienten diejenigen identifizieren konnten, die sich in vertrauter Umgebung oft verirrten und eine Tendenz zum Weglaufen zeigten. Mit der Untersuchung visuellräumlicher Störungen kann also auch ein Beitrag zur Klärung des Ausmaßes an notwendiger Betreuung bzw. Pflege geleistet werden. 1.2.1. Definition visuell-räumlicher Störungen Kerkhoff (2003) unterscheidet vier Kategorien von Störungen der visuellen Raumorientierung: Erstens, räumlich-perzeptive Störungen, zu denen Störungen der subjektiven Hauptraumachsen, der visuellen Orientierungsschätzung, der Längen-, Distanz-, Positions- und Formschätzung, der Linienhalbierung und der subjektiven Geradeausrichtung gehören; zweitens, räumlich-kognitive Störun- 5 gen, d.h. Störungen mentaler Raumoperationen wie des mentalen Rotierens oder des Pespektivenwechsels; drittens räumlich-konstruktive Störungen, d.h. die Unfähigkeit, Strukturen mit der Hand zusammenzusetzen; und viertens räumlichtopografische Störungen. Benton und Tranel (1993) dagegen unterscheiden drei Komponenten des visuellräumlichen Defizits: Die Unfähigkeit, den Ort von Punkten im Raum zu bestimmen, die fehlerhafte Einschätzung von Richtung und Abstand und die fehlerhafte topografische Orientierung. Diese seien von den visuokonstruktiven Störungen und den Störungen der Tiefenwahrnehmung und des Entfernungsschätzens zu unterscheiden. In der vorliegenden Arbeit werden als visuell-räumliche Störungen alle Störungen der Schätzung von Position, Richtung, Abstand und Länge sowie der mentalen Manipulation von Strukturen verstanden. Die Autorin geht davon aus, dass visuokonstruktive Störungen ebenfalls in erster Linie visuell-räumliche Störungen sind, dass sie jedoch auch durch Störungen der Motorik oder der Exekutivfunktionen zustande kommen können (vgl. Lezak 1995). Kerkhoff (2003) weist darauf hin, dass die einzelnen Störungen unabhängig voneinander auftreten können, was dafür spricht, dass die jeweilige Verarbeitung in unterschiedlichen Gehirnarealen erfolgt. Viele dieser Störungen treten bei Patienten mit parietalen Läsionen auf. Dies deutet auf eine wichtige Rolle des Parietallappens bei der visuell-räumlichen Verarbeitung hin. Weiterhin scheinen Patienten mit rechtshemisphärischen Läsionen häufiger visuellräumliche Störungen zu haben als solche mit linkshemisphärischen Läsionen. 1.2.2. Untersuchung visuell-räumlicher Fähigkeiten Neuropsychologische Tests, die visuell-räumliche Fähigkeiten untersuchen, sind z.B. der Linienorientierungstest (Benton et al. 1983) oder Tests der Entfernungsschätzung und der topografischen Lokalisation (Lezak 1995). Häufig werden auch visuokonstruktive Tests, die das Abzeichnen von Strichzeichnungen oder das Zusammensetzen dreidimensionaler Objekte beinhalten, zur Untersuchung visuell-räumlicher Fähigkeiten verwendet. Zu diesen zählen beispielsweise die komplexe Rey-Figur (Lezak 1995) oder der Mosaiktest aus dem HamburgWechsler-Intelligenztest (Tewes 1991). 6 Auch Tests des Uhrenlesens, -zeichnens und -stellens werden zur Untersuchung visuell-räumlicher Fähigkeiten verwendet (s. nächster Abschnitt). In vielen dieser Tests zeigen Männer bessere Leistungen als Frauen (Lezak 1995). Im normalen Alterungsprozeß nehmen die Testleistungen gegenüber jüngeren Personen ab (Swihart und Pirozzolo 1998). 1.2.3. Visuell-räumliche Störungen bei Demenzerkrankungen Defizite der visuell-räumlichen Verarbeitung sind ein Charakteristikum der Alzheimer-Demenz. Sie treten schon im frühen Verlauf der Erkrankung auf, und es scheint eine Subgruppe von Patienten zu geben, bei denen diese Einschränkungen in einem sehr frühen Stadium schon führend sind (Posteriore Kortikale Demenz; Caine und Hodges, 2001, Schmidtke et al., im Druck). Bei der Lewy-Körperchen-Demenz können schwere Defizite der visuellräumlichen Verarbeitung ebenfalls in frühen Stadien auftreten (McKeith et al. 1996). Bei den frontotemporalen und vaskulären Demenzen sind visuell-räumliche Fähigkeiten meist besser erhalten (Almkvist 2002). Dass Patienten mit diesen Erkrankungen dennoch häufig Schwierigkeiten mit visuell-räumlichen Tests haben, könnte unter anderem an den verminderten Exekutivfunktionen liegen, die für diese Krankheiten typisch sind. 1.3. Bisherige Forschungsergebnisse zu Uhrentests Tests des Uhrenlesens, Uhrenzeichnens und Uhrenstellens wurden schon früh zur Untersuchung visuell-räumlicher Verarbeitung und damit zur Untersuchung parietaler Funktionen vorgeschlagen (Critchley 1953, Christensen 1984). 1.3.1. Uhrenzeichnen In den letzten Jahrzehnten sind besonders Tests des Uhrenzeichnens populär geworden. Sie sind einfach anzuwenden, erfordern wenig Material und werden von den Patienten gut akzeptiert (Agrell und Dehlin 1998). Sie eignen sich auch zur Untersuchung von Patienten, die der Landessprache nicht mächtig sind (Borson et al. 1999, Borson et al. 2000). 7 Es gibt eine Vielzahl von Publikationen, die die Eigenschaften dieser Tests untersuchen. Verschiedene Tests wurden entwickelt, die sich in Durchführung und Bewertung mehr oder weniger voneinander unterscheiden (z.B. Shulman et al. 1986, Wolf-Klein et al. 1989, Sunderland et al. 1989, Mendez et al. 1992, Watson et al. 1993, Manos und Wu 1994). Dadurch wird die Vergleichbarkeit der Untersuchungsergebnisse eingeschränkt. Im Folgenden sollen dennoch die wichtigsten Ergebnisse aus der Erforschung der Tests des Uhrenzeichnens zusammengefasst werden: Es hat sich gezeigt, dass Tests des Uhrenzeichnens außer für visuell-räumliche auch für andere kognitive Defizite sensitiv sind (Salmon und Lange 2001, Freedman et al. 1994). Insbesondere scheinen Defizite der exekutiven Funktionen die Fähigkeit zum Uhrenzeichnen zu beeinträchtigen (Royall et al. 1998 und 1999, Libon et al. 1993, Juby et al. 2002). Manche Autoren sehen auch Hinweise auf einen Einfluß semantischer Gedächtnisfunktionen (Rouleau et al. 1996, Tuokko et al. 1992). Ergebnisse im Uhrenzeichnen korrelieren mit dem weit verbreiteten MiniMental-Status Test, einem Maß für das allgemeine kognitive Funktionsniveau (Richardson und Glass 2002, Schramm et al. 2002, Juby 1999, Heinik et al. 2002, Lieberman et al. 1999). Cahn-Weiner et al. (1999) untersuchten den Zusammenhang zwischen Uhrenzeichnen und anderen neuropsychologischen Tests und fanden signifikante Korrelationen mit visuokonstruktiven, semantischen, sprachlichen und exekutiven Tests. Weil Tests des Uhrenzeichnens von mehreren kognitiven Funktionen beeinflusst werden, sind sie auch als Instrumente zum Screening von Patienten auf das Vorliegen einer möglichen kognitiven Beeinträchtigung interessant (Shulman 2000). In der Tat scheinen Tests des Uhrenzeichnens mit Erfolg als erster Schritt zur Demenzabklärung verwendet zu werden (Inglin 1999, Stahelin et al. 1997). Einige Autoren (Lee et al. 1996, Powlishta et al. 2002) fanden jedoch eine geringe Sensitivität für die Erfassung sehr leichter Demenz. Mehrere Studien weisen darauf hin, dass Tests des Uhrenzeichnens vom Lebensalter und Bildungsstand des Patienten beeinflusst werden (Seigerschmidt et al. 2002, Paganini-Hill et al. 2001, Ainslie und Murden 1993, Heinik et al. 2002, Lieberman 1999). Jedoch gibt es in Bezug auf den Bildungsstand auch gegenteilige Ergebnisse (Gruber et al. 1997, Rouleau et al. 1996, Filley und Cullum 8 1997). Der Einfluß der Bildung scheint vom untersuchten Kollektiv abzuhängen: Ein Zusammenhang zwischen Bildung und Uhrenzeichnen ergab sich häufiger in Untersuchungen mit gesunden oder nur leicht an einer Demenz erkrankten Personen (Seigerschmidt et al. 2002, Paganini-Hill et al. 2001, Ainslie und Murden 1993, Lieberman 1999), während nur eine Untersuchung an AlzheimerPatienten (Heinik et al. 2002) einen solchen Zusammenhang erbrachte, zwei weitere (Rouleau et al. 1996, Filley und Cullum 1997) hingegen nicht. Bisher nicht eindeutig geklärt ist die Frage, ob auch eine Depression die Fähigkeit zum Uhrenzeichnen beeinträchtigt (Lee und Lawlor 1995, Kirby et al. 2001, Berger et al. 2002). Einige Autoren haben versucht, die Uhrenzeichnen-Fähigkeiten von Patienten mit verschiedenen Demenz-Diagnosen zu vergleichen. Kitabayashi et al. (2001) fanden qualitative Unterschiede zwischen den Zeichnungen von Patienten mit Alzheimer-Demenz und denen mit vaskulärer Demenz. In der Untersuchung von Heinik et al. (2002) schnitten Patienten mit vaskulärer Demenz im Uhrenzeichnen signifikant schlechter ab als Patienten mit Alzheimer-Demenz. Rascovsky et al. (2002) verglichen Patienten mit Alzheimer-Demenz und frontotemporaler Demenz und fanden, daß letztere im Uhrenzeichnen besser abschnitten. CahnWeiner et al. (2003) verglichen die Uhren-Zeichnungen von Patienten mit Alzheimer-Demenz mit denen von Patienten mit Lewy-Körperchen-Demenz. Sie stellten fest, dass es zwischen den Gruppen keinen signifikanten Unterschied in der quantitativen Bewertung, jedoch in Bezug auf qualitative Kriterien gab. Es wurden einige wenige Versuche unternommen, den Zusammenhang zwischen Leistungen im Uhrenlesen und betroffenen Gehirnregionen zu ermitteln. Die meisten Untersuchungen fanden an Patienten mit Alzheimer-Demenz statt; die verwendeten Methoden waren sehr unterschiedlich. Cahn-Weiner et al. (1999) fanden einen Zusammenhang zwischen Uhrenzeichnen und dem Volumen des rechten Temporallappens im MRT. Ueda et al. (2002) erhielten eine Korrelation zwischen Uhrenzeichnen und dem regionalen zerebralen Blutfluß in Ruhe im hinteren Temporallappen. In der Studie von Heinik et al. (2000) korrelierte das Uhrenzeichnen mit dem CVI-2, einem computertomographischen Maß für die Atrophie des Ncl. caudatus, bei Patienten mit Alzheimer-Demenz, jedoch nicht bei Patienten mit vaskulärer Demenz. Newberg et al. (2003) fanden einen Zusammenhang zwischen Uhrenzeichnen und dem Stoffwechsel im Kleinhirn; 9 temporale und parietale Regionen wurden in dieser Studie aber nicht untersucht. Die zum Teil sehr unterschiedlichen Ergebnisse dieser Studien sind wahrscheinlich Ausdruck der großen Unterschiede zwischen den verwendeten Methoden, sowohl was die Untersuchung der neurologischen Strukturen als auch die Anwendung und Beurteilung des Uhrenzeichnens angeht. Daher ist es schwierig, aus diesen Ergebnissen das Uhrenzeichnen einer bestimmten Gehirnregion zuzuordnen. Auffällig ist allerdings, dass keine Untersuchung einen Zusammenhang zwischen einem Test des Uhrenzeichnens und einem Maß parietaler Ausdehnung bzw. Funktion fand, obwohl einige (Cahn-Weiner et al., Ueda et al.) auch parietale Maße untersuchten. Die Untersuchung von Heinik et al. lässt vermuten, dass bei verschiedenen Krankheiten auch unterschiedliche Gehirnregionen beteiligt sein mögen. Dies zeigt, dass es problematisch ist, aus Ergebnissen, die an Patienten mit einer bestimmten Erkrankung erhoben wurden, direkt auf die neurologischen Korrelate des Uhrenlesens zu schließen. 1.3.2. Uhrenlesen Nur wenige Autoren haben sich mit Tests des Uhrenlesens beschäftigt. Ähnlich wie die Tests des Uhrenzeichnens unterscheiden sich auch die Tests des Uhrenlesens in Bezug auf Durchführung und Bewertung. Die wichtigsten Unterschiede liegen in der Anzahl der verwendeten Uhren, den Uhrzeiten, den Zifferblättern (mit oder ohne eingetragene Ziffern) und den Bewertungskriterien. Tuokko et al. (1992) verwenden fünf Uhren mit den Uhrzeiten 1:00, 11:10, 3:00, 9:15 und 7:30; für jede Uhr können bis zu drei Punkte vergeben werden. Dieser Test wird in Kombination mit einer Aufgabe des Uhrenzeichnens und einer des Uhrenstellens (d.h. Einzeichnen von Uhrzeiten in vorgegebene Zifferblätter) verwendet. Sie fanden, dass das Uhrenlesen für die Unterscheidung zwischen Patienten mit Alzheimer-Demenz und normalen Kontrollpersonen eine Sensitivität von 0,85 und eine Spezifität von 0,92 erzielt, und eine hohe Übereinstimmung sowohl mit Uhrenzeichnen als auch mit Uhrenstellen besteht. O’Rourke et al (1997) verwenden den gleichen Test wie Tuokko et al. in einer Längsschnittstudie. Sie untersuchten Patienten, die bei ihrer ersten Untersuchung noch keine Demenz hatten, die zum Teil aber zu einem späteren Zeitpunkt eine Demenz entwickelten. Mit einem Testwert, der Uhrenzeichnen, Uh- 10 renstellen und Uhrenlesen mit einbezog (pathologisches Ergebnis in mindestens zwei der drei Tests), konnten sie mit einer Sensitivität von 0,91 und einer Spezifität von 0,95 diejenigen Patienten identifizieren, die tatsächlich eine Demenz entwickelten. Wahlin et al. (1993) untersuchten gesunde Menschen, die mindestens 75 Jahre alt waren. Ihr Uhrenlesen-Test besteht aus fünf Uhren ohne eingetragene Ziffern mit den Uhrzeiten 11:00, 8:00, 1:15, 12:30 und 3:10. Sie fanden, dass Alter, Bildung und MMST, jedoch nicht Geschlecht, einen Einfluss auf die Leistung in Uhrentests haben. Im Gegensatz zum ebenfalls untersuchten Uhrenstellen und Mosaiktest trat jedoch beim Uhrenlesen die Verschlechterung der Leistung mit zunehmendem Alter erst später auf und war weniger ausgeprägt. Kerkhoff et al. (1997) verwendeten Uhren verschiedener Formen zur Untersuchung visuell-räumlicher Leistungen bei Patienten mit zerebrovaskulärer Hirnschädigung. Die Patienten müssen jeweils diejenigen Uhren identifizieren, die die gleiche Uhrzeit anzeigen. Diese Aufgabe soll gut mit dem Uhrenlesen im Alltag korrelieren. Sie fanden eine gute Übereinstimmung mit anderen visuellräumlichen Tests (insbesondere mit Tests der visuellen Linienorientierung), sowie eine Verbesserung im Uhrenlesen, nachdem die Wahrnehmung der Linienorientierung im Rahmen einer Rehabilitationsmaßnahme trainiert worden war. Lam et al. (1998) verwenden eine Spielzeuguhr mit drei Zeiteinstellungen: 6:30, 8:15, 9:00. Auch hier wird Uhrenlesen in Kombination mit Uhrenzeichnen und stellen verwendet. Für die Kombination aus Uhrenlesen und -stellen wird eine Punktzahl von maximal 6 vergeben. Diese Kombination hat eine niedrige Sensitivität (0,40), aber eine hohe Spezifität (0,98) für die Unterscheidung zwischen Patienten mit Demenz und normalen Kontrollpersonen. Über das Uhrenlesen alleine gibt es keine Aussage. Eine Kombination aus allen drei Tests hat insgesamt eine bessere Sensitivität und Spezifität als die Tests für sich genommen. Herrmann et al. (1998) kombinieren ebenfalls Tests des Uhrenlesens und des Uhrenzeichnens. Für das Uhrenlesen verwenden sie sechs Uhren mit und sechs ohne eingetragene Zahlen; die angezeigten Uhrzeiten sind 3:00, 8:20, 11:10, 5:45 und 10:50. Sie vergaben insgesamt vier Punkte pro Uhr (je einen für korrekt abgelesenen großen und kleinen Zeiger, Proportionen der Zeiger und korrekte Benennung von „vor“ oder „nach“). Sie stellten fest, dass Patienten mit Alzheimer-Demenz signifikant schlechter abschnitten als Patienten mit Depres- 11 sionen und normale Kontrollpersonen. Zwischen den beiden letzteren gab es jedoch keine signifikanten Unterschiede. Fahlander et al. (2002) verwenden fünf Uhren ohne eingezeichnete Ziffern, die 11:00, 8:00, 1:15, 12:30 und 3:10 anzeigen. Sie fanden, dass aus einer Reihe von neuropsychologischen Tests nur das Uhrenlesen zwischen Patienten mit vaskulärer Demenz und Patienten mit M. Alzheimer unterscheiden kann, wobei erstere schlechter abschneiden. Schmidtke und Hüll (2002), die den hier untersuchten Uhrenlesetest verwendeten, fanden, dass Patienten mit zerebraler Mikroangiopathie signifikant besser Uhren ablesen konnten als Patienten mit Alzheimer-Demenz. Insgesamt zeichnet sich ab, dass durch die Verwendung von Tests des Uhrenlesens in der Demenz-Diagnostik zusätzliche Informationen gewonnen werden können. 1.4. Der Uhrenlesetest Der in dieser Arbeit untersuchte Uhrenlesetest (s. auch Abschnitt 2.1.1 S.13) wurde mit dem Ziel entworfen, ein neues Instrument zur Erfassung visuell-räumlicher Störungen und dementieller Syndrome zu erhalten. Er sollte einfach anzuwenden und objektiv sein. Uhrenlesen als Grundlage wurde gewählt, weil davon ausgegangen werden kann, dass diese Aufgabe weniger von exekutiven Funktionen abhängt als die meisten bisher verwendeten visuell-räumlichen Tests, weil das Ablesen von Uhrzeiten besonders überlernt ist und weil es eine alltagsnahe Aufgabe ist, die eine gute Akzeptanz bei Patienten versprach. Der Test wurde von K. Schmidtke und U. Quellmalz (verstorben) entwickelt und 2002 (Schmidtke und Hüll) erstmals in einer Publikation vorgestellt. 12 1.5. Fragestellung der vorliegenden Arbeit Die vorliegende Untersuchung hat mehrere Ziele: Erstens soll durch den Vergleich mit anderen neuropsychologischen Tests festgestellt werden, inwieweit der neu entwickelte Uhrenlesetest sensitiv und spezifisch für visuell-räumliche Defizite ist und welche anderen demografischen und neuropsychologischen Variablen einen Einfluß auf die Leistung im Uhrenlesen haben. Zweitens soll gezeigt werden, dass der Uhrenlesetest für parietale Läsionen sensitiv ist. Drittens soll untersucht werden, ob und inwieweit der Uhrenlesetest ein Test für das Vorliegen einer Demenzerkrankung ist. Hierzu wird u.a. ein Grenz-Testwert gesucht, unterhalb dessen mit zufriedenstellender Sensitivität und Spezifität von einer Demenzerkrankung ausgegangen werden kann. Viertens soll explorativ festgestellt werden, inwieweit sich Patienten mit verschiedenen Demenzformen im Uhrenlesen unterscheiden. 13 2. Untersuchungskollektiv und Methoden 2.1. Untersuchungsinstrumente 2.1.1. Uhrenlesetest Der zu untersuchende Uhrenlesetest besteht aus zwölf Zifferblättern ohne Ziffern, die unterschiedliche Uhrzeiten anzeigen. Die Uhren sind auf einem Blatt abgedruckt (s. Anhang). Der Patient wird aufgefordert, die Uhrzeiten der Reihe nach abzulesen. Dabei wird für jede korrekt abgelesene Uhr ein Punkt vergeben. Als korrekt wird eine Abweichung von höchstens zwei Minuten gewertet. Für annähernd korrekte Uhrzeiten (Abweichung um bis zu fünf Minuten bzw. eine Stunde) wird ein halber Punkt vergeben. Die Punkte werden zusammengezählt und ergeben so einen Punktwert zwischen null und zwölf. Der Patient erhält dabei keine Hilfestellung vom Untersucher. Vom Patienten selbst gemachte Korrekturen werden gewertet. Hat ein Patient die ersten sechs Uhren falsch abgelesen, so darf der Test abgebrochen und mit „0“ bewertet werden. 2.1.2. Uhrentest (Uhrenzeichentest) Der in der vorliegenden Untersuchung verwendete Test des Uhrenzeichnens ist der Uhrentest nach Shulman et al. (1986 und 1993; modifizierte Version): Der Patient bekommt ein Blatt Papier mit einem aufgedruckten Kreis. Er wird aufgefordert, in den Kreis die Ziffern einer Uhr zu schreiben und anschließend die Zeiger so einzuzeichnen, dass sie „zehn nach elf“ anzeigen. Die gezeichnete Uhr wird nach vorgegebenen Kriterien (Vollständigkeit und Platzierung der Ziffern, korrektes Einzeichnen der Uhrzeit) in eine von sechs Kategorien eingeteilt. Kategorie 1 und 2 gelten als normales, 3-6 als pathologisches Ergebnis. (Uhrentest und Bewertungskriterien s. Anhang). In mehreren Studien, die verschiedene Tests des Uhrenzeichnens in Bezug auf ihre Fähigkeit, Patienten mit Demenzerkrankungen bzw. kognitiven Störungen zu erkennen, verglichen, schnitt diese Methode gut ab (Brodaty, Moore 1997; Storey et al. 2001). Andere ähnliche Studien befanden allerdings die Methode von Mendez (1992) etwas besser (Scanlan et al. 2002, Storey et al 2002). Für die Unterscheidung zwischen Patienten mit Demenzerkrankungen bzw. mit kognitiven Störungen und Kontrollpersonen erreichte die Shulman-Methode in 14 verschiedenen Studien eine Sensitivität zwischen 0,8 und 0,93 und eine Spezifität zwischen 0,28 und 0,96. Die Inter-rater-Reliabilität wird mit 0,89-0,93 angegeben (Brodaty, Moore 1997, Ploenes et al. 1994, Storey et al. 2001, Scanlan et al. 2002, Storey et al. 2002). Royall et al. (1999) fanden für die Shulman-Methode im Vergleich mit anderen Scores den geringsten Einfluss exekutiver Funktionen. 2.1.3. Neuropsychologische Testserie des CERAD Sie wurde 1989 vom „Consortium to Establish a Registry for Alzheimer’s Disease“ (CERAD) entwickelt und enthält Tests für die kognitiven Funktionen, die bei Demenzerkrankungen beeinträchtigt sind: Gedächtnis, Sprache, Praxis und allgemeine intellektuelle Leistung (Morris et al. 1989, Welsh et al. 1994). Sie enthält acht verschiedene Aufgaben, die vom Probanden nacheinander zu lösen sind: Verbale Flüssigkeit (Kategorie Tiere), modifizierter Boston-Benenn-Test, Mini-Mental Status Test, Wortlistenlernen, Wortliste Abrufen, Wortliste Wiedererkennen, Konstruktive Praxis und Konstruktive Praxis Abrufen. Alle Untertests weisen eine gute Interrater- und Test-Retest-Reliabilität auf ( Morris et al. 1989). Für die meisten Untertests fanden Welsh et al. (1994) signifikante Einflüsse von Alter, Geschlecht und Ausbildungsniveau. Einige Untertests, v.a. „Wortliste Gedächtnis“, sind für die frühe Erkennung der AlzheimerDemenz besonders geeignet (Welsh et al. 1991), andere, wie „Verbale Flüssigkeit“ und „Konstruktive Praxis“, eignen sich besser zur Verlaufskontrolle (Welsh et al. 1992). Für die deutsche Übersetzung der neuropsychologischen Testbatterie des CERAD wurde 2000 eine Normierungsstudie mit 617 gesunden älteren Probanden durchgeführt (Berres et al. 2000). Die Autoren berechneten für jeden CERAD-Rohwert das Regressionsmodell, das die Einflüsse von Alter, Geschlecht und Schulbildung am besten abbildet. Daraus entwickelten sie eine Formel, mit der für jeden Patienten und jeden Testwert ein nach Alter, Geschlecht und Schulbildung normierter Z-Wert berechnet werden kann. Die allgemeine Formel lautet: vorhergesagter Wert Z = transformierter Rohwert - Standardabweichung der Residuen 15 Die Transformation der Rohwerte dient der Anpassung an die Normalverteilung. Z = 0 entspricht dem mittleren Punktwert der entsprechenden Gruppe, Z = 1 bedeutet, dass der Punktwert eine Standardabweichung über dem mittleren Wert liegt. Die einzelnen Formeln wurden in ein Excel-basiertes Computerprogramm implementiert, das nach abgeschlossener Testung für den einzelnen Patienten automatisch alle Z-Werte berechnet und ein neuropsychologisches Profil ausgibt. Dieses Programm wird auch in unserer Gedächtnissprechstunde verwendet. Die deutsche Version der neuropsychologischen Testbattterie des CERAD wurde von Aebi (2002) für die Alzheimer’sche Erkrankung sowie für die Erfassung von Demenzen allgemein validiert. Aebi fand im großen und ganzen für die einzelnen Untertests ähnliche psychometrische Eigenschaften wie Welsh et al. (1991), mit Ausnahme des modifizierten Boston-Benenn-Tests. Dieser schnitt in ihrer Analyse deutlich schlechter ab als die englische Version, was Aebi u.a. darauf zurückführt, daß die Häufigkeit und Schwierigkeit der zu benennenden Objekte im deutschen Sprachraum anders sind als im angloamerikanischen. Im folgenden sollen diejenigen Untertests der CERAD-Testbatterie, welche für die vorliegende Untesuchung verwendet wurden, genauer beschrieben werden: Figurenzeichnen („Konstruktuve Praxis“, Rosen 1984): Der Patient wird aufgefordert, nacheinander vier einfache Strichzeichnungen (Kreis, Rombus, sich überschneidende Rechtecke und Würfel) abzuzeichnen. Insgesamt können bis zu 11 Punkte vergeben werden. Dieser Test misst visuokonstruktive Fähigkeiten. Wie bereits erwähnt, setzen visuokonstruktive Aufgaben immer auch eine intakte visuell-räumliche Verarbeitung voraus (Lezak 1995). Daher wurde dieser Test als Außenkriterium zum Uhrenlesetest eingesetzt. Mini Mental Status Test (MMST, Folstein 1975): Dieser ist in sich schon eine einfache Testserie, die Aufgaben zur örtlichen und zeitlichen Orientierung, zum Gedächtnis, zur Konzentrationsfähigkeit, zum Sprachverständnis und zu visuokonstruktiven Fähigkeiten enthält. Er ist ein weit verbreitetes Screeninginstrument und ein Verlaufsindikator für kognitive Defizite. Die maximale Punktzahl ist 30. Die Angaben zu der Punktzahl, unterhalb derer von einer Demenz ausgegangen werden muß, schwanken in der Literatur zwischen 24 und 27. Der MMST gilt als Maß für das allgemeine kognitive Funktionsniveau. 16 Wortliste: Sie besteht aus zehn Wörtern, die dem Patienten einzeln präsentiert werden und die er dann laut vorlesen soll. Anschließend wird der Patient aufgefordert, so viele Wörter wie möglich wiederzugeben. Diese Aufgabe wird dann noch zweimal mit den gleichen Wörtern, aber in anderer Reihenfolge, wiederholt. Die Anzahl der am Ende jedes Durchgangs erinnerten Wörter wird aufsummiert, so dass sich ein maximaler Punktwert von 30 ergibt („Wortlistenlernen“). Mit dieser Aufgabe wird die verbale Gedächtnisleistung (Überlagerung von Neu- und Kurzzeitgedächtnis) getestet. Zu einem späteren Zeitpunkt soll sich der Patient nochmals frei an die Wörter erinnern („Wortliste Abrufen“, max. zehn Punkte). Damit wird das verbale Kurzzeitgedächtnis getestet. Anschließend werden dem Patienten die Wörter nochmals präsentiert, zusammen mit weiteren zehn bisher unbekannten Wörtern. Der Patient soll nun entscheiden, welche von diesen Wörtern sich in der ursprünglichen Liste befanden. Die vorliegende Studie verwendete als Punktwert für diese Aufgabe die Anzahl der richtig erkannten Wörter minus die Anzahl der falsch-positiven Nennungen („Wortliste Wiedererkennen“). Dieser Test soll zeigen, ob der Patient von den erleichterten Bedingungen profitieren kann, d.h. ob primär eine Störung des Speicherns oder des Abrufens von Informationen besteht. (Anmerkung: in der Originalversion der deutschsprachigen CERAD-Testbatterie wird statt des hier berechneten Punktwertes ein Prozent-Score berechnet, der als „Diskriminabilität“ bezeichnet wird – s. Aebi 2002). Modifizierter Boston-Benenn-Test (Kaplan et al 1978): Der Patient wird aufgefordert, 15 Strichzeichnungen von Gegenständen zu benennen. Dabei gelten fünf der gesuchten Wörter als häufig, fünf als mittelhäufig und fünf als selten. Für die Auswertung wurde in der vorliegenden Untersuchung die Anzahl der falsch benannten Objekte notiert (im ursprünglichen CERAD wird pro richtig benannter Zeichnung ein Punkt vergeben). 17 2.1.4. Abzeichnen der Rey-Figur Die Rey-Figur wurde 1941 von Rey entwickelt und 1944 von Osterrieth zur Untersuchung visueller Wahrnehmung und konstruktiver Fähigkeiten standardisiert (nach Tupler et al. 1995). Der Proband ist aufgefordert, eine komplexe geometrische Figur abzuzeichnen (s. Anhang). Nach einem Zeitintervall soll er dieselbe Figur nochmals aus dem Gedächtnis aufzeichnen. In der vorliegenden Untersuchung wurde nur der Teil des Tests verwendet, bei dem die Figur abgezeichnet werden soll. Von den vielen Scoring-Systemen, die es für diesen Test gibt, wird in der vorliegenden Arbeit das von Lezak (1995) beschriebene Verfahren verwendet, für das Carr und Lincoln (1988) sehr gute Inter-rater-Reliabilitäten gefunden haben: Es bestimmt 18 Einzelteile der Figur, für die je bis zu zwei Punkte vergeben werden, und zwar sowohl für die korrekte Ausführung als auch für die Platzierung im Gesamtgebilde. Wie das Figurenzeichnen aus dem CERAD wird auch dieser visuokonstruktive Test in der vorliegenden Studie als Außenkriterium zur Beurteilung des Uhrenlesetests verwendet. 2.1.5. Aachener Aphasie Test Aus dieser Testserie wurden der Token-Test und der Benenn-Test verwendet (Huber et al. 1983), um eine Aphasie in der Gruppe der Patienten mit parietalen Läsionen auszuschließen. Der Token-Test besteht aus Plastik-Plättchen unterschiedlicher Farbe, Form und Größe. Der Patient wird aufgefordert, auf bestimmte Plättchen zu zeigen oder sie auf eine bestimmte Art nebeneinander zu legen. Die Aufgaben nehmen an Schwierigkeitsgrad zu; insgesamt sind es 50 Aufgaben. Bis zu zwei Fehler werden als normal gewertet. Der Benenntest besteht wie der Boston-Benenn-Test aus Strichzeichnungen, die zu benennen sind. Insgesamt liegen 20 Zeichnungen vor; bis zwei Benennfehler werden als normal gewertet. 2.1.6. Linienhalbieren Der Linienhalbieren-Test (Lezak 1995) besteht aus einem Blatt Papier mit mehreren unterschiedlich langen horizontal angeordneten Linien. Der Patient wird aufgefordert, jede einzelne Linie mit einem senkrechten Strich in zwei gleich lange Hälften zu teilen. Patienten mit visuellem Neglect gelingt diese Aufgabe 18 nicht. Dieser Test dient hier zum Ausschluß eines Neglect in der Gruppe der Patienten mit parietalen Läsionen. 2.2. Untersuchungskollektiv Die Zielgruppe des Uhrenlesetests sind Patienten mit möglichen oder schon festgestellten Demenzerkrankungen. Entsprechend wurde der Test an Patienten einer ambulanten Gedächtnissprechstunde erprobt, die an einer Demenzerkrankung oder an einer Leichten Kognitiven Störung leiden. Als Kontrollgruppe dienten ältere Menschen ohne bekannte Demenzerkrankung. Zusätzlich wurde der Test noch mit einigen Patienten mit parietalen Läsionen durchgeführt, um zu untersuchen, ob sich die bei Parietalhirnläsionen zu erwartenden visuell-räumlichen Störungen im Uhrenlesetest wiederspiegeln. Die untersuchten Personen wurden wie folgt ausgewählt: 2.2.1. Patienten mit dementiellen Erkrankungen oder leichter kognitiver Störung Es wurden die Daten von Patienten der Gedächtnissprechstunde des Zentrums für Geriatrie und Gerontologie Freiburg (ZGGF) analysiert. Eingeschlossen wurden alle Patienten mit den Diagnosen Alzheimer-Demenz, zerebrale Mikroangiopathie, Lewy-Körperchen-Demenz, Frontotemporale Demenz, Mischdemenz (Alzheimer-Demenz und zerebrale Mikroagiopathie) und Leichte Kognitive Störung, die zwischen Oktober 2000 und September 2003 in der Gedächtnissprechstunde untersucht wurden. Die Patienten-Daten wurden den Akten entnommen. Die Diagnose einer dementiellen Erkrankung erfolgt in der Gedächtnissprechstunde nach ausführlicher Eigen- und Fremdanamnese, neurologischer und neuropsychologischer Untersuchung und gegebenenfalls zusätzlicher Laboroder bildgebender Diagnostik durch einen auf dem Gebiet der Demenzerkrankungen erfahrenen Neurologen oder Psychiater. Die Diagnose erfolgte nach klinischen Kriterien. Es muss beachtet werden, dass bei dieser Art der Diagnosestellung falsche Diagnosen gestellt werden können, da bei den meisten dementiellen Erkrankungen, insbesondere bei M. Alzheimer, eine sichere Diagnose nur post mortem durch histopathologische Untersuchungen möglich ist. Ausgeschlossen wurden Patienten, mit denen der Uhrenlesetest nicht durchgeführt worden war oder die diesen Test vorzeitig abgebrochen hatten. 19 Von allen Patienten wurden folgende Daten berücksichtigt: 1. Demographische Daten: Alter, Geschlecht, Anzahl der Schul- und Studienjahre; 2. Neuropsychologische Daten: Ergebnis des Uhrenlesetests, des Uhrentests nach Shulman, der komplexen Rey-Figur sowie aus der CERAD-Testbatterie die Roh- und z-Werte im mod. Boston-Benenn-Test, Wortlistenlernen, Wortlistenlernen Wiedererkennen, Figurenzeichnen, MMST (nur Rohwert). Mit Ausnahme der Rey-Figur werden diese Tests, soweit es Ausdauer und Fähigkeiten des Patienten zulassen, standardmäßig bei der Untersuchung aller Patienten in der Gedächtnissprechstunde angewendet. 2.2.2. Kontrollgruppe Für die Kontrollgruppe wurden ältere Personen ohne bekannte Erkrankung des Gehirns rekrutiert. Einschlusskriterien waren: erstens, Alter von 60 Jahren oder mehr, zweitens, in der Vorgeschichte keine Erkrankung des Gehirns, kein Schädel-Hirn-Trauma und kein zerebrovaskulärer Insult (einschließlich TIA), drittens, MMST-Ergebnis von 27 oder besser. Diese Personen waren stationäre Patienten des Neurozentrums des Universitätsklinikums Freiburg, Angehörige der in der Gedächtnissprechstunde untersuchten Patienten und einige Freiwillige aus dem Bekanntenkreis der Autorin. Eine Gehirnerkrankung in der Vorgeschichte wurde, soweit dies möglich ist, durch Anamnese ausgeschlossen. Die Kontrollpersonen wurden von der Autorin rekrutiert und mit folgenden neuropsychologischen Tests untersucht: MMST (als Ein-/Ausschlusskriterium), Uhrenlesetest, Uhrentest und Figurenzeichnen aus der CERAD-Testbatterie. 2.2.3. Patienten mit parietalen Läsionen Einschlußkriterium für diese Gruppe war eine radiologisch gesicherte umschriebene Läsion des Lobus parietalis rechts oder links von mindestens zwei cm Durchmesser in allen drei Raumebenen. Ausgeschlossen wurden Patienten mit Aphasie (mehr als zwei Fehler im Benenn- oder Token-Test aus dem AAT), Neglect (abnormaler Linienhalbierungstest) oder größeren Gesichtsfeldausfällen (mittels Fingerperimetrie untersucht). Lag eine Läsion vor, die auch andere Gehirnregionen mit einbezog, so musste der parietale Anteil in allen Raumebenen mindestens zwei cm groß sein. Bei einer akuten Läsion (z.B. ischämische Schä- 20 digung) wurde darauf geachtet, dass zwischen dem Auftreten der Läsion und dem Untersuchungszeitraum mindestens eine Woche lag. Auch diese Patienten waren hauptsächlich stationäre Patienten des Neurozentrums (Neurologie oder Neurochirurgie). Zusätzlich wurden retrospektiv Daten einzelner Patienten der Gedächtnissprechstunde ausgewertet, die ebenfalls parietale Läsionen hatten. Diese Patienten wurden ebenfalls von der Autorin rekrutiert und mit folgenden Tests untersucht: Gesichtsfeld (fingerperimetrisch), Linienhalbieren, Token Test und Benenn-Test aus dem Aachener Aphasie Test (AAT), Uhrenlesetest, Uhrentest, Figurenzeichnen aus der CERAD-Testbatterie und die komplexe Rey-Figur. Tab. 2.1 (s.nächste Seite) gibt einen Überblick über die demografischen Daten des Untersuchungskollektivs. Tab. 2.1: Anzahl, Geschlecht, Alter, Schulbildung und MMST des Untersuchungskollektivs Anzahl Geschlecht männlich weiblich Alter Bildung MMST (Anzahl der Schul- bzw. (in Jahren) Studienjahre) Mittelwert (Min.-Max.) Mittelwert (Min.-Max.) Mittelwert (Min.-Max.) Kontrollpersonen 64 27 (42%) 37 (58%) 69 (60-86) 10 (7-20) 29 (27-30)1 Demenzen gesamt 200 79 (40%) 121 (60%) 74 (33-92) 10 (7-19) 21 (7-30) 2 131 44 (34%) 87 (66%) 75 (46 -92) 10 (8-19) 20 (7-29) zerebrale Mikroangiopathie 16 14 (88%) 2 (12%) 74 (57-81) 11 (8-17) 25 (19-30) Mischdemenz 19 6 (32%) 13 (68%) 78 (52-88) 9 (8-15) 20 (16-25) Frontotemporale Demenz 18 4 (22%) 14 (78%) 62 (51-82) 9 (7-15) 24 (14-30) Lewy-Körperchen-Demenz 16 11 (68%) 5 (32%) 73 (66-80) 9 (8-13) 21 (9-28) leichte kognitive Störung 105 56 (53%) 49 (47%) 74 (55-88) 10 (2-18) 26 (20-30) parietale Läsion 20 17 (85%) 3 (15%) 64 (27-83) 12 (7-24) – – Gesamt 389 179 (46 %) 210 (54%) 72 (27-92) 10 (2-24) 24 (7-30) 1 2 in dieser Gruppe diente MMST < 27 als Ausschlusskriterium nach Abschluß der Untersuchungen zur vorliegenden Studie stellte sich heraus, dass dieser Patient mit großer Wahrscheinlichkeit nicht an Alzheimer-Demenz leidet. Diagnose noch unklar 21 Alzheimer-Demenz 22 Insgesamt wurden 200 Patienten mit dementiellen Erkrankungen und 105 mit Leichter Kognitiver Störung in die Untersuchung eingeschlossen. Von den Patienten mit dementiellen Erkrankungen hatten 131 die Diagnose Alzheimer-Demenz, 14 zerebrale Mikroangiopathie, 19 Mischdemenz, 16 Lewy-Körperchen-Demenz und 18 frontotemporale Demenz. Für 42 Patienten mit einer Demenzerkrankung waren alle unter 2.2.1 genannten neuropsychologischen Tests dokumentiert. Davon hatten 27 Alzheimer-Demenz, drei zerebrale Mikroangiopathie, vier frontotemporale Demenz, drei Lewy-KörperchenDemenz und fünf Mischdemenz. Bei insgesamt 127 Patienten mit einer dementiellen Erkrankung lagen alle Tests bis auf die Rey-Figur vor. In die Kontrollgruppe wurden 64 Personen aufgenommen. Die Gruppe bestand etwa zu gleichen Teilen aus stationären Patienten und nicht-stationären Freiwilligen. Fünf der Kontrollpersonen hatten eine Depression, die zum Untersuchungszeitpunkt behandelt wurde. Eine Person gab an, unter einer Angststörung zu leiden, und eine Person hatte in der Vergangenheit an Alkoholabusus gelitten. Einige Patienten wurden zum Untersuchungszeitpunkt mit Opioid-Analgetika therapiert. 20 Personen mit einer parietalen Läsion konnten in die Untersuchung aufgenommen werden. Zwölf davon hatten einen primär intrakraniellen parietalen Tumor, zwei eine parietale Metastase und sechs eine ischämische Schädigung des Parietallappens. Zwei der Patienten mit einem Tumor waren bereits operiert und hatten einen postoperativen Defekt. Zwölf Patienten hatten eine Schädigung des rechten und acht Patienten hatten eine Schädigung des linken Parietallappens. Tab. 2.2 enthält eine Auflistung klinischer und demografischer Daten dieser Patientengruppe. Neben den 200 aufgenommenen Patienten mit Demenzerkrankungen wurden 45 Patienten aus dem o.g. Untersuchungszeitraum ausgeschlossen, da sie den Uhrenlesetest nicht hatten durchführen können oder ihn vorzeitig abgebrochen hatten. Von diesen Patienten hatten 32 Alzheimer-Demenz, drei Lewy-Körperchen-Demenz, acht Mischdemenz und je einer zerebrale Mikroangiopathie und Frontotemporale Demenz. Diese Patienten unterschieden sich in Bezug auf Alter und Schulbildung nicht signifikant von den eingeschlossenen, jedoch hatten sie im Schnitt einen schlechteren MMSTTestwert. Zwei weitere potentielle Kontrollpersonen konnten wegen eines MMST-Testwertes <27 nicht in die Untersuchung eingeschlossen werden. Tab. 2.2: Demografische und klinische Daten der Patienten mit parietalen Läsionen: Lfd. Nr. Alter Geschlecht Bildung Diagnose 65 männlich 8 Glioblastom 2 3 77 76 männlich männlich 17 8 kleiner Insult Gliom links links 4 73 männlich 16 Media-Teilinsult rechts postzentral mit großem perifokalem Ödem im subkortikalen parietalen Marklager im parietalen Marklager bis in das Splenium des Balkens hineinreichend temporo-parietal 5 65 männlich 8 rechts insulär und angrenzender Parietallappen 6 49 männlich 10 zerebrale Ischämie bei Emboli; frischer Infarkt Metastase rechts 7 63 männlich 8 Astrozytom WHO°III links 8 27 männlich 10 rechts 9 81 männlich 8 Anablastisches Astrozytom postischämischer Defekt 10 50 männlich 23 pilozytisches Astrozytom WHO°III rechts 11 62 weiblich 10 rechts 12 74 männlich 21 Z.n. MeningeomResektion Tumor temporo-parietal, direkt an der Konvexität postzentral im Kortex-MarklagerÜbergang großer TU parietal; 2 Zentren; Ödem im gesamten parietalen Marklager hinterstes Media-Stromgebiet, Konvexität des Parietallappens große Anteile des inferioren Parietallappens bis temporal und occipital und in die Basalganglien hineinreichend; Konvexität des Parietallappens mit angrenzendem Ödem hochparietal, mantelkantennah links 13 38 männlich 16 höhergradiges Gliom rechts rechts Lokalisation tiefes Marklager und parietale Konvexität bis hochparietal temporo-parietal, Schwerpunkt temporal Nebendiagnose – Ungefähre Ausdehnung CCT/NMR (cm) 2,0 x 2,0 x 2,0 – – 2,0 x 2,0 x 2,0 4,0 x 4,0 x 5,0 Zerebrale Mikroangiopathie Paranoide Psychose 4,0 x 5,0 x 6,0 – 2,0 x 2,0 x 3,0 – 3,0 x 3,0 x 3,0 – 4,0 x 4,0 x 4,0 – 4,0 x 2,0 x 3,0 – 5,0 x 5,0 x 5,0 – 4,0 x 4,0 x 4,0 Amblyopie links 4,0 x 4,0 x 4,0 – 4,0 x 4,0 x 5,0 2,0 x 3,0 x 4,0 23 1 Seite der Läsion rechts Fortsetzung von Tab.2.2: Demografische und klinische Daten der Patienten mit parietalen Läsionen: 14 66 männlich 9 15 64 männlich 24 Metastase eines Bronchial- links CA anaplastisches Astrozytom rechts 16 64 männlich 7 alter Infarkt links 17 62 weiblich 9 rechts 18 69 männlich 12 OligodendrogliomRezidiv Meningeom-Rezidiv 19 65 männlich 10 20 83 weiblich 14 links im Mittellinienspalt, verdrängt Cuneus, Präkuneus und hinteren Gyrus Cinguli; ausgedehntes par. Ödem im Bereich der Konvexität und des unterliegenden Marklagers Kortex und Marklager, direkt dem posterior-Versorgungsgebiet angrenzend – 2,0 x 2,0 x 2,0 – 3,0 x 3,0 x 3,0 Aktuell neuer Infarkt 5,0 x 4,0 x 4,0 – 2,0 x 3,0 x 3,0 – 4,5 x 3,5 x 3,0 – 3,0 x 4,0 x 4,0 Zerebrale Mikroangiopathie 5,0 x 3,0 x 3,0 24 Astrozytom – postoperati- links ver Defekt embolischer hinterer Me- rechts dia-Teilinfarkt Parietale Konvexität, mantelkantennah, mit Ödem Lobulus parietalis superior, Rinde u. Mark postzentral bis parietal; lateral auch unterliegendes Marklager cortikal, postzentral bis parietal 25 Abb. 2.1 veranschaulicht die Altersverteilung in den untersuchten Gruppen (vgl. auch Tab. 2.1 S.21). Obwohl für die Kontrollgruppe nur Patienten über 60 Jahre rekrutiert wurden, waren die Probanden der Kontrollgruppe im Mittel signifikant jünger als die Demenz-Patienten und die Patienten mit Leichter Kognitiver Störung. Innerhalb der Gruppe der Demenz-Patienten waren die Patienten mit Frontotemporaler Demenz signifikant jünger als die Patienten aller anderen Gruppen, und die Patienten mit LewyKörperchen-Erkrankung waren signifikant jünger als die Patienten mit Mischdemenz. Kontrollpersonen parietale Läsion S A A leichte kognitive Störung (MCI) Alzheimer-Demenz (DAT) S A AA A zerebrale Mikroangiopathie (SAE) S gemischte Demenz (DAT/SAE) AA A Frontotemporale Demenz (FTD) Lewy-Körperchen-Demenz (LBD) 30 40 50 60 70 80 90 Alter in Jahren Legende für „Box-und-Whiskers-Plots“: Schraffiertes Kästchen (Box): Interquartilsabstand Senkrechte Linie: Median ├ Minimum (mit Ausnahme von Extremwerten und Ausreißern) ┤ Maximum (mit Ausnahme von Extremwerten und Ausreißern) ○ Extremwerte: Werte, die 1,5 bis 3 Balkenlängen vom oberen / unteren Rand der Box entfernt sind * Ausreißer: Werte, die mehr als 3 Balkenlängen vom oberen / unteren Rand der Box entfernt sind Abb. 2.1 Altersverteilung in den einzelnen Gruppen 26 Abb. 2.2 veranschaulicht die Verteilung der Bildung in den untersuchten Gruppen, gemessen als Anzahl der Schul- und Studienjahre. Die Mediane in den einzelnen Gruppen liegen alle nahe bei acht Jahren. Dies spiegelt die Tatsache wieder, dass fast die Hälfte aller untersuchten Personen eine Bildung von acht Schuljahren angaben. Somit ist die Verteilung extrem schief. Um bei weiteren Berechnungen Fehler durch diese schiefe Verteilung zu vermeiden, wurde die Variable „Bildung“ deshalb reduziert auf „einfaches Bildungsniveau“ (entspricht bis zu neun Schuljahren) und „höheres Bildungsniveau“ (entspricht mehr als neun Schuljahre). Tab. 2.3 veranschaulicht die Verteilung des Bildungsniveaus. AAA Kontrollpersonen A parietale Läsion leichte kognitive Störung (MCI) A A A AAAAS Alzheimer-Demenz (DAT) zerebrale Mikroangiopathie (SAE) gemischte Demenz (DAT/SAE) A Frontotemporale Demenz (FTD) A A Lewy-Körperchen-Demenz (LBD) 5 10 S 15 20 Bildung (Anzahl Schuljahre) Abb. 2.2 Verteilung der Bildung in den einzelnen Gruppen (Legende für „Box-und-Whiskers-Plots“ s. Abb. 2.1 S.25) Anm: Die Mediane der Gruppen MCI, DAT, DAT/SAE, FTD und LBD liegen bei acht Jahren und fallen daher mit dem 25%-Quartil zusammen 27 Tab.2.3: Verteilung des Bildungsniveaus in den einzelnen Gruppen Bildungsstand bis 9 Jahre über 9 Jahre Kontrollpersonen 35 (55%) 29 (45%) Demenzen gesamt 106 (65%) 56 (35%) Alzheimer-Demenz (DAT) 69 (64%) 39 (36%) zerebrale Mikroangiopathie (SAE) 8 (57%) 6 (43%) Frontotemporale Demenz (FTD) 10 (71%) 4 (29%) Lewy-Körperchen-Demenz (LBD) 8 (80%) 2 (20%) Mischdemenz (DAT/SAE) 11 (69%) 5 (31%) Leichte Kognitive Störung (MCI) 48 (62%) 30 (38%) Parietale Läsion 8 (40%) 12 (60%) 197 (61%) 127 (39%) Gesamt Die Unterschiede in der Verteilung des Bildungsniveaus (d.h. Anteil der Probanden mit einfachem bzw. höherem Bildungsniveau) erwiesen sich als nicht signifikant. Die Verteilung des Geschlechts ist Tab.2.1 (S.21) zu entnehmen. In den meisten Gruppen waren mehr Frauen als Männer. Ausnahmen bildeten die Gruppe der Patienten mit parietalen Läsionen und innerhalb der Gruppe der Demenz-Patienten die Gruppen „zerebrale Mikroangiopathie“ und „Lewy-Körperchen-Erkrankung“, in denen der Anteil der Männer überwog. Diese Unterschiede erwiesen sich als signifikant. Abb. 2.3 (s. nächste Seite) veranschaulicht die Verteilung der Testergebnisse im MMST in den untersuchten Gruppen. Die Unterschiede zwischen Kontrollgruppe und Patienten mit Demenz-Erkrankungen allgemein, zwischen Kontrollgruppe und den einzelnen Demenz-Untergruppen, zwischen Kontrollgruppe und Patienten mit Leichter Kognitiver Störung und zwischen Patienten mit Demenz-Erkrankungen und Patienten mit Leichter Kognitiver Störung erwiesen sich als signifikant. (Es sei allerdings nochmals darauf hingewiesen, dass der MMST in der Kontrollgruppe als Einschlusskriterium verwendet wurde - s. Abschnitt 2.2.2 S.19)). Innerhalb der Gruppe „Patienten mit dementiellen Erkrankungen“ erzielten die Patienten der Gruppen „Alzheimer-Demenz“ und „Misch- 28 demenz“ ein signifikant schlechteres Ergebnis als die Patienten der Gruppen „zerebrale Mikroangiopathie“ und „Frontotemporale Demenz“. Kontrollpersonen leichte kognitive Störung (MCI) Alzheimer-Demenz (DAT) A zerebrale Mikroangiopathie (SAE) gemischte Demenz (DAT/SAE) A Frontotemporale Demenz (FTD) Lewy-Körperchen-Demenz (LBD) 10 15 20 MMST Abb. 2.3 Verteilung des MMST in den einzelnen Gruppen (Legende für „Box-und-Whiskers-Plots“ s. Abb. 2.1 S.25) 25 30 29 2.3. Statistische Methoden Die statistische Auswertung wurde mit dem Programm SPSS (Statistical Package for the Social Sciences) für Windows durchgeführt. In statistischen Fragen wurde diese Arbeit durch einen Mitarbeiter der Statistiksprechstunde für medizinische Dissertationen der Universität betreut. 2.3.1. Deskriptive Statistik und Vergleich der Mittelwerte Für alle demografischen und neuropsychologischen Variablen wurden in den verschiedenen Gruppen (soweit sinnvoll) Mittelwerte errechnet. Die Untersuchung auf signifikante Unterschiede zwischen einzelnen Gruppen erfolgte mit Hilfe des Abschlusstestverfahrens. Dieses Verfahren findet bei multiplen Vergleichen Anwendung. Es beruht auf nicht-parametrischen Tests und bezieht die logische Struktur der Daten mit ein. Wie bei allen Verfahren, die eine Korrektur für multiples Testen enthalten, wird auch beim Abschlusstestverfahren ein globales Signifikanzniveau festgelegt. Es gibt die Wahrscheinlichkeit an, mit der einer der vielen Tests fälschlicherweise als signifikant entschieden wird. In der vorliegenden Studie wurde als globales Signifikanzniveau p=0,05 festgelegt. 2.3.2. Einfluß demografischer Variablen und Reliabilität Der Einfluss demografischer Variablen auf den Uhrenlesetest wurde nach Gruppen getrennt untersucht. Dazu wurde das Alter in den einzelnen Gruppen mit dem Punktwert im Uhrenlesetest korreliert (Pearson-Korrelationskoeffizient). Der Einfluß von Geschlecht und Bildungsstand wurde in allen Gruppen mit dem Mann-Whitney-U-Test untersucht (Signifikanzniveau p=0,05). Als Maß für die Reliabilität des Uhrenlesens wurde die split-half Methode verwendet. Die zwölf Uhren wurden, von links oben beginnend, durchnummeriert. Dann wurden zwei Testhälften gebildet, die je aus den geradzahligen bzw. ungeradzahligen Uhren bestehen und ein Pearson-Korrelationskoeffizient der Punktwerte für die beiden Testhälften berechnet. 2.3.3. Prüfung der Validität Zur Prüfung der Validität des Uhrenlesetests als Test visuell-räumlicher Verarbeitungsstörungen wurde der Punktwert des Uhrenlesetests mit den Ergebnissen der anderen neuropsychologischen Tests korreliert (Pearson- 30 Korrelationskoeffizient). Hierzu wurden nur die Daten der Patienten mit dementiellen Erkrankungen und der Patienten mit parietalen Läsionen verwendet, um eine Verfälschung des Koeffizienten durch die z.T. erheblichen „Deckeneffekte“ in den anderen Gruppen zu vermeiden. Stimmt die Annahme, dass der Uhrenlesetest visuell-räumliche Fähigkeiten misst, so müsste sich eine gute Korrelation mit anderen Tests visuell-räumlicher Verarbeitung (Uhrentest, CERADFigurenzeichnen, Rey-Figur) ergeben, hingegen eine schlechte Korrelation mit Tests für andere kognitive Funktionen (Wortliste, Boston-Benenn-Test). Für jede Korrelationsuntersuchung wurden Daten von allen Patienten verwendet, für die ein Datenwert im jeweiligen Test bzw. für die jeweilige Variable vorlag (sog. paarweiser Fallausschluss). Bei Patienten mit dementiellen Erkrankungen hängt die Leistung in fast allen neuropsychologischen Tests nicht nur von der Abnahme der spezifischen Fähigkeiten, sondern auch von der Einschränkung des globalen kognitiven Funktionsniveaus ab. Um zu überprüfen, ob die Korrelation zwischen dem Uhrenlesetest und anderen Tests auf diesen unspezifischen Effekt zurückgeht, wurde in einem weiteren Schritt der Einfluss des MMST durch partielle Korrelation ausgeschaltet. Es wäre zu erwarten, dass, falls der Uhrenlesetest tatsächlich visuellräumliche Störungen misst, auch bei auspartialisiertem MMST eine signifikante partielle Korrelation zwischen dem Uhrenlesetest und anderen Tests visuellräumlicher Funktionen besteht. Zur weiteren Prüfung der Validität des Uhrenlesetests wurde eine Regresssionsanalyse durchgeführt. Mit Hilfe der Regression lässt sich ein mathematisches Modell berechnen, mit dem aus einer oder mehreren unabhängigen Variablen (hier: demografische und neuropsychologische Daten) der Wert einer abhängigen Variablen (hier: Uhrenlesetest) geschätzt werden kann. Der Koeffizient R² gibt an, welcher Anteil der Variabilität der abhängigen Variablen mit Hilfe der unabhängigen Variablen erklärt werden kann. Je höher der Koeffizient R², umso enger ist der statistische Zusammenhang zwischen abhängiger und unabhängigen Variablen. In der vorliegenden Untersuchung wurde eine „All Possible Subsets Regression“ durchgeführt. Das heißt, es wurden für alle möglichen Kombinationen aus ein, zwei oder drei unabhängigen Variablen Regressionsmodelle erstellt und dann diejenigen Modelle mit dem höchsten R² ausgesucht. Der Uhrenlesetest diente als abhängige, alle anderen neuropsychologischen Tests sowie 31 die demografischen Daten dienten als unabhängige Variablen. Dieses Vorgehen macht es möglich, festzustellen, welche Variablen einzeln oder in Kombination den größten Anteil an der Variabilität des Uhrenlesetests erklären können. Auch hier wird erwartet, dass die Tests visuell-räumlicher Verarbeitung einen großen Teil der Variabilität des Uhrenlesetests erklären, die anderen jedoch nicht. Diese Untersuchung wurde nur in der Gruppe der Patienten mit dementiellen Erkrankungen durchgeführt. Um zu untersuchen, ob parietale Läsionen die Fähigkeit des Uhrenlesens beeinträchtigten, wurden zunächst die mittleren Testergebnisse im Uhrenlesen von Patienten mit parietalen Läsionen und der Kontrollgruppe verglichen. Weiterhin sollte untersucht werden, ob das Ausmaß der parietalen Schädigung mit dem Ausmaß der Einschränkungen im Uhrenlesetest übereinstimmt. Dazu wurde ein Spearman-Korrelationskoeffizient zwischen dem Punktwert im Uhrenlesetest und dem Volumen der parietalen Läsion gebildet. Das Volumen wurde näherungsweise als Tiefe x Breite x Höhe (gemessen im CT / MRT, vgl. Tab.2.2) berechnet. Mit dieser Formel wird das Volumen zu hoch geschätzt, da die meisten Läsionen rund sind. Das spielt jedoch insofern keine Rolle, als das Volumen lediglich für eine Korrelationsberechnung verwendet wurde und alle Volumina gleichermassen überschätzt werden. Die Testergebnisse der Patienten mit rechtsbzw. linksseitigen Läsionen wurden mit dem Mann-Whitney-U-Test verglichen, um zu untersuchen, ob Patienten mit rechtsparietalen Läsionen größere Schwierigkeiten beim Uhrenlesen haben als Patienten mit linksparietalen Läsionen, wie dies bei anderen visuell-räumlichen Aufgaben der Fall zu sein scheint (s.1.2.1). 2.3.4. Untersuchung der Trennschärfe und Bestimmung eines Trenn-Punktwertes Zur Prüfung der Fähigkeit des Uhrenlesetests, Probanden post-hoc einer von zwei Gruppen zuzuordnen (z.B. Demenz-Patienten oder Kontrollgruppe), wurde die Methode der Response-Operating-Curve (ROC)-Analyse gewählt: Dabei werden für jeden Testwert des Uhrenlesetests die zugehörige Spezifität und Sensitivität berechnet (unter der Annahme, er würde als cut-off für die Diagnosestellung angewendet) und in einem Diagramm als Kurve aufgezeichnet. Die Fläche unter der Kurve ist ein Maß für die Trennschärfe eines Tests; je größer sie ist, umso besser kann der Test zwischen den zwei Gruppen unterscheiden. Der Vergleich von Sensitivität und Spezifität des Tests bei unterschiedlichen Testwerten erlaubt auch die Ermittlung eines optimalen 32 werten erlaubt auch die Ermittlung eines optimalen Grenz-Testwertes (cut-off) mit möglichst guter Sensitivität und Spezifität. Für diese Untersuchung wurden nur die Daten der Patienten mit dementiellen Erkrankungen und der Kontrollgruppe verwendet. 33 3. Ergebnisse 3.1. Deskriptive Statistik der Testergebnisse Mittelwert, Minimum und Maximum aller Testergebnisse in den einzelnen Gruppen sind Tab. 3.1 und 3.2 zu entnehmen. Tab. 3.1: Mittelwert, Minimum und Maximum für visuell-räumliche Tests (Uhrenlesen, Uhrentest, Rey-Figur und CERAD-Figurenzeichnen): Uhrenlesen Punktwert Mittel- (Min wert Max.) Kontrollpersonen 11,1 leichte kognitive Störung Demenzen gesamt 10,5 AlzheimerDemenz Zerebrale Mikroangiopathie Mischdemenz fronto-temporale Demenz LewyKörperchen- Demenz parietale Läsion 7,8 7,5 10,3 8,2 9,8 5,8 9,3 (8,012,0) (2,512,0) (012,0) (012,0) (5,512,0) (4,512,0) (012,0) (0,512,0) (4,012,0) Uhrentest Rey-Figur Punktwert Punktwert* Mit- (Min.- Mittel- (Min.telMax.) wert Max.) wert (1-4) – 2,0 – 2,4 (1-4) 29,8 3,3 (1-5) 23,7 3,3 (1-5) 21,7 3,0 (2-5) 28,0 3,4 (1-5) 26,1 3,4 (1-5) 32,9 3,9 (3-5) 21,4 2,7 (1-5) 27,2 Figurenzeichnen Punktwert Mittel- (Min.wert Max.) Z-Wert Figurenzeichnen Mittel(Min.wert Max.) 9,9 (7-11) -0,1 (-2,7 - 1,8) (036,0) (036,0) (034,0) (21,033,0) (7,532,0) (24,536,0) (4,035,0) 9,7 (0-11) -0,1 (-7,1 - 1,8) 8,7 (0-11) -1,0 (-6,2 - 1,8) 8,7 (0-11) -1,1 (-6,2 - 1,8) 9,4 (6-11) -0,7 (-2,8 - 1,3) 8,4 (5-11) -1,2 (-3,3 - 1,6) 9,0 (7-11) -1,1 (-2,4 - 1,1) 8,8 (2-11) -0,9 (-4,4 - 1,3) (3,036,0) 9,4 (6-11) -1,0 (-3,1 - 1,0) *Dieser Test wurde jeweils nur von einem Teil der Patienten durchgeführt (s.Abschnitt 2.2) Tab. 3.2: Mittelwert, Minimum und Maximum für Wortliste und Boston-Benenntest (nur Patienten mit einer Demenzerkrankung oder Leichter Kognitiver Störung wurden mit diesen Tests untersucht) Boston-Benenn-Test: Fehler Z-Wert BostonBenenn-Test Wortlistenlernen (Min.-Max.) (0-23) (0-17) (4-21) (3-20) (2-20) -2,9 -2,8 (-4,6 - -0,1) (-6,5 - -0,2) 6,2 6,2 (3-9) (0-10) -2,2 -1,9 (-3,7 - -0,7) (-4,3 - 0,8) (5-23) -2,1 (-4,6 - 1,9) 6,9 (2-10) -1,7 (-4,2 - 0,8) (5-21) -1,7 (-4,6 - 1,0) 7,0 (0-10) -1,6 (-4,6 - 1,3) 34 Mittel- (Min.-Maxi.) Mittel- (Min.-Max.) Mittelwert wert wert Alle Demenzen 3 (0-13) -1,1 (-5,2 - 2,1) 10,1 Alzheimer-Demenz 4 (0-13) -1,2 (-5,2 - 2,1) 9,2 Zerebrale Mikroan2 (0-5) -0,7 (-2,7 - 1,5) 13,5 giopathie Mischdemenz 4 (1-11) -1,4 (-2,9 - 0,4) 9,8 fronto-temporale 3 (0-10) -0,9 (-4,5 - 1,4) 12,6 Demenz Lewy-Körperchen2 (0-6) -0,5 (-2,9 - 1,7) 12,4 Demenz leichte kognitive Störung 2 (0-7) -0,2 (-3,2 - 1,9) 14,3 Z-Wert Summe Wort- Wortliste Wiedererken- Z-Wert Wortliste Wiederlistenlernen nen: richtig-pos. - falscherkennen pos. Mittel- (Min.-Max.) Mittel(Min.-Max.) Mittel(Min.-Max.) wert wert wert -3,0 (-6,5 - 1,9) 5,4 (-2-10) -2,5 (-5,1 - 1,6) -3,4 (-6,2 - 0,5) 4,7 (-2-10) -2,8 (-5,1 - 1,6) -1,5 (-4,6 - 0,6) 7,7 (3-10) -1,6 (-4,2 - 1,0) 35 3.2. Abhängigkeit des Uhrenlesetests von demografischen Variablen In der Kontrollgruppe und in der Gruppe der Patienten mit parietalen Läsionen war ein signifikanter inverser Zusammenhang zwischen Uhrenlesetest und Alter festzustellen (Kontrollgruppe: r = -0,36; p = 0,01; Patienten mit parietalen Läsionen: r = -0,59; p = 0,01). Für Patienten mit einer dementiellen Erkrankung und für Patienten mit Leichter Kognitiver Störung ergab sich kein Zusammenhang zwischen Uhrenlesetest und Alter. In keiner der Gruppen ließ sich ein Zusammenhang zwischen Geschlecht oder Bildungsniveau und Uhrenlesetest nachweisen (berechnet mit dem Mann-Whitney-UTest). 90 80 Alter (in Jahren) 70 60 50 7 8 9 10 11 12 13 Uhrenlesetest Abb. 3.1: Zusammenhang zwischen Alter und Uhrenlesetest in der Kontrollgruppe 36 3.3. Reliabilität Zwischen den beiden Testhälften des Uhrenlesetests ergab sich ein PearsonKorrelationskoeffizient von r=0,78 (p=0,01 - s.Abb.3.2). Damit ist ein wichtiges Reliabilitätskriterium erfüllt. 7 6 5 4 Uhrenlesetest Hälfte B 3 2 1 0 -1 -1 0 1 2 3 4 5 6 Uhrenlesetest Hälfte A Abb.3.2 Korrelation zwischen den beiden Testhälften des Uhrenlesetests 7 37 3.4. Vergleich der Testleistungen im Uhrenlesetest Die Kontrollgruppe erzielte ein signifikant besseres mittleres Testergebnis im Uhrenlesetest als die Gruppe „parietale Läsionen“ und die Gruppe „Patienten mit Demenzerkrankungen“. Es ließ sich jedoch kein signifikanter Unterschied zwischen der Kontrollgruppe und den Patienten mit Leichter Kognitiver Störung nachweisen. Die Patienten mit parietalen Läsionen erzielten im Mittel ein besseres Ergebnis als die Patienten mit Demenzerkrankungen, jedoch ein signifikant schlechteres Ergebnis als die Kontrollgruppe. Beim Vergleich der einzelnen Demenzpatienten-Untergruppen mit der Kontrollgruppe ergaben sich signifikante Unterschiede zwischen Kontrollgruppe und Patienten mit Alzheimer-Demenz, Lewy-Körperchen-Erkrankung und Mischdemenz, nicht jedoch zwischen Kontrollgruppe und Patienten mit zerebraler Mikroangiopathie oder Frontotemporaler Demenz. Innerhalb der Gruppe „Patienten mit Demenzerkrankungen“ waren Patienten mit Alzheimer-Demenz und Patienten mit Lewy-Körperchen-Demenz signifikant schlechter als Patienten mit zerebraler Mikroangiopathie und Frontotemporaler Demenz (s. auch Abb.3.3, nächste Seite). Bei der Interpretation dieser Ergebnisse muss jedoch beachtet werden, dass die Gruppen „zerebrale Mikroangiopathie“ und „Frontotemporale Demenz“ ein besseres mittleres Testergebnis im MMST hatten als die Gruppen „Alzheimer-Demenz“ und „Mischdemenz“ (vgl. Abschnitt 2.2 S.27). Abb.3.4 zeigt, dass die Ergebnisse im Uhrenlesetest in den einzelnen Gruppen ähnlich ausfallen wie die Ergebnisse anderer visuell-räumlicher Tests. 38 A Kontrollpersonen parietale Läsion S leichte kognitive Störung (MCI) A AA A Alzheimer-Demenz (DAT) SS zerebrale Mikroangiopathie (SAE) gemischte Demenz (DAT/SAE) Frontotemporale Demenz (FTD) A Lewy-Körperchen-Demenz (LBD) 0 1 2 3 4 5 6 7 8 9 10 11 12 Uhrenlesetest Punktwert Abb.3.3 Mittelwert und Standardabweichung im Uhrenlesetest in den einzelnen Gruppen (Legende für „Box-und-Whiskers-Plots“ s. Abb. 2.1 S.25) 100 90 80 Mittelwert (%) 70 Uhrentest 60 Uhrenlesetest Figurenzeichnen 50 Kontr. parietal DAT SAE FTD LBD MIX MCI Abb.3.4 Mittelwerte (in Prozent des maximalen Testwerts; beim Uhrentest inverser Prozentsatz) für die visuell-räumlichen Tests nach Gruppen Kontr. = Kontrollgruppe; parietal = Patienten m. parietalen Läsionen; DAT = Alzheimer-Demenz; SAE = zerebrale Mikroangiopathie; FTD = frontotemporale Demenz; LBD = Lewy-Körperchen-Demenz; MIX= gemischte Demenz (DAT+SAE); MCI = Leichte Kognitive Störung 39 3.5. Korrelation des Uhrenlesetests mit anderen neuropsychologischen Tests Die Korrelationen zwischen dem Uhrenlesetest und anderen neuropsychologischen Tests wurden getrennt für die Gruppe der Patienten mit einer dementiellen Erkrankung und für die Gruppe der Patienten mit parietalen Läsionen untersucht. 3.5.1. Patienten mit dementiellen Erkrankungen Der Uhrenlesetest korrelierte am besten mit dem Abzeichnen der komplexen Rey-Figur (r=0,54; p=0,01), gefolgt vom MMST (r=0,45; p=0,01) und dem Uhrentest (r=-0,42; p=0,01). Geringere Korrelationen ergaben sich mit „Wortlistenlernen“ und „Konstruktiver Praxis“. Mit dem mod. Boston-Benenn-Test und „Wortliste Wiedererkennen“ ergab sich nur eine sehr geringe bzw. gar keine signifikante Korrelation (s. auch Tab.3.3 und Abb.3.5a-g). Neutralisiert man den Einfluss des MMST mittels partieller Korrelation, so ergibt sich für Uhrenlesetest und Rey-Figur ein partieller Korrelationskoeffizient von r=0,38 (p=0,01) und für Uhrenlesetest und Uhrentest ein partieller Korrelationskoeffizient von r=0,32 (p=0,01). Für Wortlistenlernen und Figurenzeichnen konnte bei konstantem MMST keine signifikante Korrelation mit dem Uhrenlesetest nachgewiesen werden (dies gilt sowohl für die Roh- als auch für die ZWerte). Der Uhrenlesetest korreliert also mäßig mit Tests visuell-räumlicher Verarbeitung und mit Tests, die allgemeine kognitive Fähigkeiten messen, jedoch gering oder gar nicht mit anderen neuropsychologischen Tests. Eine Ausnahme bildet das Figurenzeichnen aus dem CERAD, das ebenfalls visuell-räumliche Fähigkeiten untersucht, in der vorliegenden Untersuchung jedoch nur schlecht mit dem Uhrenlesen korreliert. Tab.3.3 (s. nächste Seite) zeigt eine Übersicht über die Korrelationen der einzelnen neuropsychologischen Tests untereinander. Die im folgenden abgebildeten Grafiken veranschaulichen die Korrelationen anhand von Streudiagrammen. 40 Tab.3.3 Korrelationsmatrix: Pearson-Korrelationskoeffizienten (Signifikanzniveau p=0,05; ns=nicht signifikant) für die Korrelation der einzelnen Tests (alle Demenz-Patienten): Uhrenlesetest Rey-Figur 1 Rey1 Figur MMST Uhrentest Wortlistenlernen (Z-Wert) Figurenzeichnen (Z-Wert) 0,54 MMST 0,45 0,46 Uhrentest -0,42 n.s. -0,31 Wortlistenlernen (Z-Wert) 0,27 (0,32) n.s. 0,52 (0,53) -0,18 (-0,21) Figurenzeichnen (ZWert) 0,26 (0,23) 0,38 (0,39) 0,31 (0,23) -0,35 (-0,35) n.s. Boston Benenn-Test: Fehler (Z-Wert) -0,17 (0,19) n.s. -0,26 (0,29) n.s. (-0,25) -0,32 (0,36) -0,23 (0,23) n.s. n.s. 0,41 (0,46) n.s. 0,34 (0,45) 0,18 (n.s.) Wortliste Wiedererkennen (Z-Wert) 1 Boston BenennTest: Fehler (Z-Wert) Dieser Test wurde jeweils nur von wenigen Patienten durchgeführt (s.Abschnitt 2.2.1 S.18). Die Werte in Klammern geben, soweit vorhanden, die Korrelationskoeffizienten der Z-Werte an. -0,30 (0,31) 41 Abb.3.5a-k: Streudiagramme zur Veranschaulichung der Korrelation zwischen Uhrenlesetest und anderen neuropsychologischen Tests: 6 Diagnose 5 Mischdemenz (DAT/SAE) 4 Lewy-KörperchenDemenz (LBD) 3 fronto-temporale Demenz (FTD) 2 vaskuläre Enzephalo- Uhrentest pathie (SAE) 1 Alzheimer-Demenz (DAT) 0 -2 0 2 4 6 8 10 12 14 Uhrenlesetest Abb. 3.5a Korrelation zwischen Uhrenlesetest und Uhrentest: r=0,42 (p=0,05) 40 Diagnose 30 Mischdemenz (DAT/SAE) Lewy-Körperchen- 20 Demenz (LBD) fronto-temporale 10 Demenz (FTD) vaskuläre Enzephalo- Rey-Figur pathie (SAE) 0 Alzheimer-Demenz (DAT) -10 -2 0 2 4 6 8 10 12 14 Uhrenlesetest Abb. 3.5b Korrelation zwischen Uhrenlesetest und Rey-Figur: r=0,54 (p=0,05) 42 40 Diagnose Mischdemenz 30 (DAT/SAE) Lewy-KörperchenDemenz (LBD) 20 fronto-temporale Demenz (FTD) vaskuläre Enzephalo10 pathie (SAE) MMST Alzheimer-Demenz (DAT) 0 -2 0 2 4 6 8 10 12 14 Uhrenlesetest Abb. 3.5c Korrelation zwischen Uhrenlesetest und MMST: r=0,45 (p=0,05) 12 Diagnose 10 Mischdemenz 8 (DAT/SAE) Lewy-Körperchen- CERAD-Figurenzeichnen 6 Demenz (LBD) fronto-temporale 4 Demenz (FTD) vaskuläre Enzephalo- 2 pathie (SAE) Alzheimer-Demenz 0 (DAT) -2 -2 0 2 4 6 8 10 12 14 Uhrenlesetest Abb. 3.5d Korrelation zwischen Uhrenlesetest und CERAD-Figurenzeichnen: r=0,26 (p=0,05) 43 30 Diagnose 20 Mischdemenz (DAT/SAE) Lewy-Körperchen10 Demenz (LBD) Wortlistenlernen fronto-temporale Demenz (FTD) 0 vaskuläre Enzephalopathie (SAE) Alzheimer (DAT) -10 -2 0 2 4 6 8 10 12 14 Uhrenlesetest Abb. 3.5e Korrelation zwischen Uhrenlesetest und Wortlistenlernen: r=0,27 (p=0,05) 12 10 8 Diagnose Mischdemenz 6 Wortliste wiedererkennen (DAT/SAE) 4 Lewy-KörperchenDemenz (LBD) 2 fronto-temporale Demenz (FTD) 0 vaskuläre Enzephalo-2 pathie (SAE) -4 Alzheimer (DAT) -2 0 2 4 6 8 10 12 14 Uhrenlesetest Abb. 3.5f Korrelation zwischen Uhrenlesetest und Wortliste Wiedererkennen: keine signifikante Korrelation 44 14 12 Diagnose 10 Mischdemenz (DAT/SAE) Boston Benenntest: Fehler 8 Lewy-Körperchen6 Demenz (LBD) fronto-temporale 4 Demenz (FTD) 2 vaskuläre Enzephalopathie (SAE) 0 Alzheimer (DAT) -2 -2 0 2 4 6 8 10 12 14 Uhrenlesetest Abb. 3.5g Korrelation zwischen Uhrenlesetest und modifiziertem Boston-Benenn-Test: r=-0,1 (p=0,05) 45 3.5.2. Patienten mit parietalen Läsionen In dieser Gruppe ergab sich zwischen Uhrenlesetest und Uhrentest eine Korrelation von 0,50 (p=0,05), zwischen Uhrenlesetest und CERAD-Figurenzeichnen von 0,51 (p=0,05). Es ließ sich keine signifikante Korrelation zwischen dem Uhrenlesetest und dem Abzeichnen der Rey-Figur nachweisen (s. Abb.3.6a-d). 40 6 5 30 4 20 3 Rey-Figur Uhrentest 2 1 0 2 4 6 8 10 12 10 0 4 14 6 8 10 12 14 Uhrenlesetest Uhrenlesetest Abb.3.6a Korrelation von Uhrenlesetest und Uhrentest Abb.3.6b Korrelation von Uhrenlesetest und ReyKorrelationskoeffizient nach Pearson = 0,50 (p=0,05) Figur: es ließ sich keine signifikante Korrelation nachweisen. 12 2 Z-Wert CERAD-Figurenzeichnen 11 CERAD-Figurenzeichnen 10 9 8 7 6 5 2 4 6 Uhrenlesetest 8 10 12 14 1 0 -1 -2 -3 -4 2 4 6 8 10 12 14 Uhrenlesetest Abb.3.6c Korrelation von Uhrenlesetest und CERAD- Abb.3.6d Korrelation von Uhrenlesetest und Z-Wert Figurenzeichnen: Korrelationskoeffizient nach Pearson CERAD-Figurenzeichnen: keine signifikante Korrelation = 0,51 (p=0,05) 46 3.6. Regressionsanalyse der Testleistungen im Uhrenlesetest Die „All Possible Subsets Regression“ wurde nur mit den Datensätzen der Patienten mit dementiellen Erkrankungen durchgeführt. Sie ergab mehrere Modelle, deren R² sehr nahe beieinander lagen. Die zehn besten Modelle enthielten alle die Rey-Figur als unabhängige Variable. Uhrentest, Geschlecht, und der Z-Wert von Wortlistenlernen waren in den zehn besten Modellen mehrmals vertreten. Mit der Rey-Figur und zwei weiteren Variablen (z.B. Z-Wert Wortliste Summe und Geschlecht) ließen sich knapp 40% der Varianz des Uhrenlesetests erklären. Man kann also sagen, dass die Rey-Figur von allen Variablen den größten Teil der Varianz des Uhrenlesetests erklären kann. Uhrentest, Geschlecht und Wortliste Summe können einen weiteren Beitrag leisten. Die anderen Variablen sind mehr oder weniger austauschbar. Die Ergebnisse dieser Berechnung werden jedoch durch die geringe Fallzahl etwas abgeschwächt: Für die Berechnung dieser Modelle konnten nur die vollständigen, d.h. insgesamt 42 Datensätze (s. Abschnitt 2.2.1 S.18), verwendet werden. (Einzelheiten zu den Regressionsmodellen sind Tab.3.4 auf der nächsten Seite zu entnehmen). Um eine Regression auf der Basis einer größeren Anzahl von Datensätzen durchführen zu können, wurde in einem zweiten Schritt die Rey-Figur weggelassen, da nur verhältnismäßig wenige Patienten diesen Test gemacht hatten. So konnten im Folgenden 127 Datensätze für die Regression verwendet werden. Die in diesem Schritt berechneten Modelle hatten ein deutlich niedrigeres R². Der MMST war in den besten zehn Modellen vertreten, der Uhrentest immerhin in den ersten acht. Das beste Modell, mit MMST, Uhrentest und Alter als unabhängigen Variablen, konnte knapp 30% der Varianz des Uhrenlesetests erklären (s. auch Tab.3.5). Es zeigt sich also, dass auch der Uhrentest und der MMST zusammen einen bedeutenden Teil der Varianz des Uhrenlesetests erklären können. 47 Tab.3.4 Die „besten“ zehn Modelle der all possible subsets Regression*: Modell R R² Korrigiertes Standardfehler Unabhängige Variablen R² des Schätzers 1 ,617 0,380 0,332 2,638559 Z-Wert Wortlistenlernen, Rey-Figur, Geschlecht 2 ,615 0,379 0,33 2,642285 Z-Wert Wortlistenlernen, Rey-Figur, Uhrentest 3 ,607 0,368 0,319 2,664193 MMST, Uhrentest, Rey-Figur 4 ,600 0,360 0,309 2,682592 Rey-Figur, Geschlecht, Uhrentest 5 ,593 0,352 0,301 2,698489 Rey-Figur, Alter , Uhrentest 6 ,586 0,344 0,292 2,715311 Z-Wert Boston-Benenn-Test, Rey-Figur, Uhrentest 7 ,586 0,343 0,291 2,716928 Rey-Figur, Bildungsstand, Uhrentest 8 ,586 0,343 0,309 2,681946 Rey-Figur, Uhrentest 9 ,586 0,343 0,292 2,716237 Diskriminabilität, Rey-Figur, Uhrentest 10 ,586 0,343 0,291 2,716829 Z-Wert Figurenzeichnen, Uhrentest, Rey-Figur *Diese Modelle wurden auf der Basis von 42 Datensätzen berechnet. Tab.3.5 Die „besten“ zehn Modelle der all possible subsets Regression ohne Rey-Figur*: Modell R R² Korrigiertes Standardfehler Unabhängige Variablen R² des Schätzers 1 ,522 0,273 0,255 2,65662 MMST, Alter , Uhrentest 2 ,517 0,268 0,250 2,666212 Z-Wert Figurenzeichnen, MMST, Uhrentest 3 ,517 0,267 0,249 2,667440 MMST, Geschlecht, Uhrentest 4 ,512 0,262 0,244 2,676341 Diskriminabilität, Uhrentest , MMST 5 ,510 0,260 0,242 2,680226 MMST, Bildungsstand, Uhrentest 6 ,510 0,260 0,242 2,680569 MMST, Uhrentest , Z-Wert Boston-Benenn-Test 7 ,510 0,260 0,248 2,669999 MMST, Uhrentest 8 ,510 0,260 0,242 2,679906 Z-Wert Wortlistenlernen, Uhrentest , MMST 9 ,477 0,228 0,209 2,737532 Z-Wert Figurenzeichnen, Alter , MMST 10 ,467 0,218 0,199 2,754836 Z-Wert Figurenzeichnen, Diskriminabilität, MMST *Diese Modelle wurden auf der Basis von 127 Datensätzen berechnet. 48 3.7. Uhrenlesetest und parietale Läsionen Zwischen dem Volumen der parietalen Läsionen und dem Ergebnis im Uhrenlesetest ließ sich keine signifikante Korrelation nachweisen (vgl. Abb.3.7). 140 120 geschätztes Volumen (cm³) 100 80 60 40 Seite der Läsion 20 links rechts 0 2 4 6 8 10 12 14 Uhrenlesetest Abb.3.7 Zusammenhang zwischen geschätztem Volumen der parietalen Läsion und Uhrenlesetest Zwischen den Patienten mit rechts- und linksseitigen Läsionen ließ sich ebenfalls kein signifikanter Unterschied im Uhrenlesetest nachweisen. 49 3.8. Trennschärfe des Uhrenlesetests Mit Hilfe von ROC-Kurven wurde untersucht, wie gut der Uhrenlesetest zwischen Patienten und Kontrollgruppe zu unterscheiden vermag. Abb.3.8 zeigt die ROC-Kurve des Uhrenlesetest für die Diskrimination zwischen der Gruppe aller Demenzpatienten und der Kontrollgruppe. Zum Vergleich ist auch die ROC-Kurve des Uhrentests eingezeichnet. Die Fläche unter der Kurve als Maß für die Trennschärfe betrug für den Uhrenlesetest 0,84 (95%-Konfidenzintervall: 0,79-0,89) und für den Uhrentest 0,86 (95%Konfidenzintervall: 0,81-0,91). Die beiden Tests erweisen sich in dieser Fragestellung demnach als in etwa gleichwertig. 1,0 ,8 Sensitivität ,5 ,3 Uhrentest 0,0 0,0 Uhrenlesetest ,3 ,5 ,8 1,0 1 - Spezifität Abb.3.8 ROC-Kurve für die Unterscheidung zwischen allen Demenz-Patienten und Kontrollgruppe Abb. 3.9 enthält für jeden Punktwert des Uhrenlesetests die Sensitivität und Spezifität für die Unterscheidung zwischen Demenz-Patienten und Kontrollgruppe. Ein guter cutoff-Punkt wäre demnach z. B. 10,5 (d.h. ein Punktwert von 10,5 oder schlechter wird als pathologisch gewertet). Für diesen Punktwert ergibt sich eine Sensitivität von 0,76 und eine Spezifität von 0,70. Bei einem cut-off-Punkt von 10 wäre die Sensitivität 0,66 und die Spezifität 0,82. Zum Vergleich: der Uhrentest erreicht in dieser Untersuchung 50 für den von Shulman vorgeschlagenen cut-off-Punkt von ≤ 3 (vgl. Abschnitt 2.1.2 S.13) eine Sensitivität von 0,86 und eine Spezifität von 0,78. 1,2 1,0 ,8 ,6 ,4 Sensitivität Spezifität ,2 Anteil richtig 0,0 klassifizierte ,0 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 11,0 12,0 Uhrenlesetest: Trennwert Abb.3.9 Sensitivität, Spezifität und Anteil der richtig klassifizierten Fälle für jeden Trennwert im Uhrenlesen (alle Demenzen vs. Kontrollen) Abb.3.10 (s. nächste Seite) zeigt die ROC-Kurven von Uhrenlesetest und Uhrentest für die Unterscheidung zwischen Patienten mit Alzheimer-Demenz und Kontrollgruppe. Die Fläche unter der Kurve beträgt für den Uhrenlesetest 0,87 (95%Konfidenzintervall: 0,82-0,92) und für den Uhrentest 0,86 (95%-Konfidenzintervall: 0,80-0,92). Bei einem Trenn-Punktwert von 10,5 oder schlechter ist die Sensitivität des Uhrenlesetests für die Diagnose Alzheimer 0,82; die Spezifität beträgt 0,70. Bei einem cutoff von 10 erreicht er Sensitivität von 0,73 und eine Spezifität von 0,82 (s. Abb. 3.11, nächste Seite). Der Uhrentest erreichte in dieser Konstellation (cut-off-Wert ≤ 3) eine Sensitivität von 0,87 und eine Spezifität von 0,78. Die leichte Verbesserung der Sensitivität des Uhrenlesetests in dieser Fragestellung gegenüber dem Vergleich von Kontrollgruppe und Patienten mit Demenzen allgemein ergibt sich durch den Wegfall der Gruppen „zerebrale Mikroangiopathie“ und „Frontotemporale Demenz“, die sich im Uhrenlesetest nicht signifikant von der Kontrollgruppe unterschieden (vgl. Abschnitt 3.4 S.36). 51 1,0 ,8 ,5 Sensitivität ,3 Uhrentest Uhrenlesetest 0,0 0,0 ,3 ,5 ,8 1,0 1 - Spezifität Abb.3.10 ROC-Kurve für die Unterscheidung zwischen Alzheimer-Patienten und Kontrollgruppe 1,2 1,0 ,8 ,6 ,4 Sensitivität Spezifität ,2 Anteil richtig 0,0 klassifizierte ,0 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 11,0 12,0 Uhrenlesetest: Trennwert Abb.3.11 Sensitivität, Spezifität und Anteil der richtig klassifizierten Fälle für jeden Trennwert im Uhrenlesen (nur Alzheimer-Patienten vs. Kontrollpersonen) 52 3.9. Praktische Erfahrungen mit dem Uhrenlesetest Die Erfahrungen mit der Anwendung des Uhrenlesetests zeigen, dass er von Patienten für gewöhnlich gut akzeptiert wird, in vielen Fällen sogar besser als der Uhrentest. Dies könnte unter anderem daran liegen, dass das Ablesen einer Uhr eine sehr alltägliche Aufgabe und somit realitätsnah ist. Die Aufgabenstellung ist für den Patienten einfach zu verstehen, so dass sich keine Fehler wegen diesbezüglicher Missverständnisse ergeben. Die Anwendung und Bewertung des Uhrenlesetests ist leicht zu erlernen. Der Test erfordert außer dem Testbogen und einem Notizblatt für die Ergebnisse kein Material. Bei den meisten Patienten erfordert er wenig Zeit. Hat ein Patient allerdings große Defizite, so dauert die Anwendung unter Umständen recht lang. Dies ist der Grund, warum er in solchen Fällen nach der Hälfte abgebrochen werden darf (vgl. Abschnitt 2.1.1 S.13). Der Uhrenlesetest ist auch bei solchen Patienten gut anzuwenden, die bettlägerig sind und / oder motorische Einschränkungen haben, z.B. eine Hemiplegie nach einem Schlaganfall. Hier besteht ein deutlicher Vorteil gegenüber dem Uhrentest und anderen Papier-und-Bleistift-Tests, die voraussetzen, dass der Patient mindestens am Tisch sitzen und einen Stift halten kann. Der Uhrenlesetest setzt jedoch voraus, dass sich Patient und Untersucher verbal verständigen können. Dies schränkt seine Anwendung sowohl bei Patienten mit Sprachstörungen (z. B. Aphasie nach Schlaganfall) als auch bei ausländischen Patienten, die der deutschen Sprache nicht mächtig sind, erheblich ein. Auch Patienten mit stark vermindertem Visus können den Uhrenlesetest unter Umständen nicht durchführen. 53 4. Diskussion 4.1. Kritische Betrachtung der Methoden Im folgenden soll auf einige methodische Schwachpunkte der vorliegenden Untersuchung hingewiesen werden, die bei der Beurteilung der Ergebnisse bedacht werden müssen: Die Datenerhebung für die unter 2.2.1 (S.18) erwähnten Patienten erfolgte retrospektiv. Da nur Patienten aufgenommen werden konnten, die tatsächlich mit dem Uhrenlesetest getestet wurden, kann ungewollt eine Selektion stattgefunden haben, z.B. indem Patienten, die in fortgeschrittenen Stadien ihrer Erkrankung in die Gedächtnissprechstunde kamen, nicht mit diesem Test untersucht wurden. Auch waren die neuropsychologischen Daten vieler Patienten nicht vollständig, entweder, weil die Ergebnisse nicht dokumentiert oder weil die Tests nicht durchgeführt worden waren. Des weiteren wurden die unter 2.2.1 (S.18) genannten Patienten von den Mitarbeitern der Gedächtnissprechstunde, die Gruppen 2.2.2 (S.19) und 2.2.3 (S.19) hingegen von der Autorin getestet. Untersucherspezifische Unterschiede können daher nicht ausgeschlossen werden. Auch waren die Untersucher in der Regel in Bezug auf die Diagnose nicht verblindet. Die Diagnosestellung nach klinischen Kriterien (einschließlich Labor- und bildgebenden Untersuchungen) ist, wie schon in Absatz 2.2.1 (S.18) erwähnt, mit Unsicherheit behaftet. Für die meisten Demenzerkrankungen kann eine sichere Diagnose erst durch Obduktion und histopathologische Untersuchung gestellt werden. In der Tat hat sich seit Erhebung und Auswertung der Daten herausgestellt, dass zumindest bei einem der Patienten in der Gruppe „Alzheimer-Demenz“ die Diagnose nicht mehr haltbar ist. Die Wahrscheinlichkeit ist groß, dass weitere nicht entdeckte Fehldiagnosen in den Demenz-Gruppen vorliegen. Aus praktischen Gründen ist die Diagnosestellung auf andere Art als durch klinische Kriterien kaum möglich. Dennoch muß auch diese Tatsache die Aussagen der vorliegenden Untersuchung abschwächen. In der Kontrollgruppe erfolgte keine vertiefte neuropsychologische Untersuchung zum Ausschluß eventuell bestehender Beeinträchtigungen (s. Abschnitt 2.2.2 S.19). Lediglich der MMST diente als Screening-Test. Damit kann nicht ausgeschlossen werden, dass einzelne Kontrollpersonen an einer bisher nicht diagnostizierten Krankheit litten, die ihre geistigen Fähigkeiten beeinträchtigten. Ein MMST von 27 oder besser kann 54 hinreichend eine Demenz ausschließen, nicht jedoch eine Leichte Kognitive Störung. Einige der Kontrollpersonen litten an psychiatrischen Erkrankungen (vgl. Abschnitt 2.2 S.22). Auch sie waren im MMST nicht beeinträchtigt; dennoch waren sie sicher nicht gesund, und der Einfluß ihrer Krankheiten auf den Uhrenlesetest ist bislang nicht geklärt. Ebenfalls unklar ist, ob die Medikation mit Opioid-Analgetika, die einige der stationären Kontrollpersonen erhielten, ihr Abschneiden im Uhrenlesetest beeinträchtigt hat. Dies muß beim Vergleich der Kontrollgruppe mit den anderen Gruppen beachtet werden. Der Fehler, der durch diese Ungenauigkeit entsteht, dürfte die Ergebnisse jedoch allenfalls dahingehend verändern, dass bestehende Unterschiede zwischen den Gruppen nicht entdeckt werden. Umgekehrt können Unterschiede, die dennoch festgestellt wurden, als signifikant betrachtet werden. Obwohl in die Kontrollgruppe nur Patienten aufgenommen wurden, die mindestens 60 Jahre alt waren, war das mittlere Alter in dieser Gruppe niedriger als in fast allen anderen Gruppen (s. Abschnitt 2.2 S.25). Auch dies muss bedacht werden, da zumindest in der Kontrollgruppe ein Zusammenhang zwischen den Testleistungen im Uhrenlesetest und dem Alter festzustellen war. 4.2. Uhrenlesen als Maß visuell-räumlicher Verarbeitung Der Uhrenlesetest korreliert in der Gruppe der Patienten mit dementiellen Erkrankungen mäßig gut mit Tests visuell-räumlicher Fähigkeiten (Rey-Figur, Uhrenlesen) und des allgemeinen kognitiven Funktionsniveaus (MMST – vgl. Abschnitt 3.5 S.38 ). Der Zusammenhang zwischen Uhrenlesetest und Rey-Figur bzw. Uhrentest bleibt auch bei auspartialisiertem MMST mäßig gut (s. Abschnitt 3.5.1 S.38). Es besteht also ein Zusammenhang zwischen Uhrenlesetest und Rey-Figur bzw. Uhrentest, der sich nicht allein mit dem allgemeinen kognitiven Zustand erklären läßt. Rey-Figur, MMST und Uhrentest trugen zu den besten Regressionsmodellen bei (vgl. Abschnitt 3.6 S.45). Dies alles deutet darauf hin, dass der Uhrenlesetest bei Demenz-Patienten neben dem allgemeinen kognitiven Funktionsniveau auch visuell-räumliche Fähigkeiten bzw. Defizite misst. Andererseits korrelieren Rohwert und Z-Wert des Figurenzeichnens aus dem CERAD nicht gut mit dem Uhrenlesetest (und auch nicht mit Rey-Figur und Uhrentest), obwohl auch dieser Test ein Maß für visuokonstruktive Fähigkeiten ist (vgl. Tab. 3.3 S.39 u. Abb. 3.5d S.40). Eine mögliche Erklärung liegt darin, dass das Figurenzeich- 55 nen im Vergleich zu den anderen Tests eine recht einfache Aufgabe ist, so dass auch Patienten, die bereits Schwierigkeiten im Uhrenlesetest oder mit der Rey-Figur haben, beim Figurenzeichnen noch im Normbereich liegen. Zwar gilt der dreidimensionale Würfel als schwierig, doch ist bei dieser Teilaufgabe die Variabilität auch innerhalb der gesunden Bevölkerung sehr hoch. So gelang es 32 der 64 Kontrollpersonen nicht, den Würfel korrekt abzuzeichnen. In die vorliegende Untersuchung konnten nur Personen aufgenommen werden, die in der Lage waren, den Uhrenlesetest durchzuführen. Von diesen Patienten (insges. 200) hatten lediglich sechs einen Punktwert im Figurenzeichnen unter 6, sieben weitere hatten den Punktwert 6 (zum Vergleich: von den elf Punkten in diesem Test werden vier für den Würfel und insgesamt sieben für die anderen Figuren vergeben). Vgl. auch Tab. 3.1 (S.32): In allen Gruppen war der Mittelwert für das Figurenzeichnen größer als 8. Die meisten der Probanden lagen bei diesem Test also in einem Wertbereich, in dem der Zusammenhang zwischen dem Testergebnis und den tatsächlichen visuokonstruktiven Fähigkeiten nur mäßig ist. Da sowohl der Uhrentest als auch die komplexe Rey-Figur als visuokonstruktive Tests gelten, wäre zu erwarten, dass die Testergebnisse dieser beiden Tests miteinander korrelieren. Dies ist aber nicht der Fall (s. Tab.3.3 S.39). Dieser Wiederspruch ist schwer auszuräumen. Tuokko et al. (1992) postulieren, dass der Zusammenhang zwischen Uhrenlesen, Uhrenzeichnen und Uhrenstellen auf einer verminderten mentalen Repräsentation von Zeit beruht, d.h. dass diese Tests sensitiv für Störungen des Abstraktionsvermögens, nicht der visuell-räumlichen Verarbeitung, sein könnten. Diese These stützt sich jedoch nur auf das ähnliche Abschneiden von Alzheimer-Patienten in den drei Tests, ein Zusammenhang, der sich auch durch verminderte visuell-räumliche Fähigkeiten erklären ließe. Untersuchungen anderer Autoren (z.B. Royall et al. 1998 und 1999, Cahn-Weiner et al. 1999 – s. hierzu auch Abschnitt 1.3.1 S. 7) belegen zwar, dass Tests des Uhrenzeichnens, auch der hier verwendete Uhrentest, sensitiv für andere als visuell-räumliche Funktionen sind. Jedoch bezweifeln sie nicht, dass das Uhrenzeichnen auch eine visuell-räumliche Aufgabe ist. So fanden Cahn-Weiner et al. (1999) eine Korrelation zwischen Uhrenzeichnen und dem als visuokonstruktive Aufgabe angesehenen Mosaiktest. Sicher kann an der visuell-räumlichen Natur der komplexen Rey-Figur kein Zweifel bestehen. Die Korrelation zwischen diesem Test und dem Uhrenlesetest spricht auf jeden 56 Fall für visuell-räumliche Fähigkeiten als Grundlage zumindest des Uhrenlesetests. Da es bei den meisten Demenzerkrankungen zu einer globalen Abnahme der kognitiven Fähigkeiten kommt, ist es nicht verwunderlich, dass der Uhrenlesetest mit dem MMST als Maß für das allgemeine kognitive Funktionsniveau korreliert. Dies erklärt vermutlich auch, warum „Wortlistenlernen“ einen Beitrag zu einigen guten Regressionsmodellen leistet. In der Tat ist ja zwischen Uhrenlesetest und „Wortlistenlernen“ bei auspartialisiertem MMST keine Korrelation nachweisbar. Die Untersuchungen an Patienten mit parietalen Läsionen (vgl. Abschnitt 3.5.2 S.44) zeigten ebenfalls Korrelationen zwischen dem Uhrenlesetest und anderen visuellräumlichen Tests. Warum sich hier keine signifikante Korrelation mit der Rey-Figur, hingegen eine im Vergleich zur anderen Gruppe hohe Korrelation mit der Konstruktiven Praxis ergab, ist unklar. Möglicherweise kam hier aber die geringe Gruppengröße zum Tragen. Die einzige Publikation, die bisher darauf hinweist, dass Uhrenlesen eine visuellräumliche Aufgabe ist, ist die von Kerkhoff et al. (1997). In dieser Studie mussten die Patienten die Uhrzeit aber nicht direkt ablesen, sondern mit anderen Uhren vergleichen. Auch wenn dieser Test, wie die Autoren versichern, mit den UhrenleseFähigkeiten im Alltag korreliert, ist die Aufgabenstellung letztlich eine andere. Auch lassen sich Ergebnisse von Patienten mit zerebrovaskulären Infarkten nicht direkt auf Demenz-Patienten übertragen, da bei Demenz-Patienten meist eine Vielzahl von kognitiven Funktionen beeinträchtigt sind, die einen Test auf vielfältige Weise beeinflussen können. Trotz der starken Hinweise auf eine visuell-räumliche Komponente des Uhrenlesetests ist die Korrelation mit Rey-Figur und Uhrentest nur mäßig. Über 60% der Variabilität des Uhrenlesetests ließ sich mit den untersuchten Variablen nicht erklären. Hier ist zu beachten, dass der Uhrentest und die Rey-Figur im Gegensatz zum Uhrenlesetest auch eine exekutiv-motorische Komponente haben. Deshalb dürfte die Übereinstimmung zwischen diesen Tests und dem Uhrenlesetest bei Patienten mit ausgeprägten exekutiven oder motorischen Störungen gering sein. Aus der vorliegenden Untersuchung lässt sich nicht abschätzen, wie viel diese Störgröße ausmacht. Insgesamt spricht nach der vorliegenden Untersuchung viel dafür, dass der Uhrenlesetest visuell-räumliche Fähigkeiten misst. Dennoch kann nicht ausgeschlossen werden, dass er auch für andere hier nicht untersuchte Defizite sensitiv ist. Weitere Untersuchungen werden nötig sein, um dies zu klären. 57 4.3. Uhrenlesen als Funktion des Parietallappens Die Patienten mit parietalen Läsionen erzielten ein signifikant schlechteres Ergebnis im Uhrenlesetest als die Personen in der Kontrollgruppe (s. Abschnitt 3.4 S). Dies ist ein deutlicher Hinweis darauf, dass parietale Läsionen die Fähigkeit, Uhrzeiten zu lesen, beeinträchtigen. Es ließ sich jedoch kein Zusammenhang zwischen den Testergebnissen im Uhrenlesetest und dem Volumen der Läsion nachweisen (s. Abschnitt 3.7 S.47). Möglicherweise liegt das an den unterschiedlichen Lokalisationen innerhalb des Parietallappens: Die meisten Patienten in der vorliegenden Untersuchung hatten relativ kleine Läsionen, die sicher nicht die Funktion des gesamten Parietallappens beeinträchtigten. Nach Kerkhoff (2003) werden die einzelnen Komponenten visuellräumlicher Verarbeitung unterschiedlichen Gehirnarealen zugeschrieben. Zum Beispiel gilt die visuelle Orientierungsschätzung, die bei der Beurteilung der Ausrichtung der Uhrzeiger eine Rolle spielen könnte, als occipitoparietale Funktion. Dagegen gilt die Positionsschätzung, die wichtig für die Erfassung der Beziehung zwischen Uhrzeiger und Zifferblatt sein könnte, als Funktion des superioren Parietallappens. Deshalb könnte der Ort der Läsion entscheidend für die Ausprägung der visuellräumlichen Störung gewesen sein. Für einige der Komponenten visuell-räumlicher Verarbeitung, insbesondere für die Positions- und Orientierungsschätzung, soll eine Dominanz der rechten Gehirnhemisphäre bestehen (Benton und Tranel 1993, Kerkhoff 2003). In der vorliegenden Untersuchung ließ sich keine Dominanz einer Hemisphäre nachweisen. Jedoch waren die Fallzahlen gering, so dass hier wohl keine sichere Aussage möglich ist. Insgesamt schnitten die Patienten mit parietalen Läsionen im Uhrenlesestest signifikant besser ab als Patienten mit Demenzerkrankungen (s. Abschnitt 3.4 S.36). Vermutlich können Patienten mit einer einseitigen umschriebenen Läsion die daraus resultierenden Defizite besser ausgleichen als Patienten mit Demenzerkrankungen, die ja große Gehirnareale bilateral und diffus schädigen. Die vorliegende Studie hat keine Patienten mit umschriebenen Läsionen außerhalb des Parietallappens untersucht. Damit bleibt offen, ob Läsionen in anderen Gehirnarealen den Uhrenlesetest beeinflussen. Somit kann auch nicht ausgeschlossen werden, dass zum Uhrenlesen über die visuell-räumliche Verarbeitung hinaus andere Gehirnfunkti- 58 onen notwendig sind. Es sind noch weitere Untersuchungen nötig, um die zum Uhrenlesen notwendigen Strukturen im Gehirn zu identifizieren. 4.4. Der Uhrenlesetest als Test für Demenzerkrankungen Abschnitt 3.4 (S.36) zeigt, dass Patienten mit Demenzerkrankungen im Uhrenlesetest schlechter abschneiden als ältere Kontrollpersonen. Weiterhin zeigt die Korrelationsuntersuchung in Abschnitt 3.5 (S.38), dass zwischen dem Uhrenlesetest und dem MMST, der ein Maß für die Ausprägung einer Demenz ist, ein signifikanter Zusammenhang besteht. Somit kann der Uhrenlesetest auch als ein Test für das Vorliegen einer Demenzerkrankung gelten. Abschnitt 3.8 (S.48) zeigt, dass der Uhrenlesetest in der Lage ist, mit guter Sensitivität und Spezifität zwischen Demenz-Patienten und älteren Kontrollpersonen zu unterschieden. Allerdings gilt dies nicht in gleichem Maße für alle Demenzerkrankungen: So ließ sich zwischen den Gruppen „zerebrale Mikroangiopathie“ und „frontotemporale Demenz“ und der Kontrollgruppe kein Unterschied im mittleren Testergebnis des Uhrenlesetests nachweisen, obwohl die beiden erstgenannten Gruppen ein signifikant schlechteres mittleres MMST-Ergebnis hatten. Entsprechend sind Sensitivität und Spezifität des Uhrenlesetests auch höher, wenn man nur die Gruppe der Alzheimer-Patienten betrachtet. Dies ist mit großer Wahrscheinlichkeit auf die in Abschnitt 1.1 (ab S.1) skizzierten unterschiedlichen neuropsychologischen Profile der einzelnen Demenzerkrankungen zurückzuführen. Den Krankheitsbildern der zerebralen Mikroangiopathie und der frontotemporalen Demenz ist ein prominentes Defizit der Exekutivfunktionen gemeinsam. Diese Funktionen, wie Planen, zielgerichtetes Handeln und ständige Überprüfung des eigenen Handelns, dürften für die Durchführung des Uhrenlesetests von untergeordneter Bedeutung sein. Somit dürften Patienten, die vorwiegend exekutive Dysfunktionen aufweisen, mit dem Uhrenlesetest kaum Schwierigkeiten haben. In diesem Zusammenhang sollte auch noch bedacht werden, dass die Gruppen „zerebrale Mikroangiopathie“ und „frontotemporale Demenz“ jeweils recht klein waren (16 bzw. 18 Personen). Mit dieser geringen Anzahl lässt sich ein relativ geringer Unterschied im mittleren Testergebnis unter Umständen nicht nachweisen. Untersuchungen an größeren Gruppen könnten darüber Aufschluß geben, ob Patienten mit diesen Krankheiten im Vergleich zu Gesunden im Uhrenlesetest wirklich nicht schlechter abschneiden. 59 Mit einer Sensitivität von 0,76 und einer Spezifität von 0,70 scheint nach der vorliegenden Untersuchung ein cut-off Wert von 10,5 (d.h. 10,5 oder schlechter gilt als pathologisches Ergebnis) optimal zur Erfassung einer Demenzerkrankung. Je nach Bedarf wird man jedoch einen anderen Wert wählen, wenn die Sensitivität bedeutender erscheint und auf Kosten der Spezifität erhöht werden soll oder umgekehrt (s. dazu auch Abschnitt 3.8 (S.48) und Abb. 3.9 S.49). 4.5. Anwendung des Uhrenlesetests in der Demenzdiagnostik Der untersuchte Uhrenlesetest ist einfach anzuwenden und zu bewerten und wird von Patienten gut akzeptiert. Er ist – mit Ausnahme des Alters - unabhängig von demografischen Variablen. Im Vergleich zum Uhrentest ist der Uhrenlesetest für den Patienten realitätsnäher. In Übereinstimmung mit allen bisherigen Publikationen (vgl. Abschnitt 1.3.2 S) zum Thema hat auch die vorliegende Arbeit gezeigt, dass bei Patienten mit Demenzerkrankungen die Fähigkeit zum Ablesen von Uhrzeiten beeinträchtigt sein kann. Dies ist auch im Alltag der Patienten relevant. Deshalb stellt der Uhrenlesetest eine sinnvolle Ergänzung zur neuropsychologischen Untersuchung von DemenzPatienten dar. Der Uhrenlesetest bietet auch einen Vorteil bei Patienten, die motorisch eingeschränkt sind und die deshalb einen Test, der den Umgang mit Papier und Bleistift erfordert, nicht ausführen können. Bei diesen Patienten kann statt dessen der Uhrenlesetest zur Erfassung visuell-räumlicher Störungen verwendet werden. Mehrere Studien (Tuokko et al. 1992, Lam et al.1998, O’Rourke et al.1997) belegen, dass Uhrenlesetests in Kombination mit Tests des Uhrenzeichnens zu besseren diagnostischen Ergebnissen führen als Uhrenzeichnen allein. Hier muss abgewogen werden, wie der zusätzliche zeitliche Aufwand im Verhältnis zum daraus gewonnenen diagnostischen Vorteil steht. Kann Uhrenlesen zur Differentialdiagnose von Demenzerkrankungen beitragen? Mit dieser Frage haben sich zwei Untersuchungen beschäftigt: Fahlander et al. (2002) fanden, dass von einer Reihe von neuropsychologischen Tests nur ein Uhrenlesetest zwischen Patienten mit vaskulärer Demenz und Patienten mit Alzheimer-Demenz unterscheiden kann, wobei erstere schlechter abschneiden. 60 Schmidtke und Hüll (2002), die den hier untersuchten Uhrenlesetest verwendeten, fanden, dass Patienten mit zerebraler Mikroangiopathie signifikant besser Uhren ablesen konnten als Patienten mit Alzheimer-Demenz. Diese beiden Studien lassen sich schlecht vergleichen, da Schmidtke und Hüll Patienten mit reiner zerebraler Mikroangiopathie untersuchten, während Fahlander et al. DSM-III-R Kriterien und die Hachinski Ischaemic Scale zur Auswahl der Patienten mit vaskulärer Demenz verwendeten. Obwohl beide Studien also Patienten mit vaskulär bedingter Demenz untersuchen, sind die zugrunde gelegten Definitionen sehr verschieden. Dennoch ist es überraschend, dass die Ergebnisse so unterschiedlich ausfallen. Hier müssen weitere Untersuchungen Aufschluß geben. Die Datengrundlage der Untersuchung von Schmidtke und Hüll überschneidet sich teilweise mit der der vorliegenden Untersuchung. Hier schnitten Patienten mit zerebraler Mikroangiopathie und Patienten mit Frontotemporaler Demenz im Uhrenlesetest deutlich besser ab als Patienten mit anderen Demenz-Formen (s. Abschnitt 3.4 S.36). Es ließ sich bei diesen Gruppen zur Kontrollgruppe kein Unterschied nachweisen. Einschränkend muß allerdings gesagt werden, dass diese beiden Gruppen auch einen besseren mittleren MMST hatten als die anderen Demenz-Gruppen (s.Abschnitt 2.2). Dennoch scheint sich hier ein Unterschied abzuzeichnen, der gut zu den neuropsychologischen Profilen der unterschiedlichen Demenzerkrankungen passt: Während bei der Alzheimer-Demenz, der Lewy-Körperchen-Demenz und der gemischten Demenz visuell-räumliche Defizite häufig sind, stehen bei subkortikalen vaskulären Demenzen und bei Frontotemporalen Demenzen andere Defizite, insbesondere Defizite der Exekutivfunktionen, im Vordergrund. Folglich zeigen Patienten mit AlzheimerDemenz, Lewy-Körperchen-Demenz oder Mischdemenz deutliche Defizite im Uhrenlesetest, Patienten mit subkortikalen vaskulären Demenzen oder Frontotemporalen Demenzen jedoch kaum oder gar nicht. Letztendlich wird sich wohl kaum ein neuropsychologischer Test finden lassen, der für sich alleine eine differentialdiagnostische Aussage über die Art der Demenz erlaubt. Vielmehr ist das neuropsychologische Profil eines Patienten entscheidend, in das mehrere kognitive Fähigkeiten eingehen. Die visuell-räumliche Verarbeitung ist nur eine davon, sie sollte aber auf jeden Fall untersucht werden. Mit dem Uhrenlesetest liegt nun ein zusätzliches Instrument dazu vor. 61 5. Zusammenfassung Uhrentests stellen eine Möglichkeit der Untersuchung visuell-räumlicher Störungen bei Demenzerkrankungen dar. Die vorliegende Untersuchung prüft die Validität eines neuen Uhrenlesetests für visuell-räumliche Störungen, für Demenzerkrankungen und für Läsionen des Parietallappens, versucht, einen optimalen cut-off Punktwert zu finden und soll zeigen, ob es Unterschiede zwischen einzelnen Demenzformen beim Uhrenlesen gibt. Als Untersuchungskollektiv dienten 200 Patienten mit Demenzerkrankungen, 105 Patienten mit Leichter Kognitiver Störung, 20 Patienten mit Läsionen eines Parietallappens und 64 ältere Personen ohne bekannte zentralnervöse Erkrankung. Die neuropsychologische Untersuchung umfasste neben dem Uhrenlesetest eine Reihe weiterer visuell-räumlicher und nicht visuell-räumlicher Tests. Zur Prüfung der Validität wurden PearsonKorrelationskoeffizienten berechnet, gefolgt von einer All Possible Subsets Regression. Vergleiche zwischen den Mittelwerten einzelner Gruppen erfolgten mit dem Abschlusstestverfahren. Ein geeigneter cut-off score wurde mit Hilfe von ROC-Kurven ermittelt. Der Uhrenlesetest zeigt keine Abhängigkeit von demografischen Variablen. Er hat eine gute split-half-Reliabilität (r=0,78). Er korreliert gut bis mäßig mit der komplexen ReyFigur (r=54), dem Uhrentest (r=0,42) und dem MMST (r=0,45), mit anderen Tests dagegen gering oder gar nicht. Von den untersuchten Variablen konnten Rey-Figur, Uhrentest und MMST in der Regressionsanalyse den größten Anteil an der Variabilität des Uhrenlesetests erklären. Patienten mit Demenzerkrankungen und Patenten mit parietalen Läsionen schnitten im Uhrenlesetest signifikant schlechter ab als die Kontrollgruppe und die Patienten mit Leichter Kognitiver Störung. Innerhalb der Gruppe der Demenz-Patienten waren Patienten mit zerebraler Mikroangiopathie und Frontotemporaler Demenz deutlich besser als Alzheimer-Patienten, Patienten mit Mischdemenz und Patienten mit LewyKörperchen-Demenz. Bei den Patienten mit parietalen Läsionen ließ sich kein Zusammenhang zwischen dem Ergebnis im Uhrenlesetest und der Größe der parietalen Läsion nachweisen, ebenso wenig ein Unterschied zwischen Patienten mit rechts- und linksseitigen Läsionen. Die Untersuchung mit ROC-Kurven ergab eine gute Trennschärfe zwischen Demenz-Patienten und Kontrollpersonen. Für den ermittelten optimalen cut-off Wert von 10,5 ergab sich eine Spezifität von 0,70 und eine Sensivität von 0,76. Es hat sich also gezeigt, dass der Uhrenlesetest sensitiv für visuell-räumliche Störungen, für Demenzerkrankungen und für parietale Läsionenist und somit eine sinnvolle Ergänzung zur neuropsychologischen Demenzdiagnostik darstellt. 62 6. Literaturverzeichnis 1. Aebi C (2002) Validierung der Neuropsychologischen Testbatterie CERAD-NP. Eine Multi-center Studie Dissertation zur Erlangung der Würde einer Doktorin der Philosophie vorgelegt der Philosophisch-Historischen Fakultät der Universität Basel 2. Ainslie NK, Murden RA (1993) Effect of education on the clock-drawing dementia screen in non-demented elderly persons. J Am Geriatr Soc 41(3):249-252 3. Almkvist O (2002) Neuropsychological and Instrumental Diagnosis of Dementia: a Review. In: Maj M, Sartorius N (eds.) Dementia 2nd Edition Wiley, Chichester pp.143-165 4. Agrell B, Dehlin O (1998) The clock-drawing test. Age Ageing 27:399-403. 5. Benton A, Tranel D (1993). Visuoperceptual, Visuospatial and Visuoconstructive Disorders. In: Heilman K, Valenstein E (eds.) Clinical Neuropsychology 3rd Edition Oxford 6. Benton AL, De Hamsher K, Varney N, Spreen O (1983) Contributions to Neuropsychological Assessment. A clinical manual. Oxford University Press, New York 7. Berger AK, Fahlander K, Wahlin A, Backman L (2002) Negligible effects of depression on verbal and spatial performance in Alzheimer's disease. Dement Geriatr Cogn Disord. 13(1):1-7. 8. Berres M, Monsch AU, Bernasconi F, Thalmann B, Stahelin HB (2000) Normal ranges of neuropsychological tests for the diagnosis of Alzheimer's disease. Stud Health Technol Inform 77:195-199 9. Bickel H (2000) Demenzsyndrom und Alzheimer Krankheit: Eine Schätzung des Krankenbestandes und der jährlichen Neuerkrankungen in Deutschland. Gesundheitswesen 62:211-218 10. Borson S, Brush M, Gil E, Scanlan J, Vitaliano P, Chen J, Cashman J, Sta Maria MM, Barnhart R, Roques J. (1999) The Clock Drawing Test: utility for dementia detection in multiethnic elders. J Gerontol A Biol Sci Med Sci. 54(11):M534-540 11. Borson S, Scanlan J, Brush M, Vitaliano P, Dokmak A. (2000) The mini-cog: a cognitive 'vital signs' measure for dementia screening inmulti-lingual elderly. Int J Geriatr Psychiatry. 15(11):1021-1027 63 12. Brodaty H, Moore CM (1997) The Clock Drawing Test for dementia of the Alzheimer's type: A comparison of three scoring methods in a memory disorders clinic. Int J Geriatr Psychiatry 12(6):619-627 13. Cahn-Weiner DA, Sullivan EV, Shear PK, Fama R, Lim KO, Yesavage JA, Tinklenberg JR, Pfefferbaum A. (1999) Brain structural and cognitive correlates of clock drawing performance in Alzheimer's disease. J Int Neuropsychol Soc. 5(6):502-509 14. Cahn-Weiner DA, Williams K, Grace J, Tremont G, Westervelt H, Stern RA (2003) Discrimination of dementia with lewy bodies from Alzheimer disease and Parkinson disease using the clock drawing test. Cogn Behav Neurol. 16(2):85-92 15. Caine D, Hodges JR (2001) Heterogenity of Semantic and Visuospatial Deficits in Early Alzheimer’s Disease. Neuropsychology 15:155-164. 16. Carr EK, Lincoln NB (1988) Inter-rater reliability of the Rey figure copying test. Br J Clin Psychol 27,267-268 17. Christensen A (1984) Luria’s neuropsychological investigation Text. Munksgaard, Kopenhagen 18. Collie A, Maruff P (2002) An analysis of systems of classifying mild cognitive impairment in older people. Aust N Z J Psychiatry36:133-140 19. Critchley M (1953) The Parietal Lobes Arnold, London 20. Libon DA, Swenson RA, Barnoski EJ, Sands LP (1993) Clock drawing as an assessment tool for dementia. Arch Clin Neuropsychol 8:405-415 21. Fahlander K, Wahlin A, Almkvist O, Backman L (2002) Cognitive functioning in Alzheimer's disease and vascular dementia: further evidence for similar patterns of deficits. J Clin Exp Neuropsychol. 24(6):734-744 22. Filley CM, Cullum CM (1997) Education and cognitive function in Alzheimer's disease. Neuropsychiatry Neuropsychol Behav Neurol. 10(1):48-51 23. Folstein MF, Folstein SE, McHugh PR (1975) "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 12(3):189-98 24. Förstl H (2000) Neuropsychologie und Psychopathologie kortikaler und subkortikaler Demenzformen. In: Calabrese P, Förstl H (Hrsg.) Psychopathologie und Neuropsychologie der Demenzen Pabst, Lengerich, Berlin, Riga, Rom, Wien, Zagreb S. 201-220 64 25. Freedman M, Leach L, Kaplan E, Winocur G, Shulman KI, Delis DC (1994) Clock Drawing - A Neuropsychological Analysis. Oxford University Press, New York, Oxford 26. Gertz HJ, Wolf H (2000) Pathogenese, Klinik und Therapie der vaskulären Demenz. In: Calabrese P, Förstl H (Hrsg.) Psychopathologie und Neuropsychologie der Demenzen Pabst, Lengerich, Berlin, Riga, Rom, Wien, Zagreb, S. 178-200 27. Gruber NP, Varner RV, Chen YW, Lesser JM (1997) A comparison of the clock drawing test and the Pfeiffer Short Portable Mental Status Questionnaire in a geropsychiatry clinic. Int J Geriatr Psychiatry 12:526-532 28. Heinik J, Reider-Groswasser II, Solomesh I, Segev Y, Bleich A (2000) Clock drawing test: correlation with linear measurements of CT studies in demented patients. Int J Geriatr Psychiatry 15(12):1130-1137 29. Heinik J, Solomesh I, Raikher B, Lin R (2002) Can clock drawing test help to differentiate between dementia of the Alzheimer's type and vascular dementia? A preliminary study. Int J Geriatr Psychiatry 17(8):699-703 30. Heinik J, Solomesh I, Shein V, Becker D (2002) Clock drawing test in mild and moderate dementia of the Alzheimer's type: a comparative and correlation study. Int J Geriatr Psychiatry 17(5):480-485 31. Henderson WV, Mack W, Williams BW (1989) Spatial Disorientation in Alzheimer’s Disease. Arch Neurol 46:391-394 32. Herrmann N, Kidron D, Shulman KI, Kaplan E, Binns M, Leach L, Freedman M (1998) Clock tests in depression, Alzheimer's disease, and elderly controls. Int J Psychiatry Med. 28(4):437-447 33. Huber W, Poek K, Weniger D, Willmes K (1983) Aachener Aphasie Test. Hogrefe, Göttingen 34. Inglin D (1999) Demenzabklärung. Ther Umsch 2:94-97 35. Stahelin HB, Monsch AU, Spiegel R. (1997) Early diagnosis of dementia via a twostep screening and diagnostic procedure. Int Psychogeriatr. 9 Suppl 1:123-130 36. Juby A, Tench S, Baker V. (2002) The value of clock drawing in identifying executive cognitive dysfunction in people with a normal Mini-Mental State Examination score. CMAJ. 167(8):859-864. 37. Juby A (1999) Correlation between the Folstein Mini-Mental State Examination and three methods of clock drawing scoring. J Geriatr Psychiatry Neurol. 12(2):87-91. 65 38. Kaplan EF,Goodglass H, Weintraub S (1978) The Boston Naming Test. Boston, MA, Veterans Administration Medical Center 39. Kerkhoff G (2003) Störungen der visuellen Raumorientierung. In: Karnath HO, Thier P (Hrsg.) Neuropsychologie. Berlin Heidelberg 40. Kerkhoff G, Heldmann B (1997) Effizienz visuell-räumlicher und visueller NeglectTherapie: eine Cross-Over-Studie mit 13 Patienten. Z Neuropsychol 8:44-61 41. Kirby M, Denihan A, Bruce I, Coakley D, Lawlor BA (2001) The clock drawing test in primary care: sensitivity in dementia detection and specificity against normal and depresed elderly. Int J Geriatr Psychiatry 16:935-940 42. Kitabayashi Y, Ueda H, Narumoto J, Nakamura K, Kita H, Fukui K (2001) Qualitative analyses of clock drawings in Alzheimer's disease and vascular dementia. Psychiatry Clin Neurosci. 55(5):485-491 43. Lam LC, Chiu HF, Ng KO, Chan C, Chan WF, Li SW, Wong M (1998) Clock-face drawing, reading and setting tests in the screening of dementia in Chinese elderly adults. J Gerontol B Psychol Sci Soc Sci 53(6):353-357 44. Lee H, Swanwick GR, Coen RF, Lawlor BA (1996) Use of the clock drawing task in the diagnosis of mild and very mild Alzheimer's disease. Int Psychogeriatr. 8(3):469-476 45. Lee H, Lawlor BA (1995) State-Dependent Nature of the clock drawing test in Geriatric Depression J Am Geriatr Soc 43: 796-798 46. Lezak MD (1995) Neuropsychological Assessment. 3rd Edition Oxford University Press, New York 47. Lieberman D, Galinsky D, Fried V, Grinshpun Y, Mytlis N, Tylis R, Lieberman D (1999) Factors affecting the results of the clock drawing test in elderly patients hospitalized for physical rehabilitation. Int J Geriatr Psychiatry 14(5):325-330 48. Manos PJ, Wu R (1994) The ten point clock test: a quick screen and grading method for cognitive impairment in medical and surgical patients. Int J Psychiatry Med. 24(3):229-244 49. McKeith IG, Galasko D, Kosaka K, Perry EK, Dickson DW, Hansen LA, Salmon DP, Lowe J, Mirra SS, Byrne EJ, Lennox G, Quinn NP, Edwardson JA, Ince PG, Bergeron C, Burns A, Miller BL, Lovestone S, Collerton D, Jansen ENH, Ballard C, de Vos RAI, Wilcock GK, Jellinger KA, Perry RH (1996) Consensus guidelines for the clinical and pathologic diagnosis of dementia with Lewy bodies (DLB): Report of the consortium on DLB international workshop. Neurology. 47(5):1113-1124 66 50. Mendez MF, Ala T, Underwood KL (1992) Development of scoring criteria for the clock drawing task in Alzheimer's disease. J Am Geriatr Soc . 40(11):1095-1099 51. Morris JC, Heyman A, Mohs RC, Hughes JP, van Belle G, Fillenbaum G, Mellits ED, Clark C (1989) The Consortium to Establish a Registry for Alzheimer's Disease (CERAD). Part I. Clinical and neuropsychological assessment of Alzheimer's disease. Neurology. 39(9):1159-1165 52. Newberg A, Cotter A, Udeshi M, Brinkman F, Glosser G, Alavi A, Clark C (2003) Brain metabolism in the cerebellum and visual cortex correlates with neuropsychological testing in patients with Alzheimer's disease. Nucl Med Commun. 24(7):785-790 53. O'Rourke N, Tuokko H, Hayden S, Beattie BL (1997) Early identification of dementia: Predictive validity of the Clock Test. Arch Clin Neuropsychol 12(3):257267. 54. Osterrieth PA (1944) Le test de copie d’une figure complexe: Contribution à l’étude de la perception et de la mémoire. Archives de Psychologie 30:206-353 55. Paganini-Hill A, Clark LJ, Henderson VW, Birge SJ (2001) Clock drawing: analysis in a retirement community. J Am Geriatr Soc49(7):941-947. 56. Ploenes C, Sharp S, Martin M (1994) Der Uhrentest: Das Zeichnen einer Uhr zur Erfassung kognitiver Störungen bei geriatrischen Patienten. Z Gerontol 27(4):246252 57. Powlishta KK, von Dras DD, Stanford A, Carr DB, Tsering C, Miller JP, Morris JC (2002) The clock drawing test is a poor screen for very mild dementia. Neurology 59:989-903 58. Rascovsky K, Salmon DP, Ho GJ, Galasko D, Peavy GM, Hansen LA, Thal LJ (2002) Cognitive profiles differ in autopsy-confirmed frontotemporal dementia and AD. Neurology 58(12):1801-1808 59. Rey A (1941 ) L’examen psychologique dans les cas d’encéphalopathie traumatique Archives de Psychologie 28:286-340 60. Richardson HE, Glass JN (2002) A comparison of scoring protocols on the Clock Drawing Test in relation to ease of use, diagnostic group, and correlations with Mini-Mental State Examination. J Am Geriatr Soc. 50(1):169-173 61. Román GC (2002) Defining dementia: clinical criteria for the diagnosis of vascular dementia. Acta Neurol Scand 106(Suppl.178):6-9 67 62. Rosen WG, Mohs RC, Davis KL (1984) A New Rating Scale for Alzheimer’s Disease. Am J Psychiatry 141:1356-1364 63. Rouleau I, Salmon DP, Butters N (1996) Longitudinal analysis of clock drawing in Alzheimer's disease patients. Brain Cogn. 31(1):17-34 64. Royall DR, Cordes JA, Polk M (1998) CLOX: an executive clock drawing task. J Neurol Neurosurg Psychiatry 64:588-594 65. Royall DR, Mulroy AR, Chiodo LK, Polk MJ (1999) Clock drawing is sensitive to executive control: a comparison of six methods. J Gerontol B Psychol Sci Soc Sci 54(5):328-333 66. Salmon DP, Lange KL (2001) Cognitive screening and neuropsychological assessment in early Alzheimer's disease. Clin Geriatr Med 17(2):229-254 67. Scanlan JM, Brush M, Quijano C, Borson S (2002) Comparing clock tests for dementia screening: naive judgments vs formal systems-what is optimal? Int J Geriatr Psychiatry 17(1):14-21 68. Schmidtke K, Hüll M (2002) Neuropsychological differentiation of small vessel disease, Alzheimer's disease and mixed dementia. J Neurol Sci.203-204:17-22. 69. Schmidtke K, Hüll M, Talazko J. Posterior Cortical Atrophy: Variant of Alzheimer`s Disease? J Neurol (im Druck). 70. Schramm U, Berger G, Muller R, Kratzsch T, Peters J, Frolich L (2002) Psychometric properties of Clock Drawing Test and MMSE or Short Performance Test(SKT) in dementia screening in a memory clinic population. Int J Geriatr Psychiatry. 17(3):254-260 71. Seigerschmidt E, Mosch E, Siemen M, Forstl H, Bickel H (2002) The clock drawing test and questionable dementia: reliability and validity. Int J Geriatr Psychiatry. 17(11):1048-1054 72. Shulman KI (2000) Clock-drawing: is it the ideal cognitive screening test? Int J Geriatr Psychiatry 15:548-561 73. Shulman KI, Gold DP et al. (1993) Clock-Drawing and dementia in the community: a longitudinal study. Int J Geriatr Psychiatry 8:487-496 74. Shulman KI, Shedletsky R, Silver IL (1986) The challenge of time: Clock-drawing and cognitive function in the elderly. Int J Geriatr Psychiatry 1:135-140 75. Storey JE, Rowland JTJ, Basic D, Conforti DA (2002) Accuracy of the CDT for Detecting Dementia in a Multicultural Sample of Elderly Australian Patients. Int Psychogeriatr 14:259-271 68 76. Storey JE, Rowland JT, Basic D, Conforti DA (2001) A comparison of five clock scoring methods using ROC (receiver operating characteristic) curve analysis. Int J Geriatr Psychiatry 16(4):394-399 77. Sunderland T, Hill JL, Mellow AM, Lawlor BA, Gundersheimer J, Newhouse PA, Grafman JH (1989) Clock drawing in Alzheimer's disease. A novel measure of dementia severity. J Am Geriatr Soc37(8):725-729 78. Swihart AA, Pirozzolo FJ (1998) The Neuropsychology of Aging and Dementia: Clinical Issues In: Whitaker HA Neuropsychological studies of nonfocal brain damage New York, Heidelberg 79. Tewes U (Hrsg.) (1991) HAWIE-R – Hamburg-Wechsler-Intelligenztest für Erwachsene, Revision; Handbuch und Testanweisung. Huber, Bern, Göttingen, Toronto, Seattle 80. Tuokko H, Hadjistavropoulos T, Miller JA, Beattie BL (1992) The Clock Test: A Sensitive Measure To Differentiate Normal Elderly from Those with Alzheimer Disease J Am Geriatr Soc 40:579-584 81. Tupler LA, Welsh KA, Asare-Aboagye Y, Dawson DV (1995) Reliability of the Rey-Osterrieth Complex Figure in use with memory-impaired patients. J Clin Exp Neuropsychol 17(4):566-579 82. Ueda H, Kitabayashi Y, Narumoto J, Nakamura K, Kita H, Kishikawa Y, Fukui K (2002) Relationship between clock drawing test performance and regional cerebral blood flow in Alzheimer's disease: a single photon emission computed tomography study. Psychiatry Clin Neurosci 56(1):25-29 83. Wahlin TBR, Baeckman L, Wahlin A (1993) Visuospatial functioning and spatial orientation in a community-based sample of healthy very old persons. Arch Gerontol Geriatr 17(3):165-177 84. Watson YI, Arfken CL, Birge SJ (1993) Clock Completion: An Objective Screening Test for Dementia. J Am Geriatr Soc 41:1235-1240 85. Welsh K, Butters N, Hughes J, Mohs R, Heyman A (1991 )Detection of abnormal memory decline in mild cases of Alzheimer's disease using CERAD neuropsychological measures. Arch Neurol 48(3):278-281 86. Welsh KA, Butters N, Hughes JP, Mohs RC, Heyman A (1992) Detection and staging of dementia in Alzheimer's disease. Use of the neuropsychological measures developed for the Consortium to Establish a Registry for Alzheimer's Disease. Arch Neurol 49(5):448-452 69 87. Welsh KA, Butters N, Mohs RC, Beekly D, Edland S, Fillenbaum G, Heyman A (1994) The Consortium to Establish a Registry for Alzheimer's Disease (CERAD). Part V. A normative study of the neuropsychological battery. Neurology. 44(4):609614 88. Wilcock GK (2002) Neuropsychological and Instrumental Diagnosis of Dementia in a Clinical Context. Kommentar zu: Alkvist O. Neuropsychological and Instrumental Diagnosis of Dementia: a Review. In: Maj M, Sartorius N Dementia 2nd Edition Wiley, Chichester pp.184-187 89. Wolf-Klein GP, Silverstone FA, Levy AP, Brod MS (1989) Screening for Alzheimer's disease by clock drawing. J Am Geriatr Soc . 37(8):730-734 70 7. Anhang 7.1. Uhrenlesetest 7.2. Uhrentest 71 Der Uhrentest (verkleinert) mit zugehörigem Bewertungsschema 72 7.3. Rey-Figur Auswertung der Rey-Figur nach Lezak (1995) Einheiten: 1. Kreuz obere linke Ecke, außerhalb des Rechtecks 2. großes Rechteck 3. diagonales Kreuz 4. horizontale Mittellinie von 2. 5. vertikale Mittellinie 6. kleines Rechteck, links innerhalb v. 2. 7. kleines Segment oberhalb v. 6. 8. vier parallele Linien oben links innerhalb v. 2. 9. Dreieck rechts oberhalb v. 2. 10. kleine vertikale Linie innerhalb v. 2., unterhalb v. 9. 11. Kreis mit drei Punkten innerhalb v. 2. 12. fünf parallele Linien innerhalb v. 2., die 3. überkreuzen 13. Seiten eines Dreiecks rechts an 2. anschließend 14. Raute an 13. anschließend 15. vertikale Linie innerhalb Dreieck 13. parallel zur rechten vertikale von 2. 16. horizontale linie innerhalb von 13., die 4. nach rechts verlängert 17. Kreuz, das unterhalb von 2. an 5. anschließt 18. Quadrat, das links unten an 2. anschließt Punktverteilung: Jede der 18 Einheiten muß unabhängig berücksichtigt werden. Die Genauigkeit jeder Einheit und ihre relative Position im Gesamtbild wird bewertet. Jede Einheit wird folgendermaßen gezählt: korrekt richtig plaziert korrekt falsch plaziert verzerrt oder unvollständig richtig aber wiedererkennbar plaziert verzerrt oder unvollständig falsch aber wiedererkennbar plaziert nicht vorhanden oder nicht wiedererkennbar Maximum durchschnittlicher Wert für Erwachsene 2 P. 1 P. 1 P.t ½ P. 0 P. 36 P. 32 P. 73 7.4. CERAD-Figurenzeichnen