Studienprotokoll
Werbung

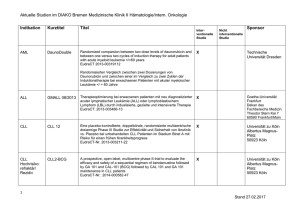
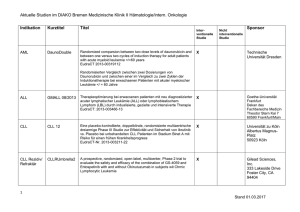
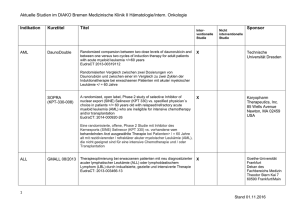
Studienprotokoll Titel DCLLSG-CLL10: Phase III Studie der kombinierten Immunchemotherapie mit Fludarabin, Cyclophosphamid und Rituximab (FCR) versus Bendamustine und Rituximab (BR) bei Patienten mit vorher unbehandelter Chronisch Lymphatischer Leukämie (CLL) Kriterien • Geischerte Diagnose einer CLL: o Binet-Stadium A, Erkrankung erfordert Behandlung o Schwere B-Symptome (z.B., Nachtschweiß, Gewichtsverlust ≥ 10% innerhalb der letzten 6 Monate, Fieber > 38 ° C für ≥ 2 Wochen ohne Anzeichen einer Infektion) o Binet-Stadium B, Erkrankung erfordert Behandlung o B-Symptome (z.B., Nachtschweiß, Gewichtsverlust ≥ 10% innerhalb der letzten 6 Monate, Fieber > 38 ° C für ≥ 2 Wochen ohne Anzeichen einer Infektion) o Progressive Lymphozytose (Anstieg von > 50% innerhalb von 2 Monaten oder Verdoppelung der peripheren Lymphozyten innerhalb von < 6 Monaten) o progressives Knochenmarksversagen (Anämie, Thrombozytopenie) o Massive, progressive oder schmerzhafte Splenomegalie oder Hypersplenismus o Lymphknoten-Cluster (> 10 cm im Durchmesser) sowie progressive oder symptomatische Lymphadenopathie o Binet-Stadium C • Keine 17p-Deletion (FISH) • WHO-Performance-Status 0-2 • Lebenserwartung > 6 Monate • Gesamt-Bilirubin ≤ 2-fache des oberen Normwertes (ULN) • AST-und ALT ≤ 2-facher ULN • Kreatinin-Clearance ≥ 70 ml / min • Schwangerschaft oder Laktation • Patienten im fortpflanzungsfähigen Alter müssen eine zuverlässige Empfängnisverhütung während der Anwendung und für ≥ 6 Monate nach Abschluss der Therapie gewährleisten • Hepatitis-B und –C negativ, HIV-negativ, keine aktive bakterielle, virale oder Pilzinfektion • CIRS ≤ 6 • Keine laufende Behandlung eines weiteren Tumors (Karzinom oder Tumoren, die durch eine Operation behandelt werden) • Keine Unverträglichkeit gegenüber monoklonalen Antikörpern oder dem Studienmedikament • Keine Krankheit, die eine längere Anwendung von oralen Kortikosteroiden (> 1 Monat) erfordert • Keine geistige Beeinträchtigung oder Rechtsunfähigkeit • Kein Umstand, der den Abschluss der Studie oder das erforderliche Follow-up gefährdet • Keine vorherige Chemotherapie, Strahlentherapie und / oder Immuntherapie o • Prednisolon unmittelbar vor Beginn der Studie Keine gleichzeitige Teilnahme an einer anderen klinischen Studie Orphanet Database. Clinical trial 2009 http://www.orpha.net/data/eth/DE/ID68563DE.pdf Vorgesehene Behandlung Arm I: Experimental Patients receive fludarabine phosphate IV and cyclophosphamide IV on days 1-3. Patients also receive rituximab IV on day 0 of course 1 and on day 1 of courses 2-6. Treatment repeats every 28 days for 6 courses in the absence of disease progression or unacceptable toxicity. Biological: rituximab, Given IV Drug: cyclophosphamide, Given IV Drug: fludarabine phosphate, Given IV Arm II: Experimental Patients receive bendamustine hydrochloride IV on days 1 and 2. Patients also receive rituximab as in arm I. Treatment repeats every 28 days for 6 courses in the absence of disease progression or unacceptable toxicity. Biological: rituximab, Given IV Drug: bendamustine hydrochloride, Given IV Angestrebte Patientenzahl 550 Patienten Beginn der Studie September 2008 Voraussichtliches Studienende Januar 2018 Studienphase Phase III Studiendesign Randomisierte, offene Therapiestudie Orphanet Database. Clinical trial 2009 http://www.orpha.net/data/eth/DE/ID68563DE.pdf