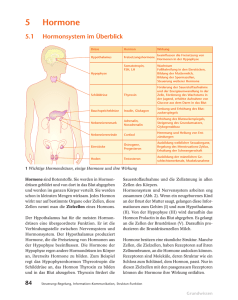
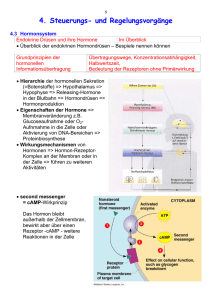
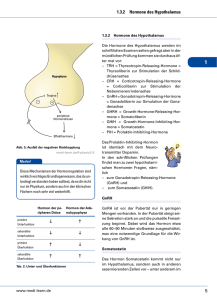
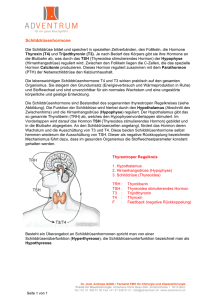
1 Endokrinologie und Stoffwechsel
Werbung
1.1 Einführung in die Endokrinologie – 2 1.2 Erkrankungen des Hypothalamus und der Hypophyse – 5 1.3 Erkrankungen der Schilddrüse – 19 1.4 Erkrankungen der Nebenniere – 43 1.5 Endokrin aktive Tumoren des Gastrointestinaltraktes – 61 1.6 Hypogonadismus des Mannes und Gynäkomastie – 70 1.7 Calcium- und Phosphatstoffwechsel – 74 1.8 Diabetes mellitus – 90 1.9 Porphyrie – 116 1.10 Metabolisches Syndrom, Adipositas, Hyperurikämie und Fettstoffwechselstörungen – 121 Aus H. Lehnert, K. Werdan: Innere Medizin – essentials (ISBN 3-13-117294-0) © Georg Thieme Verlag Stuttgart 2006 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 1 Endokrinologie und Stoffwechsel 1 1.1 Endokrinologie und Stoffwechsel Einführung in die Endokrinologie 111111111111111111111111111111111 C. Schulz, H. Lehnert Gegenstand der Endokrinologie ist die Synthese, Sekretion und Wirkung von Hormonen zur Aufrechterhaltung der Homöostase und Adaptation an sich verändernde innere und äußere Bedingungen. Klassische endokrine Zellen sezernieren ein Hormon in ein Blutgefäß, über das es zu seinem Wirkort transportiert wird (Beispiel: Sekretion von LH aus der Hypophyse und Wirkung an Testes oder Ovar). Eine parakrine Wirkung bezieht sich auf die Interaktion benachbarter Zellen, eine autokrine auf die einer sezernierten Substanz mit der Zelle, in der sie gebildet wurde. Neuroendokrine Zellen sezernieren Hormone (z. B. Noradrenalin) aus Nervenendigungen in ein Blutgefäß mit einer hieraus resultierenden endokrinen Wirkung. Bildungsorte von Hormonen sind dabei sowohl klassische endokrine Organe (z. B. Hypophyse, Schilddrüse, Nebennieren, Hoden), wie nahezu jedes andere Organ des menschlichen Körpers auch (z. B. Herz, Niere, Magen, Haut). Eine Übersicht hierzu gibt die Tabelle 1.1. Aus biochemischer Sicht können drei Arten von Hormonen unterschieden werden: § Peptidhormone, § Steroidhormone, § biogene Amine. Nicht berücksichtigt sind bei dieser Einordnung die Schilddrüsenhormone T4 und T3, die als Tyrosin-Derivate (nicht Metabolite!) aus der Verbindung von zwei Tyrosinmolekülen entstehen. Die Synthese von Peptidhormonen beginnt mit der Transkription der in der DNA enthaltenen genetischen Informationen. Auf beiden Seiten des kodierenden Genabschnitts befinden sich regulatorische Sequenzen, die letztlich für die Transkription verantwortlich sind. Upstream, am 5‘-Ende des kodierenden Genabschnitts, liegt die Promotorregion, die die Bindung der RNA-Polymerase steuert. Zahlreiche Transkriptionsfaktoren (Enhancer) befinden sich in der Nachbarschaft dieses Genabschnitts und kontrollieren den Zeitpunkt der Transkription und häufig auch die Gewebespezifität der Genexpression. Ein Beispiel für einen solchen Transkriptionsfaktor sind hormonresponsive Elemente (HRE). Als Folge der Gentranskription entsteht zunächst heteronukleäre RNA, die im Zellkern durch RNA-Prozessierung zu reifer m-RNA wird. Nach dem Transport in das Zytoplasma erfolgt im endoplasmatischen Retikulum die Translation zum Pro-Hormon. Durch die Einwirkung von Peptidasen (bzw. N-Glykosylierung bei Glykoproteinen) und die anschließende weitere post-translationale Prozessierung entsteht im Golgi-Apparat das zellspezifische Hormon. Aus dem Golgi-Apparat erfolgt der Transport in sekretorische Vesikel, die mit der Zellmembran fusionieren können und so nach Einfluss bestimmter Stimuli (z. B. Ca++) zur Freisetzung des Hormons führen (Exozytose). Diese Vorgänge sind in Abb. 1.1 dargestellt. Steroidhormone entstehen dagegen intrazellulär in einer Reihe von enzymatischen Schritten aus Cholesterol, der Ausgangssubstanz für die Steroidbiosynthese. Nach seinem Transport in die Mitochondrien entsteht dort Pregnenolon und hieraus das zellspezifische Steroidhormon. Die weiteren Schritte sind im Kapitel „Nebenniere“ dargestellt. Sowohl Peptid- wie Steroidhormone zirkulieren im Blut gebunden an Bindungsproteine. Dabei befinden sich gebundenes und biologisch aktives, freies Hormon in einem Bindungsgleichgewicht. Situationen, die zu einer Veränderung der Konzentration der gebundenen Hormone führen (z. B. Erhöhung durch Schwangerschaft oder Einnahme von Kontrazeptiva, Erniedrigung durch Hypalbuminämie) bewirken keine Veränderung der Hormonaktivität und -wirkung, da die Menge freien Hormons im Wesentlichen konstant bleibt. Biogene Amine sind Metabolite essenzieller Aminosäuren und besitzen eine duale Bedeutung als lokal wirkende Neurotransmitter des zentralen und peripheren Nervensystems auf der einen und als systemisch wirkendes Hormon auf der anderen Seite. Die wichtigsten Beispiele hierfür sind die Katecholamine, die über das geschwindigkeitsbestimmende Enzym Tyrosinhydroxylase aus Tyrosin entstehen (s. Kapitel „Nebenniere“), und Serotonin, das durch Hydroxylierung und anschließende Decarboxylierung aus Tryptophan entsteht. Abhängig von der Enzymkinetik beeinflusst eine veränderte Verfüg- 2 Aus H. Lehnert, K. Werdan: Innere Medizin – essentials (ISBN 3-13-117294-0) © Georg Thieme Verlag Stuttgart 2006 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 1 1.1 Einführung in die Endokrinologie „Drüse“ Hormon Art des Hormons Hypothalamus Thyreotropin-releasing-Hormon (TRH) Corticotropin-releasing-Faktor (CRF) Gonadotropin-releasing-Hormon (GnRH, LHRH) Wachstumshormon-releasing-Hormon (GHRH) Somatostatin Peptidhormone Dopamin (= prolaktininhibierender Faktor) Biogenes Amin Hypophyse (Vorderlappen) Thyreoideastimulierendes Hormon (TSH) Luteinisierungshormon (LH) Follikelstimulierendes Hormon (FSH) Wachstumshormon Adrenokortikotropes Hormon (ACTH) Prolaktin Peptidhormone Hypophyse (Hinterlappen) Vasopressin (= ADH) Oxytocin Peptidhormone Schilddrüse Thyroxin (T4) Trijodthyronin (T3) Tyrosin-Derivate Calcitonin Peptidhormon Nebenschilddrüse Parathormon Peptidhormon Nebennierenrinde Aldosteron Cortisol Dehydroepiandrosteronsulfat (DHEAS) Testosteron Steroidhormone Nebennierenmark Dopamin Noradrenalin Adrenalin Katecholamine (Biogene Amine) Ovarien Hoden Östrogen Progesteron Testosteron Steroidhormone Endokrines Pankreas Insulin Glukagon Somatostatin Peptidhormone Magen Gastrin Ghrelin Peptidhormone Duodenum Jejunum Sekretin Cholecystokinin Peptidhormone Serotonin Biogenes Amin Leptin Peptidhormon Fettgewebe Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tabelle 1.1 Relevante endokrine Organsysteme und Hormone 3 Aus H. Lehnert, K. Werdan: Innere Medizin – essentials (ISBN 3-13-117294-0) © Georg Thieme Verlag Stuttgart 2006 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 1 Endokrinologie und Stoffwechsel TATA Gen (DNA) Exon Intron Exon Intron 5'-Ende Exon Intron 3'-Ende Promotorregion nicht kodierend m-RNA 5'-Ende Start Nukleus Transkription zu heteronukleärer (hn) RNA und posttranskriptionale Prozessierung nicht kodierende Sequenz kodierend Zytoplasma AAAAA Ribosomen 3'-Ende Stop Translation Met Pro-Hormon Signalsequenz Stop post-translationale Prozessierung Hormon Vesikel Sekretion Abb. 1.1 Synthese von Peptidhormonen. barkeit dieser Aminosäuren auch die Bildung und Freisetzung ihrer Hormonmetabolite. Die Wirkung von Hormonen auf ihre Zielzellen wird über Rezeptoren ausgeübt, die im Wesentlichen in membranständige und zytoplasmatische oder nukleäre eingeteilt werden können. Aufgrund ihrer hydrophilen Struktur sind Peptidhormone (z. B. die Hypophysenhormone) nicht in der Lage, die Zellmembran zu durchqueren (daher hier: membranständige Rezeptoren), während die lipophilen Steroid- und Schilddrüsenhormone hierzu in der Lage sind und an zytoplasmatische bzw. nukleäre Rezeptoren binden. Die Gruppe der membranständigen Rezeptoren wird grundsätzlich unterteilt in Rezeptoren mit sieben transmembranösen Schleifen und solche mit nur einem transmembranösen Abschnitt. Liganden der ersten Gruppe sind z. B. die Hypophysenhormone LH, FSH, TSH oder ACTH, hypothalamische Releasing-Hormone oder auch biogene Amine (Neurotransmitter) wie z. B. Adrenalin, Serotonin oder Acetylcholin. Diese Rezeptoren sind an ein anderes Membranprotein, G-Protein, gekoppelt. Dies kann ein die Adenylatzyklase aktivierendes (Gs) oder inhibierendes (Gi) oder ein Phospholipase C aktivierendes (Gq) G-Protein sein, das dann durch eine Beeinflussung der intrazellulären Signaltransduktion über Second-messenger-Systeme zur Zellantwort führt (Abb. 1.2). Veränderungen in der Bildung von G-Proteinen können zu typischen endokrinen Krankheitsbildern führen; Zellmutationen mit Bildung von stimulatorischem G-Protein liegen zahlreichen Fällen von Akromegalie zugrunde, eine verminderte Bildung z. B. dem Pseudohypoparathyreoidismus. Rezeptoren mit einem transmembranösen Segment sind dagegen nicht G-Protein-gekoppelt und lassen sich in solche mit und ohne intrinsische Aktivität einteilen. Intrinsische Aktivität besitzen beispielsweise die Rezeptoren für Insulin oder auch Insulin-like growth factor (IGF-I), die als Tyrosinkinase eine Autophosphorylierung und damit eine Aktivierung der Signaltransduktion bewirken können. Hormone wie Wachstumshormon oder Prolaktin wirken ebenfalls über Rezeptoren mit einem transmembranösen Segment, sie gehören jedoch einer Multisubunit-Rezeptor-Familie an und besitzen keine intrinsische Tyrosinkinase-Aktivität. Steroidhormone dagegen wirken über intrazellulär gelegene Rezeptoren, die durch diese Bindung aktiviert werden und hierdurch wiederum die Bindung an bestimmte DNA-Abschnitte (HRE, s.o.) ermöglichen. Daher gelten diese Rezeptoren auch als Transkriptionsfaktoren, bei denen Mutationen typischerweise zu Hormonresistenz-Syndromen führen können. Eines der wesentlichen Prinzipien endokriner Regulation ist die Feed-back-Kontrolle der Hor- 4 Aus H. Lehnert, K. Werdan: Innere Medizin – essentials (ISBN 3-13-117294-0) © Georg Thieme Verlag Stuttgart 2006 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Golgi-Apparat 1.2 Erkrankungen des Hypothalamus und der Hypophyse NH2 Plasma Zellmembran Zytoplasma Hormon + Rezeptor COOH Abb. 1.2 Wirkung von Hormonen über Rezeptoren mit sieben transmembranösen Schleifen (oben rechts). Abkürzungen für G-Protein s. Text, DAG: Diacylglycerol, IP3: Inositoltriphosphat. Aktivierung von G-Protein Gs; Gi; Gq cAMP / Aktivierung von Phospholipase C Ca++, DAG, IP3 monsekretion. Der wichtigste Kontrollmechanismus hierbei ist das negative feed-back. Typisches Beispiel ist die Steuerung der Sekretion hypophysärer Hormone durch die Hormone ihrer Zielorgane (z. B. Nebenniere o Hypophyse) im Sinne eines long feed-back. Der Begriff ultra-long feed-back bezieht sich auf die Kontrolle hypothalamischer durch periphere Hormone (z. B. Cortisol o CRF), der Begriff short feed-back auf die Kontrolle hypothalamischer durch hypophysäre Hormone (z. B. ACTH o CRF). Durch diese Mechanismen wird unter Ruhebedingungen und in nicht pathologischen Zuständen die endokrine Homöostase gewährleistet. Positive Feed-back-Mechanismen sind dagegen seltener; ein Beispiel ist die präovulatorische Freisetzung von LH als Folge eines Östrogenanstieges. Diese Feed-back-Kontrolle ist damit auch für die Rhythmik der Hormonsekretion verantwortlich; diese Rhythmik kann sehr unterschiedlich sein und bewegt sich beispielsweise von ultradianen Rhythmen (z. B. 90-Minuten-Perioden der Gonadotropin-Sekretion), zirkadianen Rhythmen (z. B. täglicher Rhythmus der Cortisolsekretion) bis hin zu monatlichen (Reproduktion) und jährlichen Rhythmen. Die wesentliche methodische Basis zur Beschreibung dieser physiologischen Prinzipien und der endokrinen Krankheitsbilder ist eine zuverlässige Hormonanalytik. Hormone werden i.d.R. durch Immunoassays gemessen, die auf der Reaktion zwischen Antikörper und Antigen (Hormon) beruhen. Diese Assays können radioaktiv sein (RIA: Radioimmunoassay, IRMA: immunoradiometrischer Assay) oder aber, wie dies in zunehmendem Maß geschieht, auch nichtradioaktiv (Beispiel: Lumineszenzassay). Bioassays, die die biologische Aktivität eines Hormons mit der einer Referenzpräparation vergleichen, sind im Wesentlichen experimentel- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Aktivierung oder Inhibierung von Adenylatzyklase len Fragestellungen vorbehalten. Unverändert haben Rezeptorassays eine große klinische Bedeutung, z. B. in der Charakterisierung der Rezeptordichte hormonabhängiger Tumoren. Schließlich sind molekulargenetische Techniken von größter Bedeutung bei der Diagnostik endokriner Erkrankungen. Die spezielle klinische Anwendung wird bei den einzelnen Krankheitsbildern besprochen. Tab. 1.2 gibt einen Überblick. 1.2 Erkrankungen des Hypothalamus und der Hypophyse 1111 J. Hensen, H. Lehnert 1.2.1 Grundlagen Raumfordernde Prozesse im Hypothalamus Dem Hypothalamus kommt eine zentrale Stellung in der endokrinen Regulation zu. Er setzt die so genannten „releasing“- und „release“inhibierenden Hormone frei, die auf den Hypophysenvorderlappen über das portalvenöse Gefäßsystem wirken. Er ist an der Regulation des Wasser- und Elektrolythaushaltes, an der zirkadianen Rhythmik, aber auch an der Regulation von Körpertemperatur, Appetit und Nahrungsaufnahme wesentlich beteiligt. Störungen und Tumoren im Bereich des Hypothalamus (Tab. 1.3) können eine Pubertas praecox durch gesteigerte Gonadotropinsekretion oder auch durch Sekretion von E-HCG bei Germinomen bewirken. Daneben können Störungen der kalorischen Balance ein so genanntes „dienzephalisches Syndrom“ verursachen (extreme Abmagerung, Hyperkinesie, Blässe). Auf der anderen Seite kann auch eine Adipositas auftreten, z. B. die Dystrophia adiposogeni- 5 Aus H. Lehnert, K. Werdan: Innere Medizin – essentials (ISBN 3-13-117294-0) © Georg Thieme Verlag Stuttgart 2006 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden!