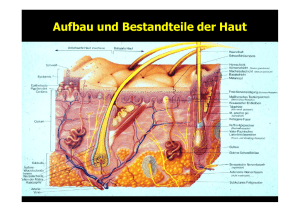
MMP-1 Expression in Melanomen von Schimmeln
Werbung

1 Aus dem Department für der Veterinärmedizinischen Universität Wien (Departmentsprecher: Univ.-Prof. Dr.med.vet. Florien Jenner Dipl.ACVS Dipl.ECVS) Fach: Pferdechirurgie „MMP-1 Expression in Melanomen von Schimmeln“ Diplomarbeit zur Erlangung des akademischen Grades Magistra medicinae veterinariae der Veterinärmedizinischen Universität Wien vorgelegt von Julia Andrea Eichberger Wien, im September 2013 2 Betreuerin Dipl.-Ing. Dr. Sabine Brandt Klinik für Pferde, Pferdechirurgie, Forschungsgruppe Onkologie 1. Gutachterin Dipl.-Ing. Dr. Sabine Brandt Klinik für Pferde, Pferdechirurgie, Forschungsgruppe Onkologie 2. Gutachterin Ao.Univ.-Prof. Dr.med.vet. Miriam Kleiter Dipl.ACVR-RO Dipl.ECVIM-CA (Oncol) Klinik für Interne Medizin Kleintiere, Onkologie 3 DANKSAGUNG Ohne die professionelle Unterstützung folgender Personen wäre das Erstellen dieser Diplomarbeit nicht möglich gewesen: Zu Beginn möchte ich mich bei meiner Betreuerin Dipl.-Ing. Dr. Sabine Brandt, die mir im Rahmen meiner Arbeit immer beratend zur Seite stand, und Ihrem Team für die herzliche Aufnahme in die Forschungsgruppe Onkologie bedanken. Des Weiteren möchte ich mich bei Mag. rer. nat. Dr. rer. nat. Barbara Pratscher bedanken, die mir das wissenschaftliche Arbeiten näher brachte und einen Einblick in die Forschung ermöglichte. Sie stand mir immer mit Rat und Tat zur Seite, motivierte mich bei so mancher Durststrecke und bewies Ihre schier endlose Geduld bei der Korrektur meiner Arbeit. Außerdem ein großes Dankeschön an alle weiteren Laborkollegen und Laborkolleginnen für deren Hilfe, das angenehme Arbeitsklima und die schönen Stunden. Auf privater Seite möchte ich mich bei meinen Eltern bedanken, für Ihre unentwegte Unterstützung und Liebe, die sie mir stets entgegen gebracht haben. 4 INHALTSVERZEICHNIS ABKÜRZUNGSVERZEICHNIS ......................................................................................................................... 6 1 2 EINLEITUNG & FRAGESTELLUNG ..................................................................................................... 8 1.1 DAS MELANOM ..................................................................................................................................... 8 1.2 MATRIX – METALLOPROTEINASEN EXPRESSION IM TUMOR ................................................................. 8 1.3 FRAGESTELLUNG .................................................................................................................................. 9 LITERATURÜBERSICHT ...................................................................................................................... 10 2.1 MELANOZYTÄRE TUMOREN ................................................................................................................ 10 2.2 DAS EQUINE MELANOM ...................................................................................................................... 11 2.2.1 Epidemiologie ................................................................................................................................. 11 2.2.2 Dispositionen .................................................................................................................................. 11 2.2.3 Pathologische Einteilung ................................................................................................................ 13 2.2.4 Dignität ........................................................................................................................................... 15 2.2.5 Klinik............................................................................................................................................... 16 2.2.6 Metastasierung................................................................................................................................ 17 2.2.7 Äthiologie und Pathogenese............................................................................................................ 17 2.2.8 Diagnostik....................................................................................................................................... 18 2.2.9 Therapie .......................................................................................................................................... 19 2.2.10 Prognose ......................................................................................................................................... 23 2.3 2.3.1 Einteilung........................................................................................................................................ 24 2.3.2 Struktureller Aufbau........................................................................................................................ 25 2.3.3 Regulation....................................................................................................................................... 26 2.3.4 Funktionen ...................................................................................................................................... 28 2.3.5 MMPs im Melanom......................................................................................................................... 28 2.4 3 MATRIX – METALLOPROTEINASEN ..................................................................................................... 24 MATRIX – METALLOPROTEINASE – 1 .................................................................................................. 30 2.4.1 Funktion .......................................................................................................................................... 30 2.4.2 Hochregulierung im Tumor ............................................................................................................ 30 MATERIAL & METHODEN................................................................................................................... 33 3.1 ETHISCHE GENEHMIGUNG ................................................................................................................... 33 3.2 MATERIAL........................................................................................................................................... 34 3.3 PATIENTEN .......................................................................................................................................... 35 3.4 METHODE ........................................................................................................................................... 44 3.4.1 RNA–Isolierung .............................................................................................................................. 44 5 4 3.4.2 DNase-Verdau ................................................................................................................................ 44 3.4.3 Clean up.......................................................................................................................................... 45 3.4.4 RNA – Konzentrationsbestimmung und Überprüfung der Reinheit ................................................ 46 3.4.5 Reverse Transkription / cDNA Synthese ......................................................................................... 47 3.4.6 9DOLGLHUXQJGHUF'1$PLWWHOVȕ-Aktin PCR.................................................................................... 48 3.4.7 Primer Effizienz .............................................................................................................................. 50 3.4.8 qPCR............................................................................................................................................... 52 ERGEBNISSE............................................................................................................................................ 54 4.1 KONZENTRATION & QUALITÄT DER RNA........................................................................................... 54 4.2 Ǻ-AKTIN PCR...................................................................................................................................... 55 4.3 PRIMER EFFIZIENZ .............................................................................................................................. 56 4.4 QPCR .................................................................................................................................................. 60 4.4.1 Messergebnisse der Melanom-, Zellkultur- und Hautproben ......................................................... 60 4.4.2 Auswertung im Arithmetischen Mittelwertvergleich ....................................................................... 62 4.4.3 Relative Quantifizierung mittels kompaUDWLYHUǻǻ&T Methode....................................................... 63 4.5 ZUSAMMENFASSUNG DER ERGEBNISSE ............................................................................................... 64 5 DISKUSSION............................................................................................................................................. 65 6 ZUSAMMENFASSUNG ........................................................................................................................... 68 7 EXTENDED SUMMARY ......................................................................................................................... 69 8 LITERATURVERZEICHNIS.................................................................................................................. 70 9 ABBILDUNGS-, FORMEL- UND TABELLENVERZEICHNIS ......................................................... 76 9.1 ABBILDUNGSVERZEICHNIS .................................................................................................................. 76 9.2 FORMELVERZEICHNIS.......................................................................................................................... 77 9.3 TABELLENVERZEICHNIS ...................................................................................................................... 78 6 ABKÜRZUNGSVERZEICHNIS A.D. Aqua bidestillata ASIP Agouti signalisierendes Protein bp Basenpaare cDNA komplementäre Desoxyribonukleinsäure CT cycle threshold DMSO Dimethylsulfoxid DNA Desoxyribonukleinsäure dNTP Desoxyribonukleosidtriphosphate DOPA Dihydroxyphenylalanin DTT Dithiothreitol ECM Extrazelluläre Matrix EGF Epidermaler Wachstumsfaktor EtOH Ethanol FAM 6-Carboxy-Fluorescein NTC non template control MGB minor groove binder MgCl2 Magnesiumchlorid min. Minute(n) ml Milliliter mM Millimol MMP Matrix – Metalloproteinasen MMP-1 Matrix – Metalloproteinase – 1 mRNA messenger ribonucleic acid MT–MMP Membran – ständige Matrix - Metalloproteinase NFQ nicht fluoreszierender Quencher PCR Polymerasekettenreaktion PGDF Platelet-derived growth factor qPCR quantitative Real-Time-PCR 7 RECK reversion-inducing cysteine-rich protein with Kazal motifs RPS–13 Ribosomal Protein S-13 sec. Sekunde(n) TAE Tris-Acetat-EDTA UMM Universal Master Mix VEGF vascular endothelial growth factor VIC Fluoreszenzfarbstoff °C Grad Celsius μg Mikrogramm μl Mikroliter 8 1 EINLEITUNG & FRAGESTELLUNG 1.1 Das Melanom Melanome sind von Melanozyten ausgehende Tumoren (SELTENHAMMER, 2000; PSCHYREMBEL, 2012) und gehören in die Gruppe der Rundzelltumoren (MISCHKE, 2005). In der Humanmedizin werden Melanome, auch bekannt als „schwarzer Hautkrebs“, immer unter den malignen Neoplasien aufgelistet (SELTENHAMMER, 2000) und sind nicht nur in Österreich, wie die Statistik Austria in ihrer Publikation „Krebsinzidenz und Mortalitätsinziden“ bekanntgab, unter den am häufigsten diagnostizierten Hauttumoren verbucht (STATISITIK AUSTRIA, 2012), sondern auch die WHO verzeichnete eine weltweit steigende Inzidenz mit annähernd gleichbleibend hoher Letalität, welche in etwa 0,1% der globalen Mortalität entspricht (GIRICZ et al., 2010). Aber auch in der Veterinärmedizin sind Melanome weltweit bei den verschiedenen Tierarten zu finden. Nicht nur bei Säugetieren, wie z.B. dem Hund, der Katze, dem Schwein (MEUTEN, 2002) und dem Pferd, wurden Melanome unterschiedlicher Dignität beschrieben (SCOTT u. MILLER, 2003), auch bei anderen Wirbeltieren treten diese in Erscheinung, beispielsweise dem Zahnkarpfen Xiphophorus, der als ältestes Tiermodell für die Melanomentstehung beschrieben wird (HENGGE u. DUMMER, 2006). Der hohe Malignitätsgrad, die annähernd konstante Mortalitätsrate und die limitierten Therapiemöglichkeiten im fortgeschrittenen Stadium sind Einschränkungen, welche die Melanomforschung im human- als auch im veterinärmedizinischen Bereich vorantreiben. Es gibt zahlreiche wissenschaftliche Veröffentlichungen, die sich mit Melanomen und deren Therapien befassen, jedoch wenig Information zu prognostischen Biomarkern. 1.2 Matrix – Metalloproteinasen Expression im Tumor Die Karzinogenese und Metastasierung des Melanoms ist äußerst komplex und ein mehrstufiger Prozess (HOFMANN et al., 2005). Der Abbau der Basalmembran und der extrazellulären Matrix (ECM) durch Matrix-Metalloproteinasen (MMPs) spielen neben verschiedenen anderen proteolytischen Enzymen bei der Migration, Invasion und Metastasierung von kutanen Melanomen eine essenzielle Rolle (HOFMANN et al., 2000). 9 Eine Vielzahl von MMPs und ihrer Gewebsinhibitoren (TIMPs) werden von Melanomzellen exprimiert, welche die Invasion und das Wachstum des Tumors fördern (HOFMANN et al., 2000; BOURBOULIA u. STETLER-STEVENSON, 2010). 1.3 Fragestellung Grundlage für die vorliegende Diplomarbeit waren erste, noch nicht veröffentlichte Ergebnisse einer RNA-Sequenzierungsanalyse von Schimmelmelanome und makroskopisch unveränderter Haut. Durchgeführt wurde diese Studie von der Forschungsgruppe Onkologie der Pferdeklinik der Veterinärmedizinischen Universität Wien unter der Leitung von Dipl.-Ing. Dr. Sabine Brandt im Jahr 2012. Diese ersten Ergebnisse zeigten eine geringgradige Hochregulation der MMP-1 Expression im Melanom im Vergleich zu unveränderter Haut. Sowohl in der Human- als auch in der Veterinärmedizin ist eine vermehrte Expression von MMP-1 im Tumor bekannt (NIKKOLA et al., 2002; HOFMANN et al., 2005; PARADO u. SELMAN, 2005; BOURBOULIA u. STETLER-STEVENSON, 2010; YUAN et al.2010, FOLEY et al., 2012; LIU et al., 2012). Daraus ergab sich die Hypothese dieser Forschungsarbeit, die wie folgt lautet: „Die Transkription von MMP-1 ist im Schimmelmelanom hochreguliert.“ 10 2 LITERATURÜBERSICHT 2.1 Melanozytäre Tumoren Die Nomenklatur melanozytärer Hautveränderungen ist durchwegs komplex und verwirrend, da diese in verschiedenen Publikationen unterschiedlich interpretiert werden (SCOTT u. MILLER, 2003). Um Verwirrungen vorzubeugen seien zu Beginn dieser Arbeit einige Termini definiert: Melanozytäre Tumoren melaninproduzierenden umfassen Zellen, eine Gruppe sogenannten von Neoplasien, Melanozyten, welche zusammengesetzt aus sind. Melanozyten sind dendritische Zellen, die von neuroektodermalen Melanoblasten abstammen und im Laufe der Embryogenese zur Epidermis, Dermis und anderen Zielorten, wie etwa in die Haarfollikel, die Meningen, die Nebennieren und in die Intima des Herzens, wandern. Sie sind zwischen den Basalzellen in der dermoepidermalen Junktionszone angeordnet (SELTENHAMMER, 2000; MEUTEN, 2002; SMITH et al., 2002; ROWE u. SULLINS, 2004; PSCHYREMBEL, 2012). Das Pigment Melanin, ein komplex und hoch inhomogenes Polymer bestehend aus monometrischen Einheiten von DOPA und / oder Cysteinyl - DOPA, gelangt über dendritische Fortsätze der Melanosomen, dem Syntheseort des Melanins, zu den Keratinozyten. Die Hauptaufgabe des Melanins ist der Schutz der epidermalen Zellen vor Schäden durch UV-Bestrahlung (ECKHART et al., 2000; SELTENHAMMER, 2000; MEUTEN, 2002; SMITH et al., 2002; ROWE u. SULLINS, 2004). Melanozytäre Tumoren spielen bei Equiden, vor allem aber bei Schimmeln, eine besondere Rolle (SCHONIGER u. SUMMERS, 2009). 11 2.2 Das Equine Melanom Melanome werden schon seit vielen Jahrhunderten, bei Pferden aller Farben, beschrieben. Es handelt sich dabei um eine Neoplasie neuroektodermaler Herkunft (ROWE u. SULLINS, 2004) an der Haut und selten an der Schleimhaut, der Uvea, den Konjunktiven und den Hirnhäuten (PSCHYREMBEL, 2012). 2.2.1 Epidemiologie Neben Sarkoiden und Plattenepithelkarzinomen zählen Melanome zu den 3 häufigsten Tumoren bei Pferden (FOY et al., 2002). Ihre Inzidenz unterscheidet sich je nach Autor und Publikation. Sie beträgt 3% (ROONEY u. ROBERTSON, 1996) bis 18,7% aller equinen Neoplasmen (SELTENHAMMER et al., 2003; SCOTT u. MILLER, 2003) und circa 6% (SELTENHAMMER, 2000) bis 15% aller equinen Hauttumoren (SELTENHAMMER, 2000; SMITH et al., 2002). Diese durchwegs weite Spanne lässt darauf schließen, dass die Dunkelziffer weit größer ist. Dies beruht unter anderem darauf, dass kleine Tumore von Tierbesitzern nicht erkannt werden oder dem Melanom aufgrund seines protrahierten Krankheitsverlaufs beim Schimmel als gutartig erscheinender Tumor geringe Beachtung geschenkt wird (SELTENHAMMER, 2000). Dies wiederum spiegelt die nur seltene histologische Untersuchung (MACGILLIVRAY et al., 2002; SCOTT u. MILLER, 2003) und Dokumentation der kutanten Umfangsvermehrungen wieder (RONNEY u. ROBERTSON, 1996; SCOTT u. MILLER, 2003). 2.2.2 Dispositionen 2.2.2.1 Genetische Disposition Melanome werden bei Pferden jeder Fellfarbe beschrieben. Zweifellos besteht hierbei eine Korrelation zwischen Fellfarbe des Pferdes und Tumorhäufigkeit. Schimmel sind im Vergleich zu Pferden mit anderer Fellfarbe deutlich überrepräsentiert. Schätzungsweise 80% aller Schimmel, die 15 Jahre und älter sind, weisen klinisch ein Melanom auf (ROONEY u. ROBERTSON, 1996; FOY et al., 2002; SELTENHAMMER et al., 2003; KNOTTENBELT, 2009; MOORE et al., 2012). 12 Es ist bekannt, dass das phänotyische Schimmelaussehen autosomal dominant vererbt wird. PIELBERG et. al. zeigten 2008 in ihrer Arbeit, dass das Ergrauen mit dem Alter auf einer 4,6kb – Duplikation im Intron 6 des Syntaxin 17-Gens (STX17) basiert. Sowohl das mutationtragende Gen als auch dessen Nachbargen NR4A3 sind bei Schimmelmelanomen überrepräsentiert. Außerdem weisen Schimmel, welche einen mutationsbedingten Funktionsverlust des Agouti signalisierenden Proteins (ASIP) tragen, eine höhere Inzidenz für Melanome auf. Dieser Funktionsverlust von ASIP basiert auf einer vermehrten Signalwirkung des Melanocortin-1 Rezeptors, welcher die Entwicklung von Melanomen fördert (PIELBERG et al., 2008). Pferde, welche homozygote Mutationen tragen, depigmentieren schneller als Schimmel mit heterozygotem Genotyp. Homozygote Individuen weisen darüber hinaus eine höhere Inzidenz für Melanome und Vitiligo-ähnliche Depigmentierung auf (CURIK et al., 2013). Darüber hinaus wird angenommen, dass jeder Schimmel, wenn er nur alt genug wird, klinisch Melanome vorweisen kann (MOORE et al., 2012). 2.2.2.2 Pferdrassen bedingte Disposition Zu den häufigsten betroffenen Rassen zählen Araber, Lipizzaner, Percheron (FOY et al. 2002; SCOTT u. MILLER, 2003) sowie aus diesen Rassen gezüchtete oder gekreuzte Nachkommen (SCOTT u. MILLER, 2003). Es wird vermutet, dass die erhöhte Inzidenz bei Schimmeln möglicherweise auf genetischen Prädispositionen beruht (KNOTTENBELT, 2009), siehe Kapitel 2.2.2.1. Mehrfach beschrieben ist, dass bis zu 80% aller Schimmel, die älter als 15 Jahre sind, Melanome entwickeln, worunter die Mehrheit benignes Verhalten aufweist (ROONEY u. ROBERTSON, 1996; SCOTT u. MILLER, 2003; MACGILLIVRAY et al., 2002; BURDEN, 2012; MOORE et al., 2012). 2.2.2.3 Geschlechtliche Disposition Es gibt weder eine geschlechtliche Disposition noch geschlechtsspezifische Prädilektionsstellen (FOY et al. 2002; SCOTT u. MILLER, 2003; SELTENHAMMER et al., 2003; KNOTTENBELT, 2009; MOORE et al., 2012), noch hat sich bis jetzt erwiesen, dass die Kastration einen eindeutigen Effekt auf die Entwicklung und/oder die Progression des equinen malignen Melanoms hätte (SELTENHAMMER, 2000; MOORE et al., 2012). 13 2.2.2.4 Altersbedingte Disposition Nur sehr selten sind bereits kongenital Melanome vorhanden (SCOTT u. MILLER, 2003; SELTENHAMMER et al. 2003). MOORE et al. berichteten 2012 über 3 kongenitale Melanome wobei 2 von 3 Pferden durch chirurgische Exzision überlebten. Das 3. Pferd wurde aufgrund des expansiven und infiltrativen Tumorwachstums und schon vorhandener Metastasierung euthanasiert. Klassischerweise kommt es zum Auftreten von Melanomen in einem Alter von über 2 Jahren bis 15 Jahren (MOORE et al., 2012). FOLEY et al. (1991) beschäftigten sich mit dem Auftreten und histologischen Erscheinungsbild von kongenitalen und erworbenen Melanomen innerhalb der ersten 2 Lebensjahre. So wurden hier vier kongenitale Melanome, elf Melanome innerhalb des 1. Lebensjahres und drei innerhalb des 2. Lebensjahres beschrieben. Diese Melanome unterscheiden sich im Vergleich zum Melanom bei älteren Pferden nicht nur durch das Alter des Auftretens selbst sondern auch durch ihre Lokalisation und epitheliale Entwicklung. So waren diese Melanome junger Pferde solitär an den Beinen, dem Körperstamm und am Unterlid lokalisiert, nicht eingekapselt und häufig ulzeriert (FOLEY et al., 1991). 2.2.2.5 Häufige Lokalisationen Charakteristische Lokalisationen für primäre Tumoren beim Schimmel sind vor allem die Schweifrübenunterseite, die perineale und die anogenitale Region. Aber auch an Lippen, Ohren, Augen und deren Umgebung, Luftsäcken, Euter sowie in der Parotisregion treten Melanome häufig auf. An den Beinen sind Melanome weitaus seltener lokalisiert (ROONEY u. ROBERTSON, 1996; SELTENHAMMER, 2000; FOY et al. 2002; MACGILLIVRAY et al. 2002; SCOTT u. MILLER, 2003; KNOTTENBELT, 2009; BURDEN, 2012; MOORE et al., 2012). 2.2.3 Pathologische Einteilung Eine vielzitierte retrospektive Studie von VALENTINE (1995) unterteilt die melanozytären Hautveränderungen beim Pferd nach ihren klinischen und pathologischen Verhaltensmustern in die folgenden 4 Typen: 14 1. Melanozytäre Naevi 2. Anaplastisches malignes Melanom 3. Dermales Melanom 4. Dermale Melanomatose 2.2.3.1 Melanozytäre Naevi (Synonym: Melanozytoma) Melanozytäre Naevi werden hauptsächlich bei jüngeren Schimmeln und nicht-pigmentierten Pferden beobachtet und stellen sich meist als solitäre, nicht abgekapselte, stark pigmentierte kutane, häufig ulzerierende Umfangsvermehrungen unterschiedlicher Größe dar, welche eher selten an den typischen Lokalisationen zu finden sind. Weit häufiger sind sie an den Beinen, im Nacken und am Rumpf lokalisiert. Histologisch sind diese in den oberen Schichten der Dermis bis hin zur dermoepidermalen Grenze lokalisiert (ROWE u. SULLINS, 2004; KNOTTENBELT, 2009; MOORE et al., 2012). 2.2.3.2 Anaplastisches malignes Melanom (Synonym: Melanosarkom) Es handelt sich dabei um die aggressivste Form des Melanoms. Ihr histologisches Erscheinungsbild ist durch eine Ansammlung von vielen pleomorphen Epithelzellen gekennzeichnet, welche unterschiedlich stark pigmentiert sind und einen hohen Mitose-Index aufweisen. Anaplastische maligne Melanome treten bei Pferden aller Rassen auf und sind durch ein stark invasives, rasches und metastasierendes Wachstum gekennzeichnet, in ihrer Häufigkeit des Auftretens aber durchwegs selten (ROWE u. SULLINS, 2004; KNOTTENBELT, 2009; MOORE et al., 2012). 2.2.3.3 Dermales Melanom & dermale Melanomatose Das dermale Melanom und die dermale Melanomatose zählen zu den am häufigsten vorkommenden Melanomtypen und sind histologisch nicht voneinander zu unterscheiden. Sie präsentieren sich als undeutlich abgrenzbare, stark pigmentierte Tumorzellen in den tieferen Schichten der Dermis. Sie unterscheiden sich durch ihr klinisches Erscheinungsbild. Während das dermale Melanom solitär, multipel oder konfluierend an unterschiedlichen Stellen beim alternden Schimmeln auftritt, findet man die dermale Melanomatose nur bei alten Schimmel an der Schweifrübenunterseite, dem Perineum und den äußeren Genitalien und sie neigen zu 15 viszeraler Metastasierung (ROWE u. SULLINS, 2004; KNOTTENBELT, 2009; MORRE et al., 2013). Eine aktuellere Publikation von SCHÖNIGER u. SUMMERS (2009) beschreibt die Ähnlichkeit von zwanzig Pferdemelanomen zum humanen Naevus und schlägt dabei eine der Humanmedizin ähnlichen Einteilung in die folgenden Untergruppen vor: 1. Intradermale einfache melanozytäre Naevi 2. Zelluläre blaue Naevi 3. Kombinierte zelluläre blaue Naevus Bei allen Melanomen handelte es sich um intradermale, verschiebliche, gut abgrenzbare, nicht eingekapselte symmetrische Massen. Ihre Unterteilung basiert im Unterschied, aber nicht im Widerspruch, zu VALENTINE (1995) auf der zytomorphologischen Struktur von Melanomen, ihrer untypischen Lokalisation, der Abwesenheit von erhöhter Tumorfrequenz bei grauen Pferden sowie der Ähnlichkeit zu den Untergruppen des menschlichen Naevus (SCHONIGER u. SUMMERS, 2009). 2.2.4 Dignität Das Melanom bei Menschen und Tieren ist, mit Ausnahme des Schimmels und nichtpigmentierter Pferde, durch ein malignes Verhaltensmuster mit frühzeitiger Neigung zur Metastasierung auf lymphogenem und/oder hämatogenem Weg gekennzeichnet (SELTENHAMMER, 2000; FOY et al. 2002). Über die klinische und pathologische Natur des Melanoms beim Schimmel wird schon seit mehr als 200 Jahren diskutiert. Einerseits gibt es die Meinung, dass es sich bei Melanomen entweder um eine nicht neoplastische, benigne pigmentierte Zelldysplasie oder eine Pigmenteinlagerungskrankheit handelt. Demgegenüber werden Melanome als wahre Neoplasie beschrieben (SCOTT u. MILLER, 2003; MOORE et al., 2012). Heutzutage wird das Melanom beim Schimmel und nichtpigmentierten Pferd hinsichtlich seiner Dignität als eine Neoplasie mit malignem Potential bis hin zu einer malignen Neoplasie beschrieben (MOORE et al., 2012). Diese Melanome erfüllen aber eine Vielzahl benigner 16 Tumorkriterien, sind meist von einer Kapsel umgeben und kaum vaskularisiert und können sich über viele Jahre in einer Art Ruhe-Stadium befinden (SELTENHAMMER et al., 2006). KNOTTENBELT et al. beschreiben 2009, dass 95% der Melanome bei der Diagnosestellung benign sind und davon circa 30% eine maligne Transformation durchmachen und auch metastasieren. Im Gegensatz dazu behaupten SELTENHAMMER et al., (2003) und MOORE et al., (2012), dass 66% eine maligne Transformation durchmachen. Darüber hinaus beschreibt KNOTTENBELT et al., (2009) eine erhöhte Tendenz zur malignen Transformation beim Nicht–Schimmel (FOY et al., 2002; KNOTTENBELT et al., 2009). Nichtsdestotrotz handelt es sich beim equinen Melanom um einen multizentrischen Tumor mit der Neigung zu infiltrativem Wachstum (MOORE et al., 2012). Unabhängig von der malignen Transformationsrate beschreiben SELTENHAMMER et al., (2006) eine Metastasierungsrate von 75-100% beim Schimmel. 2.2.5 Klinik Melanome stellen sich meistens als unterschiedlich stark pigmentierte (schwarze, braune oder graue), einzelne bis multiple, weiche bis harte, kuppeldachähnliche, kugelige oder flache, lokal invasive oder nicht-invasive, gut abgegrenzte Knoten in der Haut oder Unterhaut dar, welche sowohl gestielt als auch ungestielt auftreten und in ihrer Größe deutlich variieren können. Häufig konfluieren kleinere Melanome zu einem Tumorkonglomerat, welches der Haut ein kopfsteinpflasterartiges Aussehen verleiht, ohne das Allgemeinbefinden des Tieres zu beeinträchtigen. Die darüberliegende Haut ist entweder intakt oder zeigt Alopezie, selten kommt es zur Ulzeration und der Produktion von schwarzem, teerartigem Ausfluss (ROONEY u. ROBERTSON, 1996; FOY et al., 2002; SCOTT u. MILLER, 2003; SELTENHAMMER et al. 2003; KNOTTENBELT, 2009; BURDEN, 2012; MOORE et al., 2012). Die klinischen Symptome sind abhängig von der Lokalisation, der Größe und dem Verhaltensmuster der Läsion (KNOTTENBELT, 2009) Die Entstehung von Melanomen erfolgt ohne klinische Vorzeichen, jedoch beschreiben SELTENHAMMER et al., 2003, dass vitiligoähnliche Depigmentierung als ein Vorzeichen angesehen werden kann (SELTENHAMMER et al., 2003). 17 Folgende drei Erscheinungsformen werden beschrieben (MEUTEN, 2002; SCOTT u. MILLER, 2003; SELTENHAMMER et al., 2003): (1) Langsames Wachstum über Jahre hinweg ohne jegliche Metastasenbildung: dies stellt eine häufige Form des Melanoms dar. Sie ist sind von eher geringerer klinischer Bedeutung, es sei denn die Tumoren behindern physiologische Prozesse wie den Harn- oder Kotabsatz bzw. die Fortpflanzung (FOY et al., 2002). (2) Ausbildung eines anfangs gutartigen Tumors, der bösartig wird: nach einem langsamen Wachstum über viele Jahre hinweg kommt es zu einer schnellen Wachstumsphase, welche mit einer malignen Transformation assoziiert ist, die lokal invasives Wachstum und fortschreitende Metastasierung bedingt (FOY et al., 2002) (3) In diese Gruppe fallen 30% der Tumore: Sie sind von Beginn an hoch malige, d.h. invasiv wachsend und metastasierend und vergleichbar mit dem humanen malignen Melanom (ROONEY u. ROBERTSON, 1996; FOY et al., 2002). 2.2.6 Metastasierung Melanome metastasieren auf hämatogenem oder lymphatischem Weg in die regionalen Lymphknoten, die Lunge, die Leber, die Milz, an seröse Oberflächen, die Nieren, das Gehirn, die Knochen, das Herz, den Skelettmuskel und in und/oder an Blutgefäßen (FOY et al. 2002; MACGILLIVRAY et al. 2002; KNOTTENBELT, 2009). Die in Folge auftretenden klinischen Symptome sind abhängig von den betroffenen Organen, dem Infiltrationsausmaß (FOY et al. 2002; MACGILLIVRAY et al. 2002) und der Wachstumsrate der Tumormetastasen (ROONEY u. ROBERTSON, 1996). 2.2.7 Äthiologie und Pathogenese In der Humanmedizin ist bereits bekannt, dass gewisse Risikofaktoren zur Melanomentstehung beitragen. Zu diesen zählen zum Beispiel exzessive UV–Strahlung (SCOTT u. MILLER, 2003; PIELBERG et al., 2008; CURIK et. al., 2013), eine große Anzahl melanozytärer Nävi, helle Haut- und Haarfarbe sowie fortschreitendes Alter und eine 18 genetische Prädisposition (PIELBERG et al., 2008; CURIK et. al., 2013) sowie die chronische Exposition mit Insektiziden (SCOTT u. MILLER, 2003). In der Veterinärmedizin hingegen gibt es die verschiedensten Theorien zur Pathogenese des Melanoms bei Pferd, die Äthiologie ist jedoch bis heute ungeklärt (ROONEY u. ROBERTSON, 1996; FOY et al. 2002; SCOTT u. MILLER, 2003). Es wird überlegt, ob das Auftreten von Melanomen beim alternden Schimmel aufgrund einer Störung des Melaninmetabolismus zustande kommt. Einerseits anlässlich der Formation von neuen Melanoblasten, anderseits durch die Aktivitätsabnahme von Melanoblasten, mit dem Resultat einer fokalen Zone an Pigmentüberschuss in der Haut (FOY et al., 2002; SCOTT u. MILLER, 2003). Die UV-Exposition, welche in der Humanmedizin schon seit langem einen bekannten Faktor für die Melanomentstehung darstellt, ist beim den Schimmel wohl kein Risikofaktor (FOY et al., 2002; SCOTT u. MILLER, 2003; KNOTTENBELT, 2009), hingegen werden bei diesem Melanome gehäuft an mukokutanen Übergängen bzw. haarlosen und sehr dünnen Hautstellen beschrieben (BENGTSTRÖM, 2011). 2.2.8 Diagnostik In der Humanmedizin wird die Auflichtmikroskopie und die exzisionale Biopsie mit anschließender pathohistologischer Untersuchung als Goldstandard für Diagnose, Prognose und Therapie angesehen wird (FERRONE ,2012; SHARFMAN u. ABRAHAM, 2012).In der Veterinärmedizin wird bereits das äußerliche Erscheinungsbild beim Schimmel, auch wenn es durchwegs variieren kann, sowie die typische Lokalisation meist schon als Pathognomon anzusehen. Darüber hinaus kann die histologische Untersuchung einer Biopsie zur Bekräftigung der Diagnose und genaueren Klassifizierung hinzugezogen werden (FOY et al., 2002; KNOTTENBELT, 2009). Auf Grund seiner lymphogenen und hämatogenen Metastasierungsaffinität ist eine rektale Untersuchung vor allem bei der Diagnose von Primärläsionen im anogenitalen Bereich indiziert, da Metastasen für Kot- und Harnabsatzstörungen mitverantwortlich sein können (SCOTT u. MILLER, 2003; KNOTTENBELT, 2009). 19 2.2.9 Therapie In der Literatur werden viele verschiedene Möglichkeiten zur Behandlung von Melanomen beim Pferd beschrieben jedoch gibt es bis heute keine weltweit akzeptierte Behandlungsmöglichkeit. Die Schwierigkeit in der Therapie liegt darin, dass bis heute viele Effekte der Initiation und Progression des malignen Melanoms sowohl in der Tiermedizin als auch in der Humanmedizin noch unbekannt sind (MOORE, 2012). Während in der Humanmedizin die chirurgische Entfernung im beginnenden Stadium die höchsten Aussichten auf Heilung bietet (FERRONE ,2012; SHARFMAN u. ABRAHAM, 2012) beschreiben FOY et al., (2002) und ROWE u. SULLINS (2004) dass kleinere equine melanozytäre Tumore, sofern sie keine klinischen Symptome verursachen, noch keiner Behandlung bedürfen. Bei Vergrößerung des Melanoms und Auftreten von klinischen Symptomen ist jedoch ein therapeutisches Einschreiten notwendig (ROWE u. SULLINS, 2004). KNOTTENBELT (2009) hingegen empfiehlt eine frühzeitige Therapie. 2.2.9.1 Die chirurgische Exzision Die chirurgische Exzision kann im Falle von kleineren, solitären Melanomen kurativ sein (SCOTT u. MILLER, 2003). Hierbei sollte darauf geachtet werden, einen möglichst großen Abstand zum Tumor und damit die Entfernung im gesunden Gewebe zu gewährleisten (FOY et al. 2002; BURDEN, 2012). Die chirurgische Exzision stellt sich jedoch für bereits metastasierende Melanome, ungünstige Lokalisationen, zunehmende Größe, konfluierende Melanome oder lokale Invasion als unpraktisch bis unmöglich dar (SCOTT u. MILLER, 2003). Ausdrücklich zu erwähnen ist, dass eine nur zytoreduktive Chirurgie ohne sauberen Schnittrand das Fortschreiten der Krankheit nicht verhindert (MOORE et al., 2012). Dies basiert auf der Begründung, dass eine komplette Tumorentfernung im gesunden Gewebe an Stellen um den Anus oder der Schweifrübenunterseite beinahe unmöglich ist und auf Grund des erhöhten Infektionsdruckes im Anogenitalbereich mit einer verzögerten Wundheilung zu rechnen ist. Des Weiteren schreiben einige Autoren (VALENTINE, 1995; SELTENHAMMER, 2000; ROWE u. SULLINS, 2004; BURDEN, 2012), dass eine chirurgische Stimulation der abnormen Melanoblasten das Tumorwachstum und die Metastasierung vorantreibt. 20 2.2.9.2 Die Kryotherapie Bei der Kryotherapie handelt es sich um ein medizinisches Verfahren, welches abhängig von der Tumorgröße sowohl als Monotherapie als auch als Kombinationstherapie mit einer chirurgischen Exzision eingesetzt werden kann. Letztere wird meist hinzugezogen, wenn die Rezidivgefahr durch wiederholte Kälteeinwirkung reduziert werden soll (FOY et al. 2002; SCOTT u. MILLER, 2003; BURDEN, 2012). 2.2.9.3 Der Histamin – 2 – Rezeptor – Antagonist Die anti-tumor Wirkung der oralen systemischen Applikation von Cimetidin, einem Histamin–2–Rezeptor–Antagonisten, basiert je nach Autor auf unterschiedlichen Wirkmechanismen. So sollen eine selektive Inhibierung von T-Suppressor-Zellen, eine verbesserte Aktivität von natürlichen Killerzellen und ein antiinflamatorische Effekt zu einer Reduktion von Tumorgröße und -anzahl führen. Die Publikationen darüber weisen unterschiedlich erfolgreiche Resultate auf (FOY et al., 2002; SCOTT u. MILLER, 2003; KNOTTENBELT, 2009; BURDEN, 2012; MOORE et al., 2012). FOY et al., (2002) empfehlen, dass die Therapie, wenn sie innerhalb von 3 Monaten keine Tumor-Regression zeigt, als ineffektiv anzusehen ist und abgesetzt werden soll. KNOTTENBELT (2009) hingegen schildert, dass bei ausbleibendem Therapie-Erfolg, das Medikament schon nach 3–4 Wochen abgesetzt werden soll. 2.2.9.4 Die intraläsional verabreichte Chemotherapie Cisplatin (cis-diamminedichloroplatinum) ist eine der effektivsten Antitumor-Medikamente in der Humanmedizin (LIPPERT, 1999). Auch in der Tiermedizin wurden beim Hund und bei Equiden Therapierfolge mit diesem Zytostatikum nachgewiesen (SELTENHAMMER, 2000; THÉON et al., 2007). Es eignet sich für die intratumorale und topische Anwendung da es keine Gewebsnekrosen verursacht. Die Wirkung ist dosis- und zeitabhängig und seine Zytotoxizität unabhängig von der Tumorwachstumsrate (THÉON et al. 2007). Des Weiteren wird keine Resistenzentwicklung für Melanome beschrieben, was die Wiederholung des Therapieprotokolls erlaubt (BURDEN, 2012). 21 Man unterscheidet bei dieser Therapie 2 unterschiedliche Ansätze (HEWES, 2007; THÉON et al., 2007; BURDEN, 2012): 1. Die perkutane intraläsional verabreichte Injektion von Cisplatin ist sowohl alleine bei kleineren Tumoren, als auch im Zusammenhang mit chirurgischer Entfernung (perioperativ, intraoperativ als auch postoperativ) oder in Kombination mit chirurgischer Entfernung und CO2–Laser bei größeren Tumoren als erfolgreich anzusehen (FOY et al., 2002). Sie umfasst eine Serie von 4 intratumoralen Applikationen einer Cisplatin-Öl-Emulsion, welche ihre Wirksubstanz langsam freisetzt, im 2 Wochen Rhythmus (BURDEN, 2012). 2. Dem gegenüber steht die chirurgische Implantation von biologisch abbaubaren Cisplatin haltigen Kügelchen, mit einem Durchmesser von 3mm, welche sich aus den folgenden Komponenten zusammensetzen: Protein-Trägermatrix, Vasokonstriktor und ~ 1,6mg Cisplatin pro Kügelchen (HEWES, 2004). Es wird empfohlen präoperativ mit einer Antibiose sowie einer anti-inflammatorischen Therapie zu starten (HEWES, 2004). THÉON et al. (2007) berichtet von einer 81%igen Erfolgsrate bei der Behandlung von 16 subkutanen und dermalen melanzytischen Tumoren mit der perkutanen, intraläsionen Applikation einer auf Sesamöl basierenden Cisplatinformulation in Kombination mit dem Vasokonstrikor Epinephrin (THÉON et al., 2007; MOORE et al., 2012). Aber auch andere Autoren (FOY et al., 2002) berichten von erfolgreich behandelten Melanomen mit dieser intraläsionalen Behandlungsmethode. Der Behandlungserfolg mit cisplatinhaltigen Kügelchen, sowohl als Monotherapie als auch in Kombination mit chirurgischer Therapie oder CO2-Laser zeigten gute Erfolge nach 2 Jahren (MOORE et al., 2012). HEWES (2004) berichtet, dass 93% seiner Patienten, welche alle Schimmel waren und mit cisplatinhaltigen Kügelchen therapiert wurden, eine Rückbildung der Tumorgröße aufwiesen (HEWES, 2004). Die therapeutische Implantation ermöglicht eine Applikation von größeren Medikamentenkonzentrationen am Zielort, welche über eine gewisse Zeitspanne ans Zielgewebe abgegeben wurden, womit eine geringere Gesamtmenge 22 des Chemotherapeutikums im Vergleich zur systemischen Verabreichung benötigt wird (HEWES, 2007). THÉON et al. (2007) und KNOTTENBELT (2009) beschreiben optimalere Ergebnisse bei größeren Tumoren bei großflächiger Tumorentfernung mit anschließender Cisplatin Therapie (THÉON et al., 2007). 2.2.9.5 Die Vakzinierung Mittels autochtoner Melanomvakzinierung wurden im Rahmen einer Vorstudie erfolgversprechende Ergebnisse erzielt (FOY et al., 2002; KNOTTENBELT, 2009), so beobachtete man bei elf von zwölf Pferden eine Tumorregression. Die hierfür verwendete Vakzine enthielt vollständig autogene Tumorzellen sowie Adjuvanz, diese wurde subkutan über die regionalen Lymphknoten appliziert (MOORE et al., 2012). BERGMAN et al., (2003) berichten in ihrer Studie über die Vakzinierung mit humanen Tyrosinase von malignem Melanom im fortgeschrittenen Stadium bei Hunden. Die Ergebnisse der Studie machten deutlich, dass es sich um eine sichere und potentiell wirksame Behandlung handelt, mit minimaler lokaler Toxizität und dem Ausbleiben der systemischen Toxizität. Die Erfolge der Vakzinierung äußerten sich sowohl klinisch als auch mit einer deutlich längeren Überlebenszeit der Tiere (BERGMAN et al., 2003). Erste Untersuchungen zur Tyrosinaseexpression im Melanomen des Pferdes zeigen, dass diese Vakzine auch für das Pferd von Interesse sein kann (PHILLIPS et al., 2012). 2.2.9.6 Toremifene Toremifene, ein Triphenylethylen-Derivat, wird in der Humanmedizin bei Frauen mit metastasierendem Brustkrebs eingesetzt (SHELLY et al., 2008). Basierend auf einer in vitroStudie, welche sich mit der Gewebskonzentration des Pharmakons bei einer melanozytären Zelllinie beschäftigte, wurde ein Fallbericht von einem Pferd publiziert, welches nach transdermaler topischer Behandlung eines nicht histologisch nachgewiesenen Melanoms eine geringgradige Reduktion in der Tumorgröße zeigte (MOORE et al., 2012). 2.2.9.7 Immunotherapien Der Einsatz unspezifischer Immunmodulatoren bei Melanomen wurde in der Veterinärmedizin mit wechselnden Erfolgen verzeichnet. Zum Einsatz kamen unter anderem 23 mikrobiologische Wirkstoffe wie Coley´s toxin, Bacillus Calmette-Guérin (BCG) und Corynebacterium parvum (FOY et al., 2002; KNOTTENBELT, 2009). 2.2.10 Prognose Beim Pferd wird die Diagnose Melanom zumeist in einem fortgeschrittenen Stadium gestellt in der eine chirurgische Exzision nur selten Heilung verschafft, da die Absiedelung von Metastasen in die regionalen Lymphknoten meist schon stattgefunden hat. Aufgrund dessen ist die Diagnose meist mit einer schlechten Prognose verknüpft (SMITH et al., 2002). Obwohl die Mehrheit der equinen Melanome über lange Zeit ein gutartiges Verhalten aufweist und fast jeder Schimmel mit zunehmendem Alter Melanome entwickelt, sollten diese nicht unterschätzt und regelmäßig kontrolliert werden. Denn abhängig von ihrer Lokalisation, der Größe und der möglichen Metastasierung sind klinische Symptome unterschiedlichen Schweregrades zu erwarten, welche das Tier nicht selbst beeinträchtigen müssen, jedoch einen Einsatz als Arbeits- und Sporttier verhindern können (SCOTT u. MILLER, 2003; KNOTTENBELT, 2009). 24 2.3 Matrix – Metalloproteinasen Matrix Metalloproteinasen (MMPs) gehören in die Familie der Zink-abhängigen Endopeptidasen, welche eine wichtige Rolle in der Degradierung der einzelnen Komponenten der extrazellulären Matrix (ECM) spielen (AYAD et al., 1998; PARDO u. SELMAN, 2005; LIU et al., 2012). Neben der ECM sind MMPs auch in der Lage, Nicht-Matrix-Substrate zu spalten (PARDO u. SELMAN, 2005). 2.3.1 Einteilung Heute existieren zwei verschiedene Systeme, um die Mitglieder der Matrix Metalloproteinasen einzuteilen. Dem numerischen System, das fortlaufend die Enzyme nach chronologischer Entdeckung nummeriert, steht die Einteilung nach der Spaltung des Substrat (AYAD et al. 1998) und der zellulären Lokalisation (YUAN et al., 2010) gegenüber. Im Laufe der Zeit erhielten einige MMPs zwei Nummern, da erst später erkannt wurde, dass es sich um zwei identische MMPs handelt (AYAD et al. 1998). Zurzeit sind mindestens 24 MMPs bekannt (YUAN et al., 2010; FOLEY et al., 2012; LIU et al., 2012), welche nach einem substratspaltenden und zelllokalisationsabhängigen System in die folgenden Gruppen eingeteilt werden (BOURBOULIA u. STETLER-STEVENSON, 2010; YUAN et al., 2010): x Collagenasen x Gelatinasen x Matrilysine x Stromelysine x Membran-ständige MMPs 25 2.3.2 Struktureller Aufbau Der strukturelle Aufbau nahezu aller MMPs beinhaltet ein ähnliches Grundgerüst aus (HOFMANN et al., 2005; PARDO u. SELMAN, 2005; BOURBOULIA u. STETLERSTEVENSON, 2010): x einer Signal-Präpeptid-Domäne, welches das Protein durch das endoplasmatische Retikulum leitet, bevor es sezerniert wird x einer N-terminalen Propeptid–Domäne, welche die enzymatische Latenz und Inaktivität durch Blockierung der katalytischen Domäne für aktivierende oder hemmende Substanzen sicherstellt x einer katalytischen Domäne mit Zn2+-Bindungsstelle, welche nach erfolgreicher Abspaltung von Prä- und Propeptid ihre enzymatische Aktivität freisetzen x einer Gelenkregion, welche die Verbindungsstelle zwischen der katalytischen Domäne und der Hämopexin-Domäne darstellt, außer bei Matrilysinen x einer COOH–terminalen Hämopexin–Domäne, an welche die N-terminale Region der TIMPs bindt und die Aktivität der MMPs hemmt Abbildung 1: Struktureller Aufbau von MMPs (modifiziert nach BOURBOULIA u. STETLER-STEVENSON, 2010) 26 Gelatinasen besitzen zusätzlich noch eine Fibronektin–Typ2-Domäne innerhalb der katalytischen Domäne. MT-MMPs weisen hingegen noch eine transmembrane Domäne am Cterminalen Ende sowie eine intrazelluläre Domäne auf. MMP-7 und MMP-26 hingegen sind kleiner als die anderen MMPs, da sie weder eine hämopexinähnliche Domäne, noch eine Gelenksregion besitzen (HOFMANN et al., 2000; BOURBOULIA u. STETLER-STEVENSON, 2010). 2.3.3 Regulation Die Regulation der MMPs ist mitunter sehr komplex und erfolgt auf folgenden Ebenen (OH et al., 2001; HOFMANN et al., 2005; PARDO u. SELMAN, 2005): 1. Synthese als inaktive Proform 2. Genexpression (transkriptionelle Regulation, post-transkriptionelle Regulation & translationelle Regulation) 3. Inhibierung der enzymatischen Aktivität MMPs werden als lösliche inaktive Proenzyme, auch Zymogene genannt, sezerniert. Die extrazelluläre Aktivierung erfolgt durch proteolytische Abspaltung der N–terminalen Propetidsequenz (PARDO u. SELMAN, 2005; LIU et al., 2012). Dieser Vorgang wird in der Literatur als „Cystin-Switch“ bezeichnet (PARDO u. SELMAN, 2005). Nach erfolgter Abspaltung der N–terminalen Propetid–Domäne erfolgt eine autolytische Spaltung der Domäne. Für die Aktivierung sind einerseits die Interaktion einzelner MMPs miteinander und/oder externe Stimuli erforderlich (HOFMANN et al., 2000). 27 Faktoren, welche auf die Expression von MMPs Einfluss haben (HOFMANN et al., 2005): – Zytokine o expressionsfördernd: Interleukine IL-1 und IL-6, Tumornekrosefaktor TNF-Į) o expressionshemmend: IL-4, IL-10, INF-ȖXQG7*)-ȕ – Wachstumsfaktoren (EGF, PGDF, VEGF) – Hormone – Onkogene – Tumorpromotoren – Aktivierungsprotein-1 (AP-1) Eine Vielzahl von Molekülen können MMPs in ihrer Aktivität hemmen. Dies erfolgt primär durch die Aktivität von Gewebsinhibitoren der Matrix-Metalloproteinasen (TIMPs), welche einerseits am proMMP oder andereseits an der aktiven MMP-Form binden. Dadurch kommt es zu einer Inhibierung der autokatalytischen Aktivität des Zymogens bzw. zur Inhibierung der proteolytischen Kapazität der aktiven Proteinase (HOFMANN et al., 2005). TIMPs umfassen das gesamte MMP Spektrum und unterscheiden sich lediglich in ihrer Hemmaffinität (BOURBOULIA u. STETLER-STEVENSON, 2010). TIMPs werden außer zur Inhibierung auch zur Aktivierung einiger MMPs genutzt (HOFMANN et al., 2005). Die Hemmung von MMPs erfolgt aber auch durch reversion-inducing cysteine-rich protein with Kazal motifs (RECK). Das Glykoprotein RECK, welches ein Molekularesgewicht von 110 kDa aufweist, enthält Serin-Protease-Inhibitor-ähnliche Domänen und ist mittels Cterminalen Gylcosylphosphatidylinosin (GPI) an der Zellmembran verankert. Es ist an vielen humanen Zellen zu finden, wohingegen es in Tumorzelllinien nur in geringen Mengen bis gar nicht nachweisbar ist. Untersuchungen ergaben eine negative Regualtion von MMP-9, MMP2 und MT1-MMP. Die Ergebnisse bekräftigen die modulierende Wirkung von RECK auf MMPs sowie dessen Funktion als Inhibitior für Tumorangiogenese, - invasion und – metastasierung (OH et al., 2001). 28 2.3.4 Funktionen Die Proteine der MMP–Familie sind unter anderem in den Abbau der ECM bei physiologischen Prozessen, beispielsweise der embryologischen Entwicklung und der Remodellierung von Geweben bei der Wundheilung, beteiligt. Des Weiteren sind sie bei pathologischen Prozessen aufzufinden, wie zum Beispiel bei Arthritis, Tumorentstehung und Metastasierung (PARDO u. SELMAN, 2005.). Es gibt mittlerweile viele Berichte, welche die komplexe Natur der Tumorgenese und die damit in Beziehung stehende direkte Rolle der MMPs bei der Zelladhäsion, Migration, Tumorangiogenese sowie den Einfluss proteolytischer Prozesse von Zytokinen, Chemokinen, Wachstumsfaktoren und deren Rezeptoren beschreiben (BOURBOULIA u. STETLERSTEVENSON, 2010). BOURBOULIA u. STETLER-STEVENSON (2010) beschreiben im Anschluss an die proteolytische Matrix sowie die Degradierung und Spaltung der Zelladhäsionen die Migration und Invasion des Tumors ins umliegende Gewebe. Die anschließende Tumorangiogenese erfolgt durch die Spaltung und Migration von Endothelzellen in Richtung Tumor. MMPs spielen durch den Abbau der ECM in diesem Schritt der Neoangiogenese eine wichtige Rolle (OH et al., 2001; BOURBOULIA u. STETLER-STEVENSON, 2010). 2.3.5 MMPs im Melanom Das Expressionsprofil von einigen MMPs sowie TIMPs und deren Beitrag zum invasiven Verhalten wurde an humanen und murinen Zelllinien untersucht. Bisher konnte eine Korrelation des Phänotyps mit der vermehrten Expression von MMP-1, auf welche im Kapitel 2.4 genauer eingegangen wird, sowie MMP-2 und MMP-9 aufgezeigt werden. In Vitro wurde die vermehrte MMP-2 Expression mit der Progression des Melanoms assoziiert, basierend auf einem MMP-2 Nachweis in hoch invasiven Zelllinien und der Abwesenheit von MMP-2 in weniger invasiven. Dies wurde auch in vivo bestätigt. Die modulierende Wirkung von MMP-2 auf die Zelladhäsion ermöglicht eine Streuung des Tumors über die Komponenten der ECM hinaus. MMP–9 zeigt in vitro nur bei Melanomzellen fortgeschrittenen Stadiums eine vermehrte Expression. In Vivo zeigte eine Studie mit MMP-9-defizienten Mäusen, dass die Bildung von Metastasen unterdrückt war. Hinweise lassen aber vermuten, dass nicht die Melanomzellen 29 selbst, sondern Tumorumgebende Zellen MMP-9 sezernieren und dies für die Bildung von Metastasen ausschlaggebend ist (HOFMANN et al., 2005). Die übereinstimmenden Ergebnisse der in vitro und in vivo Studien verdeutlichen, dass die proteolytische Balance zwischen der Produktion von MMPs und TIMPs eine entscheidende Rolle in der Kapazität der Metastasierung einnimmt. So wurde gezeigt, dass eine vermehrte Expression von TIMPS eine Reduktion der Tumorgröße veranlasst und die Metastasierung eindämmt. Jedoch ist bis heute noch unklar, wie genau die spezifische Aktivierung in vivo abläuft und wie sich die funktionell aktiven MMPs während der Migration von Melanomzellen verhalten (HOFMANN et al., 2005). 30 2.4 Matrix – Metalloproteinase – 1 Die MMP-1, auch bekannt als „Interstitielle Kollagenase”, „Kollagenase-1“ und „Fibroblastenkollagenase“, wurde 1962 von GROSS und LAPIERE in einer in vitro Studie über die Degradierung von nativen Kollagenfibrillen bei der Metamorphose einer Kaulquappe zum Frosch das erste Mal beschrieben. Darüber hinaus war die menschliche Fibroblastenkollagenase die erste Wirbeltier-Kollagenase, welche als Protein gereinigt und als cDNA vervielfältigt wurde. Während nachgewiesen wurde, dass MMP-1 in normalem homöostatischen Gewebe oftmals nicht detektierbar ist, zeigte sich, dass MMP-1 bei diversen physiologischen (z.B. Wundheilung, Embryogenese) und pathologischen Prozessen (z.B. Tumorgenese, Entzündung) eine vermehrte Expression aufwies. Des Weiteren wurde nachgewiesen, dass MMP-1 auch in vitro von einer Vielzahl von Zellen, unter anderem Fibroblasten, Makrophagen, Endothel- und Epithelzellen produziert wird (PARDO u. SELMAN, 2005). 2.4.1 Funktion MMP-1 ist neben MMP-8, MMP-13 und MMP-14 im Stande, fibrilläre Kollagene (Kollagene des Typs 1, 2 und 3) in seiner Trippelhelix hydrolytisch zu spalten (YUAN et al., 2010). Zusätzlich ist es aber auch in der Lage, Zelloberflächenmoleküle und andere nicht-Matrix Elemente zu spalten (PARDO u. SELMAN, 2005). 2.4.2 Hochregulierung im Tumor Bisherige Studien konnten zeigen, dass ein Anstieg der Expression von MMP–1 Entwicklung, Progression und Metastasierung von Melanomen beeinflusst, sowohl durch das Umformen der ECM, als auch durch die Bildung bioaktiver Moleküle und die proteolytische Abtrennung von Membranproteinen der extrazellulären Domänen (GIRICZ et al., 2010; LIU et al., 2012). Die vermehrte Expression von MMP-1 wird in der Humanmedizin mit vielen verschiedenen Tumorarten assoziiert, wie etwa Lungen- und Brustkrebs und dem Melanom. Außerdem wird die vermehrte Expression mit einer schlechten klinischen Langzeitprognose und hoher Invasivität verknüpft (FOLEY et al., 2012) 31 2.4.2.1 MMP-1 in der Humanmedizin MMP-1 ist am 11q22 – 23 Gen lokalisiert und 17kb lang. Es wird von vielen Zellen exprimiert und mit einer Reihe von Erkrankungen in Zusammenhang gebracht, wie zum Beispiel Arthritis, Autoimmunerkrankungen, kardiovaskulären und fibrotischen Erkrankungen, sowie Tumoren (NIKKOLA et al., 2002; PARDO u. SELMAN, 2005). Bei der Progression von humanen Melanomen spielt eine Vielzahl von proteolytischen Enzymen eine wichtige Rolle. Neben einem Teil des plasminogenaktivierenden Systems gehören auch Mitglieder der Matrix-Metalloproteinasen dazu, wie z.B. MMP-1, -2, -9, -13 und MT-MMP sowie TIMP-1, -2 und -3 (HOFMANN et al., 2000). Die Expression von MMP-1 moduliert die Entwicklung, Progression und Metastasierung durch den Abbau der ECM. Speziell Patienten mit Melanomen, welche eine vermehrte Expression von MMP1 aufweisen, haben eine schlechtere Langzeitprognose (NIKKOLA et al., 2002). 2.4.2.2 MMP-1 in der Veterinärmedizin Nicht nur in der Humanmedizin, sondern auch in der Veterinärmedizin wurde die MMP-1Expression in vitro, und zwar in Sarkoid–Fibroblasten beim Pferd nachgewiesen. YUAN et al. (2010) bewiesen, dass eine Papillomvirusinfektion und die virale Genexpression zu einer vermehrten Synthese der MMPs führen und infolgedessen für die Invasivitt der Fibroblasten verantwortlich ist. Dies wurde einerseits mittels RT-qPCR an Sarkoiden und von diesen abstammenden Sarkoid-Fibroblasten-Zelllinien, sowie an equinen embryonalen Fibroblasten und physiologisch intakter Haut untersucht. Die Studie ergab eine deutliche Hochregulation von MMP-1 in den von Sarkoiden abstammenden Zelllinien und eine moderat erhöhte Expression in den Sarkoiden im Vergleich zur Haut und den equinen embryonalen Fibroblasten, welche eine deutlich niedrigere MMP-1 Aktivität aufwiesen. Es bestand jedoch keine direkte Relation zwischen den Tumorproben und den daraus kultivierten Zelllinien. Desweiteren wurde mittels Zymographie die vermehrte MMP-1 Expression untersucht. Dieses Verfahren hat den Vorteil, dass sowohl die inaktiven Vorstufen, als auch die aktive Form von MMP-1 in allen Tumorproben und Zelllinien deutlich detektierbar waren. Um zu kontrollieren, ob die Hochregulation von MMPs für die Invasion bei Sarkoid-Fibroblasten verantwortlich ist, zogen die Autoren YUAN et al. (2010) den MMP Inhibitor GM6001 heran. Dieser stellte eine Inaktivierung von MMP-1, MMP-2 und MMP-9 erfolgreich her, was sich durch eine reduzierte Invasion von Sarkoidzellen um 35-40% darstellte (YUAN et al., 2010). 32 Jedoch ist bis jetzt unbekannt, wie das Virus die Expression von MMP–1 reguliert (YUAN et al., 2011). 33 3 MATERIAL & METHODEN 3.1 Ethische Genehmigung Die vorliegende Arbeit wurde von der Ethik-Kommission der Veterinärmedizinischen Universität Wien und vom zuständigen Bundesministerium für Wissenschaft und Forschung gemäß § 26 des Tierversuchsgesetz 2012, BGBl. I Nr.114/2012 genehmigt. Die Bescheid - Nummer lautet: BMWF – GZ 68.205/0102 - II/3b/2013. 34 3.2 Material Im Rahmen dieser Diplomarbeit wurden 9 Melanome, 1 primäre Melanomzellinie und 8 Hautproben von insgesamt 12 Pferden an der Veterinärmedizinischen Universität, Pferdeklinik, Forschungsgruppe Onkologie, auf ihre MMP–1 Expression analysiert. Das Gewebe wurde direkt nach der chirurgischen Exzision in circa 5x5mm große Stücke geteilt und in TRI – Reagent® (Sigma, Österreich) bis zur weiteren Verarbeitung auf -20°C eingefroren. Tabelle 1: Proben – Umfang Pferd #1 #2 #3 #4 #5 #6 #7 #8 #9 # 10 # 11 # 12 Proben - Code ARI BT CAL CT CH DIN DT DH DOL T DOL H DOL ZK 1 GT GH LT LH HAC MIR SCH Proben – Typ Melanom Melanom Melanom Melanom Haut Melanom Melanom Haut Melanom Haut Melanomzellen Melanom Haut Melanom Haut Haut Haut Haut 35 3.3 Patienten Die Patienten wurden im Vorfeld klinisch untersucht und anschließend erfolgte eine Erfassung aller adspektorisch und palpatorisch detektierbaren Melanome durch einen Tierarzt. Die adspektorische Untersuchung erfolgte vor allem an primären Prädilektionsstellen, aber auch Lippen, Augenlider und die Parotis-Region wurden sowohl adspektorisch als auch palpatorisch untersucht. Zum Schluss wurde die gesamte Hautoberfläche auf potentielle Tumoren systematisch kontrolliert. Auf eine rektale Untersuchung musste verzichtet werden. Pferde, die andersfarbig als Schimmel waren, wurden im Rahmen dieser Arbeit ausgeschlossen. Die 9 Melanomproben sowie die eine primäre Melanomzelllinie, welche im Rahmen dieser Diplomarbeit untersucht wurden, stammten von 3 Stuten und 6 Wallachen unterschiedlicher Rassen. Die Altersspanne der Tiere reichte von 3 Jahren bis 21 Jahre. Die nachfolgenden Tabellen (Tabelle 2 - 13) und Abbildungen (Abbildungen 8 – 13) liefern das Signalement sowie die Melanomlokalisation der einzelnen Patienten und entstammen zum einen aus Aufzeichnungen der Forschungsgruppe Onkologie bzw. Tierinformationssystem (TIS) der Veterinärmedizinischen Universität Wien. aus dem 36 Tabelle 2: Pferd # 1 Proben - Code Rasse Geschlecht Alter Farbe Melanom Lokalisation ARI Deutsches Warmblut Wallach 21 Jahre Schimmel Auf der rechten Thoraxseite befinden sich circa 2 Handbreit über dem Sternum und 2 Finger breit hinter der Trizepsmuskulatur eine breitbasig aufsitzende kugelige, circa bohnengroße derbe Umfangsvermehrung, die gegenüber der Haut verschieblich, gegenüber der Unterlage nicht verschieblich ist. Sonografisch stellt sie sich als 7mm unter der Haut liegende, der Faszie breit aufsitzende, homogen echoarme Masse dar, die gegenüber der Muskulatur relativ gut abgegrenzt und 1,6x1cm groß ist, ventral davon lassen sich entlang der Faszie noch mindestens drei in einer Reihe angeordnete ca. 1mm große Massen darstellen (Verdacht auf Absiedelung entlang der Lymphbahn). 37 Tabelle 3: Pferd # 2 Proben Code Rasse Geschlecht Alter Farbe Melanom Lokalisation BT Lipizzaner Stute 11 Jahre Schimmel multiple Melanome unterschiedlicher Größe (Durchmesser: 0,5 – 1 cm) an der Schweifrübenunterseite und den Anus umgebend. Abbildung 2: Pferd # 2 Tabelle 4: Pferd # 3 Name Rasse Geschlecht Alter Farbe Melanom Lokalisation CAL Österreichisches Warmblut Stute 3 Jahre Schimmel Ein Melanom an Schweifrübe und Anus (11mm). 38 Tabelle 5: Pferd # 4 Name Rasse Geschlecht Alter Farbe Melanom Lokalisation CT & CH Pony – Mix Wallach 20 Jahre Schimmel Ein Melanom an der Schweifrübenunterseite mit einem Durchmesser von 6mm. Abbildung 3: Pferd # 4 Tabelle 6: Pferd # 5 Name Rasse Geschlecht Alter Farbe Melanom Lokalisation DIN unbekannt Wallach unbekannt Schimmel Ein Melanom an der Schweifrübe. 39 Tabelle 7: Pferd # 6 Name Rasse Geschlecht Alter Farbe Melanom Lokalisation Abbildung 4: Pferd # 6 DT & DH Trakehner Wallach 15 Jahre Schimmel 1 Melanom Bauch links, nähe Penisschaft 1,7cm weitere multiple Melanome den Penisschaft umgebend, teilweise konfluierend, circa faustgroß. 40 Tabelle 8: Pferd # 7 Name Rasse Geschlecht Alter Farbe Melanom Lokalisation Abbildung 5: Pferd # 7 DOL T, DOL H, DOL ZK 1 Islandpferd Wallach 14 Jahre Schimmel 3 linsengroße Melanome ventral Schweifansatz rechte Seite, links dorsal unterhalb der Schweifrübe circa erbsengroßes Melanom, rechts vom Anus circa auf 01:00 ein weiteres linsengroßes Melanom, im Bereich der Anusöffnung (Rosette) zwei circa erbsengroße Melanome palpierbar auf 11:00 und 05:00, im Bereich der Schenkelspalte circa 15cm distal des Anus circa walnussgroßes Melanom 41 Tabelle 9: Pferd # 8 Name Rasse Geschlecht Alter Farbe Melanom Lokalisation Abbildung 6: Pferd # 8 GT, GH Shagya Araber Stute 20+ Jahre Schimmel 2 Melanome unter der Schweifrübe (beide circa 8mm im Durchmesser) 42 Tabelle 10: Pferd # 9 Name Rasse Geschlecht Alter Farbe Melanom Lokalisation LT, LH Welsh Mountain Pony Wallach 19 Jahre Schimmel 2 Melanome unter der Schweifrübe (4mm und 6mm Durchmesser) Abbildung 7: Pferd # 9 Tabelle 11: Pferd # 10 Name Rasse Geschlecht Alter Farbe HAC Andalusier Hengst 12 Jahre Schimmel 43 Tabelle 12: Pferd # 11 Name Rasse Geschlecht Alter Farbe MIR Lipizzaner Stute 16 Jahre Schimmel Tabelle 13: Pferd # 12 Name Rasse Geschlecht Alter Farbe SCH Connemara Pony Stute 19 Jahre Schimmel 44 3.4 Methode Die Aufarbeitung der Melanom- und Hautproben, sowie der Zellen, erfolgte immer nach dem gleichen, unten aufgelisteten Arbeitsschritten im Labor der Forschungsgruppe Onkologie. 3.4.1 RNA–Isolierung Die in TRI-Reagent® (Sigma-Aldrich Handels GmbH, Österreich) eingefrorenen Tumor– und Hautproben wurden auf Eis aufgetaut, in einer Petrischale manuell mit dem Skalpell zerkleinert und mittels Ultra-Turrax T8 (IKA®-Werke GmbH & Co.KG, Deutschland) in 1ml TRI-Reagent® auf Eis homogenisiert. Dazu wurden 0,2ml Chloroform pro ml TRI–Reagent® gegeben, für 15 Sekunden geschüttelt und 10 Minuten bei Raumtemperatur inkubiert. Im Anschluss wurde alles bei 12000xg für 15 Minuten bei 4°C zentrifugiert. Die RNA enthaltende wässrige Phase wurde in ein neues Reaktionsgefäß übergeführt und mit 0,5ml Isopropanol per ml TRI Reagent® versetzt, mit der Hand geschüttelt und 10 Minuten bei Raumtemperatur inkubiert. Anschließend wurden die Proben bei 12000xg für 10 Minuten bei 4°C zentrifugiert. Der Überstand wurde verworfen, das RNA-Pellet mit 1ml 75% Ethanol gewaschen und nochmals bei 7500xg bei 4°C für 5 Minuten zentrifugiert. Der Überstand wurde abgehoben und erneut verworfen und das Pellet luftgetrocknet und in 5-20μl sterilem Wasser gelöst. 3.4.2 DNase-Verdau Im Anschluss an die RNA-Isolierung wurde ein DNase-Verdau durchgeführt. Verwendet wurden hierfür die Reagenzien des RNeasy Mini Kit (250) (Qiagen, Deutschland) entsprechend der Herstellerangaben. Alle Zentrifugierschritte wurden in einer Sigma1-15K Zentrifuge (Sigma-Aldrich Handels GmbH, Österreich) bei maximaler Geschwindigkeit durchgeführt. 45 Kurz zusammengefasst wurden ȝO57/VRZLHȝO(W2+SURReaktionsgefäß/Probe hinzu pipettiert, in RNeasy Minisäulen überführt, 15 Sekunden zentrifugiert und der 'XUFKIOXVVYHUZRUIHQ3UR0LQLVlXOHZXUGHQȝO5:KLQ]XSLSHWWLHUWVHF]HQWULIXJLHUW und der 'XUFKIOXVV ZLHGHU YHUZRUIHQ $OV QlFKVWHV ZXUGHQ ȝO 5'' VRZLH ȝO '1DVH , (Roche, Österreich) in einem separatem Röhrchen vorsichtig gemischt und ȝOSäule aufgetragen und 15 Minuten bei Raumtemperatur inkubiert. Im Anschluss wurden erneut ȝO5:6lXOH hinzugefügt und 15 Sekunden zentrifugiert und der Durchfluss verworfen. Im daraXI IROJHQGHQ 6FKULWW ZXUGHQ ]XHUVW ȝO 53( SUR 6lXOH KLQ]upipettiert und 15 Sekunden zentrifugiert und der Durchfluss wieder YHUZRUIHQ $QVFKOLHHQG ZXUGHQ ȝO 80% EtOH pro Säule hinzugefügt und 2 Minuten zentrifugiert, der Durchfluss verworfen und zum Trocknen der Säule erneut für 5 Minuten zentrifugiert. Die RNA wurde dann mit 200μl A.D. pro Säule in ein frisches Eppendorf eluiert LQ ZHOFKHV ȝO 51DVH287 (Life Technologies, Österreich) vorlegt war. Nach abgeschlossenem DNase-Verdau wurde die RNA im Eppendorf auf Eis zur weiteren Verwendung gelagert bzw. auf -20°C eingefroren. 3.4.3 Clean up Mit Hilfe des Gene JET RNA Cleanup and Concentration Micro Kit (Thermo Fisher Scientific, Österreich) erfolgte bei stark melaninhaltigen Proben eine Reinigung der RNA nach dem DNase-Verdau. Für die Aufreinigung wurde die Probe mit 200μl nukleasefreiem Wasser aufgefüllt und 100μl Bindungspuffer hinzugefügt und vorsichtig gemischt. Zusätzlich wurden 300μl absolutes Ethanol hinzupipettiert und wiederholt gemischt. Das gesamte Gemisch wurde in eine GeneJET RNA Purification Microsäule mit vormontiertem Sammelröhrchen überführt und für 30 Sekunden bei 12000xg zentrifugiert. Der Durchfluss wurde verworfen und 700 μl Waschpuffer 1 hinzugefügt und 30 Sekunden bei 12000xg zentrifugiert. Der Durchfluss wurde wieder verworfen und zweimal infolge mit 700μl Waschpuffer 2 gewaschen und 30 Sekunden bei 1400xg zentrifugiert. Im Anschluss wurde erneut 1 Minute bei 12000xg zentrifugiert, um den restlichen Waschpuffer zu entfernen. Die RNA wurde mit 10μl sterilem, nukleasefreiem Wasser in ein neues Röhrchen eluiert. 46 3.4.4 RNA – Konzentrationsbestimmung und Überprüfung der Reinheit Die RNA Konzentration wurde photometrisch (U-3000 Spektrophotometer, Hitachi, Österreich) unter Verwendung einer Quarzküvette (UV 6040, Hellma, Deutschland) im Anschluss an eine Kalibrierung, bestimmt. Hierfür wurde eine 1:100 Verdünnung der Probe mit RNase-freiem Wasser erstellt. Die Doppel-0HVVXQJHQ HUIROJWHQ EHL Ȝ QP und 280nm. Zur Berechnung der Konzentration an Nukleotiden wurde folgende Formel herangezogen (MÜLHARDT, 2009): Formel 1: Berechnung der RNA – Konzentration c>PlRNA / ml @ ODO 260 * H 40 * VF100 C = Konzentration der Ausgangslösung [μl RNA/ml] 2'Ȝ = Absorption bei 260nm İ = Extinktionskoeffizient für RNA = 40 VF100 = Verdünnungsfaktor Für die weitere Verwendung wurde der arithmetische Mittelwert der RNA - Konzentration beider Messungen berechnet. Um die RNA–Reinheit zu ermitteln, erfolgte auch eine Messung GHU 9HUGQQXQJ EHL Ȝ 280nm, welche dem Absorptionsmaximum von Proteinen entspricht. Der Quotient zwischen den beiden Absorptionswerten, welche pH abhängig sind, liefert Aufschluss über die RNA– Reinheit (MÜLHARDT, 2009). Für RNA gilt: OD260/280 = 2,0 Æ entspricht einer 100 %igen Reinheit 47 3.4.5 Reverse Transkription / cDNA Synthese Für die reverse Tanskription der gereinigten RNA zu cDNA wurde ein SuperScript III–Kit (Invitrogen by Life Technologies, Österreich). Zu jeweils 5 μg RNA wurden 1μl random hexamers Primer (50ng/ μl), 1μl 10mM dNTP mix hinzugefügt und auf 10μl mit sterilem Wasser aufgefüllt. Dieses Gemisch wurde für 5 Minuten bei 65°C inkubiert und daraufhin für mindestens 1 Minute auf Eis gekühlt. Die in Tabelle 14 angeführten Komponenten wurden in ein nukleasefreies Reaktionsgefäß überführt und vorsichtig gemischt. Tabelle 14: cDNA - Synthese - Reaktionsgemisch Substrat 10xRT Puffer 25mM MgCl2 0,1M DTT RNaseOUTTM (40U/μl) SuperScriptTM III RT (200U/μl) Volumen pro Reaktion 2 μl 4 μl 2 μl 1 μl 1 μl 10 μl Zu jedem RNA/Primer–Gemisch wurden 10μl des cDNA-Synthesemix hinzugefügt, schonend gemischt und durch kurzes zentrifugieren am Boden gesammelt. Das Gemisch wurde bei folgenden Temperaturen inkubiert: Tabelle 15: Reaktionsbedingungen für Reverse Transkription Reaktionsbedingungen Anlagerung der Randomhexamer - Primers Reverse Transkription Inaktivierung der Reversen Transkriptase 10 min. 50 min. 5 min. 25 °C 50 °C 85°C 48 Im nächsten Schritt wurden die Proben auf Eis gestellt und in jedes 1μl RNase H hinzu pipettiert und weitere 20 Minuten bei 37°C inkubiert. 3.4.6 Validierung GHUF'1$PLWWHOVȕ-Aktin PCR Zur Qualitätskontrolle der Nukleinsäuren wurde ȕ–Aktin als Referenzgen mittel PCR bestimmt. Bei den speziell gewählten, von Dipl.-Ing. Dr. Sabine Brandt entworfenen Primern handelte es sich um sogenannte „wobbel primer“ R =A/G, die das ȕ-Aktin-Gen mehrerer Spezies erkennen können. Verwendete Primer, PCR–Ansatz und –Bedingungen siehe Tabellen 16 & 17. Tabelle 16: Primer – Sequenzen Bezeichnung Sequenz (5´ Æ 3´) ȕ–Aktin TACA CCC ACA CTG TGC CCA TCT ACG (24) ¶ȕ–Aktin CGT CRT ACT CCT GCT TGC TGA TCC (24) 49 Tabelle 17: ß-Aktin PCR Ansatz und Reaktionsbedingungen ȕ–Aktin – PCR Reaktionsansatz 9ROXPHQ>ȝO@SUR5HDNWLRQ Substrat ȝO A.D. ȝO 5x Puffer HF (ThermoScientific) ȝO DMSO (Sigma-Aldrich) ȝO dNTP (Roche) ȝO ¶ȕ–Aktin 9ROIUSPROȝO (VBC Biotech) ȝO ¶ȕ–Aktin 9ROIUSPROȝO (VBC Biotech) ȝO Phusion DNA Polymerase (ThermoScientific) ȈȝO ȝO Reaktionsbedingungen 98 °C 2min. 98 °C 15 sec. 70 °C 30 sec 45x 72 °C 30 sec. 72 °C 5 min. & 98 °C 2min. cDNA ȈȝO Die PCR-Produkte wurden mittels Gelelektrophorese auf einem 1,5% Agarosegel in TAEPuffer mit dem DNA-Farbstoff Ethidiumbromid unter UV–Licht sichtbar gemacht und mittels FluorChem 3 Imaging System (Biozym, Österreich) fotografiert. Für die Herstellung des 1,5% Agarosegels wurden 2,25g Agarose in einen Erlenmeyerkolben eingewogen, mit 150ml TAE-Puffer aufgefüllt und für 4 Minuten in der Mikrowelle erhitzt. Anschließend wurde das flüssige Gel unter fließendem Wasser abgekühlt und 8μl Ethidiumbromid [10mg/ml] hinzupipettiert und in eine Gelkammer zur Aushärtung gegossen. Der TAE Puffer, wurde nach Standardmethode hergestellt. Die Reagenzien waren alle von Sigma-Aldrich, Österreich, hierfür wurden 4,84g Trisma Base (pH 8), 1,142ml CH3COOH, 0,744g Na-EDTAx 2H2O mit A.D. auf 1000ml aufgefüllt. Die gelelektrophoretische Auftrennung der PCR-Produkte erfolgte in einer Gelkammer (ComPhor L Midi, Bioplastics, Biozym) in TAE Puffer für 40 Minuten bei 110 Volt Gleichspannung. 50 3.4.7 Primer Effizienz Um die Primer Effizienz des MMP-1–Assays sowie des RPS–13–Assays in der qPCR (StepOne, Applied Biosystems by Life Technology, Österreich) im Vorfeld zu evaluieren, wurde eine 5–stufige geometrische Verdünnungsreihe mit ȝl cDNA aus einer equinen Melanomzellinie in Doppelbestimmung durchgeführt. Die nachfolgenden Konzentrationen wurden getestet: x 100ng/5μl x 50ng/5μl x 25ng/5μl x 12,5ng/5μl x 6,25ng/5μl Verwendete Primer, Probes (3´MGB/NFQ), siehe Tabelle 18 & 19, sowie alle verwendeten Reagenzien stammen von Applied Biosystems (Life Technology). Tabelle 18: Primer Sequenzen von MMP-1 MMP-1 – Primer Assay ID 03468020_m1 5´ – Reporter FAM (6-Carboxy-Fluorescein) Tabelle 19: Primer Sequenz von RPS-13 RPS-13 – Primer Vorwärtsprimer Sequenz (5´ Æ 3´) GTGCCCACTTGGCTGAAGTT Rückwärtsprimer Sequenz (3´ Æ 5´) TCTTGGCCAGCTTGTAGATCTG 5´ – Reporter VIC-CGTCTGACGACGACGTGAG 51 Die nachfolgende Tabelle 20 zeigt den Ansatz und die Reaktionsbedingungen für die qPCR. Tabelle 20: qPCR Ansatz und Reaktionsbedingungen Reaktionsansatz 9ROXPHQ>ȝO@SUR5HDNWLRQ Substanz ȝO Universal Master Mix MMP 1 Assay Mix FAM ȝO RPS 13 Assay Mix VIC ȝO A.D. Ȉ5 ȝO Master-Mix ȝO cDNA Reaktionsbedingungen 95 °C 10min. 95 °C 15min. 45 Zyklen 60 °C 1min. Für die Berechnung der Effizienz wurde folgende Formel herangezogen (PFAFFL, 2001): Formel 2: Berechnung der Effizienz Effizienz (%) = 10[-1/Steigung] Die Steigung basiert auf der linearen Funktion einer Geraden (http://rfdz.ph-noe.ac.at/fileadmin/lernpfade/lernpfad_schnittstelle89_funktionen/sites/06_lineare_fkt.html). Formel 3: lineare Funktion einer Geraden y = kx + d k = Steigung der Geraden d = Achsenabschnitt Die Gültigkeit der Aussage hängt von der tatsächlichen Übereinstimmung der 52 PCR-Effizienzen beider Gene ab. Generell ist eine Effizienz zwischen 90 und 110% zulässig (APPLIED BIOSYSTEMS BY LIFE TECHNOLOGIES, 2011). Je größer die Unterschiede sind, umso größer ist der Fehler der ǻǻCT-Methode (LIVAK u. SCHMITTGEN, 2001). Ein weiterer kritischer Parameter zur Evaluierung der PCR Effizenz ist R². Hierbei handelt es sich um einen statistischen Wert, welcher die Genauigkeit der einzelnen Parameter widerspiegelt. R² > 0,99 spricht für eine gute Korrelation zweier Messwerte (APPLIED BIOSYSTEMS BY LIFE TECHNOLOGIE, 2011). 3.4.8 qPCR Für die quantitative Bestimmung von MMP–1 wurden die in Tabelle 1 aufgelisteten Proben, mit einer cDNA Konzentration von 100ng/5ȝOPLWGHPVFKRQHUZlKQWHQ3URWRNRll in Tabelle 20 herangezogen. Für die Auswertung der Ergebnisse wurden folgende Kriterien festgelegt: 1. Sowohl MMP-1 als auch RPS–13 mussten in den Doppelbestimmungen nachweisbar sein 2. Maximaler Zyklus–Unterschied betrug 0,5 Zyklen Die Auswertung erfolgte mittels kompaUDWLYHUǻǻ&T–Methode: 1. durch Vergleich des Arithmetischen Mittelwertes 2. sowie im direkten Vergleich 53 Die Berechnung und Auswertung der Ergebnisse erfolgte auf Basis folgender Formeln (LIVAK u. SCHMITTGEN, 2001) entsprechend den Empfehlungen von Applied Biosystems by Life Technologies, Österreich: Formel 4%HUHFKQXQJǻ&T Mean Formel 5: kompaUDWLYHUǻǻ&T Meathode Wenn die Effizienz annähernd gleich ist, gilt für die ermittelten ǻCT Werte die nachfolgende Formel 6, um die n-fache Expression zu berechnen(APPLIED BIOSYSTEMS BY LIFE TECHNOLOGIES, 2001): Formel 6: n – fache – Expression n – fache - Expression = 2 - ǻǻ&7 54 4 Ergebnisse 4.1 Konzentration & Qualität der RNA Aufbauend auf den photometrisch gemessenen $EVRUEWLRQVTXRWLHQWHQȜ = 260nm und Ȝ = 280nm der Doppelbestimmung wurden die in Tabelle 21 stehenden Werte ermittelt. Tabelle 21: Arithmetische Mittelwerte der RNA Konzentration & -Qualität Proben – ID ARI BT CAL CT CH DIN DT DH DOL T DOL H DOL ZK 1 GT GH LT LH HAC MIR SCH Konzentration >QJȝO@ 507 480 340 520 420 760 660 333.33 2786 3162 1224 460 420 520 560 1080 1300 514 Qualität 1,81 3,43 1,42 4,33 5,25 1,81 2,36 3,13 1,32 1,65 1,88 4,60 10,50 1,13 4,00 2,02 1,68 1,76 55 4.2 ȕ-Aktin PCR Um die Reverse Transkription zu überprüfen, sowie sicherzustellen, dass die Proben aus LQWDNWHU 51$ JHZRQQHQ ZXUGHQ ZXUGH HLQH ȕ-Aktin PCR von allen Proben durchgeführt. Von allen 22 Proben konnte bei 17 Proben ȕ-Aktin nachgewiesen werden. Für die NTC wurde A.D. und als positive Kontrolle eine bereits bekannte DNA herangezogen. Abbildung 8: ß-Aktin-PCR 56 4.3 Primer Effizienz Wie im Methodenteil bereits beschrieben, wurde die Effizienz der Primer erfasst. Tabelle 22: ǻ&T – Berechung zur relativen Quantifizierung log [ng] 2,00 1,70 1,40 1,10 0,80 [ng] 100ng 50ng 25ng 12,5ng 6,25ng &ɬ0HDQ MMP-1 Assay 27,8922081 28,8907375 29,813055 30,8150406 31,7876091 &ɬ0HDQ536-13 Assay 24,1156731 25,7363091 26,2764988 27,3851833 28,4285393 ǻ&ɬ 3,77653503 3,15442848 3,53655624 3,42985725 3,35906982 Dabei wurde eine deutliche invers proportionale Zunahme des CT-Werts bei abnehmender Konzentration beobachtet (Tabelle 22) und in den nachfolgenden Abbildungen grafisch dargestellt (Abbildung 9 und 10). 57 Abbildung 9: MMP-1 Primer Effizienz ǻ&ɬ0HDQ MMP-1 Primer Effizienz y = 0,9715x + 26,925 R2 = 0,9999 33 32 31 30 29 28 27 26 25 2,00 1,70 1,40 1,10 0,80 log[ng] Abbildung 9: Ermittlung der MMP-1 Primer-Effizienz. Auf der X-Achse sind die logarithmierten Startkonzentrationen (umgerechnet aus der Menge cDNA) aufgetragen und auf der Y-Achse die gemessenen CT-Werte. Abbildung 10: RPS-13 Primer – Effizienz RPS-13 Primer Effizienz y = 1,0275x + 23,306 ǻ&ɬ0HDQ R2 = 0,9812 29 28 27 26 25 24 23 22 21 2,00 1,70 1,40 1,10 0,80 log [ng] Abbildung 10: Ermittlung der RPS-13 Primer-Effizienz. Auf der X-Achse sind die logarithmierten Startkonzentrationen (umgerechnet aus der Menge cDNA) aufgetragen und auf der Y-Achse die gemessenen CT-Werte. 58 Die nachfolgende Abbildung 11 vereint die ǻ&T beider Verdünnungsreihen. Die Annäherung der Steigung der Geraden an Null (-0,056) deutet, wie im Kapitel 3.4.7 beschrieben, auf eine annähernd gleiche Effizienz der beiden Analysen hin (LIVAK u. SCHMITTGEN, 2001). Abbildung 11: Vergleich der relativen Effizienz von MMP-1 und RPS-13 Vergleich der relativen Effizienz MMP-1 & RPS-13 y = -0,056x + 3,6191 3,9 3,8 3,7 ǻ&ɬ 3,6 3,5 3,4 3,3 3,2 3,1 3 2,00 1,70 1,40 lg [ng] Gesamt RNA 1,10 0,80 59 Die nachfolgenden Abbildungen (Abbildung 12 und Abbildung 13) zeigen auf der X-Achse die CT–Werte (Cycle), auf der Y-$FKVH GLH JHPHVVHQHQ )OXRUHV]HQ]HQ ǻ5Q und die Korrelation der Grafen der einzelnen Konzentrationen, welche in Doppelbestimmung durchgeführt wurden. Abbildung 12: Darstellung der PCR-Amplifikation des MMP-1-Assays Abbildung 13: Amplifikation Plot RPS-13 60 4.4 qPCR Die Ergebnisse der qPCR wurden, wie im Methodenteil bereits beschrieben, ermittelt und ausgewertet. 4.4.1 Messergebnisse der Melanom-, Zellkultur- und Hautproben Die nachfolgende Tabelle 23 liefert die CT – Werte (CT) der Doppelbestimmung des MMP-1 und RPS-13 Assays, sowie die berechnete CT Differenz (CTDiff.), den CT Mittelwert (CT Mean) und die daraus errechnete Normalisierung des jeweiligen Gens (ǻCT). Die Ergebnisse der Melanomproben ARI, CAL, DIN und DOL T, sowie der Hautproben CH, GH, HAC und SCH wurden im Rahmen dieser Arbeit aufgrund fehlender Ergebnisse in der Doppelbestimmung bzw. zu hoher Zyklus-Unterschiede ausgeschlossen. Aus diesem Grund HUIROJWHGLH$XVZHUWXQJQXUIUGHUȕ-Aktin positiven Proben. 61 Tabelle 23: CT – Werte Proben – ID BT CT DT DH DOL H DOL ZK 1 GT LT LH MIR Target – Name RPS13 RPS13 MMP1 MMP1 RPS13 RPS13 MMP1 MMP1 RPS13 RPS13 MMP1 MMP1 RPS13 RPS13 MMP1 MMP1 RPS13 RPS13 MMP1 MMP1 RPS13 RPS13 MMP1 MMP1 RPS13 RPS13 MMP1 MMP1 RPS13 RPS13 MMP1 MMP1 MMP1 MMP1 RPS13 RPS13 RPS13 RPS13 MMP1 MMP1 CT 32,350 32,755 32,783 32,927 32,656 33,114 34,087 34,414 29,977 30,070 30,535 30,557 30,400 30,720 36,879 36,888 36,526 36,931 35,324 36,245 25,510 25,883 25,793 25,844 35,366 36,015 30,360 30,493 30,640 31,024 30,798 30,947 36,386 37,192 30,850 31,090 26,560 26,676 31,725 31,822 CT Diff. 0,405 CT Mean ǻ CT 32,552 0,303 0,144 32,855 0,458 32,885 1,365 0,327 34,250 0,093 30,024 0,522 0,022 30,546 0,320 30,560 0,009 36,883 6,323 0,405 36,729 -0,944 0,921 35,784 0,373 25,697 0,050 25,819 0,648 35,691 0,122 -5,264 0,133 30,427 0,384 30,832 0,041 0,150 30,873 0,807 36,789 0,240 30,970 0,116 26,618 5,819 5,155 0,098 31,773 62 4.4.2 Auswertung im Arithmetischen Mittelwertvergleich Die nachfolgende Tabelle 24 vergleicht alle Haut und Melanomproben im arithmetischen Mittelwert Vergleich. Tabelle 24: Arithmetischer Mittelwertvergleich Haut - Proben Proben – ID ǻCT - Wert DH 6,32312775 DOL H -0,94437408 LH 5,81921387 Mittelwert ǻǻCT 2-ǻǻ&7 ǻCT Haut Melanom - Proben Proben – ID ǻCT – Wert BT 0,303 CT 1,365 DT 0,522 GT -5,264 LT 0,041 MIR 5,155 3,73265585 ǻCT Melanom 0,35366667 -3,37898918 10,40344315 Die Berechnung des Arithmetischen Mittelwertes der Haut- und Tumorproben zeigt eine 10fache Hochregulierung der MMP-1 Expression im Melanom im Vergleich zur Haut. 63 4.4.3 Relative Quantifizierung mittels kompaUDWLYHUǻǻCT Methode Die nachfolgende Tabelle 25 vergleicht die Expression von MMP-1 im Melanom zur Haut beim selben Pferd, sowie die Expression von einer etablierten primären Melanomzelllinie zur Haut des Pferdes. Tabelle 25: RelatiYH4XDQWLIL]LHUXQJPLWWHOVNRPSDUDWLYHUǻǻCT – Methode Nummer #1 #2 #3 Proben - ID DT DH LT LH DOL ZK 1 DOL H ǻCT Melanom ǻCT Haut 0,52229881 6,32312775 0,0407753 5,81921387 0,12181854 0,94437408 ǻǻCT = ǻCT Melanom – ǻCT Haut 2-ǻǻCT -5,8008 55,746 -5,7784 54,887 1,0662 0,4775 Die Melanom-Proben DT und LT zeigen eine deutliche Hochregulation von MMP-1 im Vergleich zur Haut desselben Pferds. Auffällig ist, dass Melanomzelllinie eine deutlich niedrigere Expression aufweist. 64 4.5 Zusammenfassung der Ergebnisse Im Vorfeld wurde die Konzentrationsbestimmung über Messung der optischen Dichte sowie der Reinheit bestimmt. Daran angeschlossen wurde eine qualitative ȕ-Aktin-PCR durchgeführt, um den erfolgreichen DNase-Verdau und die reverse Transkription zu überprüfen. Die PCR Produkte wurden hierfür mittels Gelelektrophorese aufgetrennt und mittels Ethidiumbromidfärbung visualisiert. Nach diesen beiden Arbeitsschritten wiesen 5 von 22 Proben auf mangelnde Qualität hin. Die Pimer-Effizienz errechnete sich für MMP-1 mit 100% und für RPS-13 mit 98%. Dies spricht, wie in Abbildung 11 grafisch dargestellt, für eine gute Übereinstimmung der PrimerEffizienzen beider Gene. Es zeigte sich eine deutliche invers proportionale Zunahme der CT Werte bei abnehmender Konzentration. Mittels qPCR konnte die quantitative Expression von MMP-1 in den Melanomproben, der Zelllinie und der Haut erfasst werden. Die Ergebnisse zeigten beim Vergleich der arithmetischen Mittelwerte eine deutlich vermehrte Expression der MMP-1 Konzentration in Melanomproben, welche sich als 10-fache Hochregulation der Expression darstellte. Auch die Ergebnisse der relativen Quantifizierung zeigen eine deutlich vermehrte Expression der MMP-1 Konzentration, währenddessen die Expression in der Zelllinie geringer war als bei der kompaUDWLYHQǻǻCT – Methode (siehe Tabelle 25). 65 5 Diskussion Diese Diplomarbeit basiert auf ersten präliminären Ergebnissen einer RNA– Sequenzierungsanalyse der Forschungsgruppe Onkologie der Veterinärmedizinischen Universität Wien, welche eine Hochregulierung von MMP-1 in 3 Melanomen beim Schimmel im Vergleich zu 3 Hautproben zeigen konnte. Die Kenntnis aus der Humanmedizin, dass MMP-1 in verschiedenen Tumoren hochreguliert ist (FOLEY et al., 2012), sowie der Nachweis, dass MMP-1 auch im equinen Sarkoid vermehrt exprimiert ist (YUAN et al., 2011) ermutigte ebenfalls zu dieser Studie. In dieser Arbeit wurde die MMP-1 Expression in einer größeren Anzahl von Schimmelmelanomen im Vergleich zur gesunden Schimmelhaut untersucht. Dabei sollte geklärt werden, ob eine Hochregulation auf mRNA-Ebene wie von den RNASequenzierungsergebnissen suggeriert, tatsächlich vorliegt. Für die Aufarbeitung dieser Fragestellung erfolgte eine RNA-Isolierung mit anschließendem DNAse-Verdau und Clean-up von insgesamt 9 Tumor-, 8 Hautproben und einer primären Melanomzelllinie. Der Ziel des Clean-up war es, das Melanin weitestgehend aus der Probe zu entfernen, da ECKHART et al. (2000) beschrieben haben, dass Melanin ein potenter Inhibitor der thermostabilen DNA Polymerase in vitro ist und dass der inhibitorische Effekt sich einerseits aus der irreversiblen und andererseits aus der reversiblen Polymerase-Melanin Interaktion zusammensetzt. Dies begründet, warum trotz Clean-up stark-melaninhaltige Proben wie DOL T in der PCR kein Ergebnis lieferten. Zur Bestimmung der Qualität und Reinheit der RNA wurde die Methode der Absorptionsspektrometrie gewählt. Die Berechnung der Reinheit (260/280 Ratio) lieferte bei den Proben, BT, CT, CH, DT, DH, GT, GH, LH, HAC über das erwartete Maß hinaus hohe Werte. Dieses Ergebnis macht die RNA – Konzentration fraglich. Über die im Methodenteil erklärte Messung und Berechnung der Reinheit besteht Einigkeit in der Literatur, jedoch gibt es Publikationen, welche darauf hinweisen, dass die Messungen sowohl vom pH als auch vom 66 Salzgehalt des verwendeten Wassers abhängig sind, und infolgedessen Unterschiede in der errechneten Konzentration entstehen können (MÜLHARDT, 2009). Von allen getesteten cDNAs konnten nach Anwendung aller Ausschlusskriterien zur Wahl der Qualität leider nur 2 Proben mittels kompaUDWLYHU ǻǻCT Methode ausgewertet werden. Die Ergebnisse zeigten, sowie auch schon aus der Humanmedizin bekannt (HOFMANN et al., 2000), eine vermehrte Expression von MMP-1. Ein weiterer interessanter Aspekt dieser Arbeit ist, dass die MMP-1 Expression von in Zellkultur kultivierter, primärer Melanomzellen deutlich niedriger war, als in den Melanomproben. Auch YUAN et al. (2010) hat schon beobachtet, dass die MMPs in Zelllinien nicht im selben Ausmaß wie in Tumorproben exprimiert werden. Er führt dies auf die unterschiedliche Variabilität zwischen natürlich vorkommenden Tumoren und im Rahmen der Kultivierung und Subkultivierung entstandenen Veränderungen zurück (YUAN et al., 2010). Möglicherweise steht diese Veränderung der MMP-1-Expression in vitro mit der fehlenden Wechselwirkung mit umliegendem Gewebe im Zusammenhang. Zusammenfassend bestätigen die hier angeführten Resultate die Ergebnisse der RNASequenzierungsanalyse sowie die Arbeitshypothese dieser Forschungsarbeit. In der Humanmedizin ist die Überexpression von MMP-1 sowohl in vitro als auch in vivo nachgewiesen und wird sowohl mit chronischen Hautwunden als auch mit verschiedenen Neoplasien assoziiert (NIKKOLA et al., 2002). HOFMAN et al., (2000) beschreiben den Nachweis der vermehrte Expression von MMP-1, neben anderen MMPs, auch im Melanom. NIKKOLA et al., (2002) haben nachweisen können, dass Patienten mit MMP-1 positiven Metastasen eine kürzere symptomfreie Zeit aufweisen konnten, im Vergleich zu Patienten mit MMP-1 negativen Metastasen (NIKKOLA et al., 2002). Darüber hinaus ist ihnen aufgefallen, dass die Anwesenheit von Melanin mit einem hohen Expressionslevel von MMP-1 korreliert (NIKKOLA et al., 2002). Die Ergebnisse dieser Forschungsarbeit liefern für das Schimmelmelanom in der Veterinärmedizin den entsprechenden ersten Nachweis. Jedoch kann auf Grund fehlender 67 Studien in diesem Bereich noch nicht auf einen Zusammenhang zwischen vermehrter Expression und kürzerer Überlebenszeit der Patienten geschlossen werden. Die vermehrte Expression von MMP-1 korreliert in der Humanmedizin mit Tumorinvasion und somit mit einer schlechteren Prognose und einer kürzeren Überlebenszeit der Patienten (NIKKOLA et al., 2002). Hierzu gibt es in der Tiermedizin auf Grund fehlender Studien keine Daten. Bisher ist in der Veterinärmedizin nur bekannt, dass eine Papillomavirusinfektion mit einer vermehrten Synthese der MMPs in Sarkoidzellen in Zusammenhang steht, wobei im Speziellen virale Onkogene dafür mitverantwortlich gemacht werden (YUAN et al., 2011). Neben seiner Rolle als Diagnose- und Prognosewerkzeug kann auch darüber diskutiert werden, ob MMP-1 als sinnvoller Marker zur Verlaufs- und Therapiekontrolle herangezogen werden kann. So zeigte sich in der Humanmedizin, dass die Vermehrte Expression von MMP2 und MMP-9 mit der Invasivität und Progression des Melanoms korrelieren. Während MMP1 und MMP-13 mit der Invasion der Primärtumore in Verbindung gebracht werden (NIKKOLA et al., 2002). Als neue Therapiestrategie wird die Hemmung von MMPs mit niedermolekularen Substanzen in der Humanmedizin gerade erforscht. Es zeigte sich, dass ein chemisch modifiziertes nicht antibiotisches Tetrazyklin-Derivat nur die MMP-2 und MMP-9 Expression erfolgreich inhibierte (HOFMANN et al., 2005). In der Veterinärmedizin liegen zu diesem Thema noch keine Forschungsergebnisse vor. Die weitere Forschung am Melanom des Schimmels soll dem Pferdepatienten zu Gute kommen, ein besseres Verständnis zu die Ätiologie, Krankheitsverlauf und Metastasierung liefern. Dies wiederum kann zu verbesserten therapeutischen Strategien führen, von denen sowohl die Veterinärmedizin als auch die Humanmedizin profitieren können. 68 6 Zusammenfassung Melanome gehören zu den melanozytären Tumoren und treten bei Pferden aller Rassen, unterschiedlichen Alters, verschiedener Fellfarbe und unabhängig von ihrem Geschlecht auf. Sie zählen zu den häufigsten Neoplasien der Haut. Ihre Bedeutung in der Veterinärmedizin ist nicht zu unterschätzen, vor allem Schimmel weisen eine ausgeprägt hohe Prävalenz auf. Die klinisch-pathologische Natur der Melanome beim Schimmel wird auf Grund des besonderen Verhaltens seit mehr als 200 Jahren diskutiert. Zu den häufigsten Prädilektionsstellen zählen Schweifrübenunterseite und anogenital Region, aber auch Augen sowie deren Lider, Lippen, Nacken und Parotisregion. Nicht zuletzt die bis jetzt weitgehend ungeklärte Ätiologie, die Unterschiede zur Humanmedizin und fehlende Therapieerfolge im fortgeschrittenen Stadium machen das equine Melanom forschungsrelevant. Gegenstand der hier präsentierten Arbeit war es, die MMP-1 Expression in Melanomen und intakter Haut von Schimmeln auf mRNA-Ebene vergleichend zu analysieren. Melanomproben von 9 Pferden wurden einer RNA-Extraktion und cDNA Synthese zugeführt. Erfolg des DNase-Verdaus und PCR kompatible Qualität wurden mittels einer ȕ-Aktin-PCR ermittelt und die mRNA-Levels von MMP-1 mittels qPCR untersucht. Die Ergebnisse zeigten in beiden Auswertungsmethoden, Summen- und Einzelvergleich, eine vermehrte Expression von MMP-1 im Vergleich zu intakter Haut und eine geringere Überexpression in einer Melanomzellkultur. Zusammengefasst bestätigen die hier präsentierten Daten die Arbeitshypothese, dass die Expression von MMP-1 im Melanom im Vergleich zur gesunden Haut hochreguliert ist. Schlüsselwörter: Pferd, Schimmel, Hautneoplasie, Melanom, Haut, MMP-1, RPS-13, qPCR, komparative ǻǻ CT Methode 69 7 Extended Summary Melanomas are melanocytic tumours seen in horses of any breed, coat colour or age, without any gender predilection. They are very common skin-tumours. The particular importance of melanomas should not be underestimated in veterinary medicine, especially because grey horses show a high prevalence. The clinical and pathological nature of equine melanoma has been discussed for over 200 years because of their special clinical behavior. Typical sites of melanoma development are underneath the tail and in the perianal region, eyes, eyelids, lips, neck and parotid salivary gland. The largely unknown aetiology, the differences to human melanomas and the lack of effective strategies for treatment of advanced stages of melanoma are the main reasons for performing melanoma research. The aim of the current project was to confirm primliminary data on the up-regulation of MMP-1 mRNA in melanoma of grey horses. To this aim, 9 tumour samples, 8 skin samples and one melanoma cell line were subjected to RNA extraction and subsequent reverse transcription of the latter to cDNA. Successful DNase digestion and amplification-compatible quality of cDNA was confirmed by ȕ-actin PCR. Subsequently MMP-1 mRNA levels in tumour tissue and cells versus intact skin were assessed by qPCR. As it was not possible to use comparative ǻǻCT analysis in all cases the arithmetic mean of tumour, skin and cell culture have been compared. Both analytical methods yielded comp… results, i.e. an up regulation of MMP-1 mRNA in equine melanoma and to a lesser extend, in an equine primary melanoma cell line in comparison to intact horse skin. Accordingly the results of this work support the working hypothesis. Keywords: horse; grey-horse; skin neoplasia; grey-horse-melanoma; skin; MMP-1; RPS-13; qPCR; comparative ǻǻCT method; 70 8 Literaturverzeichnis APPLIED BIOSYSTEMS BY LIFE TECHNOLOGIES (1) APPLICATION NOTE REAL – TIME PCR: UNDERSTANDING CT (2011) http://www.lifetechnologies.com/content/dam/LifeTech/migration/en/filelibrary/nucleic-acidamplification-expressionprofiling/pdfs.par.70657.file.dat/understanding%20ct%20application%20note.pdf (2) USER BULLETIN #2 ABI PRISM 7700 SEQUENCE DETECTION SYSTEM (1997, letztes Update: 10/2001) http://www3.appliedbiosystems.com/cms/groups/mcb_support/documents/generaldocuments/cms_0409 80.pdf AYAD, S., BOOT-HANDFORD, R.P., HUMPHRIES, M.J., KADLER, K.E., SHUTTLEWORTH, C.A. (1998): The Extracellular Matrix Proteins. In: AYAD, S., BOOTHANDFORD, R.P., HUMPHRIES, M.J., KADLER, K.E., SHUTTLEWORTH, C.A.: The Extracellular Matrix Facts Book. 2. Aufl., Academic Press, 17 und 202-204. BENGTSTRÖM, J. (2011): Cutaneous Melanoma in the Grey Horse. Sveriges lantbruksuniversitet, Institutionen för biomedicin och folkhälsovetenskap. Examensarbete 2011:52 BERGMAN, P.J., MCKNIGHT, J., NOVOSAD, A., CHARNEY, S., FARRELLY, J., CRAFT, D., WULDERK, M., JEFFERS, Y., SADELAIN, M., HOHENHAUS, A.E., SEGAL, N., GREGOR, P., ENGELHORN, M., RIVIERE, I., HOUGHTON, A.N., WOLCHOK, J.D. (2003): Long-Term Survival of Dogs with Advanced Malignant Melanoma after DNA Vaccination with Xenogeneic Human Tyrosinase: A Phase I Trial. Clinical Cancer Research 9,1284-1290. 71 BOURBOULIA, D., STETLER-STEVENSON, W.G. (2010): Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): Positive and negative regulators in tumor cell adhesion. Seminars in cancer biology 20, 161-168. BURDEN, K. (2011): Melanomas and their effect on the grey horse. Young Scientists Journal 10, 75-81. CURIK, I., DRUML, T., SELTENHAMMER, M., SUNDSTRÖM, E., PIELBERG, G.R., ANDERSSON, L., SÖLKNER, J. (2013): Complex inheritance of melanoma and pigmentation of coat and skin in Grey horses. PLoS genetics 9, e1003248. ECKHART, L., BACH, J., BAN, J., TSCHACHLER, E. (2000): Melanin binds reversibly to thermostable DNA polymerase and inhibits its activity. Biochemical and biophysical research communications 271, 726-730. FERRONE, S. (2012): From Basic Reasearch to Clinical Application. 2. Aufl., Springer Verlag, Berlin-Heidelberg FOLEY, C.J., LUO, C., O'CALLAGHAN, K., HINDS, P.W., COVIC, L., KULIOPULOS, A. (2012): Matrix metalloprotease-1a promotes tumorigenesis and metastasis. The Journal of biological chemistry 287, 24330-24338. FOLEY, G.L., VALENTINE, B.A., KINCAID, A.L. (1991): Congenital and acquired melanocytomas (benign melanomas) in eighteen young horses. Veterinary Pathology 28, 363369. FOY, J.M., RASHMIR-RAVEN, A.M., BRASHIER, M.K. (2002): Common Equine Skin Tumors. Compendium 24, 242-254. GIRICZ, O., LAUER, J.L., FIELDS, G.B. (2010): Variability in melanoma metalloproteinase expression profiling. Journal of biomolecular techniques 21, 194-204. 72 HEWES, C.A. (2007): How to use bioabsorbable cisplatin beads to treat cutaneous neoplasia. Proceedings of the 53rd Annual Convention of the American Association of Equine Practitioners 53, 399-402. HOFMANN, U.B., HOUBEN, R., BROCKER, E.B., BECKER, J.C. (2005): Role of matrix metalloproteinases in melanoma cell invasion. Biochimie 87, 307-314. HOFMANN, U.B., WESTPHAL, J.R., VAN MUIJEN, G.N.P., RUITER, D.J. (2000): Matrix Metalloproteinaes in Human Melanoma. Journal of Investigative Dermatology 115, 337 – 344. KNOTTENBELT, D.C. (2009): Melanoma and Melanosarcoma. In: KNOTTENBELT, D.C: Pascoe´s Principles & Practice of Equine Dermatology. 2. Aufl., Saunders Elsevier Science, S. 421-426. LIPPERT, B. (1999): Cisplatin: chemistry and biochemisty of a leading anticancer drug. New York, Wiley-VCH LIU, H., WEI, Q., GERSHENWALD, J.E., PRIETO, V.G., LEE, J.E., DUVIC, M., GRIMM, E.A., WANG, L.E. (2012): Influence of single nucleotide polymorphisms in the MMP1 promoter region on cutaneous melanoma progression. Melanoma research 22, 169-175. LIVAK, K.J., SCHMITTGEN, T.D. (2001): Analysis of relative gene expression data using real-time quantitative PCR and the 2-ǻǻ&7 Method. Methods 25, 402-408. MACGILLIVRAY, K.C., SWEENEY, R.W., DEL PIERO, F. (2002): Metastatic melanoma in horses. Journal of Veterinary Internal Medicine 16, 452-456. MEUTEN, D.J. (2002): Melanocytic Tumors. In: MEUTEN, D.J.: Tumors in Domestic Animals. 4 Aufl., Iowa State Press, S.78-84. MISCHKE, R. (2005): Melanome. In: MISCHKE, R.: Zytologisches Praktikum für die Veterinärmedizin. Schlütersche, Hannover, S.125 – 129. 73 MOORE, J.S., SHAW, C., SHAW, E., BUECHNER-MAXWELL, V., SCARRATT, W.K., CRISMAN, M., FURR, M., ROBERTSON, J. (2012): Melanoma in horses: Current perspectives. Equine Veterinary Education 25, 144-151. MÜLHARDT, C. (2009): Konzentrationsbestimmung von Nucleinsäurelösungen. In: MÜLHARDT, C.: Der Experimentator Molekularbiologie/Genomics. 6.Aufl., Spektrum Akademischer Verlag Heidelberg, S.42 – 44. NIKKOLA, J., VIHINEN, P., VLAYKOVA, T., HAHKA-KEMPPINEN, M., KÄHÄRI, V., PYRHÖNEN, S. (2002): High expression levels of collagenase-1 and stromelysin-1 correlate with shorter disease-free survival in human metastatic melanoma. International Journal of Cancer 97, 432-438. OH, J., TAKAHASHI, R., KONDO, S., MIZOGUCHI, A., ADACHI, E., SASAHARA, R.M., NISHIMURA, S., IMAMURA, Y., KITAYAMA, H., ALEXANDER, D.B., IDE, C., HORAN, T.P., ARAKAWA, T., YOSHIDA, H., NISHIKAWA, S., ITOH, Y., SEIKI, M., ITOHARA, S., TAKAHASHI, C., NODA, M. (2001): The membrane-anchored MMP inhibitor RECK is a key regulator of extracellular matrix integrity and angiogenesis. Cell 107, 789-800. PARDO, A., SELMAN, M. (2005): MMP-1: the elder of the family. The international journal of biochemistry & cell biology 37, 283-288. PFAFFL, M.W. (2001): A new mathematical mode for relative quantification in real-time RT-PCR. Nucleic Acid Reasearch 29, 2002-2007. PHILLIPS, J.C., LEMBCKE, L.M., NOLTENIUS, C.E., NEWMAN, S.J., BLACKFORD, J.T., GROSENBAUGH, D.A., LEARD, A.T. (2012): Evaluation of tyrosinase expression in canine and equine melanocytic tumors. American Journal of Veterinary Research 73 (2): 272278 PIELBERG, G.R., GOLOVKO, A., SUNDSTRÖM, E., CURIK, I., LENNARTSSON, J., SELTENHAMMER, M.H., DRUML, T., BINNS, M., FITZSIMMONS, C., LINDGREN, G., 74 SANDBERG, K., BAUMUNG, R., VETTERLEIN, M., STRÖMBERG, S., GRABHERR, M., WADE, C., LINDBLAD-TOH, K., PONTÉN, F., HELDIN, C.H., SÖLKNER, J., ANDERSSON, L. (2008): A cis-acting regulatory mutation causes premature hair graying and susceptibility to melanoma in the horse. Nature Genetics 40, 1004-1009. PSCHYREMBEL (2012): Klinisches Wörterbuch 2013. 264. überarbeitete Auflage, Verlag Walter de Gruyter, Berlin/Bosten. ROONEY, J.R., ROBERTSON, J.L. (1996): Melanoma. In: ROONEY, J.R., ROBERTSON, J.L.: Equine Pathology. 1. Aufl., Iowa State University Press, S. 304-305. ROWE, E.L., SULLINS, K.E. (2004): Excision as treatment of dermal melanomatosis in horses: 11 cases (1994-2000). Journal of the American Veterinary Medical Association 225, 94-96. SATYAMOORTHY, K., LI, G., VAN BELLE, P.A., ELDER, D.E., HERLYN, M. (2002): A versatile method for the removal of melanin from ribonucleic acids in melanocytic cells. Melanoma research 12, 449-452. SCHÖNIGER, S., SUMMERS, B.A. (2009): Equine skin tumours in 20 horses resembling three variants of human melanocytic naevi. Veterinary Dermatology 20, 165-173. SCOTT, D.W., MILLER, W.H. (2003): Melanocytic Neoplasms. In: SCOTT, D.W., MILLER, W.H.: Equine Dermatology. Saunders Elsevier Science, St. Louis, Missouri, S. 764-773. SELTENHAMMER, M.H., VETTERLEIN, M., NEUMÜLLER, J., MAJDIC, O., KOHL, P., NIEBAUER, G.W. (2006): Establishment and Characterisazation of Melanoma Cell Lines Derived from Grey Horses. DVG-Tagung , Hannover, Germany, 10.-11.2.2006. SELTENHAMMER, M.H., SIMHOFER, H., SCHERZER, S., ZECHNER, R., CURIK, I., SOLKNER, J., BRANDT, S.M., JANSEN, B., PEHAMBERGER, H., EISENMENGER, E. (2003): Equine melanoma in a population of 296 grey Lipizzaner horses. Equine veterinary journal 35, 153-157. 75 SELTENHAMMER, M. (2000): Vergleichende Untersuchungen zum Equinen und Humanen Melanom. Dissertation, Vet. Med. Univ. Wien SHARFMAN, W.H., ABRAHAM, J. (2012): Melanoma: Emerging Cancer Therapeutics. Demos Medical Publishing LLC, New York, USA SHELLY, W., DRAPER, M.W., KRISHNAN, V., WONG, M., JAFFE, R.B. (2008): Selective estrogen receptor modulators: an update on recent clinical findings. Obstet Gynecol Surv 63, 163-181 SMITH, S.H., GOLDSCHMIDT, M.H., MCMANUS, P.M. (2002): A Comparative Review of Melanocytic Neoplasms. Veterinary Pathology 39, 651-678. STATISTIK AUSTRIA (2012): Krebsinzidenz und http://www.statistik.at/web_de/statistiken/gesundheit/krebserkrankungen/; Mortalität in Österreich; Erscheinungsdatum: 07/2012. THÉON, A.P., WILSON, W.D., MAGDESIAN, K.G., PUSTERLA, N., SNYDER, J.R., GALUPPO, L.D. (2007): Long-term outcome associated with intratumoral chemotherapy with cisplatin for cutaneous tumors in equidae: 573 cases (1995-2004). Journal of the American Veterinary Medical Association 230, 1506-1513. VALENTINE, B.A. (1995): Equine melanocytic tumors: a retrospective study of 53 horses (1988 to 1991). Journal of Veterinary Internal Medicine 9, 291-297. YUAN, Z., GAULT, E.A., CAMPO, M.S., NASIR, L. (2011): Upregulation of equine matrix metalloproteinase 1 by bovine papillomavirus type 1 is through the transcription factor activator protein-1. The Journal of general virology 92, 2608-2619. YUAN, Z., GOBEIL, P.A., CAMPO, M.S., NASIR, L. (2010): Equine sarcoid fibroblasts over-express matrix metalloproteinases and are invasive. Virology 396, 143-151. http://rfdz.ph-noe.ac.at/fileadmin/lernpfade/lernpfad_schnittstelle89_funktionen/sites/06_lineare_fkt.html 76 9 Abbildungs-, Formel- und Tabellenverzeichnis 9.1 Abbildungsverzeichnis Abbildung 1: Struktureller Aufbau von MMPs........................................................................25 Abbildung 2: Pferd # 2 .............................................................................................................37 Abbildung 3: Pferd # 4 .............................................................................................................38 Abbildung 4: Pferd # 6 .............................................................................................................39 Abbildung 5: Pferd # 7 .............................................................................................................40 Abbildung 6: Pferd # 8 .............................................................................................................41 Abbildung 7: Pferd # 9 .............................................................................................................42 Abbildung 8: ß-Aktin-PCR.......................................................................................................55 Abbildung 9: MMP-1 Primer Effizienz....................................................................................57 Abbildung 10: RPS-13 Primer – Effizienz ...............................................................................57 Abbildung 11: Vergleich der relativen Effizienz von MMP-1 und RPS-13 ............................58 Abbildung 12: Darstellung der PCR-Amplifikation des MMP-1-Assays ................................59 Abbildung 13: Amplifikation Plot RPS-13 ..............................................................................59 77 9.2 Formelverzeichnis Formel 1: Berechnung der RNA – Konzentration....................................................................46 Formel 2: Berechnung der Effizienz ........................................................................................51 Formel 3: lineare Funktion einer Geraden................................................................................51 Formel 4%HUHFKQXQJǻ&T Mean ...........................................................................................53 )RUPHONRPSDUDWLYHUǻǻ&T Meathode.................................................................................53 Formel 6: n – fache – Expression .............................................................................................53 78 9.3 Tabellenverzeichnis Tabelle 1: Proben – Umfang.....................................................................................................34 Tabelle 2: Pferd # 1 ..................................................................................................................36 Tabelle 3: Pferd # 2 ..................................................................................................................37 Tabelle 4: Pferd # 3 ..................................................................................................................37 Tabelle 5: Pferd # 4 ..................................................................................................................38 Tabelle 6: Pferd # 5 ..................................................................................................................38 Tabelle 7: Pferd # 6 ..................................................................................................................39 Tabelle 8: Pferd # 7 ..................................................................................................................40 Tabelle 9: Pferd # 8 ..................................................................................................................41 Tabelle 10: Pferd # 9 ................................................................................................................42 Tabelle 11: Pferd # 10 ..............................................................................................................42 Tabelle 12: Pferd # 11 ..............................................................................................................43 Tabelle 13: Pferd # 12 ..............................................................................................................43 Tabelle 14: cDNA - Synthese - Reaktionsgemisch ..................................................................47 Tabelle 15: Reaktionsbedingungen für Reverse Transkription ................................................47 Tabelle 16: Primer – Sequenzen...............................................................................................48 Tabelle 17: ß-Aktin PCR Ansatz und Reaktionsbedingungen .................................................49 Tabelle 18: Primer Sequenzen von MMP-1 .............................................................................50 Tabelle 19: Primer Sequenz von RPS-13 .................................................................................50 Tabelle 20: qPCR Ansatz und Reaktionsbedingungen.............................................................51 Tabelle 21: Arithmetische Mittelwerte der RNA Konzentration & -Qualität ..........................54 7DEHOOHǻ&T – Berechung zur relativen Quantifizierung ...................................................56 Tabelle 23: CT – Werte .............................................................................................................61 Tabelle 24: Arithmetischer Mittelwertvergleich ......................................................................62 Tabelle 255HODWLYH4XDQWLIL]LHUXQJPLWWHOVNRPSDUDWLYHUǻǻ&T – Methode.........................63