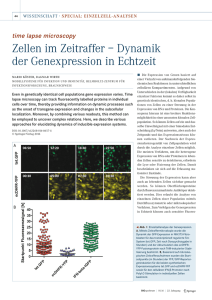
Nachweis und immunhistochemische Differenzierung von
Werbung

Aus der Klinik für Dermatologie, Venerologie und Allergologie des St. Josef- Hospitals Bochum -Universitätsklinik der Ruhr-Universität BochumDirektor: Prof. Dr. med. P. Altmeyer Nachweis und immunhistochemische Differenzierung von Entzündungszellen im Fettgewebe bei Patienten mit einer zirkumskripten Sklerodermie Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Melanie Cisewski aus Marl 2012 Dekan: Prof. Dr. med. Klaus Überla Referent: Prof. Dr. med. Alexander Kreuter Korreferent: Prof. Dr. med. Martina Bacharach-Buhles Tag der Mündlichen Prüfung: 28.05.2013 Abstract Cisewski, Melanie Nachweis und Differenzierung von Entzündungszellen im Fettgewebe bei Patienten mit einer zirkumskripten Sklerodermie Problem: Die zirkumskripte Sklerodermie ist eine Erkrankung aus dem Formenkreis der Kollagenosen. Ein bislang nicht abschließend geklärter Pathomechanismus führt zu einem sklerotischen Umbau der Haut. Je nach Subtyp können Dermis, Epidermis, Subkutis sowie die hautnahen extrakutanen Strukturen bestehend aus Faszien, Muskulatur und Knochen betroffen sein. Gegenstand der vorliegenden Arbeit war der Nachweis und die immunhistochemische Differenzierung von Entzündungszellen im Fettgewebe, im Sinne einer septalen Pannikulitis bei der zirkumskripten Sklerodermie um neue Erkenntnisse über den Pathomechanismus und ggf. Hinweise auf die zukünftige Therapie zu erlangen. Als Referenzgruppe wurde von uns ein Patientenkollektiv mit Erythema nodosum als Prototyp einer septalen Pannikulitis gewählt. Methoden: Mittels immunhistochemischer Färbetechnik erfolgte die Differenzierung der für eine Entzündungsreaktion wichtigen Zellpopulationen in T-Lymphozyten (CD3+), T-Helferzellen (CD4+), zytotoxische/T-Suppressorzellen (CD8+), Granulozyten (CD15+), B-Lymphozyten (CD20+) und Makrophagen (CD68+) im Fettgewebe bei 28 Patienten mit einer zirkumskripten Sklerodermie. Als Referenzgruppe verwendeten wir Hautproben von 20 Patienten mit der Diagnose eines Erythema nodosum. Ergebnisse: Die mikroskopische Auszählung der immunhistochemisch gefärbten Präparate ergab im Fettgewebe für die ZS im Vergleich zum EN signifikant weniger CD3+ (15,04±16,7 vs. 30,6±17,6; p< 0,002), CD8+ (10±12,5 vs. 18,3±10,9; p=0,00117) und CD68+ (14±15,8 vs. 38,7±13,4; p< 0,0001) positive Zellen. Kein signifikanter Unterschied ergab sich bei den Marken CD4 (negativ vs. 5,4±10,7; p=0,0790) und CD20 (15,7±25,7 vs. 5,6±6,5; p=0,7697). Diskussion: Die vorliegende Arbeit zeigt, dass immunhistochemische Zellen im Fettgewebe bei der zirkumskripten Sklerodermie sowie in der Referenzgruppe dem Erythema nodosum nachgewiesen werden können. Bis auf CD15 (Granulozyten) sowie CD4 (T-Helferzellen) bei der ZS ließen sich alle untersuchten Marker in den Proben nachweisen, was für den komplexen und bis dato nicht abschließend geklärten Pathomechanismus beider Krankheitsbilder spricht. Ein bedeutsamer Unterschied zwischen den Stichproben fand sich im quantitativen Auftreten von zytotoxischen CD3+/CD8+ Zellen bzw. von Makrophagen (CD68). Die Evaluation der Entzündungszellen im Fettgewebe bei der ZS soll in Zukunft ein besseres Verständnis des Pathomechanismus bei der ZS erbringen und ggf. therapeutische Konsequenzen daraus entwickeln lassen. Für Klaudia Inhaltsverzeichnis 1 Einleitung 1.1 Die Geschichte der Sklerodermie 1.2 Die zirkumskripte Sklerodermie 1.2.1 1.3 Seite 7 Definition der zirkumskripten Sklerodermie 1.3.1 Definition der systemischen Sklerodermie 1.3.2 Vergleich der systemischen Sklerodermie 1.4 Epidemiologie der zirkumskripten Sklerodermie 1.5 Ätiologie der zirkumskripten Sklerodermie 8-9 9 9 1.5.1 Trauma 10 1.5.2 Radiatio 10 1.5.3 Medikamente 10 1.5.4 Infektion 11 Klassifikation der zirkumskripten Sklerodermie 1.6.1 Übersicht der Klassifikation 11-12 1.6.2.1 Die limitierte Sklerodermie 12 1.6.2.2 Die Plaque Morphea 12 1.6.2.3 Die Guttata Morphea 13 1.6.2.4 Atrophodermia of Pierini-Pasini 13 1.6.3.1 Generalisierte Form der zirkumskripten Sklerodermie 13 1.6.3.2 Die eosinophile Fasziitis 13-14 1.6.3.3 Disabling pansclerotic morphea 14 1.6.4.1 Lineare Form der zirkumskripten Sklerodermie 14 1.6.4.2 Zirkumskripte Sklerodermie vom Typ ,,En coup de sabre“ 14 1.6.4.3 Progressive faziale Hemiatrophie 15 1.6.5.1 Tiefe Form der zirkumskripten Sklerodermie (Deep Morphea) 1.7 8 Die systemische Sklerodermie mit der zirkumskripten Sklerodermie 1.6 7 15 Diagnostik der zirkumskripten Sklerodermie 1.7.1 Laborchemische Parameter 1.7.2 Antikörperprofile bei der zirkumskripten Sklerodermie 15 16-17 1 1.8 Allgemeine Histopathologie der zirkumskripten Sklerodermie 17 1.9 Pathogenese der zirkumskripten Sklerodermie 18-19 1.10 Therapiemöglichkeiten 1.10.1 Topische Therapie 19-20 1.10.2 Die systemische Therapie 20 1.10.3 Phototherapie 20-21 1.10.4 Chirurgische Therapie 21-22 1.11 Die Pannikulitis 1.11.1 Definition der Pannikulitis 22 1.11.2 Klinisches Erscheinungsbild der Pannikulitis 22 1.12 Klassifikation und Einteilung der Pannikulitis 1.12.1 Lobuläre Pannikulitis: 23-24 1.12.2 Septale Pannikulitis: 24-25 1.13 Die Pannikulitis bei der zirkumskripten Sklerodermie 25-26 1.14 Das Erythema nodosum 1.14.1 Definition des Erythema nodosum 25 1.15 Epidemiologie und Ätiologie 26 1.16 Klinisches Erscheinungsbild des Erythema nodosum 26-27 1.17 Diagnostik des Erythema nodosum 27 1.18 Histologie des Erythema nodosum 27-28 1.19 Pathogenese des Erythema nodosum 28 1.20 Therapiemöglichkeiten des Erythema nodosum 28 1.21 Das Immunsystem im Rahmen einer Entzündung 28 1.22 Das angeborene oder unspezifische Immunsystem 29-30 1.23 Das adaptive Immunsystem 30 2 Aktuelle Zielsetzung 31 3 Material & Methoden 3.1 Einleitung 32 3.2 Das Patientenkollektiv 32-33 3.3 Entnahme und Herstellung der Gewebeproben 33 3.3.1 Gewebevorbehandlung und Paraffineinbettung 33-34 3.3.2 Entparaffinisierung und Färbevorbehandlung 34 3.4 Immunhistochemische Färbung der Gewebeschnitte 3.5 Immunhistochemische Marker 3.5.1 CD3 35-36 37 2 3.5.2 CD4 37-38 3.5.3 CD8 38 3.5.4 CD15 38 3.5.5 CD20 38 3.5.6 CD68 39 3.6 Auswertung der Gewebeschnitte 39-40 3.7 Auswertung und Statistik 40 4 Ergebnisse 4.1 Auswertung der HE gefärbten Präparate 4.2 4.1.1 Auswertung bei der zirkumskripten Sklerodermie 41 4.1.2 Auswertung beim Erythema nodosum 41 Auswertung der Immunhistochemie 4.2.1 Expression von CD3 im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.2 Expression von CD3 im Fettgewebe beim Erythema nodosum 4.2.3 42 42 Vergleich der CD3 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum 4.2.4 Expression von CD4 im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.5 43 Expression von CD4 im Fettgewebe beim Erythema nodosum 4.2.6 43 44 Vergleich der CD4 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum 4.2.7 Expression von CD15 im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.8 46 Expression von CD8 im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.10 45 Expression von CD15 im Fettgewebe beim Erythema nodosum 4.2.9 45 46 Expression von CD8 im Fettgewebe beim Erythema nodosum 47 3 4.2.11 Vergleich der CD8 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum 4.2.12 CD20 Expression im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.13 49 CD68 Expression im Fettgewebe bei dem Erythema nodosum 4.2.16 48 Expression von CD68 im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.15 48 CD20 Expression im Fettgewebe bei dem Erythema nodosum 4.2.14 47 50 Vergleich der CD68 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum 51 5 Diskussion 5.1 Die septale Pannikulitis bei der zirkumskripten Sklerodermie 52-53 5.2 Die septale Pannikulitis beim Erythema nodosum 53 5.3 Interpretation und Diskussion der immunhistologischen Untersuchung 54-60 5.4 Diskussion der Methodik 60-61 5.5 Perspektiven 61-62 6 Zusammenfassung 63 7 Literaturverzeichnis 64-81 Danksagung Lebenslauf 4 Abbildungsverzeichnis Abbildung 1: CD3 Expression im Fettgewebe bei der zirkumskripten Sklerodermie Abbildung 2: CD3 Expression im Fettgewebe beim Erythema nodosum Abbildung 3: 49 CD68 Expression im Fettgewebe bei der zirkumskripten Sklerodermie Abbildung 10: 48 CD20 Expression im Fettgewebe beim Erythema nodosum Abbildung 9: 47 CD20 Expression im Fettgewebe bei der zirkumskripten Sklerodermie Abbildung 8: 46 CD8 Expression im Fettgewebe beim Erythema nodosum Abbildung 7: 45 CD8 Expression im Fettgewebe bei der zirkumskripten Sklerodermie Abbildung 6: 44 CD4 Expression im Fettgewebe beim Erythema nodosum Abbildung 5: 43 Negative CD4 Expression im Fettgewebe bei der zirkumskripten Sklerodermie Abbildung 4: 42 50 CD68 Expression im Fettgewebe beim Erythema nodosum 51 5 Tabellenverzeichnis Tabelle 1: Verdünnungsangaben der verwendeten Antikörper Tabelle 2: Expressionsunterschiede immunhistochemisch 36 angefärbter Entzündungszellen im Fettgewebe bei Patienten mit einer zirkumskripten Sklerodermie (ZS) und Patienten mit einem Erythema nodosum (EN) 41 6 1 Einleitung 1.1 Die Geschichte der Sklerodermie Der Name Sklerodermie leitet sich aus den griechischen Wörtern skleros (hart) und derma (Haut) ab. Er ist ein Sammelbegriff für eine heterogene Krankheitsgruppe, welche die systemische Sklerose, die zirkumskripte Sklerodermie mit ihren klinischen Subtypen und die sogenannten Überlappungssyndrome umfasst. Die systemische Sklerodermie stellt eine chronisch-entzündliche Autoimmunerkrankung der Haut mit und ohne Beteiligung der inneren Organe dar (Miehle et al., 1999). Der Terminus Sklerodermie wird oft mit den Begriffen systemische Sklerodermie oder progressiv systemische Sklerose synonym verwendet, wodurch sich terminologische Probleme ergeben. Bereits in den Schriften von Hippocrates (460-370 v.Chr.) wurde von Fällen mit Hauterkrankungen ähnlich denen der Sklerodermie berichtet. Die erste sichere Beschreibung der Krankheit veröffentlichte im Jahre 1753 der italienische Arzt Carlo Curzio in einer Monographie. Hier beschrieb der Mediziner eine 17-jährige Patientin, die ihm mit einem Symptomkomplex aus umschriebenen Verhärtungen der Haut und perioralem Engegefühl zugewiesen worden war. Seine klinische Untersuchung ergab einen Wärmeverlust der Haut bei ungestörten peripheren Pulsen. Die sonstige Anamnese war unauffällig. Seine Behandlung bestand aus warmen Milch- und Dampfbädern, wiederholtem Aderlass und der Gabe von kleinen Dosen Quecksilber (Capusan, 1971). Ein Jahrhundert (1845) später folgte die erste Beschreibung von sklerodermiformen Erkrankungen mit systemischem Organbefall durch den französischen Mediziner Elie Gintrac (Gintrac, 2010). Das Alibert Keloid Syndrom war die erste detaillierte Beschreibung einer Morphea im Jahre 1854 (Addison, 1854). Die histopathologischen Veränderung der Sklerodermie mit ihren vermehrten Kollagenfaserbündeln und der verdickten Wandstruktur von Gefäßen wurde in der Arbeit von Matsui im Jahre 1924 erfasst (Matsui, 1924). 7 1.2 Die zirkumskripte Sklerodermie 1.2.1 Definition der zirkumskripten Sklerodermie Die zirkumskripte Sklerodermie ist eine Erkrankung aus dem Formenkreis der Kollagenosen. Bei der zirkumskripten Sklerodermie führen bislang nicht abschließend geklärte Pathomechanismen zu einem sklerotischen Umbau der Haut (Vierra and Cunningham, 1999; Kreuter, 2012). Je nach Subtyp können Dermis, Epidermis, Subkutis sowie hautnahe extrakutane Strukturen bestehend aus Faszien, Muskulatur und Knochen betroffen sein (Zulian et al., 2005; Zulian, 2004; Kreuter et al., 2009). Die zirkumskripte Sklerodermie ist nicht mit dem Raynaudsyndrom, der Akrosklerose oder einer inneren Organbeteiligung assoziiert (Jablonska and Blaszczyk, 2004). 1.3 Die systemische Sklerodermie 1.3.1 Definition der systemischen Sklerodermie Abzugrenzen ist die zirkumskripte Sklerodermie mit ihrer distinktiven Ätiologie, Verlauf und Prognose von der systemischen Sklerodermie (Harrison et al., 2009). Bei der systemischen Sklerodermie handelt es sich um eine chronisch verlaufende Systemerkrankung mit humoralen und zellulären Immunphänomenen im Rahmen einer Autoimmunerkrankung (Altmeyer and Bacharach-Buhles, 2002). Gekennzeichnet ist die systemische Sklerodermie durch einen sklerotischen Umbau der Haut, von verschiedenen inneren Organe sowie einer begleitenden obliterierenden Angiopathie. Neben den Hautsklerosen sind in erster Linie die Lunge, meist in Form einer Lungenfibrose oder pulmonal-arteriellen Hypertonie, die Speiseröhre mit dem Leitsymptom der Dysphagie und die Nieren, einhergehend mit einem renalen Hypertonus und einer chronischen Proteinurie, betroffen. Zudem kann es zu einer obliterierenden Vaskulopathie des Herzmuskels sowie zu Veränderungen im Bewegungsapparat kommen (Harrison et al., 2009; Steen and Medsger, 2000). Die systemischen Sklerodermie unterteilt sich in die zwei klinischen Unterformen, die limitierte systemische Sklerodermie und die diffuse systemische Sklerodermie, worauf im weiteren Verlauf nicht näher eingegangen werden soll. Die Verlaufsform 8 der systemischen Sklerodermie ist sehr variabel und geht je nach Schwere der Organbeteiligung und deren Komplikationen mit einer erhöhten Mortalität einher. 1.3.2 Vergleich der systemischen Sklerodermie mit der zirkumskripten Sklerodermie Ein Übergang einer zirkumskripten Sklerodermie in eine systemische Sklerodermie tritt so gut wie nie auf, wurde jedoch in Einzelfällen beschrieben (Takehara and Sato, 2005; Birdi et al., 1993; Mayorquin et al., 1994; Dehen et al., 1994). Solche Übergänge wurden vor allem im Kindesalter gesehen (Zulian, 2004). Kinder erkranken häufiger an einer zirkumskripten Sklerodermie, vor allem an der linearen Form (Vierra and Cunningham, 1999). Bei ihnen geht die Erkrankung mit einer Beteiligung des Skeletts, der Augen oder des Nervensystems einher (Marzaano et al., 2003). Die zirkumskripte Sklerodermie kann zur systemischen Sklerodermie ein sehr ähnliches histologisches Bild zeigen. Eine Abgrenzung ist mikroskopisch nicht möglich (Haustein and Mittag, 2003; Mc Kee et al., 2005). Im Frühstadium zeigt sich bei der systemischen Sklerodermie ein perivaskuläres, periadnexielles, diffuses Rundzellinfiltrat mit Lymphozyten, Plasmazellen und wenigen Makrophagen. Zudem kommt es zur Ausbildung eines Dermisödems sowie einer geringen Fibrose. Im Spätstadium zeigt sich die Dermis verbreitert. In der Dermis und Subkutis findet man perivaskuläre Rundzellinfiltrate sowie verbreiterte Kollagenfaserbündel. Im Fettgewebe kann eine septale sowie gemischte (lobulär/septal) Pannikulitis nachgewiesen werden. Es kommt zu einer Bindegewebsvermehrung. Die Histopathologie wird im Verlauf dieser Arbeit im Detail beschrieben (Haustein and Mittag, 2003; Mc Kee et al., 2005). 1.4 Epidemiologie der zirkumskripten Sklerodermie Die zirkumskripte Sklerodermie ist eine seltene Erkrankung, deren Inzidenz mit einer Häufigkeit von 27 pro 1 Millionen Einwohner angegeben wird (Peterson et al., 1997; Silman et al., 1988; Kreuter et al., 2009). An einer zirkumskripten Sklerodermie erkranken Frauen häufiger als Männer, die Ratio beträgt 2,6-6:1 (Silman and Black, 1988; Kreuter et al., 2009). 9 1.5 Ätiologie der zirkumskripten Sklerodermie Die Pathoätiologie der zirkumskripten Sklerodermie ist ein multifaktorieller Prozess, der bisher nicht endgültig geklärt ist (Fett and Werth, 2011; Kreuter, 2012). Diskutiert werden prädisponierende Faktoren wie körperliche Traumata, verschiedene Medikamente, Infektionskrankheiten oder autoimmunologische Prozesse (Blaszczyk et al., 1996; Fett and Werth, 2011). Sie könnten über eine Mikrozirkulationsstörung zu einer vermehrten Freisetzung von Adhäsionsmolekülen führen (Kreuter, 2012). 1.5.1 Trauma In zwei großen retrospektiven Studien konnte gezeigt werden, dass die Anamnese betroffener Patienten in bis zu 12% unterschiedliche körperliche Traumata als möglichen Auslösemechanismus ergab (Zulian et al., 2006; Christen-Zaech et al., 2008). So fanden sich Morphea-typische Läsionen nach diversen Impfungen (Masern, Mumps, Diphtherie, Tetanus, Keuchhusten, Hepatitis B) ebenso wie nach Vitamin-B12 oder Kalium–Injektionen (Torrelo et al., 2006; Ho et al., 2004). Diskutiert wurde, dass durch den Einstich selber oder durch die injizierten Vakzine ein überschießender Heilungsprozess angestoßen worden war. 1.5.2 Radiatio In der Literatur fanden sich verschiedene Fallbeschreibungen, in denen von einer neu aufgetretenen zirkumskripten Sklerodermie in Folge einer Radiotherapie berichtet worden war (Herrmann et al., 2009; Fett and Werth, 2011). 1.5.3 Medikamente Es werden Medikamente verschiedener Wirkstoffgruppen als mögliche Auslöser einer zirkumskripten Sklerodermie diskutiert (z.B. Bisoprolol, Bleomycin, Peplomycin, D-Penicillamine, Bromocriptine, L-5-Hydroxytryptophane in Kombination mit Carbidopa, Pentazozine, Balicabtib, Ibuprofen (Peroni et al., 2008; Fett and Werth, 2011). 10 1.5.4 Infektion In der Vergangenheit wurde oftmals ein Zusammenhang zwischen einer Infektion mit Borrelia burgdorferi und der klinische Manifestation einer Morphea diskutiert. So fand z.B. die Arbeitsgruppe um Eisendle in 51% ihres Patientenguts mit einer zirkumskripten Sklerodermie eine positive Borrelienserologie (Eisendle et al., 2007). Die Daten sind aber insgesamt widersprüchlich und eindeutige Beweise für einen pathogenetischen Zusammenhang zwischen einer Infektion mit Borrelia burgdorferi und der zirkumskripten Sklerodermie fehlt bislang (Buechner et al., 1993; Kreuter et al., 2009). 1.6 Klassifikation der zirkumskripten Sklerodermie Entsprechend dem breiten klinischen Spektrum der zirkumskripten Sklerodermie wurden in der Vergangenheit verschieden Klassifikationen vorgeschlagen (Kreuter et al., 2009). Im Jahre 1930 erfolgte durch O. Leary und Nomlands eine erste Einteilung der kutanen und systemischen Sklerodermie (O.Leary and Nomland, 1930). Es folgten eine Reihe weiterer Klassifikationen (Jablonska and Blaszczyk, 2004; Tuffanelli and Winkelmann, 1955; Schachter, 1989; Peterson et al., 1995). In 2008 wurde in der Leitlinie zur Diagnostik und Therapie der zirkumskripten Sklerodermie der Deutschen Dermatologischen Gesellschaft eine Klassifikation vorgeschlagen, welche das Ausmaß, die Ausbreitung und die Tiefe des fibrotischen Prozesses berücksichtigt (Kreuter et al., 2009; Kreuter et al., 2012). Hieraus resultiert eine Einteilung in die vier Hauptformen "limitiert, generalisiert, linear und tief". Vorteil dieser einfachen Klassifikation ist der eindeutige Bezug zu den therapeutischen Empfehlungen dieser Leitlinie. 1.6.1 Übersicht der Klassifikation Limitierte Form Morphea (Plaque-Typ); Morphea guttata (Sonderform der Morphea); Atrophodermia Pierini-Pasini (Sonderform der Morphea). 11 Generalisierte Form Generalisierte zirkumskripte Sklerodermie (Befall mindestens dreier anatomischer Areale); Disabling pansclerotic morphea (schwer verlaufende Sonderform); Eosinophile Fasziitis (Sonderform mit führendem Befall der Faszie). Lineare Form Lineare zirkumskripte Sklerodermie (meist Befall der Extremitäten); Linerare zirkumskripte Sklerodermie vom Typ ,,en coup de sabre“; Progressive fasziale Hemiatrophie (Synonym Parry Romberg Syndrom). Tiefe Form (Leitlinie zirkumskripte Sklerodermie 2009) 1.6.2.1 Die limitierte Sklerodermie Unterteilt wird die limitierte zirkumskripte Sklerodermie in die Subtypen Plaque Morphea, Morphea guttata und Atrophodermia of Pierini-Pasini. 1.6.2.2 Die Plaque Morphea Die Plaque Morphea ist die häufigste Form der zirkumskripten Sklerodermie und kommt in 70% beim Erwachsenen und in ca. 30% bei Kindern vor (Zulian et al., 2006). Makroskopisch zeigen sich in charakteristischer Weise größer als 1 cm durchmessende Herde, die in der Regel mindestens an ein bis zwei Lokalisationen auftreten. Die Prädilektionsstellen sind der Rumpf, insbesondere in der Submammärregion und der Übergang von der Hüft- zur Inguinalregion (Kreuter et al., 2009; Peterson et al., 1995). Je nach Phase der Erkrankungen kommt es zu spezifischen Hautveränderungen. In der Frühphase der Erkrankungen imponieren makroskopisch erythematöse, ovale Läsionen, die in einem elfenbeinfarbigen Kolorit erscheinen. Im späteren Verlauf kommt es zu einer Sklerose der betroffenen Hautareale. Ein lila erscheinender Randsaum kennzeichnet die Aktivität der Erkrankung (Peterson et al., 1995). 12 1.6.2.3 Die Guttata Morphea Makroskopisch zeigen sich bei dieser Form der Morphea disseminierte, rumpfbetonte, weißlich-gelbliche, sklerotische, ca. 2-10mm messende Makulae. Initial findet sich ein schwaches Erythem, gefolgt von einer milden Induration mit Hypooder Hyperpigmentation. Die Genitalregion wird ausgespart (Peterson et al., 1995). 1.6.2.4 Atrophodermia of Pierini-Pasini Hierbei handelt es sich möglicherweise um eine frühe abortive Form der GuttataForm (Kreuter et al., 2009). Sie wurde erstmals im Jahre 1923 durch Pasini sowie im Jahre 1936 von Pierini beschrieben. Synonym bezeichnete Jablonska diese Erkrankung als ,,superfizielle Morphea“ (Jablonska and Blaszczyk, 2004). Charakteristikum der Atrophodermia of Pierini-Pasini sind stammbetonte, hyperpigmentierte und atrophische Läsionen, die klinisch asymptomatisch sind. Mikroskopisch zeigt sich eine superfizielle Dermatitis, wohingegen eine Sklerose oftmals fehlt (Mc Niff et al., 1999). 1.6.3.1 Generalisierte Form der zirkumskripten Sklerodermie Diese Form liegt vor, wenn mindestens drei anatomische Lokalisationen (am häufigsten: Rumpf, Oberschenkel, Lumbosakralregion), betroffen sind. Die Hauterscheinungen treten oftmals symmetrisch auf. Die sich häufig in verschiedenen Stadien der Erkrankung befindlichen Plaques können zu größeren Arealen konfluieren (Kreuter et al., 2009). 1.6.3.2 Eosinophile Fasziitis Die eosinophile Fasziitis (Shulman Syndrom) wird zumeist der zirkumskripten Sklerodermie zugeordnet. Dieser Subtyp führt zu einer plötzlichen Sklerose tiefer gelegener Bindegewebsstrukturen. Je nach Schwere der Erkrankung kann es zu Indurationen der Haut kommen. Kontrakturen der Extremitäten sind üblich. Klinische Symptome wie das Karpaltunnelsyndrom, Arthralgien oder Myalgien treten häufig auf (Bielsa and Ariza, 2007). Klinisch imponieren ödematöse, livide verfärbte Schwellungen vor allem der proximalen Extremitäten. Im Differentialblutbild 13 zeigt sich eine Eosinophilie. Gehäuft treten hämolytische Anämien, Thrombozytopenien, eine BSG-Beschleunigung und/oder einer Hypergammaglobulinämie auf. Eine Assoziation der eosinophilen Fasziitis zu hämatoonkologischen Erkrankungen wird beobachtet (Doyle and Ginsburg, 1989; Person and Su, 1981). 1.6.3.3 Disabling pansclerotic morphea Als sehr seltene Form der zirkumskripten Sklerodermie kann die ,,Disabling pansclerotic morphea“ bezeichnet werden. Die erstmalig im Jahre 1980 durch die Arbeitsgruppe um Diaz-Peres beschriebene, sehr aggressive Form der zirkumskripten Sklerodermie, tritt vor allem in der Adoleszenz auf. Charakteristisch sind generalisiert auftretende, sklerotische Veränderungen, die von der Haut bis auf den Knochen reichen können. Erheblich Veränderungen, vor allem an den Extremitäten, führen zu Kontrakturen. Oft kommt es zu Wundheilungsstörungen. In einigen Fällen wurde ein viszeraler Befall mit Lungen-, Herz- und Nierenbeteiligung beschrieben (Diaz- Peres et al., 1980; Forsea et al., 2008). 1.6.4.1 Lineare Form der zirkumskripten Sklerodermie Die hauptsächlich (60%) in der Kindheit und Adoleszenz vorkommende lineare Form ist durch lineare, indurierte Plaques der Dermis, des subkutanen Fettgewebes, der Muskeln und Knochen gekennzeichnet (Vierra and Cunningham, 1999; Peterson et al., 1995). Bei massivem Befall der Extremitäten kann es zu Atrophien und Gelenkkontrakturen kommen. Die lineare Form der zirkumskripten Sklerodermie unterteilt sich desweiteren in die beiden Subtypen „en coup de sabre“ und die „progressive faziale Hemiatrophie“. 1.6.4.2 Zirkumskripte Sklerodermie vom Typ „en coup de sabre“ Die bekannteste Form der ZS ist die vom Typ „en coup de sabre“. Sie tritt zumeist im Gesicht und Haarbereich auf. Makroskopisch besteht der Anschein, als habe man den Patienten mit einem Säbelhieb an der Stirn gestreift. Im Bereich der Läsionen kann es zu tiefen Indurationen kommen. Nicht selten bestehen zentralnervöse Beteiligungen (Blaszczyk et al., 2003). 14 1.6.4.3 Progressive faziale Hemiatrophie Eine verwandte Erkrankung ist die sog. progressive faziale Hemiatrophie (Synonym: Hemiatrophia faciei oder Parry Romberg-Syndrom). Bezeichnend ist bei diesem Subtyp der linearen Form der zirkumskripten Sklerodermie eine primär atrophische Umwandlung des betroffenen subkutanen Gewebes, der Muskulatur und des Knochens, vornehmlich im Gesichtsbereich. Eine fibrotische Veränderung des Gewebes tritt kaum auf. Die Erkrankung betrifft vornehmlich das Jugend- und Kindesalter (Sommer et al., 2006; Tollefson and Witman, 2007). Das gleichzeitige Auftreten einer linearen zirkumskripten Sklerodermie vom Typ „en coup de sabre“ und der progressiven fazialen Hemiatrophie wird in der Literatur mit bis zu 40% angegeben, was für eine gemeinsame Pathogenese spricht (Kreuter et al., 2009; Jablonska, 1975). 1.6.5.1 Tiefe Form der zirkumskripten Sklerodermie (Deep Morphea) Bei der mit Abstand (5%) am seltensten vorkommenden Deep morphea sind primär die tiefe Dermis, das subkutane Fettgewebe, die Faszie oder der darunterliegende Muskel betroffen. Die Läsionen treten häufig symmetrisch auf (Person and Su, 1981; Bielsa and Ariza, 2007; Peterson et al., 1995). Eine Diagnosestellung erfolgt mikroskopisch mittels tiefer Biopsie, vorzugsweise aus makroskopischen frischen, entzündlichen Läsionen (Kreuter, 2009). Die Morphea kann eine systemische, autoimmune Komponente besitzen (Leitenberg et al., 2009). Es wurden Überlappungen mit anderen Autoimmunerkrankungen wie z.B. dem systemischen Lupus Erythematodes, der Vitiligo, der Autoimmunhepatitis, der Hashimoto Thyreoiditis und der Myasthenia gravis beobachtet (Zulian, 2004). 1.7 Diagnostik der zirkumskripten Sklerodermie 1.7.1 Laborchemische Parameter Laborchemisch finden sich bei der zirkumskripten Sklerodermie ggf. unspezifische Entzündungszeichen wie eine erhöhte Blutsenkungsgeschwindigkeit und eine Erhöhung von akuten Phase Proteinen. 15 1.7.2 Antikörperprofile bei der zirkumskripten Sklerodermie Der Fokus von verschiedenen Arbeitsgruppen in den letzten Jahren galt dem Nachweis von Antikörper im Serum. Allerdings existieren im Gegensatz zur systemischen Sklerodermie bei der zirkumskripten Sklerodermie keine charakteristischen serologischen Parameter. Nennenswert sind in diesem Zusammenhang dennoch die antinukleären Antikörper (ANA), Antikörper gegen Einzelstrang-DNA (Anti-ss-DNA-AK) sowie anti-Histone Antikörper bei der lineare zirkumskripte Sklerodermie (Sato et al., 1993; Takehara et al., 1983; Zulian, 2004; Takehara and Sato, 2005). Im Jahre 1977 beschrieben Rodnan und Kollegen als erste den Nachweis von Anti-Einzel-Strang DNS-AK bei Patienten mit einer linearen zirkumskripten Sklerodermie (Rodnan et al., 1977). Einige Jahre später fand die Arbeitsgruppe um Falanga eine positive Korrelation von Antikörpertitern und bestehenden Gelenkkontrakturen (Falanga et al., 1986). Im Jahre 1983 gelang der Arbeitsgruppe von Takahara als erster der Nachweis von ANA´s in menschlichen Zellkulturen bei Patienten mit einer lokalisierten Sklerodermie mittels indirekter Immunfloureszenz (Takehara et al., 1983). In weiteren Studien konnte gezeigt werden, dass ANA´s bei 47-80% der Patienten mit einer lokalisierten Sklerodermie nachgewiesen werden können (Sato et al., 1993). Sie finden sich bei Erwachsenen häufiger als bei Kindern (Leitenberg et al., 2009). Der Nachweis von Antihiston-Antikörpern bei Patienten mit einer lokalisierten Sklerodermie (speziell der Histone H1 und H3) gelang der Arbeitsgruppe um Sato im Jahre 1993 durch ELISA- sowie durch Immunoblotting (Sato et al., 1993). Dabei korrelierte der Antihiston-Antikörpertiter mit dem Anti-ss-DNS-Antikörpertiter, der Krankheitsaktivität sowie der Anzahl der Läsionen und der betroffenen Körperregionen (Sato et al., 2004). Ein hoher Antihiston-Antikörpertiter ist in ca. 90 % initial ein Marker für den medikamentös induzierten Lupus Erythematodes (Fritzler and Tan, 1978). Mittels indirekter Immunfluoreszenz konnte in 2001 erstmals der Nachweis von Anti-U1 RNP bei Patienten mit lokalisierter Sklerodermie im Serum erbracht werden. Initial galt der U1 RNP Antikörper als serologischer Marker für Mischkollagenosen (Yamane et al., 2001). Bei Gelenkbeteiligung im Rahmen einer zirkumskripten Sklerodermie der Extremitäten kann bei 25-40% der Patienten laborchemisch ein positiver Rheumafaktor nachgewiesen werden (Kreuter et al., 2009). 16 Der Anti-Topoisomerase 1 Antikörper ist spezifisch für die progressive systemische Sklerodermie und lässt sich bei der zirkumskripten Sklerodermie nicht nachweisen (Sato et al., 1993). Jedoch konnte bei 76% der Patienten mit einer lokalisierten Sklerodermie, vor allem bei der generalisierten Morphea (85%) ein erhöhter Titer des Anti-Topoisomerase 2 Antikörpers nachgewiesen werden (Sato et al., 1993). Antiphospholipid Antikörper konnten in einer Studie von Sato bei 24% der Patienten mit einer generalisierten zirkumskripten Sklerodermie nachgewiesen werden (Sato et al., 1993). Zusammenfassend lässt sich sagen, dass die Bestimmung und der Nachweis von Antikörpern bei der zirkumskripten Sklerodermie zurzeit Gegenstand intensiver Forschungsanstrengungen sind, mit dem Ziel eine spezifische Diagnostik und ggf. Therapie zu ermöglichen. Vermutlich handelt es sich bei den bisher ermittelten Antikörpern um unspezifische Autoimmunphänomene. 1.8 Allgemeine Histopathologie der zirkumskripten Sklerodermie Histologisch lassen sich bei der zirkumskripten Sklerodermie unterschiedliche Phasen beobachten. Es wird eine Unterteilung in eine frühe entzündliche Phase, eine intermediäre Phase und eine späte fibrotische Phase vorgenommen. Im Anfangsstadium zeigt sich ein dichtes lymphohistozytäres Entzündungsinfiltrat der oberflächlichen, je nach Krankheitstyp auch der tiefen Gefäße. Zudem erkennt man eine endotheliale Zellschwellung, eine Reduktion der elastischen Fasern und verdickte Kollagenfaserbündel. In der intermediären Phase infiltrieren Entzündungszellen oftmals die tiefe Dermis sowie das subkutane Fettgewebe, wobei sich ggf. eine septale Pannikulitis sowie verdickte Fettgewebstrabekel beobachten lassen. Große Bereiche des subkutanen Fettgewebes sind durch neu geformte Kollagenfaserbündel charakterisiert. Im späten sklerotischen Stadium zeigen sich eine Vermehrung des dermalen Bindegewebes und eine Verdrängung des subkutanen Fettgewebes. Typisch sind verbreitete Kollagenfaserbündel, die parallel zur Hautoberfläche verlaufen. Epidermal findet sich jetzt ein nur noch geringes Entzündungsinfiltrat. Es kommt zu einer Atrophie der Hautanhangsgebilde (Kreuter, 2012; Vierra and Cunningham, 1999; Haustein and Mittag, 2003; Bielsa and Ariza, 2007; Fett and Werth, 2011) 17 1.9 Pathogenese der zirkumskripten Sklerodermie In der Literatur gibt es Hinweise, dass in den entzündlichen Infiltraten durch Entzündungszellen Zytokine (im wesentlichen TFG-β, PDGF sowie CTGF) freigesetzt werden, die dann zu einer Aktivierung von mesenchymalen Zellen führen (Jimenez et al., 1996; Leask and Abraham, 2004). Weitestgehend unklar ist, ob diese Zytokine zu einer Aktivierung bereits vorhandener Fibroblasten oder aber zur Differenzierung von mesenchymalen Vorläuferzellen aus dem Gewebe bzw. deren Zirkulation beitragen (Kreuter, 2012). Die Arbeitsgruppe um Higasi geht davon aus, dass die endotheliale Schädigung neben der verstärkten Abgabe von chemotaktischen Zytokinen auch zu einer vermehrten Expression vaskulärer Zelladhäsionsmolekülen (VACAM1, ICAM 1 und E-Selectin) führt. Dieser Vorgang rekrutiert T-Zellen, die wiederum profibrotische Zytokine (IL4/6 und TGFß) produzieren wodurch weitere eosinophile Granulozyten, CD4-positive T-Zellen und Makrophagen angelockt werden (Salmon-Her et al., 1996). Die Hochregulation von TGFß führt durch Fibroblastenaktivierung zu einer vermehrten Synthese von Kollagen, Fibronektin und Proteoglykan (Kubo et al., 2001). Gleichzeitig bewirkt TGFß eine verminderte Proteasenproduktion und einen Anstieg von Proteaseinhibitoren, was zu einem Ungleichgewicht in der Kollagensynthese und deren Abbau führt. Es gibt drei TGF-Rezeptoren. In Hautläsionen von Patienten mit ZS konnten die Rezeptortypen 1 und 2 nachgewiesen werden (Kubo et al., 2001). Die Inhibierung des Kollagenabbaus wird durch Anti-MMP Antikörper vermittelt. Bei Patienten mit einer zirkumskripten Sklerodermie sind Autoantikörper gegen die Anti-MMP-Antikörper nachgewiesen worden, die zur Inhibierung der MMP1Kollagenase fähig sind (Kreuter, 2012; Tomimura et al., 2008). Zudem scheint der Insulin-like growth factor (IGF) in der Pathogenese der Morphea eine Rolle zu spielen. Der IGF fördert die Kollagensynthese sowie die Fibroblastenrekrutierung und erhöht damit die extrazelluläre Matrix (Fawzi et al., 2008). Man geht davon aus, dass bei der zirkumskripten Sklerodermie eine Autoimmunerkrankung mit Beteiligung einer zellulären und humoralen Immunantwort im Rahmen einer Aktivierung des adaptiven Immunsystems stattfindet (Takehara and Sato, 2005; Leitenberger et al., 2009). Immunopathologisch konnten im Serum von Patienten mit einer lokalisierten Sklerodermie hyperreaktive T- und B-Zellen nachgewiesen werden. Vor allem zeigte sich eine erhöhte Aktivität von CD818 positiven T-Zellen im Serum ähnlich wie im Patientengut mit einer systemischen Sklerodermie. Demgegenüber war die Anzahl CD4-positiver Zellen im Serum signifikant höher als bei Patienten, die an einer systemischen Sklerodermie erkrankt waren (Sato et al., 1996). Durch CD30-positive T-Zellen wird eine Antikörperproduktion von spezifischen B-Zellen induziert, was auf eine Th2 Immunantwort schließen lässt. Der Anti-Histon Antikörper IGM korreliert positiv mit CD30 (Sato et al., 1996). Der IL 2 Rezeptor scheint als Marker für die Krankheitsaktivität zu dienen (Vierra and Cunningham, 1999). Diverse Zytokine und lösliche Faktoren wurden bei der zirkumskripten Sklerodermie zur Beurteilung des Verlaufes und der Krankheitsaktivität beschrieben, haben aber sich aber bislang im klinischen Alltag nicht etabliert (Ihn et al., 1995; Ihn et al., 2000; Kreuter et al., 2009). 1.10 Therapiemöglichkeiten Bei der zirkumskripten Sklerodermie existieren bisher keine internationalen Therapieleitlinien sowie eine kausale Therapie (Kreuter et al., 2007; 2009). Es gibt jedoch effektive Behandlungsansätze vor allem im akuten entzündlichen Stadium. Die Therapie ist abhängig von der Krankheitsaktivität, dem Subtyp und dem Stadium der Erkrankung (Kreuter et al., 2009). Optional bestehen therapeutische Ansätze topisch, systemisch sowie der ultravioletten (UV) Phototherapie (Kreuter, 2012). 1.10.1 Topische Therapie Bei der topischen Therapie verwendet man mittel- bis hochpotente Steroide, die bis zu 3 Monate lang täglich auf aktive Läsionen aufgetragen werden sollten. Intraläsional applizierte Glukokortikosteroide werden bei der ,,en coup de sabre“ Form im aktiven Randbereich appliziert. Die Wirksamkeit ist bisher in Studien nicht belegt, dennoch sind topische Steroide “ State of the Art“ bei oberflächlichen Formen der ZS. In einer Arbeit wurde die Wirksamkeit von topischem Calcipotriol allein und in Kombination mit UVA1-Phototherapie untersucht. Angewendet wurde diese Therapieform über 3 Monate. Sie ist vor allem bei der oberflächlichen Form der zirkumskripten Sklerodermie vom Plaque Typ wirksam (Cunningham et al., 1998; Kreuter et al., 2001). 19 Mancuso und Berdondini überprüften in einer kleinen Pilotstudie die Wirksamkeit von Tacrolimus 0,1% bei der Morphea. Es konnte ein Rückgang des Erythems und eine Sklerosereduktion im Rahmen der dreimonatigen Therapiedauer beobachtet werden (Mancuso et al., 2005). Imiquimod führt über einer Induktion von Interferon zu einer Hemmung der TGF-ß und wirkt so anti-fibrotisch (Dytoc et al., 2005). Diese Therapieform wird aufgrund der schwachen Datenlagen derzeit nicht von führenden Experten empfohlen (Kreuter et al., 2009). Ebenso zeigte die Studie der Arbeitsgruppe um Hunzelmann in der Verwendung von intraläsional appliziertem Interferon keinen signifikanten Therapieerfolg (Hunzelmann et al., 1997). 1.10.2 Systemische Therapie Der Einsatz von systemischen Steroiden ist der frühen Phase schwerer Verlaufsformen vorbehalten. Etabliert hat sich eine Kombinationstherapie aus systemischen Steroiden und Methotrexat (Uziel et al., 2000; Kreuter et al., 2005). Nach aktueller Studienlage werden Substanzen wie Calcitriol, D-Penizillamin und Penizillin aufgrund des Nebenwirkungsspektrums sowie des mangelhaften Wirksamkeitsnachweis nicht mehr empfohlen. In einzelnen Fallberichten wurde von einem erfolgreichen Einsatz von Cyclosporin A, Azathioprin, Chloroquin, Phenytoin, Colchicin, Retinoide, extrakorporaler Photorese, Plasmapherese oder intravenöser Immunglobuline berichtet. 1.10.3 Phototherapie Ein effektives Behandlungskonzept in der Behandlung sklerotischer Hauterkrankungen ist die Anwendung der Phototherapie mit ultravioletten Strahlen (Kreuter and Gamblicher, 2008; Kreuter et al., 2009; Kreuter, 2012). Langwellige UVA Strahlen dringen in die Dermis ein und zeigen eine antiinflammatorische und antifibrotische Wirkung (Breuckmann et al., 2004; Sunderkötter et al., 2006). Die Arbeitsgruppe um Stein erbrachte in 1989 (Stein et al., 1989) erstmalig den Nachweis, dass UVB-Strahlung in vitro die Matrix-Metalloproteinase-1 induzieren kann und somit zu einem Kollagenabbau führt. Scharffetter wies 1991 eine Induktion der interstitiellen Kollagenase durch UVA Bestrahlung nach (Scharffetter et al., 1991). Der antiinflammatorische Effekt wird durch die von den UV-Strahlen ausge20 löste Apoptose von T-Zellen, die Depletion von Langerhanszellen und die Modulation pro-inflammatorischer Zytokine bewirkt (Kreuter et al., 2009). Aufgrund der Eindringtiefe ist die Phototherapie damit erste Wahl in der Behandlung der limitierten Form der zirkumskripten Sklerodermie und kommt für Formen mit Beteiligung tiefer gelegener Strukturen eher nicht in Frage. Bei der PUVA-Therapie werden photosensibilisierte Psoralene entweder oral gegeben oder topisch verabreicht. Diese Therapieform hat sich vor allem in der frühen entzündlichen Phase der limitierten zirkumskripten Sklerodermie etabliert. Bekannt ist zudem der Einsatz von Breitband-UVA (320-420nm). Vergleichsuntersuchungen mit anderen UV-Modalitäten existieren bislang nicht (Kreuter et al., 2006). Als gute und effektive Behandlungsoption hat sich die Verwendung von UVA-1 Phototherapie bei der ZS etabliert (Kreuter, 2012). Es existieren drei verschiedene Dossisregime, low-dose UVA1 (10-20 J/cm²), medium-dose UVA1 (30- 50 J/cm²), und high-dose UVA1 (130 J/cm²) (Kreuter et al., 2006; Kreuter et al., 2008, Kreuter et al., 2009). In verschiedenen Studien wurden die einzelnen Dosisregime hinsichtlich ihrer Wirksamkeit verglichen. Als effektiv erwies sich zudem in einer Studie von Stege (Stege et al., 1997) die high-dose UVA Therapie. In darauffolgenden prospektiven Studien erwies sich low-dose als auch medium-dose UVA1 als wirksamer (Kreuter et al., 2009). Kreuter und Kollegen wiesen 2006 in ihrer randomisiert-kontrollierten Studie die erhöhte Wirksamkeit von medium-dose UVA1 nach (Kreuter et al., 2006). Die Behandlung sollte drei- fünfmal wöchentlich für insgesamt 40 Sitzungen statt finden (Kreuter et al., 2006; Kreuter et al., 2009). Auch wenn keine kontrollierten Studien vorhanden sind, so ist bei den verschiedenen Sklerodermieformen in jedem Fall eine frühzeitige und konsequente Physiotherapie empfehlenswert um Kontrakturen vorzubeugen. 1.10.4 Chirurgische Therapie Chirurgische Eingriffe sind ausschließlich bei der linearen zirkumskripten Sklerodermie angezeigt. Je nach Ausmaß der Kontrakturen kann eine Intervention mittels Sehnenverlängerung wegen Bewegungseinschränkung, Transplantatdeckung bei Substanzdefekt und aus kosmetischen Gründen im inaktiven Erkrankungsstadium erfolgen (Kreuter et al., 2009). 21 1.11 Die Pannikulitis 1.11.1 Definition der Pannikulitis Der Begriff Pannikulitis beschreibt eine heterogene Gruppe entzündlicher Erkrankungen, welche das Unterhautfettgewebe betreffen. Immer ist eine Biopsie zur histopathologischen Diagnosesicherung nötig (Requena, 2008; Requena and Yus, 2001). Chemische und mechanische Reize sowie diverse Noxen können zu einem Untergang von Fettzellen unter Freisetzung von Fettsäuren führen. Der entzündliche Vorgang im Fettgewebe ist ein dynamischer Prozess. Je nach Stadium können verschiedene histopathologische Charakteristika nachgewiesen werden (Patterson, 2003; Requena and Yus, 2001). Häufig ist die Pannikulitis eine Begleitmanifestation bei bestehenden Erkrankungen des rheumatischen oder autoimmunologischen Formenkreises. 1.11.2 Klinisches Erscheinungsbild der Pannikulitis In der Vergangenheit war die bekannteste Erkrankung des subkutanen Fettgewebes die im Jahre 1892 beschriebene Pfeifer-Weber-Christian Erkrankung (Pfeifer, 1892; Brill, 1936; White and Winkelmann, 1998). Klinisch imponiert hier ein Spektrum aus körperlichem Schwächegefühl, wiederholtem Erbrechen, einer ausgeprägten Müdigkeit, rheumatoiden Gelenkbeschwerden und Fieber. Die Inspektion der Haut ergibt multiple, unterschiedlich große, druckschmerzhafte, subkutane Knoten, die mit einer Rötung und Schwellung der bedeckenden Haut einhergehen. Die Hautaffektionen heilen nur langsam ab und hinterlassen eine Hauteinziehung infolge der Vernarbung im subkutanen Fettgewebe (Requena, 2008). 1.12 Klassifikation und Einteilung der Pannikulitis Eine allgemein akzeptierte Klassifikation der Pannikulitis existiert nicht, was in der Vergangenheit dazu führte, dass von Pathologen und Klinikern für ein und dieselbe Erkrankung verschiedene Bezeichnungen verwendet wurden. Etabliert hat sich in den letzten Jahren eine Klassifikation nach histologischen sowie ätiologischen Kriterien (Patterson, 2003). Einige Autoren nehmen an, dass eine Unterteilung in 22 eine lobuläre und septale Pannikulits diagnostisch hilfreich sein könnte. Da jedoch häufig Mischbilder beobachtet werden, ist die Interpretation mitunter schwierig und eine eindeutige Diagnose nicht immer zu stellen. Histopathologisch erfolgt zudem eine Unterteilung in eine Form mit und ohne begleitende Vaskulitis (Requena and Yus, 2001). 1.12.1 Lobuläre Pannikulitis Ohne Vaskulitis: o Pannikulitis nodularis nonsuppurativa febrilis et recidivans (PfeifferWeber-Christian-Syndrom); o Lipogranulomatosis subcutanea; o Pannikulitis, pankreatische; o Physikalische/traumatische/artifizielle Pannikulitis; o o o Kältepannikulitis; Druckpannikulitis; Pannikulitis nach Injektionen; Pannikulitis durch Artefakte. Pannikulitis mit "needle shaped clefts" in Lipozyten: Sclerema adiposum neonatorum; Adiponecrosis subcutanea neonatorum; Pannikulitis, poststeroidale. Lobuläre Pannikulitiden bei Kollagenosen: Lupus-Pannikulitis; Systemische Sklerodermie; Morphea; Pannikulitis bei Dermatomyositis. Lobuläre Pannikulitis bei sonstigen Erkrankungen: Sarkoidose; Granuloma anulare; Necrobiosis lipoidica; 23 Pannikulitis bei chronischer Polyarthritis (rheumatoide Arthritis); o o Pannikulitis calcificans (Niereninsuffizienz). Pannikulitis bei malignen Systemerkrankungen: Pannikulitisches, kutanes T-Zell-Lymphom; Leukämien der Haut; Pannikulitis, histiozytäre, zytophagische. Pannikulitis durch Infektionen: Pannikulitis, bakterielle; Pannikulitis, mykotische. Mit Vaskulitis: o Erythema induratum Bazin (Nodularvaskulitis). 1.12.2 Septale Pannikulitis Ohne Vaskulitis: o Erythema nodosum; o Necrobiosis lipoidica; o Eosinophile Fasziitis; o AAT-Mangel-assoziierte Pannikulitis; o Dermatoliposklerose. Mit Vaskulitis: o Polyarteriitis nodosa, systemische; o Polyarteriitis nodosa, kutane; o Thrombophlebitis migrans. (Altmeyer and Bacharach-Buhles, 2002) 24 Wir verzichteten auf eine detaillierte Beschreibung der einzelnen Erkrankungen und richten unser Augenmerk vor allem auf die septale Pannikulitis im Rahmen der zirkumskripten Sklerodermie sowie des Erythema nodosum. Diese beiden Formen waren Gegenstand unserer experimentellen Arbeit. 1.13 Die Pannikulitis bei der zirkumskripten Sklerodermie Die Morphea, vor allem die Morphea profunda, ist durch eine subkutane Entzündungsreaktion charakterisiert und unterscheidet sie damit von anderen Formen der Sklerodermie (Su and Person, 1981). Bei dieser tiefen Form der Morphea sind Dermis, Subkutis, Faszien sowie die superfizielle Muskulatur betroffen (Peterson et al., 1995). Primär sind das Fettgewebe sowie die Faszien durch entzündliche Infiltrate involviert. Es handelt sich um eine septale Pannikulitis. Eine detaillierte Differenzierung der Entzündungszellen im Fettgewebe bei der zirkumskripten Sklerodermie ist bisher noch nicht untersucht worden und ist Gegenstand dieser Arbeit. Bei der zirkumskripten Sklerodermie werden unterschiedliche Auslöser diskutiert, die bei einer entsprechenden genetischen Prädisposition zu einer immunologisch getriggerten entzündlichen Reaktion mit anschließend gestörter Regulation des Bindegewebs-Stoffwechsels und der Fibroblastenaktivität führen (Kreuter, 2012, Kreuter et al., 2009; Gabrielli et al., 2009). 1.14 Das Erythema nodosum 1.14.1 Definition des Erythema nodosum Erstmalig von William im Jahre 1798 beschrieben, handelt es beim Erythema nodosum um eine akut verlaufende, allergische, hyperergische und schmerzhafte Hauterkrankung. Das Erythema nodosum ist die häufigste klinisch-pathologische Variante einer septalen Pannikulitis (Requena and Yus, 2008; Requena and Requena, 2002; Pink and Barker, 2012). 25 1.15 Epidemiologie und Ätiologie Die Prävalenz in Mitteleuropa beträgt 100-200/100000 Einwohner pro Jahr, die Inzidenz 2-8/10000 Einwohner pro Jahr. Frauen sind in der Regel (3 bis 5x) häufiger betroffen. Das Hauptmanifestationsalter liegt zwischen dem 15. und 30. Lebensjahr. Das Erythema nodosum ist ein poliätiologisches Krankheitsbild. Eine Vielzahl von Triggerfaktoren sowie geographische Unterschiede werden diskutiert (GarcíaPorrúa et al., 2000). Als häufigste Ursache bei Kindern und Jugendlichen kommt eine Infektion der oberen Atemwege mit ß-hämolysierenden Streptokokken in Betracht. Ca. 2 bis 3 Wochen nach Krankheitsbeginn sind die typischen Hautläsionen nachweisbar (García-Porrúa et al., 2000). Das Erythema nodosum ist bei der Tuberkulose und dem rheumatischen Fieber ein Epiphänomen. Die Sarkoidose ist in 1/3 der Fälle mit einem Erythema nodosum assoziiert (Marcoval et al., 2003). Bei Erwachsenen findet sich ein gehäuftes Auftreten bei Patienten mit chronisch entzündlichen Darmerkrankungen, wobei die Hautläsionen häufiger bei der Colitis ulcerosa als beim Morbus Crohn beobachtet werden (Durand et al., 1991; McCallum and Kinmont, 1968). Klinisch erscheinen auch beim Morbus Behçet die für das Erythema nodosum typischen Hautläsionen. Es handelt sich hierbei histopathologisch meist um eine lobuläre Pannikulitis mit Leukozytoklasten und einer begleitenden lymphatischen Vaskulitis (Chun et al., 1989; Kim and LeBoit, 2000). Auch im Rahmen von malignen Grunderkrankungen wie dem Morbus Hodgkin, verschiedener anderer Lymphome und diverser solider Tumore kann es zu einer entzündlichen Reaktion der Haut im Sinne eines Erythema nodosum kommen (Kluger et al., 2011; Perez et al., 2006; Lin et al., 2004). 1.16 Klinisches Erscheinungsbild des Erythema nodosum Die Erkrankung ist gekennzeichnet durch den akuten Beginn und dem typischen klinischen Bild mit plötzlich auftretendem, symmetrisch verteilten, schmerzhaft tastbaren Knoten bevorzugt an den Streckseiten der Unterschenkel (Moll et al., 2005). Zu Beginn zeigen sich rötliche Plaques, die im Verlauf erhaben erscheinen und konfluieren. Im Verlauf imponiert dann ein Farbumschlag zu Gelb bis Grün, ähnlich einem abblassenden Hämatom. Die Abheilung findet ohne Narbenbildung oder Atrophie statt. Ulzerationen werden nicht beobachtet. Die Läsionen zeigen nicht selten eine Spontanheilung. Rezidive sind ungewöhnlich (Requena and Yus, 26 2008; Requena and Requena, 2002; Requena and Yus, 2007). In der akuten Krankheitsphase zeigen sich Prodromalerscheinungen wie Fieber, Gelenk- und Gastrointestinale Beschwerden. Zudem kann es zu einer begleitenden Lymphadenopathien, Hepatomegalien, Splenomegalien oder Pleuritiden kommen (Psychos et al., 2000). 1.17 Diagnostik des Erythema nodosum Eine detaillierte Anamnese und Evaluation der Grunderkrankung sind erforderlich. Laborchemisch sollte eine Bestimmung der Entzündungsfaktoren (CRP, Leukozyten, IL6 und BSG) sowie eine der Grunderkrankung angepasste Laboranalytik erfolgen (z.B. Antistreptolysintiter, Yersinienserologie) erfolgen (Requena and Yus, 2008; Requena and Requena, 2002). 1.18 Histologie des Erythema nodosum Bei dem Erythema nodosum handelt es sich histopathologisch um eine vorwiegend septale Pannikulitis ohne eine begleitende Vaskulitis (Requena and Yus, 2001). In der Frühphase der Läsionen findet man ein Ödem, Hämorrhagien und eine Neutrophilie. Aktivierte Neutrophile synthetisieren reaktiven Sauerstoff. Dies führt zur oxidativen Gewebszerstörung und fördert die Entzündungsreaktion im Gewebe. In seltenen Fällen zeigt sich ein dominant eosinophiles Zellinfiltrat (Winkelmann and Frigas, 1986). In dem Spätstadium beobachtet man verdickte, fibrotische Septen sowie periseptale Granulation. Es lassen sich Lymphozyten, Histiozyten und multiple Riesenzellen nachweisen (Förstrom and Winkelmann, 1977). Eine zentrale Fettgewebsnekrose kommt nicht vor. Sogenannte Miescher-Granulome sind pathognomonisch für das Erythema nodosum (Miescher, 1947; Miescher, 1951; Yus et al., 1989). Es handelt sich hierbei um septale, histiozytäre Granulome mit vielkernigen Riesenzellen in radiärer Anordnung um eine “zentrale Lücke“ (Moll et al., 2005). In der Frühphase des Erythema nodosum sind die Miescher-Granulome in den Septen umgeben von Neutrophilen. 27 1.19 Pathogenese des Erythema nodosum Das Erythema nodosum stellt eine unspezifische Hautreaktion auf eine große Vielfalt von Antigenen dar, was eine komplexe Immunreaktion voraussetzt. Wahrscheinlich liegt dem eine Typ III und/oder Typ IV Immunreaktion zugrunde. In den Läsionen lassen sich zirkulierende Immunkomplexe und eine Komplementaktivierung nachweisen (Hedfors and Norberg, 1974; Baldock and Catterall, 1975; Jones et al., 1976). Vermittelt durch Antigen-spezifische CD4-Zellen kommt es zu einer Freisetzung von Zytokinen sowie zu einer Rekrutierung von Makrophagen. Ein lokaler Gewebsschaden ist die Folge, der zu einer granulomatösen Entzündungsreaktion führt. 1.20 Therapiemöglichkeiten des Erythema nodosum Die Behandlung richtet sich nach der mit dem Erythema nodosum assoziierten Grunderkrankung. Eine symptomatische Therapie steht im Vordergrund. ASS und nichtsteroidale Antirheumatika wirken analgetisch sowie antipyretisch. Nach Ausschluss einer akuten bakteriellen oder viralen Infektion als Ursache können systemische Steroide verwendet werden. Einige Patienten profitierten von einer Behandlung mit Colchicin oder Hydroxychloroquin (Jarret and Goodfield, 1996). 1.21 Das Immunsystem im Rahmen einer Entzündung Es handelt sich um ein hocheffizientes biologisches Abwehrsystem und dient dem menschlichen Organismus als Schutz vor Krankheitserregern. Seine Eigenschaften bestehen aus Erkennung von Pathogenen mittels eines Repertoire von Antigenrezeptoren, einem Gedächtnis, was eine effektivere Reaktion bei erneutem Antigenkontakt ermöglicht und der immunologischen Toleranz, um Schäden auf das gesunde, körpereigene Gewebe zu verhindern. Das Immunsystem lässt sich in eine angeborene oder unspezifische Immunabwehr und in eine adaptive oder spezifische Immunabwehr unterteilen (Harrison et al., 2009; Janeway et al., 2002). 28 1.22 Das angeborene oder unspezifische Immunsystem Phylogenetisch handelt es sich um den älteren Teil der Immunantwort. Dazu zählen die anatomischen Barrieren, die zellvermittelte Abwehr mittels Phagozytose, allgemeine entzündliche Reaktionen sowie das Komplementsystem (Harrison et al., 2009; Janeway et al., 2002).Die Erkennung von Pathogenen durch hämatopoetische und nicht hämatopoetische Zellen führt zur Aktivierung und Produktion von Komplementfaktoren sowie zur Synthese von Zytokinen und antimikrobiellen Peptiden, die als Effektormoleküle agieren. Dendritischen Zellen sind in der Lage auszureifen und Oberflächenmoleküle zu exprimieren, die wichtig für die Antigenpräsentation sind und zu einer Aktivierung der adaptiven Immunantwort führen. Die Effektorzellen des angeborenen Immunsystems sind also an der initialen Immunabwehr von Pathogenen beteiligt und spielen eine Mediatorrolle bei der Rekrutierung und Aktivierung von B- und T-Lymphozyten und somit der Induktion der spezifischen Immunabwehr. Dies findet sich ebenfalls bei der Sklerodermie (Harrison et al., 2009; Janeway et al., 2002). Bei der zirkumskripten Sklerodermie sowie bei der systemischen Sklerodermie handelt es sich um entzündlich getriggert Autoimmunerkrankungen (Takehara and Sato, 2005; Leitenberger et al., 2009). Das vermehrte Vorkommen von B- und T-Zellen im Serum wird beschrieben. Regulatorische T-Zellen spielen eine Schlüsselfunktion bei der Aufrechterhaltung der immunologischen Toleranz gegen Selbstantigene in der Peripherie (Harrison et al., 2009). Makrophagen und Monozyten gelten als die wichtigsten zellulären Vertreter des angeborenen Immunsystems. Sie phagozytieren und zerstören Mikroorganismen. Zudem setzen sie Entzündungsmediatoren wie Prostaglandine, Leukotriene oder Zytokine frei (Harrison et al.2009). Zytokine sind Botenstoffe, die sowohl bei der angeborenen als auch der adaptiven Immunantwort von besonderer Bedeutung sind. Ihre gestörte Expression kann z.B. im Rahmen von Autoimmunerkrankungen auftreten. T-Zellen lassen sich anhand ihres Zytokinmusters in funktionelle Subpopulationen einteilen, die entweder die zellulär vermittelte Th1 Antwort oder die humoral Th2 Immunantworten steuern. An chronischen Entzündungen sind Th17 Lymphozyten, die das Interleukin 17 produzieren beteiligt (Kurzinski et al., 2011). Wie zuvor bei der systemischen Sklerodermie konnten bei der zirkumskripten Sklerodermie das Vorhandensein von Zytokinen im Serum sowie im Gewebe nachgewiesen werden. Angenommen wird eine Dysbalance zwischen den Th1, Th2 und Th17-Helferzellen. In einem frühen Stadien findet man überwiegend Th1 29 und Th17-Helferzellen (zelluläre unspezifische, angeborene Immunantwort), im fibrotischen Spätstadium sind Th2 Zellen (erworbenes Immunsystem) dominant (Kurzinski et al., 2011). 1.23 Das adaptive Immunsystem Das adaptive Immunsystem ist der phylogenetisch jüngere Anteil der Immunabwehr. Er ist gekennzeichnet ist durch eine Antigen-spezifische Antwort auf Pathogene. Gedächtniszellen ermöglichen bei erneutem Kontakt mit dem gleichen Antigen eine schnellere und stärkere Immunantwort. Es vermittelt sowohl die zelluläre sowie die humorale Immunantwort. T-Lymphozyten gewährleisten die zelluläre Immunantwort. B-Lymphozyten sind für die humorale Immunantwort verantwortlich und in der Lage, Antikörper zu bilden (Harrison et al.2009). Migrations- und Homingverhalten sorgen für eine Verteilung der immunkompetenten Zellen in den Geweben und regeln deren relativen Anteil in den einzelnen Subpopulationen. Damit die Migration der Lymphozyten gerichtet abläuft, sind in diesem Prozess Adhäsionsmoleküle wie Selektine, Integrine, verschiedene vaskuläre Liganden sowie Chemokine und ihre korrespondierenden Rezeptoren involviert. Die im Blut vorhandenen Lymphozyten müssen zunächst Kontakt zur Gefäßwand bekommen. Dieser Vorgang wird Adhäsion genannt. Anschließend erfolgt eine durch verschiedene Chemokine und deren Rezeptoren gesteuerte Wanderung des Lymphozyten durch die Gefäßwand mit anschließender Migration zum Ort der Entzündung. TLymphozyten sind Lymphozyten die im Thymus ausreifen und Träger der zellulären Immunantwort sind. Zu ihnen zählen T-Helfer-Zellen, zytotoxische T-Zellen und regulatorische T-Zellen. CD8-positive zytotoxische T-Zellen sind spezialisiert auf die Zerstörung virusinfizierter oder körperfremder Zellen. CD4-positive THelferzellen sind an der Regulation von T-/B-Zellantworten sowie der Steuerung der Monozyten-/Makrophagenaktivität beteiligt. Die von T-Zellen spezifisch exprimierten Oberflächenmoleküle sind charakteristisch für die intrathymischen Entwicklungsstadien. B-Zell-Lymphozyten entstehen im Knochenmark, exprimieren membrangebundene Immunglobuline und sind nach Antigenkontakt in der Lage, Antikörper zu bilden (Harrison et al.2009). Die Abwesenheit pathogener Autoreaktivität wird als immunologische Toleranz bezeichnet. Bei Autoimmunerkrankungen handelt es sich um einen Überbegriff von Krankheiten, deren Ursache eine überschießende Reaktion des Immunsystems gegen das körpereigene Gewebe ist. 30 2 Aktuelle Zielsetzung Gegenstand der vorliegenden Arbeit war der Nachweis und die immunhistochemische Differenzierung von Entzündungszellen im Fettgewebe, im Sinne einer septalen Pannikulitis, bei der zirkumskripten Sklerodermie. Es erfolgte hierbei die Darstellung der für eine Entzündungsreaktion wichtigen Zellpopulationen mittels immunhistochemischer Färbetechnik. Differenziert wurden T-Lymphozyten im gesamten (CD3+), T-Helferzellen (CD4+), zytotoxische/TSuppressorzellen (CD8+), Granulozyten (CD15+), B-Lymphozyten (CD20+) und Makrophagen (CD68+). Eine Abgrenzung zu anderen Pannikulitiden ist oftmals nicht eindeutig, weshalb wir als Referenzgruppe das Erythema nodosum verwendeten. In unserer Arbeit ergaben sich folgende Fragestellungen: 1. Sind im Fettgewebe bei der zirkumskripten Sklerodermie und dem Erythema nodosum Entzündungszellen im Fettgewebe, im Sinne einer septalen Pannikulitis, nachweißbar? 2. Gibt es signifikante Unterschiede im Nachweis und der Differenzierung der septalen Pannikulitis bei der zirkumskripten Sklerodermie und dem Erythema nodosum? 3. Kann die septale Pannikulitis bei der zirkumskripten Sklerodermie als Diagnosekriterium verwendet werden? 31 3 Material & Methoden 3.1 Einleitung Gegenstand dieser Arbeit war der Nachweis und die immunhistochemische Differenzierung von Entzündungszellen im Fettgewebe bei Patienten mit der Diagnose einer zirkumskripten Sklerodermie. Als Referenzgruppe untersuchten wir Patienten mit der Diagnose eines Erythema nodosum. In unserer experimentellen Arbeit erfolgte eine detaillierte Darstellung der Zellpopulationen mittels immunhistochemischer Färbetechnik. Nachgewiesen wurden T-Lymphozyten im gesamten (CD3+), T-Helferzellen (CD4+), zytotoxische/TSuppressorzellen (CD8+), Granulozyten (CD15+), B-Lymphozyten (CD20+) und Makrophagen (CD68+). 3.2 Das Patientenkollektiv Das untersuchte Kollektiv setzte sich aus Patienten, die entweder mit der Verdachtsdiagnose einer zirkumskripten Sklerodermie oder zur Therapieeskalation bei bereits bestehender Diagnose in der Kollagenoseambulanz der Klinik für Dermatologie, Allergologie und Venerologie der Ruhr Universität Bochum im St. Josef- Krankenhaus in Bochum vorstellig wurden, zusammen. Für die vorliegende Arbeit wurden Hautbiopsien von insgesamt 112 Patienten untersucht, die sich im Zeitraum von 2000 bis 2007 mit der klinischen und histopathologisch gesicherten Diagnose einer zirkumskripten Sklerodermie in ambulanter oder stationärer Behandlung befanden. Zwei Drittel der Patienten waren Frauen. Die Geburtsjahrgänge lagen zwischen 1926 und 1994. Die HE- gefärbten Präparate wurden lichtmikroskopisch auf das Vorliegen einer septalen Pannikulitis durch einen erfahrenen Histopathologen hin nachuntersucht. In dieser Färbung zeigte sich das für die Pannikulitis spezifische entzündliche Infiltrat blau. Es blieben insgesamt 28 Proben, die den Kriterien entsprachen. Als Vergleichsgruppen untersuchten wir die Hautbiopsien von 20 Patienten, ebenfalls aus dem Kollektiv des St. Josef Krankenhaus, mit der gesicherten Diagnose eines Ery32 thema nodosum. In der Gruppe fanden sich 85% Frauen und 15% Männer. Die Geburtsjahrgänge lagen zwischen 1940-1980. 3.3 Entnahme und Herstellung der Gewebeproben Nach ordentlicher Aufklärung des Patienten über mögliche Risiken und Komplikationen, führten wir die Hautbiopsie mittels Rundstanze (6mm) unter sterilen Kautelen in Lokalanästhesie (Scandicain 1%) durch. Bei der Entnahme wurde darauf geachtet, dass die Probe aus klinisch typischen und frischen Läsionen erfolgte. Das Gewebe sollte durch den operativen Eingriff nicht gequetscht werden. 3.3.1 Gewebevorbehandlung und Paraffineinbettung Um die entnommenen Gewebeprobe lichtmikroskopisch, histopathologisch und immunhistochemisch zu beurteilen bedurfte es einer speziellen Gewebevorbehandlung. Direkt im Anschluss an die Entnahme der Stanzbiopsien wurden diese in ein Gefäß mit 5% Formaldehyd für die Dauer von zwei Stunden bei Raumtemperatur verbracht. Die Einbettung der fixierten Präparate erfolgte mit Hilfe eines VakuumInfiltrations-Prozessors (Bayer, Leverkusen, Deutschland). Zunächst wurden die Präparate erneut für vier Stunde bei 40°C in 10% neutral gepuffertem Formalin fixiert. Anschließend wurde bei 40°C eine aufsteigende Alkoholreihe mit folgenden Stationen durchlaufen, in denen die Präparate jeweils eine Stunde verblieben. 70% Alkohol 96% Alkohol 100% Alkohol Xylol II Xylol I Abschließend wurden die Präparate jeweils eine Stunde bei 60°C in Paraffin eingebettet. Die in Paraffin gebetteten Präparate wurden nach der Aushärtung und Erkaltung mittels Mikrotom in 4μm dicke Schnitte geschnitten und im warmen Wasserbad auf Objektträger gebracht (SuperFrost Plus, Langenbrinck, Emmendingen, Deutschland). Die Objektträger für die Färbungen CD3, CD4, CD8, CD15, 33 CD20 und CD68 wurden für den Kochvorgang in der Mikrowelle zusätzlich mit Poly-L-Lysin beschichtet. 3.3.2 Entparaffinisierung und Färbevorbehandlung Vor der histologischen Routinefärbung der mit den Paraffinschnitten beschichteten Objektträger war eine Entfernung des in alle Gewebespalten eingedrungenen Paraffins (Einbettmittel) notwendig. Diese Entparaffinisierung begann im Brutschrank bei 60°C für mindestens 20 Minuten. Danach folgte das Durchlaufen einer absteigenden Alkoholreihe für zweimal 10 Minuten in Xylol und für jeweils 5 Minuten in Ethanol. Xylol 1 Xylol 2 Ethanol 99% Ethanol 99% Ethanol 96% Ethanol 70% Ethanol 50% Nach einem erneuten Waschgang mit destilliertem Wasser über 5 Minuten erfolgte dann die Vorbereitung der Präparate entsprechend ihrer nun vorgesehenen Spezialfärbungen. Bei diesen speziellen immunhistochemischen Nachweismethoden musste dem eigentlichen Färbevorgang ein Kochzyklus vorgeschaltet werden. Hierfür wurden die Gewebeschnitte in ein Waschbad mit einer speziellen Pufferlösung zur Mikrowellenbehandlung gebracht (ProTaq IV, Quartett, Berlin, Deutschland). Der Kochvorgang erfolgte in einer 3-Schritt-Technik mit zweimaligem Kochen für sechs Minuten bei 600 Watt sowie einmaligen Kochen für fünf Minuten bei 180 Watt in der Mikrowelle. Anschließend wurden die Schnitte 30 Minuten bei Raumtemperatur abgekühlt und für fünf Minuten mit destilliertem Wasser gewaschen. Es folgte der Färbevorgang mit Hilfe eines Färbeautomaten für Immunhistochemie (DAKO REAL Detection System, Alkaline Phosphatase/ RED, Rabbit/ Mouse). 34 3.4 Immunhistochemische Färbung der Gewebeschnitte Die Immunhistochemie beschäftigt sich mit dem Nachweis und der präzisen Lokalisation eines spezifischen Antigens (Proteins) in Gewebeabschnitten oder Zellen (Janeway et al., 2002). Diese Methode wird seit 1950 verwendet. Eine Steigerung der Effizienz der Methode sowie der Spezifität der Reaktionen erlaubt heute den Nachweis einer Vielzahl von Antigenen an Formaldehyd-fixiertem, Paraffineingebettetem Gewebe (Böker et al. 1996). Als erster Schritt wird ein primärer, monoklonaler Antikörper eingesetzt, der sich gegen eine spezifische Sequenz von 5-10 Aminosäuren (Epitop) eines gesuchten Antigens im Gewebe bindet. In einem zweiten Schritt der Reaktion wird dann entweder eine direkte oder eine indirekte Methoden angewandt um den primären, im Gewebe gebunden Antikörper (Antikörper-Antigen-Bindung) nachzuweisen. Bei der direkten Methode koppelt man die primären Antikörper mit einem Markermolekül, um dieses dann nach der Immunreaktion im Gewebe nachweisen zu können. Bei der indirekten Methode, welche für unsere Präparate verwendet wurden, wird die Antigen-Antikörperreaktionen im Gewebe durch zusätzliche immunologische oder chemische Reaktionen sichtbar gemacht und erreichen dadurch eine Amplifikation des Nachweissignals. Als Nachweismethode für unsere immunhistochemische Färbung der Präparate wurde das DAKO REAL Detection System verwendet, welches auf der hochsensitiven Streptavidin-Biotin-Methode basiert. Als immunologische Bindungen werden verschiedene gegeneinander gerichtete Antikörper oder chemische Affinitäten wie z.B. zwischen Streptavidin und Biotin (Streptavidin-Biotin-Komplex) verwendet, um eine Verstärkung des Nachweissignals zu erreichen. An den primären Antikörper bindet der mit Biotin markierte sekundäre Antikörper. Der biotinylierte Sekundärantikörper ist multivalent, eine Reaktion mit mehreren Streptavidinmolekülen ist möglich. Konjugiert sind die Streptavidinmoleküle mit einer alkalischen Phosphatase, die eine besondere Bedeutung im sogenannten Alkaline Phosphatase Fast Red Detection Kit hat. Die Alkalische Phosphatase vermittelt als Enzym die Reaktion mit dem Farbstoff Fast Red Chromogen, der als Substrat dient und erreicht somit eine Amplifikation des Fluoreszenzsignals. 35 Praktisch wurden folgende Einzelschritte durchlaufen: Die entsprechend vorbereiteten Präparate wurden zunächst mit einer Demaskierungslösung (Target Retrival Solution) für 20 Minuten gespült und für weitere 20 Minuten in einem Wasserbad bei 96°C inkubiert. In dem DAKO Autostainer erfolgte dann die Beschichtung der Präparate mit primären, Biotin-markierten Kaninchen-Antikörper (DAKO, Hamburg) bei 25 Grad für 30 Minuten. Hierzu waren je nach Antikörper spezielle Verdünnungen nötig. Tab. 1: Verdünnungsangaben der verwendeten Antikörper Antikörper Inkubationszeit Verdünnung CD3 30 Minuten 1:250 CD4 30 Minuten 1:100 CD8 30 Minuten 1:10 CD15 30 Minuten Keine CD20 30 Minuten 1:3000 CD68 30 Minuten 1:400 In einem weiteren Vorgang erfolgte die Zugabe des sekundären biotinylierten Maus-anti-Kaninchen-Antikörper (DAKO, Hamburg). Nach achtminütiger Inkubationszeit sowie zweiminütiger Waschung mit einem speziellen Autostainer-Puffer (DAKO, Hamburg) wurde der mit alkalischer Phosphatase konjugierte Streptavidin-Biotin-Komplex (DAKO) hinzugefügt und für 30 Minuten inkubiert. Nach einem Waschvorgang sowie der Inkubation und Zugabe eines Enhancers erfolgte die Amplifikation des Farbstoffes Fast Red Chromogen (Red permanent, DAKO, Hamburg) mit einer Inkubationszeit von 8 Minuten. Es erfolgte eine Gegenfärbung der Präparate mit Hämatoxylin zu nukleären Blaufärbung. Anschließend wurden die Präparate in Mowiol (Polyvinylalkohol, Roche Molecular Biochemicals, Mannheim) eingebettet. Als Kontrolle verwendeten wir eine Probe eines Lymphoms, welches jeweils positiv auf die oben erwähnten Marker reagiert. Für die verschiedenen Färbereihen mit den unterschiedlichen immunhistochemischen Marker verwendeten wir jeweils konsekutive Schnitte, um eine Auswertung und Zuordnung der positiven Zellen sicher zu stellen. 36 3.5 Immunhistochemische Marker 3.5.1 CD3 Das CD3 wurde im Jahre 1983 auf einem Leukozyten-Workshop etabliert. Das Antigen besteht aus 4 Polypeptidketten. Das Molekulargewicht beträgt 16-68 kDa (Mason et al., 1989; Campana et al., 1989). Der polyklonale Antikörper (DAKO, Hamburg, Deutschland) reagiert mit der intrazellulären zytoplasmatischen Domäne des CD3-Antigenrezeptor-Komplexes und ist somit hochspezifisch für T-Lymphozyten (Mason et al., 1989). Als Epitop dient die nicht-glykosylierte Epsilon Kette. Eine CD3-Ketten vermittelte Signaltransduktion (Phosphorylierung des CD3-Komplexes) ist der erste Schritt der TZellaktivierung und deutet auf eine frühe Beteiligung des T-Zellsystems hin. Außerdem kommt es bei der großen Mehrheit neoplastischer Zellen vor und gilt als wesentlicher Marker für die erste Bewertung chronischer lymphoproliferativer Störungen. Die markierten Zellen weisen eine Oberflächenfärbung und/oder eine Färbung des Zytoplasmas auf (Campana et al., 1987). 3.5.2 CD4 CD4 ist ein Glykoprotein von 55 kDa mit fünf Immunglobulin-ähnlichen externen Domänen, einer transmembranen Domäne und einer stark konservierten intrazellulären Domäne. Der Antikörper markiert Thymozyten und T-Helferzellen (Leong and Cooper, 2003). Bei der MHC-Klasse-II-beschränkten, antigeninduzierten T-Zellaktivierung wirkt CD4 als Corezeptor und verstärkt somit die Zelladhäsion. Die Expression von CD4 findet während der T-Zellentwicklung statt, auf unreifen Thymozyten fehlt dieser (Dabbs, 2006). CD4 wird in T-Helferzellen exprimiert. Ein Vorkommen wird in etwa 80–90% der reifen Thymozyten, 55–65% der reifen peripheren T-Zellen sowie Untergruppen von Suppressor- oder zytotoxischen T-Zellen beschrieben. CD4 wird zudem auf Monozyten/Makrophagen, Langerhans-Zellen und anderen dendritischen Zellen, jedoch nicht auf B-Zellen, exprimiert (Leong et al., 2003). 37 CD4 spielt eine wichtige Rolle bei der Immunphänotypisierung von reaktiven Lymphozyten und lymphoproliferativen Erkrankungen. Die markierten Zellen weisen eine Membranfärbung auf. 3.5.3 CD8 CD8 ist ein dimeres transmembranöses Glykoprotein (Molekulargewicht 68kDa) das mit dem T-Zellrezeptor auf einer T-Zelle sowie mit des MHC-Klasse1 Molekül auf einer Zielzelle interagieren und den Immun-Erkennungskomplex stabilisiert. Der monoklonale Antikörper CD8 (DAKO, Hamburg, Deutschland) ist für den spezifischen Nachweis von zytotoxischen/Suppressorzellen geeignet. Die markierten Zellen weisen eine membranöse Oberflächenfärbung auf (Kishimoto et al., 1996). 3.5.4 CD15 CD15 ist ein Kohlenhydratantigen, dass sowohl von Glykoproteinen als auch von Glykolipiden getragen wird. CD15 dient als Ligand für Selektine und könnte auch durch eine direkte Lewis-X-Interaktion an der Zelladhäsion beteiligt sein. CD15 wird hauptsächlich auf reifen Granulozyten und Monozyten, jedoch auch auf unreifen Knochenmarkszellen und auf leukämischen Zellen myelo-monozytärer Abstammung exprimiert (Kishimoto et al, 1997). Die Färbereaktion zeigt ein zytoplasmatisches und/oder membranöses Muster. 3.5.5 CD20 CD20 ist ein strukturell einzigartiges Glykoprotein (Molekulargewicht 33kDa), dass auf B-Vorläuferzellen und reifen B-Zellen exprimiert wird. In reifen Plasmazellen geht diese Expression verloren (Zhou and Tedder, 1995). CD20 wird eine wichtige Rolle im Rahmen der B-Zellregulation zugeschrieben (Tedder and Engel, 1994). Die nachgewiesen B-Zellen zeigen eine charakteristische Färbung an der zytoplasmatischen Seite der Zelloberflächenmembran. 38 3.5.6 CD68 CD68 ist ein Transmembran-Glykoprotein (Molekulargewicht 110kDa) das hauptsächlich in Lysosomen lokalisiert ist. Es gehört zur Familie der LAMP Glykoproteine, die am lysosomalen Transport bzw. der Endozytose beteiligt sind. CD68 wird in zytoplasmatischen Granula stark und auf der Oberfläche von Makrophagen, Monozyten, Neutrophilen, Basophilen und NK-Zellen schwach exprimiert. Anders als viele andere CD-Leukozyten-Antigene ist das CD68-Molekül sehr heterogen und verschiedene Antikörper gegen CD68 weisen unterschiedliche zelluläre Reaktivitäten auf. Charakteristisch ist eine diffuse oder granuläre- zytoplasmatische Färbung (Kishimoto et al., 1996; Warnke et al., 1989). 3.6 Auswertung der Gewebeschnitte Die Auswertung der immunhistochemisch gefärbten Präparate erfolgte mit dem Lichtmikroskop (SM-LUX, Leitz, Wetzlar, Deutschland). Dabei wurde das Standardokular gegen ein spezielles Rasterokular ausgetauscht um die immunhistochemisch positiv rot gefärbten Zellen in Relation zu dem blau gefärbten Gesamtentzündungsinfiltrat im Fettgewebe zu bestimmen bzw. auszuzählen. Das Präparat wurde zunächst in seiner Gesamtheit bei 10-facher Vergrößerung betrachtet. Entlang der Schichtfolgen der Haut wurde die Epidermis mit dem Stratum corneum, dem Stratum granulosum, Stratum spinosum und dem Stratum basale sowie der Dermis mit dem Stratum papillare und dem Stratum reticulare dargestellt. Besondere Fokussierung galt der Subkutis mit dem dort vorkommenden Panniculum adiposum und den darin ggf. enthaltenem Entzündungsinfiltrat (Pannikulitis). Hierfür wurde das Okular auf die 400fache Vergrößerung eingestellt um die darin enthaltenen Zellen zu zählen. Durch das Okular erscheint ein gitterförmiges Raster (0,25mm x 0,25mm), was ein systematisches Auszählen der Zellen durch die virtuellen (dermalen) Felder ermöglichte. Pro Präparat legten wir drei Zählraster in einer Reihe fest. Zuerst wurden die blauen Zellen (Gesamtentzündungsinfiltrat) und anschließend die immunhistochemisch roten gefärbten Zellen einer Reihe gezählt. Als Hilfsmittel 39 verwendeten wir einen handelsüblichen Handzähler. Der Vorgang wurde für jeden speziellen immunhistochemischen Marker sowie für die beiden von uns untersuchten Krankheitsbilder durchgeführt. Kam es nach zweimaliger Kontrolle des Zählergebnisses zu Abweichungen, wurde das jeweilige Präparat durch eine zweite Person erneut begutachtet. 3.7 Auswertung und Statistik Ein prozentualer Mittelwert wurde aus der Summe der einzelnen Zählergebnisse pro dermales Feld erhoben. Dieser Vorgang wurde jeweils für CD3, CD4, CD8, CD15, CD20 und CD68 vorgenommen. Für die statistischen Auswertung verwendetet wir den Mann-Whitney-Test, einen parameterfreien Test zur Überprüfung ob die zentrale Tendenz zweier unabhängiger Stichproben, unterschiedlich ist. Die abhängige Variable ist ordinal skaliert, muss jedoch nicht normal verteilt sein. Der Mann- Whitney Test ist ein Homogenitätstest, ein Rangsummentest/Rangtest und dient zur Überprüfung der Signifikanz der Übereinstimmung zweier Verteilungen, also ob zwei unabhängige Verteilungen zu derselben Grundgesamtheit gehören. Man kann Mittelwertsunterschiede zwischen einer Experimental- (hier der septalen Pannikulitis bei der zirkumskripten Sklerodermie) und einer Kontrollgruppe (hier der septalen Pannikulitis beim Erythema nodosum) untersuchen. Die Berechnungen erfolgten mit den Statistikprogrammen SPSS 15.0 (SPSS für Windows) und STATA ver. 9. Folgende Signifikanzschranke wurde festgelegt: p< 0,05 signifikant. Mittelwert und Standardabweichung wurden mit hierfür allgemein gebräuchlichen Formeln durch das Datenverarbeitungsprogramm EXCEL (MICROSOFT) ermittelt. 40 4 Ergebnisse 4.1 Auswertung der HE gefärbten Präparate 4.1.1 Auswertung bei der zirkumskripten Sklerodermie Von den insgesamt 112 durchuntersuchten Proben wiesen 28 Hautbiopsien von Patienten mit einer zirkumskripten Sklerodermie eine septale Pannikulitis im HE gefärbten Präparat auf. 4.1.2 Auswertung beim Erythema nodosum In der Referenzgruppen (Erythema nodosum) ließ sich in allen der 20 angefertigten und HE gefärbten Proben eine septale Pannikulitis nachweisen. 4.2 Auswertung der Immunhistochemie Tab. 2: Expressionsunterschiede immunhistochemisch angefärbter Entzündungszellen im Fettgewebe bei Patienten mit einer zirkumskripten Sklerodermie (ZS) und Patienten mit einem Erythema nodosum (EN). Die Ergebnisse sind als Mittelwerte±Standardabweichung in Prozent sowie dem Median angegeben. Als signifikant wurde p< 0,05 festgelegt. Marker ZS EN p- Wert CD3 15,04±16,7 13 CD4 negativ CD8 10±12,5 4,5 30,6±17,6 5,4±10,7 18,3±10,9 30 0 15 < 0,002 0,0790 0,00117 CD15 negativ negativ CD20 CD68 15,7±25,7 14±15,8 3,5 11 5,6±6,5 38,7±13,4 3 41,5 0,7697 < 0,0001 41 4.2.1 Expression von CD3 im Fettgewebe bei der zirkumskripten Sklerodermie In unserer Arbeit zeigte sich eine positive Expression mit 15,04±16,7% des CD3Pan-Zelllymphozytenmarkers im Fettgewebe bei 17 von 28 Patienten. Abb. 1: CD3 Expression im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.2 Expression von CD3 im Fettgewebe beim Erythema nodosum In unserer Referenzgruppe konnte ebenfalls eine positive CD3 Expression mit 30,6±17,6 verzeichnet werden. 42 Abb. 2: CD3 Expression im Fettgewebe beim Erythema nodosum 4.2.3 Vergleich der CD3 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum Bei zirkumskripten Sklerodermie zeigte sich in der statistischen Auswertung signifikant weniger CD3 positive Zellen im Fettgewebe im Vergleich zum Erythema nodosum (z= -3,030; p< 0,002). 4.2.4 Expression von CD4 im Fettgewebe bei der zirkumskripten Sklerodermie Die Auswertung im Fettgewebe bei der zirkumskripten Sklerodermie ergab keinen Nachweis von CD4 positive Zellen. 43 Abb. 3: Negative CD4 Expression im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.5 Expression von CD4 im Fettgewebe beim Erythema nodosum In der Referenzgruppe ließ sich bei 6 der 20 Proben eine CD4 Expression mit 5,4±10,7% im Fettgewebe nachweisen (Abbildung 4). 44 Abb. 4: CD4 Expression im Fettgewebe beim Erythema nodosum 4.2.6 Vergleich der CD4 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum Die statistische Auswertung ergab für p=0,0790 und verfehlte damit die statistische Signifikanz. 4.2.7 Expression von CD15 im Fettgewebe bei der zirkumskripten Sklerodermie Im Fettgewebe konnte keine Expression von CD15 nachgewiesen werden. 45 4.2.8 Expression von CD15 im Fettgewebe beim Erythema nodosum Beim Erythema nodosum konnte keine Expression von CD15 im Fettgewebe nachgewiesen werden. 4.2.9 Expression von CD8 im Fettgewebe bei der zirkumskripten Sklerodermie Die Markierung mit dem CD8 Antikörper erbrachte einen positiven Nachweis mit 10±12,5% in den Präparaten. Abb. 5: CD8 Expression im Fettgewebe bei der zirkumskripten Sklerodermie 46 4.2.10 Expression von CD8 im Fettgewebe beim Erythema nodosum 19 von 20 Präparaten zeigten eine positive Expression. Für die CD8 Markierung betrug die Anzahl positiv gezählter Zellen 18,3±10,9%. Abb. 6: CD8 Expression im Fettgewebe beim Erythema nodosum 4.2.11 Vergleich der CD8 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum Die statistische Auswertung ergab, dass bei der zirkumskripten Sklerodermie signifikant weniger CD8 positive Zellen im Fettgewebe im Vergleich zum Erythema nodosum nachweisbar waren (p<0,011). 47 4.2.12 CD20 Expression im Fettgewebe bei der zirkumskripten Sklerodermie Die CD20 Positivität belief sich im Fettgewebe auf 15,7±25,7%. 19 von 28 Präparaten zeigten sich positiv. In 8 Präparaten konnte eine CD20 Expression nur in der Dermis und nicht im Fettgewebe erbracht werden. Abb. 7: CD20 Expression im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.13 CD20 Expression im Fettgewebe beim Erythema nodosum Bei dem Erythema nodosum zeigten 16 von 20 Präparaten eine positive CD20 Expression. Die mikroskopische Zählung ergab 5,6±6,5%. Bei 3 Präparaten konnte keine positive CD20 Expression nachgewiesen werden. 1 Präparat zeigte eine positive Expression in der Dermis, jedoch keine im Fettgewebe. 48 Abb. 8: CD20 Expression im Fettgewebe beim Erythema nodosum 4.2.14 Expression von CD68 im Fettgewebe bei der zirkumskripten Sklerodermie Die CD68 Expression zeigte sich mit 14±15,8% bei 18 von 28 Präparaten positiv. Bei 10 Proben ergab die Auswertung eine positive CD68 Expression in der Dermis aber nicht im Fettgewebe. 49 Abb. 9: CD68 Expression im Fettgewebe bei der zirkumskripten Sklerodermie 4.2.15 CD68 Expression im Fettgewebe beim Erythema nodosum Bei dem Erythema nodosum konnte im Fettgewebe von 19 von 20 Präparaten eine positive CD68 Expression nachgewiesen werden. Die CD68 Positivität belief sich auf 38,7±13,4%. 50 Abb. 10: CD68 Expression im Fettgewebe beim Erythema nodosum 4.2.16 Vergleich der CD68 Expression bei der zirkumskripten Sklerodermie und dem Erythema nodosum Die Auswertung ergab bei zirkumskripten Sklerodermie hoch signifikant weniger CD68 positive Zellen im Fettgewebe im Vergleich zum Erythema nodosum (z= 4,255; p< 0,001). 51 5 Diskussion Die zirkumskripte Sklerodermie ist eine Bindegewebserkrankung, die durch eine verdickte und fibrotisch veränderte Haut charakterisiert ist. Die Pathogenese ist bislang nicht eindeutig geklärt. Immunologische Faktoren scheinen eine wichtige Rolle zu spielen (Vierra and Cunningham, 1999; Kreuter, 2012). In dem phasenhaften, entzündlichen Prozess zeigen sich im Früh- und Intermediärstadium perivaskulär entzündliche Infiltrate in der Dermis. In der vorliegenden Arbeit wurde bei Patienten mit der klinischen und histopathologischen Diagnose einer septalen Pannikulitis im Rahmen einer zirkumskripten Sklerodermie erstmals Entzündungszellen im Fettgewebe systematisch analysiert und immunhistochemisch differenziert. Die ausgewählten immunhistochemischen Marker sollten neue Erkenntnisse in Bezug auf die Pathogenese einer septalen Pannikulitis bei der zirkumskripten Sklerodermie ermöglichen. Im Fokus standen hierbei der Nachweis von T- und B-Lymphozyten, Granulozyten und Makrophagen sowie der Vergleich mit dem Erythema nodosum als Prototyp einer septalen Pannikulitis (Requena, 2008; Requena and Yus, 2008; Requena and Requena, 2002). 5.1 Die septale Pannikulitis bei der zirkumskripten Sklerodermie Die Pannikulitis repräsentiert ein heterogenes Krankheitsbild. Unterschiedliche Pannikulitiden zeigen häufig eine makroskopisch ähnliche Ausprägung, weshalb eine Biopsie zur histopathologischen Diagnosesicherung nötig ist (Requena and Yus, 2001; Requena and Sánchez, 2007). Der entzündliche Vorgang im Fettgewebe ist ein dynamischer Prozess. Je nach Stadium können verschiedene Charakteristika nachgewiesen werden (Patterson, 2003). Dies spiegelt sich auch in unseren Ergebnissen wider. In einigen der Proben (28 von 112) konnte ein entzündliches Infiltrat im Fettgewebe nachgewiesen werden. In diesen Präparaten zeigte sich dann eine septale Pannikulitis mit unterschiedlichem Nachweis der von uns untersuchten Oberflächenmarker, was auf einen phasenhaften Verlauf der Entzündung hindeuten könnte. Anderer Untersucher (Requena, 2008; Su and Green, 1986; Person and Su, 1981; Winkelmann and Frigas, 1986; Hansen and Callen, 2010) kamen zu vergleichbaren Ergebnissen. Bei der tiefen Form der Morphea dominiert ein lymphozytäres Zellinfiltrat bis in die Subcutis hinein. Zudem können eosinophile Zellen und Ma52 krophagen histologisch nachgewiesen werden (Bielsa and Ariza, 2007). Die Kombination einer septalen Pannikulitis mit ihrem lymphozytären Infiltrat sowie einer dermalen und subkutanen Sklerose bei der zirkumskripten Sklerodermie ist einzigartig. Dies könnte hilfreich bei der Differenzialdiagnose der SklerodermiePannikulitis zu anderen Formen der septalen Pannikulitis sein. Bisher gibt es kaum Untersuchungen zur Inzidenz der septalen Pannikulitis bei der zirkumskripten Sklerodermie. So ist z.B. die selten vorkommende Morphea profunda durch eine subkutane Entzündungsreaktion mit Nachweis einer septalen Pannikulitis charakterisiert (Su and Person, 1983). In einer anderen Arbeit fanden sich im Fettgewebe vorwiegend Plasmazellen (Tomb et al., 2009). Die Arbeitsgruppe um Zulian beschrieb in tiefen Hautbiopsien von Patienten mit einer eosinophilen Fasziitis, eosinophile Infiltrate im Fettgewebe und den Faszien (Zulian et al., 2006). Im Rahmen der Literaturrecherche fand sich keine Arbeit, in welcher das Entzündungsinfiltrat bei der mit einer septalen Pannikulitis einhergehenden zirkumskripten Sklerodermie immunhistochemisch differenziert worden war. 5.2 Die septale Pannikulitis beim Erythema nodosum In unserer Referenzgruppe wurden Patienten mit einer septalen Pannikulitis i.R. eines Erythema nodosum eingeschlossen. Es lag ein repräsentatives Kollektiv vor (Requena and Yus, 2008; Requena and Requena, 2002). Das Erythema nodosum ist die häufigste Form einer Pannikulitis (Ter Poorten and Thiers, 2002; Requena and Yus, 2001). Histopathologisch handelt es sich vorwiegend um eine septale Pannikulitis ohne begleitende Vaskulitis (Requena and Yus, 2008; Requena and Requena, 2002). Dies kam auch in unseren Präparaten zur Darstellung. Das subkutane Fettgewebe war verdickt und zeigte eine Infiltration von Entzündungszellen bis in die periseptalen Areale. Abhängig vom Stadium der Entzündung fand sich ein spezifisches entzündliches Zellinfiltrat tief perivaskulär sowie in der Dermis. Ähnlich der zirkumskripten Sklerodermie werden unterschiedliche entzündliche Stadien beobachtet (Requena and Yus, 2008; Requena and Requena, 2002). In erster Linie handelt es sich beim Erythema nodosum um eine neutrophile Pannikulitis. Ein Rückgang der neutrophilen Infiltrate wird in einem späteren Stadium beobachtet (granulomatöses Stadium) (Diaz et al., 2000). 53 5.3 Interpretation und Diskussion der immunhistologischen Untersuchung CD3 ist ein hochspezifischer Marker für T-Zellen. Die Expression findet durch menschliche T-Zellen im Thymus, im peripheren lymphatischen Gewebe sowie im Blut statt. Das mit CD3 determinierte Antigen ist zunächst in frühen Thymozyten zytoplasmatisch nachzuweisen und erscheint später bei der Zellreifung auf der TZell-Oberfläche (Mason et al., 1989; Campana et al., 1989). In unserer Arbeit war die Expression von CD3 im Fettgewebe bei Patienten mit einer ZS positiv. Auch die Arbeitsgruppe um Xie (Xie et al., 2008) fand in ihrem Patientenkollektiv mit einer zirkumskripten Sklerodermie ein erhöhtes Vorkommen von CD3+ Zellen in der Dermis im Vergleich zu gesunden Kontrollpersonen. Sie schrieben den spezifischen T-Zellen eine Bedeutsamkeit in der Pathogenese der zirkumskripten Sklerodermie zu. Balabanova und Kollegen konnten bei Patienten mit profunder Sklerodermie überwiegend lymphozytäre Infiltrate mit CD3+ Zellen in der Dermis nachweisen (Balabanova and Obreshkova, 1999). In keine der Arbeiten wurde allerdings der Fokus auf das Fettgewebe gelegt. Um genauere Angaben über die Verteilung sowie die Infiltration und Migration von Entzündungszellen machen zu können, sind weitere Untersuchung erforderlich. In unseren Auswertung ergab sich auch in der Referenzgruppe des Erythema nodosum eine positive CD3 Expression. Andere Arbeitsgruppen kamen zu ähnlichen Ergebnissen. So lag z.B. der histologisch gesicherte Anteil an CD3+ Zellen in der Dermis in einer vergleichenden Untersuchung zum Morbus Behçet bei 71 % (Kim and LeBoit, 2000). Bei der septalen Pannikulitis zeigte sich unabhängig von der Erkrankungsform eine deutliche Beteiligung von CD3+ Zellen am Entzündungsprozess im Fettgewebe. Die statistische Auswertung ergab signifikant mehr CD3+ Zellen in der Gruppe mit dem Erythema nodosum als bei der ZS. Der Grund für den quantitativen Unterschied ist aber nicht ganz klar und kann anhand unserer Ergebnisse nicht abschließend geklärt werden. Sicherlich sprechen unsere Daten aber für eine bedeutsame Beteiligung des spezifischen T-Zell-Systems am Krankheitsverlauf. Weitere Untersuchungen sind in Zukunft erforderlich. CD4 ist ein monomeres Glykoprotein (Molekulargewicht 59kDa) und wird auf reifen T-Zellen vor allem T-Helferzellen exprimiert (Leong et al., 2003). Wir fanden bei der zirkumskripten Sklerodermie im Fettgewebe eine negative CD4 Expression 54 vor. Damit decken sich unsere Daten nicht mit denen aus der Dermis oder dem Blut gewonnen Angaben in der Literatur. Xie und Kollegen untersuchten die immunhistochemische Charakteristika in der Dermis der zirkumskripten Sklerodermie (Xie et al., 2008). Sie konnten nachweisen, dass in der Dermis signifikant mehr CD1a+, CD3+, CD4+, CD8+, CD20+, CD25+ und CD57+ Zellen als bei gesunden Probanden nachweisbar waren. In der Studie von Sato und Kollegen untersuchte die Gruppe den löslichen CD4- und CD8-Titer im Serum von Patienten, die wegen einer lokalisierten Sklerodermie behandelt wurden. Dabei imponierte ein signifikant erhöhter CD4-Titer. Dieses Phänomen trat sowohl bei der zirkumskripten als auch bei der systemischen Sklerodermie auf (Sato et al., 1996). Für die unterschiedlichen Ergebnisse existieren mehrere Erklärungssansätze. Sie können z.B. in der Verschiedenheit des untersuchten Gewebes oder dem unterschiedlichen Untersuchungszeitpunkt liegen. Möglicherweise hatte noch keine Migration der T-Helferzellen in das Fettgewebe stattgefunden. Auch der Einfluss einer bereits durchgeführten Therapie auf das Zellbild ist nicht ausgeschlossen. In Anbetracht der Seltenheit der Erkrankung sind die untersuchten Stichproben allesamt sehr klein, was Einfluss auf die Power der Studien hat. In der Referenzgruppe des Erythema nodosum konnte eine positive Expression von CD4 im Fettgewebe nachgewiesen werden, sodass hier im Entzündungsinfiltrat spezifische T-Helferzellen vorlagen. Das Erythema nodosum stellt eine unspezifische Hautreaktion auf eine große Vielfallt von Antigenen dar, was eine komplexe Immunreaktion voraussetzt. Wahrscheinlich liegt dem eine Typ III und/oder Typ IV Immunreaktion zugrunde. Vermittelt wird diese durch antigenspezifische CD4+ Zellen, die Zytokine freisetzen und Makrophagen an den Ort des Geschehens locken (Janeway et al., 2002). Obwohl sich bei dem Erythema nodosum im Vergleich zur Sklerodermie eine positive CD4 Expression nachweisen ließ, erreichte der Vergleich der beiden Gruppen keine statistische Signifikanz. Bei der zirkumskripten Sklerodermie liegt wahrscheinlich eine Autoimmunerkrankung vor. Bei dem Erythema nodosum handelt es sich um einen entzündlichen Prozess im Bereich der Septen zwischen den subkutanen Fettläppchen (Pannikulitis) als immunologische Reaktion auf die unterschiedlichsten Stimuli (Nenoff et al., 2006). Zudem lässt sich festhalten, dass bei beiden Erkrankung der genaue Pathomechanismus auf immunologischer Ebene bisher unzureichend untersucht worden ist. Eine positive Expression von CD4+ konnte beim Erythema nodosum nachgewiesen werden und unterstützt somit die 55 These, dass spezifische T-Helferzellen bei der Entzündung eine Rolle spielen. Anhand unserer Ergebnisse scheint dies bei der zirkumskripten Sklerodermie nicht der Fall zu sein. Zukünftig sind weitere Untersuchungen bezüglich der CD4 Expression im Fettgewebe erforderlich, um eine bessere Aussage bezüglich deren Vorkommen und Funktion im Pathomechanismus bei der Pannikulitis zu erlangen. Der Oberflächenmarker CD8 findet sich vor allem auf zytotoxischen T-Zellen bzw. Suppressor T-Zellen. Diese können an MHC Klasse 1 Moleküle binden und sind damit wichtig für die Erkennung von Zielzellen. Sie sorgen für eine negative Rückkopplung im Immunsystem und verhindern somit eine Endlos-Stimulation. CD8+ Zellen sezernieren Zytokine und stimulieren Makrophagen zum intrazellulären Abtöten phagozytierter Partikel (Kishimoto et al., 1996). Zudem verstärken sie die Bildung des T-Zell-Rezeptors und sind Ausgangspunkt immunologischer Signalkaskaden. In unserer Arbeit konnte bei der zirkumskripten Sklerodermie im Fettgewebe eine positive Expression von CD8 nachgewiesen werden. Damit decken sich unsere Daten mit denen der Arbeitsgruppe um Xie. Diese fand in ihrer immunhistochemischen Untersuchung in der Dermis von Patienten mit zirkumskripter Sklerodermie signifikant mehr CD8+ Zellen als in der von gesunden Probanden (Xie et al., 2008). Auch aus dem Serum gewonnene Hinweise unterstützen unsere Ergebnisse (Sato et al., 1996). Vergleichsdaten aus dem Fettgewebe liegen uns nicht vor. Die Gewichtung auf CD8+ (zytotoxischen) Helferzellen ist Ausdruck einer Beteiligung des T-Zellsystems und spricht für dessen bedeutsame Funktion in der Pathogenese, die auch bei anderen Autoimmunerkrankungen wie dem Diabetes mellitus Typ I oder der Polymyositis nachgewiesen werden konnten (Nishio et al., 2001; Zhang et al., 2002). In der von uns untersuchten Referenzgruppe ließ sich ebenfalls eine positive Expression von CD8 im Fettgewebe verzeichnen. Auch andere Untersuchungen kamen zu vergleichbaren Ergebnissen. So fand die Arbeitsgruppe um Kim in ihrer Studie zum histopathologischen Vergleich des Erythema nodosum mit den Nodosum-änlichen Läsionen beim Morbus Behçet einen signifikanten Anteil an CD8+ Zellen im Entzündungsinfiltrat (Kim and Leboit, 2000). Bei der zirkumskripten Sklerodermie ließen sich im Fettgewebe signifikant weniger CD8+ Zellen im Vergleich zum Erythema nodosum nachweisen. Unsere Daten machen deutlich, das zyto56 toxische CD8+ Zellen bei der septalen Pannikulitis unterschiedlicher Ursache offenbar eine bedeutsame Rolle spielen. Während aber die Sklerodermie wahrscheinlich eine Autoimmunerkrankung darstellt, ist das Erythema nodosum ein Begleitphänomen bei sehr unterschiedlichen Krankheitsbildern. Daten betreffend die systemische Sklerodermie stellen die Dysregulation des Immunsystems durch vermehrtes Auftreten von CD8+ Zellen in den Vordergrund (Fuschiotti et. al., 2009). Der Pathomechanismus ist aber bei keiner der Erkrankungen bislang ganz verstanden worden. Damit bleibt der Unterschied in unseren beiden Stichproben unklar. Der CD15 Oberflächenmarker wird von Granulozyten exprimiert. Diese Zellpopulation ist indirekt an der Zelladhäsion beteiligt und ist bei der unspezifischen, angeborenen Immunantwort von besonderer Bedeutung (Kannagi et. al., 1996). Granulozyten werden im Knochenmark gebildet und in das Blut abgegeben. Die Lebensdauer von basophilen Granulozyten beträgt etwa 7 Tage, die von neutrophilen Granulozyten 1-4 Tage. Der Abbau der Granulozyten erfolgt im mononukleären Phagozytosesystem (Monozyten). Sie können die Blutbahn verlassen und in das Gewebe einwandern. Die Expression von CD15 war bei der zirkumskripten Sklerodermie im Fettgewebe negativ. Dies ist ein starker Hinweis darauf, dass keine direkte Beteiligung des unspezifischen Immunsystems vorlag. Da Granulozyten in nahezu jede Entzündungsreaktion einbezogen sind, spricht ihr Fehlen für einen komplexen Pathomechanismus der Pannikulitis in unserem Patientenkollektiv. Allerdings hat auch der Zeitpunkt der Biopsie erheblichen Einfluss auf das Zellbild der sich dynamisch ändernden Erkrankung (Diaz et al., 2000). Eine immunhistochemische Untersuchung des Fettgewebes ist bisher bei Pannikulitis im Rahmen einer zirkumskripten Sklerodermie noch nicht untersucht worden. Vergleichsdaten anderer Arbeitsgruppen liegen uns nicht vor. Weitere Untersuchungen bezüglich der Expression des Oberflächenmarkers sind in Zukunft angezeigt, um dessen Rolle in der entzündlichen Pathogenese der Pannikulitis bei der zirkumskripten Sklerodermie zu klären. Die Expression für CD15 fiel auch in unserer Vergleichsgruppe negativ aus. Die Daten decken sich mit den Untersuchungsergebnissen von Rojas-Villarrage und Kollegen (Rojas-Villarrage et al., 2006). Sie führten an insgesamt 26 Proben von Patienten mit der Diagnose einer Pannikulitis im Rahmen eines Erythema nodo57 sum umfangreiche immunhistochemische Untersuchung durch. Auch hier fiel die Expression von CD15 überwiegend negativ aus. Nur in zwei Fällen, die mit einer begleitenden Vaskulitis einhergingen, war der Marker nachweisbar. Unsere Untersuchung ergab eine negative Expression von CD15 in beiden Patientenkollektiven. Damit gibt es keinen Hinweis auf eine bedeutsame Beteiligung von CD15+ Zellen bei der septalen Panikulitis der untersuchten Krankheitsbilder. Die Daten decken sich mit den Untersuchungsergebnissen anderer Arbeitsgruppen. Das CD20-Molekül ist bei der B-Zell-Aktivierung, -Proliferation und – Differenzierung von besonderer Bedeutung (Leong et al., 2003). Das Antigen wird in der Frühentwicklung der Prä-B-Zellen exprimiert und bis zu deren Differenzierung zu Plasmazellen beibehalten. Eine schwache Expression von CD20 kommt in einer Subpopulation der T-Zellen vor (Leong et al., 2003). Das CD20-Antigen wird auf ALL-, B-Zell-, CLL-, Haarzellleukämie- und Burkitt-Lymphom-Zellen exprimiert (Pezzutto et al., 1989). In unserer Arbeit konnte bei der zirkumskripten Sklerodermie eine positive CD20 Expression im Fettgewebe nachgewiesen werden. Dies lässt auf das Vorhandensein von B-Zellen/Plasmazellen und somit auf eine Beteiligung des adaptiven Immunsystems schließen. B-Zellen sind Träger der humoralen Immunantwort. Durch ein Antigen aktiviert wandeln sie sich in Plasmazellen oder Gedächtniszellen um und sind in der Lage Antikörper zu bilden. Andere Arbeitsgruppen fanden in ihren histopathologischen Untersuchungen einen signifikanten Anteil an CD20+ Zellen in der Dermis (Stefanaki et al., 2008). Dabei ist die Funktion der B-Lymphozyten in dem Pathomechanismus der zirkumskripten Sklerodermie nicht ganz klar. Möglicherweise spielt dabei die lokale Sekretion von Antikörpern bzw. eine Aktivierung des Komplementsystems eine Rolle (Stefanaki et al., 2008). Auch bei der systemischen Sklerodermie gewonnene Daten unterstützen den besonderen Stellenwert der B-Lymphozyten im Krankheitsgeschehen. So stellte die Arbeitsgruppe von Sato und Kollegen (Sato, 2006; Hasequawa et al., 2005) den Zusammenhang zwischen B-Zell Aktivierung und der forcierten fibrotischen Gewebsveränderung durch eine exessive IL6 Synthese her. In der Referenzgruppe war der Nachweis von CD20 positiv. Aufgrund der derzeitigen Datenlage ist aber ein Vergleich mit der Literatur nur mit Einschränkung möglich. Von den verschiedenen Arbeitsgruppen wird zumeist von einem lymphozytä58 ren Infiltrat berichtet (Requena and Sánchez, 2007). Bislang ist aber keine immunhistochemische Untersuchung auf CD20 hin durchgeführt worden. Damit kann zurzeit über den Pathomechanismus nur spekuliert werden. Eine lokale Interaktion mit den anderen Zellen des Immunsystems erscheint am wahrscheinlichsten. In beiden untersuchten Stichproben konnten somit CD20+ Zellen im Fettgewebe nachgewiesen werden. Damit scheint das humorale Immunsystem von besonderer Bedeutung zu sein. Der genaue Pathomechanismus ist aber noch nicht verstanden. Eine lokale Interaktion der B-/Plasmazellen mit den anderen Zellen des Immunsystems erscheint am wahrscheinlichsten. Weitere Untersuchungen sind hier erforderlich. Ein bedeutsamer Unterschied im Auftreten von CD20+ Zellen bei den verschiedenen Grunderkrankungen ließ sich nicht darstellen. Der Oberflächenmarker CD68 ist spezifisch für Makrophagen. Makrophagen dienen der Beseitigung von Pathogenen durch Phagozytose. Sie stellen stammesgeschichtlich die vermutlich ältesten Vermittler der angeborenen Immunabwehr dar. Körperfremde Proteine oder Glycoproteine, wie etwa auf der Oberfläche von Viren und Bakterien, werden im Gewebe von Makrophagen erkannt. Ein einmal aufgenommenes Peptidfragment findet dann Bindung an die MHC II Moleküle und wird an der Zelloberfläche dem adaptiven Immunsystem zur Erkennung angeboten. Das adaptive Immunsystem ist darauf hin in der Lage, Antigene gezielt zu eleminieren (Kishimoto et al., 1996; Warnke et al., 1989). In unserer Arbeit konnte im Fettgewebe bei der zirkumskripten Sklerodermie eine positive CD68 Expression nachgewiesen werden. Eine Untersuchung von HigashiKuwata und Kollegen (Higashi-Kuwata et al., 2009) kam zu einem vergleichbaren Ergebnis. In ihrer Arbeit untersuchte die Arbeitsgruppe den immunhistochemischen Nachweis von aktivierten Makrophagen bei der zirkumskripten Sklerodermie. Als Oberflächenantigene wurde u.a. das CD68 verwendet. Der Marker war in ihrem Sklerodermiekollektiv signifikant häufiger nachweisbar als bei gesunden Kontrollpersonen. Auch die Gruppe um Ishikawa (Ishikawa and Ishikawa, 1992) demonstrierte bei der systemischen Sklerodermie eine Zunahme des Makrophagen/T-Zell-Quotienten und schloss daraus auf eine wichtige Funktion der Makrophagen in der Pathogenese. Von verschiedenen Autoren war bereits auf den besonderen Stellenwert der Makrophagen in der Pathogenese der systemischen Sklerodermie hingewiesen worden. So scheinen sie eine potentiell wichtige Quelle 59 für Fibrose-induzierende Cytokine wie z.B. den TGF-β zu sein (Andrews et al., 1987; Ishikawa and Ishikawa, 1992). In unsere Kontrollgruppe mit dem Erythema nodosum konnte eine positive CD68 Expression verzeichnet werden. Auch andere Untersucher beobachteten vergleichbare Ergebnisse. So lag etwa der Anteil mit CD68+ Zellen in einer Untersuchung von Kim und Kollegen bei durchschnittlich 21% (Kim and LeBoit, 2000). Die Arbeitsgruppe von Rojas-Villarraga (Rojas-Villarraga et al., 2006) konnte insbesondere in aktiven Läsionen Makrophagen nachweisen. Demgegenüber fiel die Markierung mit CD68 Antikörpern in älteren Herden negativ aus. Bei der zirkumskripten Sklerodermie zeigten sich signifikant weniger CD68 positive Zellen im Fettgewebe im Vergleich zum Erythema nodosum. Der Grund für dieses Ergebnis ist aber nicht ganz klar und kann anhand der uns vorliegenden Daten noch nicht ausreichend erklärt werden. Hier sind weitere Untersuchungen in Zukunft erforderlich, die zunächst den Pathomechanismus der einzelnen Erkrankungen weiter klären müssen. Es bleibt aber festzuhalten, dass Makrophagen bei der septalen Panikulitis unabhängig von der hier untersuchen Entitäten von besonderer Bedeutung sind. 5.4 Diskussion der Methodik Um Zählfehler in der Auswertung zu vermeiden werteten wir die Proben jeweils zweimal aus. Im Falle einer Diskrepanz wurde eine zweite Person hinzugezogen. Im Rahmen des Herstellungsprozesses wurden einige Präparate komplett oder teilweise zerstört und war nicht mehr auszuwerten. Dies minimierte die Stichprobe. Die Diagnosestellung einer Pannikulitis hängt stark vom Fettgewebsanteil im Biopsat ab. Idealerweise werden die Proben mit einer spindelförmigen Exzision mit dem Skalpell durchgeführt, sodass mit Sicherheit mehr als zwei Fettgewebsläppchen gewonnen werden. In unserer Arbeit entnahmen wir die Hautbiopsien mittels einer Stanze mit der empfohlenen Größe von über 6 mm. Mittels kleinerer Biopsiestanzen erlangt man aufgrund der kleineren Probe häufig keine und nur zufällig eine Diagnose. Quetschartefakte werden häufig bei zu kleinen Biopsien mit der klinischen Fragestellung nach ,,Pannikulitis“ angetroffen. Dies versuchten wir durch die von uns gewählte Stanzengröße zu vermeiden. 60 In unserer Arbeit setzen wir zur immunhistochemischen Differenzierung der Lymphozyten die Avidin-Biotin-Komplex Methode ein. Sie zeichnet sich durch eine gute Sensitivität, Signalverstärkung und eine intensive Anfärbung aus (Bonnard et al., 1984). Die Fixation und die Paraffineinbettung in das Gewebe sind besonders kritische Schritte im Arbeitsablauf des immunhistochemischen Verfahrens. Ein Antigen muss nachweisbar, fixiert und für den Primärantikörper zugänglich sein (Bourne, 1989). Falls ein Antigen mangelhaft fixiert ist kommt es zur Auswaschung. Überfixierung führt zu Denaturierung oder Demaskierung des Antigens (Bourne, 1989). Minimiert wurden die oben genannten Phänomene, durch sorgfältiges und standardisiertes Arbeiten. Hilfe durch erfahrene MTA`s war jederzeit möglich. Die Auswertung der in jeder Färbereihe mitgeführten positiven und negativen Kontrollen reduzierten die methodischen Fehler als Ursache unspezifischer Färbungen. Zudem sind wir in unserer Arbeit von einer kleinen Stichprobengröße ausgegangen. Interessant wäre es unsere Ergebnisse an einem größeren Patientenkollektiv zu validieren. 5.5 Perspektiven In unserer deskriptiven Arbeit wurde erstmals eine Untersuchung zur Expression von Entzündungszellen mittels immunhistochemischer, markierter Oberflächenmarker an einem Patientenkollektiv mit einer septalen Pannikulitis bei der zirkumskripten Sklerodermie durchgeführt. Diese Studie liefert wichtige Daten bezüglich der qualitativen und der quantitativen Zusammensetzung des entzündlichen Infiltrates im Fettgewebe. Andere Arbeitsgruppen hatten bereits in der Vergangenheit eine Differenzierung von Entzündungszellen in der Dermis sowie deren Auftreten im Serum bei der zirkumskripten Sklerodermie untersucht, um so Hinweise auf die Pathogenese und Differenzialdiagnose entzündlicher, fibroisierender Hauterkrankungen zu erlangen. Im klinischen Alltag haben sich diese Marker bisher nicht durchgesetzt und die Diagnose einer zirkumskripten Sklerodermie wird weiterhin anhand der Anamnese, der makroskopisch sowie mikroskopisch typischen Läsionen sowie dem klinischen Verlauf gestellt. Unsere Arbeit stellt eine erste Grundlage für weiterführende immunhistochemischer Untersuchungen dar. Zukünftige Untersuchungen an größeren Patientenkollektiven, auch im Zusammenhang mit anderen serologischen-klinischen Parametern und weiteren Oberflächenmarkern 61 sind wünschenswert. Auch der Vergleich mit verschiedenen Referenzgruppen aus dem Formenkreis der Kollagenosen mag hilfreich erscheinen um die Pathogenese der Erkrankung weiter zu verstehen und langfristig eine individualisierte, Stadiengerechte Therapien zu etablieren. 62 6 Zusammenfassung Gegenstand dieser Arbeit war der Nachweis und die immunhistochemische Differenzierung von Entzündungszellen im Fettgewebe bei Patienten mit der Diagnose einer zirkumskripten Sklerodermie. Als Referenzgruppe untersuchten wir Patienten mit der Diagnose eines Erythema nodosum. Der genaue Pathomechanismus ist bei beiden Erkrankungen nicht abschließend geklärt. In unserer experimentellen Arbeit erfolgte eine detaillierte Darstellung der Zellpopulationen mittels immunhistochemischer Färbetechnik. Nachgewiesen wurden T-Lymphozyten im gesamten (CD3+), T-Helferzellen (CD4+), zytotoxische/T-Suppressorzellen (CD8+), Granulozyten (CD15+), B-Lymphozyten (CD20+) und Makrophagen (CD68+). Bis auf CD15 (Granulozyten) und CD4+ bei der zirkumskripten Sklerodermie ließen sich alle untersuchten Marker in den Proben nachweisen, was für den komplexen Pathomechanismus beider Krankheitsbilder spricht. Die Ergebnisse decken sich mit denen aus der Dermis gewonnen Daten anderer Arbeitsgruppen. Ein bedeutsamer Unterschied zwischen den Stichproben fand sich im quantitativen Auftreten von zytotoxischen CD3+/CD8+ Zellen bzw. von Makrophagen (CD68+). Beide Zelllinien traten häufiger in der Gruppe mit dem Erythema nodosum auf. Der Grund hierfür ist nicht ganz klar und lässt sich auch anhand der von uns gewonnen Daten nicht weiter erklären. Möglicherweise spielt die unterschiedliche Genese der Erkrankungen dabei eine Rolle. Allerdings ist der Pathomechanismus in keinem Fall abschließend geklärt. Auffällig war das der Nachweis von CD4+ Zellen im Fettgeweben bei der zirkumskripten Sklerodermie negativ ausfiel. Andere Untersucher kamen in der Dermis zu unterschiedlichen Ergebnissen. Hierfür existieren mehrere Erklärungsansätze. Sie können z.B. in der Verschiedenheit des untersuchten Gewebes oder dem unterschiedlichen Untersuchungszeitpunkt liegen. Möglicherweise hatte noch keine Migration der T-Helferzellen in das Fettgewebe stattgefunden. Auch der Einfluss einer bereits durchgeführten Therapie auf das Zellbild ist nicht ausgeschlossen. Allerdings ergab der Vergleich mit dem CD4+ Zellen positiven Erythema nodosum keine statistische Signifikanz. In Anbetracht der Seltenheit der Erkrankung sind die untersuchten Stichproben allesamt sehr klein, was Einfluss auf die Power der Studien hat. 63 Literaturverzeichnis Addison, T. (1854). On the keliod of Alibert, and on true keloid. Med. Chirug. 37, 27-47 Almeida, M.S., Lima, S.C., Calvalho, L.L., Almeida, J.V., Santos, L.G., Rolim, J.R., Rocha ,T.E. (2010). Panniculitis- an unusual cutaneous manifestation of systemic sclerosis. J. Cutan. Pathol. 37 ,1170-1173 Altmeyer, P., Bacharach-Buhles M. (2002). Springer- Enzeklopädie der Dermatologie, Allergologie und Umweltmedizin. Springer- Verlag, Berlin Heidelberg. Andrews, B.S., Friou, G.J., Berman, M.A. (1987). Changes in circulating monocytes in patients with progressive systemic sclerosis. J. Rheumatol. 14,930–935 Balabanova, M., Obreshkova, E. (1999). Scleroderma profunda. Clinicopathological studies. Adv. Exp. Med. Biol. 455, 105-109 Baldock, N.E., Catterall, M.D. (1975). Erythema nodosum from Yersinia enterocolitica. Br. J. Dermatol. 93, 719-720 Birdi, N., Laxer, R.M., Thorner, P., Fritzler, M.J., Silverman, E.D. (1993). Localized scleroderma processing to systemic disease. Case report and review of the literature. Arthritis Rheum. 36, 410-415 Bielsa, I., Ariza, A. (2007). Deep morphea. Semin. Cutan. Med. Surg. 26, 90-95 Blaszczyk, M., Krolicki,L., Krasu, M., Glinksa, O., Jablonska, S. (2003). Progressive facial hemiatrophy: central nervous system involment and relationchip with scleroderma en coup de sabre. J. Rheumatol. 30, 1997-2004 Blaszczyk, M., Janniger, C.K., Jablonska, S. (1996). Childhood scleroderma and its peculiarities. Cutis. 58, 141-144; 148-152 64 Bonnard, C., Papermaster, D.S., Kraehlenbuhl, J.P., Polak, J.M., Varndell, I.N. (1984). The strepatvidin-biotin bridge technique: application in light and electron mikroscop immuncytochemistry. Immunolabellin for electron microscopie. Elsevier Science Publisher Amsterdam. 95-111 Bourne, J. (Hrsg.) (1989). Handbuch der Immunperoxidase- Färbemethode. DAKO Corporation, Carpinteria. USA, 7-37 Böker, W., Denk, H., Heitz, Ph.U. (1996). Pathologiebuch. 98-136 Breuckmann, F., Gambichler, T., Altmeyer, P., Kreuter, A. (2004). UVA/UVA1 phototherapy and PUVA photochemotherapy in connective tissue diseases and related disorders: a research based review. BMC Dermatol. 4, 11 Brill, G. (1936). Relapsing febrile nodular nonsupporative pannikulits (weberchristians. Disease). Baltimore. Warfely press. Buechner, S. A., Winkelmann, R. K, Lauterschlager, S., Gilli, L., Rufli, T. (1993). Localized scleroderma associated with Borrelia burgdorferi infection. Clinical, histologic and immunhistochemical observations. J. Am. Acad. Dermatol. 29, 190-196 Campana, D., Thompson, J.S., Amlot, P., Brown, S., Janossy, G. (1987). The cytoplasmic expression of CD3 antigens in normal and malignant cells of the T lymphoid lineage. J. Immunol 138, 648-655 Caperton, E.M., Hathaway, D.E., Dehner, L.P. (1976). Morphea, fasciitis and scleroderma with eosinophilia: a broad spectrum of disease. Arthritis Rheum. 19, 792793 Capusan, I. (1971). Scleroderma or scleroedema? Comments on the case published in 1753 by Dr. Carlo Curzio of Naples. G. Ital. Dermatol. Minerva Dermatol. 46, 40-47 65 Christen- Zaech, S., Hakim, M.D., Afsar, F.S., Paller, A.S. (2008). Pediatric morphea (localized morphea): review of 136 patients. J. AM. Acad. Dermatol. 59, 385-396 Chun, S.I., Su, W.P., Lee, S., Rogers, R.S. (1989). Erythema nodosum-like lesions in Behçet's syndrome: a histopathologic study of 30 cases. J. Cutan. Pathol. 16, 259-265 Chung, L., Lin, J., Furst, D.E., Fiorentino, D. (2006). Systemic and localized scleroderma. Clin. Dermatol. 24, 374-392 Cunningham, B.B., Landells, I.D., Langman, C., Sailer, D.E., Paller, A.S. (1998). Topical calcipotriene for morphea/linear scleroderma. J. Am. Acad. Dermatol. 39, 211-215 Dabbs, D.J. (2006). Ed. Diagnostic Immunohistochemistry, Elsevier Inc. 141-150 Dehen, L., Roujeau, J.C., Cosnes, A., Revuz, J. (1994). Internal involment in localized scleroderma. Medicine (Baltimore). 73, 241-245 Diaz- Peres, J.L., Connolly, S.M., Winkelmann, R.K. (1980). Disabling pansclerotic morphea of children. Arch Dermatol. 116, 169-173 Diaz, C., Borghi, S., Weyers, W. (2000). Panniculitis: definition of terms and diagnostic strategy. Am. J. Dermatopathol. 22, 530-549 Doyle, J.A., Ginsburg, W.W. (1989). Eosinophile Fasciitis. Med. Clin. North. Am. 73, 1157-1166 Durand, J.M., Lefèvre, P., Weiller, C. (1991). Erythema nodosum and coeliac disease. Br J Dermatol.125, 291-292 Dytoc, M., Ting ,P.T., Man, J., Sawyer, D., Fiorillo, L. (2005). First case series on the use of imiquimod for morphea. Br. J. Dermatol. 153, 815-820 66 Eisendle, K., Grabner, T., Zelger, B. (2007). Morphea: a manifestation of infection with borrelia species? Br. J. Dermtol. Dec. 157, 1189-1198 Falanga, V., Medsger, T.A. Jr, Reichlin, M., Rodnan ,G.P. (1986). Linear scleroderma. clinical spectrum, prognosis, and laboratory abnormalities. Ann Intern med. 104, 849-857 Fawzi, M.M., Tawfik, S.O., Eissa, A.M., El-Komy, M.H., Abdel-Halim, M.R., Shaker, O.G. (2008). Expression of insulin-like growth factor-I in lesional and nonlesional skin of patients with morphea. Br. J. Dermatol. 159, 86-90 Fett, N., Werth, M.D. (2011). Update on morphea: part I. Epidemiology, clinical presentation, and pathogenesis. J. AM. Acad. Dermatol. 64, 217-228 Fett, N., Werth, MD. (2011). Update on morphea: part II. Outcome measures and treatment. J. AM. Acad. Dermatol. 64, 231-242 Forsea, A.M., Cretu, A.N., Ionescu, R., Giurcaneanu, C. (2008). Disabling pansclerotic morphea of childhood-unusual case and management challenges. J. Med. Life. 1, 348-354 Förström, L., Winkelmann, R.K. (1977). Acute panniculitis: a clinical and histopathologic study of 34 cases. Arch. Dermatol. 113, 909-917 Fritzler, M.J., Tan, E.M. (1978). Antibodies to histone in drug- induces and idiopathic lupus erythematodes. J. Clin. Invest. 62, 560-567 Fuschiotti, P., Medsger,T.A Jr, Morel, P.A. (2009). Effector CD8+ T cells in systemic sclerosis patients produce abnormally high levels of interleukin-13 associated with increased skin fibrosis. Arthritis Rheum. 60, 1119- 1128 Gabrielli, A., Avedimento, E.V., Krieg, T. (2009). Scleroderma. N. Engl. J. Med. 360, 1989-2003 67 Gamblicher, T., Tigges, C., Burkert, B., Höxtermann, S., Altmeyer, P., Kreuter, A. (2010). Absolute count of T and B lymphocyt subsets is decreased in systemic sclerosis. Eur. J. Med. Res. 15, 44-46 García-Porrúa, C., González-Gay, M.A., Vázquez-Caruncho, M., López-Lazaro, L., Lueiro, M., Fernández , M.L., Alvarez-Ferreira ,J., Pujol, R.M. (2000). Erythema nodosum: etiologic and predictive factors in a defined population. Arthritis Rheum. 43, 584-592 Goyert, S.M. CD68 workshop panel report. In: Kishimoto, T., Kikutani, H., von dem Borne AEG, Goyert, S.M., Mason, D.Y., Miyasaka, M. (1996). Leucocyte typing VI. White cell differentiation antigens. Proceedings of the 6th International Workshop and Conference. Kobe, Japan. New York, London: Garland Publishing.14, 10151016 Gupta,R.A., Fiorentino, D. (2007). Localized scleroderma and systemic sclerosis: is there a connection? Best Pract. Clin. Rheumatol. 21, 1025-1036 Hansen, C. B., Callen, J.P. (2010). Connective tissue panniculitis: lupus panniculitis, dermatomyositis, morphea/ scleroderma. Dermatol. Ther. 23, 341-349 Harrison, T.R., Fauci, A.S., Braunwald, E., Kasper, D.L., Hauser, S.L., Longo, D.L, Jameson, J.L. (2009). Harrisons Innere Medizin in Dietel, M., Suttorp, N., Zeitz, M. (Hrsg.). Charity. 2586-2599 Hasequawa. M., Fujimoto, M., Takehara, K., Sato, S. (2005). Pathogenesis of systemic sclerosis: altered B cell function is the key linking systemic autoimmunity and tissue fibrosis. J. Dermatol. 39, 1-7 Haustein, U., Mittag, M. (2003). Morphea. in: Histopathologie der Haut, Springer, Berlin. 457-459 Hedfors, E., Norberg, R. (1974). Evidence for circulating immune complexes in sarcoidosis. Clin. Exp. Dermatol .16, 493-496 68 Herrmann, T., Günther, C., Csere, P. (2009). Localized morphea- a rare but significant secondary complication following breast cancer radiotherapy. Case report and review of the literature on radiation reaction among patients with scleroderma/ morphea. Strahlenenther Onkol. 185, 603-607 Ho, J., Rothchild, Y.H., Sengelmann, R. (2004). Vitamin B12- associated localized scleroderma and its treatment. Dermatol. Surg. 30, 1252-1255 Hunzelmann, N., Anders, S., Fierlbeck, G. (1997). Double-blind, placebocontrolled study of intralesional interferon gamma for the treatment of localized scleroderma. J. Am. Acad. Dermatol. 36, 433-435 Ihn, H., Sato, S., Fujimoto, M. (1995). Demonstration of interleukin-2, interleukin-4 and interleukin-6 in sera from patients with localized scleroderma. Arch Dermatol Res. 287, 193 Ihn, H., Yazawa, N., Kubo, M. (2000). Circulating levels of soluble CD30 are increased in patients with localized scleroderma and correlated with serological and clinical features of the disease. J. Rheumatol. 27, 698-702 Ishikawa, O., Ishikawa, H. (1992). Macrophage infiltration in the skin of patients with systemic sclerosis. J Rheumatol.19, 1202–1206 Jablonska, S. (1975). Facial hemiatrophy and its relation to localized scleroderma. In: Jablonska S. Scleroderma and pseudoscleroderma. PZWL, Warsaw, 537-548 Jablonska, S. (1975). Localised Scleroderma. In: Jablonska S (ed) Scleroderma and pseudoscleroderma. PZWL, Warsaw, 277-303 Jablonska, S., Blaszczyk, M. (2004). Is superficial morphea synonymous with atrophoderma Pasini- Pierni? J Am Acad Dermatol. 50, 979-980 Janeway, C., Travers, P., Walport, M., Shlomchik, M. (2002). Janeway Immunologie in Mahlke, K. (Hrsg.), 317-387 69 Jarret, P., Goodfield, M.J.D. (1996). Hydroxychloroquine and chronic erythema nodosum (letter). Br. J. Dermatol. 134, 373 Jimenez, S.A., Hitraya, E., Varga,J. (1996). Pathogenesis of scleroderma. Collagen. Rheum. Dis. Clin. North Am. 22, 647-674 Jones, J.V., Cumming, R.H., Asplin, C.M. (1976). Evidence for circulating immune complexes in erythema nodosum and early sarcoidosis. Ann. N. Y. Acad. Sci. 278, 212-219 Kannagi, R. AS5. CD15 workshop panel report. In: Kishimoto, T., Kikutani,H., von dem Borne AEG, Goyert, S.M, Mason, D.Y., Miyasaka, M. (1997). Leucocyte typing VI. White cell differentiation antigens. Proceedings of the 6th International Workshop and Conference; 1996. 10-14; Kobe, Japan. New York, London: Garland Publishing Inc. 348-351 Kim, B., LeBoit, P.E. (2000). Histopathologic features of erythema nodosum--like lesions in Behçet disease: a comparison with erythema nodosum focusing on the role of vasculitis. Am. J. Dermatopathol. 22, 379-390 Kishimoto, T., Kikutani, H., von dem Borne, A., Goyert, S.M., Mason, D.Y., Miyasaka, M. (1996). Leucocyte typing VI. White cell differentiation antigens. Proceedings of the 6th International Workshop and Conference. Kobe, Japan. New York, London: Garland Publishing. 65-67 Kreuter, A., Gambichler, T., Avermaete, A. (2001). Combined treatment with calcipotriol ointment and low-dose ultraviolet A1 phototherapy in childhood morphea. Pediatr. Dermatol. 18, 241-245 Kreuter, A., Gambichler, T., Breuckmann, F. (2005). Pulsed high-dose corticosteroids combined with lowdose methotrexate in severe localized scleroderma. Arch. Dermatol. 141, 847-852 70 Kreuter, A., Hyun, J., Stücker ,M., Sommer, A., Altmeyer,P., Gambichler ,T. (2006). A randomized controlled study of low-dose UVA1, medium-dose UVA1, and narrowband UVB phototherapy in the treatment of localized scleroderma. J Am. Acad. Dermatol. 54, 440-447 Kreuter, A., Gamblicher, T. (2008). UV- A1 phototherapy for sclerotic skin diseases: implications for optimizing patient selection and management. Arch Dermatol. 16. 314-316 Kreuter, A., Krieg, T., Worm, M., Wenzel, J., Gambichler, T., Kuhn, A., Aberer, E., Scharffetter-Kochanek, K., Hunzelmann, N. (2009). AWMF Guideline no. 013/066. Diagnosis and therapy of circumscribed scleroderma. J. Dtsch Dermatol Ges. 2009. 7, 1-14 Kreuter, A., Höxtermann, S., Gambichler, T., Tigges, C., Hahn, S.A., Schieren, G. (2009). Detection of clonal T cells in the circulation of patients with nephrogenic systemic fibrosis. Arch. Dermatol. 145, 1164-1169 Kreuter, A. (2012). Localized scleroderma. Dermatologic Therapy. 25, 135-147 Kluger, N., Girard, C., Guillot, B. (2011). Erythema nodosum and Hodgkin's disease: a rare association that should not be neglected. 40, 199-200 Kubo, M., Ihn, H., Yamane, K., Tamaki, K. (2001). Up-regulated expression of transforming growth factor beta receptors in dermal fibroblasts in skin sections from patients with localized scleroderma. Arthritis Rheum. 44, 731-734 Kurzinski, K., Torok, K.S. (2011). Cytokine profiles in localized scleroderma and relationship to clinical features. Cytokine. 55, 157-164 Leask, A., Abraham, D.J. (2004). TGF-beta signaling and the fibrotic response.18, 816-827 71 Leitenberg, J.J., Cayce, R.L., Haley, R.W., Adams- Huet, B., Bergstresser, P.R., Jacobe, H.T. (2009). Distinct autoimmune syndromes in morphea: a review of 245 adult and pediatric cases. Arch. Dermatol. 145, 545-550 Leong, A.S-Y, Cooper, K., Leong,F.J.W-H. (2003). Manual of diagnostic antibodies for immunohistology; London: Oxford University Press. 89-91 Lin, J.T., Chen, P.M., Huang, D.F., Kwang, W.K., Lo, K., Wang, W.S. (2004). Erythema nodosum associated with carcinoid tumour. Clin. Exp. Dermatol. 29, 426427 Mayorquin, F.J., Mccurley, T.L., Lenvenier, J.E., Myers, L.K., Becker, J.A., Graham, T.P., Pincus, T. (1994). Progression of childhood linear scleroderma to fatal systemic sclerosis. J. Rheumatolog. 21, 1955-1957 Mancuso, G., Berdondini, R.M. (2005). Localized scleroderma: response to occlusive treatment with tacrolimus ointment. Br. J. Dermatol. 152, 180-12 Marcoval, J., Moreno, A., Mañá, J. (2003). Papular sarcoidosis of the knees: a clue for the diagnosis of erythema nodosum-associated sarcoidosis. J. Am. Acad. Dermatol. 49, 75-78 Marzaano, A.V., Menni, S., Parodi, A., Borghi, A., Fuligni, A., Fabbri, P., Caputo, R. (2003). Localized scleroderma in adults and children. Clinical and laboratory investigations on 239 cases. Eur. J. Dermatol. 13, 171-176 Mason, D.Y., Cordell, J., Brown, M., Pallesen, G., Ralfkiaer, E., Rothbard, J. (1989). Detection of cells in paraffin wax embedded tissue using antibodies against a peptide sequence from the CD3 antigen. J. Clin. Pathol. 42, 1194-1200 Mason, D.Y., Comans-Bitter, W.M., Cordell, J.L., Verhoeven, M. A., Van Dongen, J.J. (1990). Antibody L26 recognizes an intracellular epitop on the B- cell- associated CD 20 antigen. Am. J. Pathol. 136, 1215-1222 72 Matsui, S. (1924) Über die Pathologie und Pathogenese von Sklerodermia universalis. Tokio. McCallum, D.I., Kinmont, P.D. (1968). Dermatological manifestations of crohn's disease. Br. J. Dermatol. 80, 1-8 McKee, P., Calonje, J., Granter, S. (2005). Localized scleroderma. in: Pathology of the Skin: With Clinical Correlations. 3 815-821 Mc Niff, J.M., Glusac, E.J., Lazova, R.Z., Carroll, C.B. (1999). Morphea limited to the superficial reticular dermis: an underrecognized histologic phenomenon. Am. J. Dermatopathol. 21, 315-319 Miehle, W., Fehr, K., Schattenkirchner, M. (1999). Rheumatologie in Praxis und Klinik. Thieme, Stuttgart; Auflage: 2. 12, 954-960 Miescher, G. (1947). Zur Histologie des Erythema nodosum. Acta. Derm. Venereol. 27, 447-468 Miescher, G. (1951). Zur Frage der Radiärknötchen beim Erythema nodosum. Arch. Dermatol. Syphl 193, 251-256 Moll, I., Jung, E., Bob, A., Bob, K. (2005). Duale Reihe Dermatologie. Georg Thieme Verlag , Stuttgart New York, 148- 150 Morell, A., Betlloch, I., Sevila, A., Banuls, J., Botella, R. (1994). Morphea like reaction after vitamin K injections. Contact Dermatitis. 31, 45-46 Nenoff, P., W. Handrick, W., Paasch, U., Mügge, C.,Berthold, W. (2006). Das Erythema nodosum – eine Übersicht. MIKROBIOLOGE 16.Jg. Nishimura, S., Manabe, I., Nagasaki, M., Eto, K., Yamashita, H., Ohsugi, M., Otsu, M.,Hara, K., Ueki, K., Suquira, S., Yoshimura, K., Kadowaki, T., Nagai ,R. (2009). CD8+ effector T- cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat. med. 15, 914-920 73 Nishio, J., Suzuki, M., Miyasaka, N., Kohsaka, H. (2001). Clonal biases of peripheral CD8 T cell repertoire directly reflect local inflammation in polymyositis. J. Immunol. 167, 4051-4058 O`Leary PA, Nomland R. (1930). Clinical study of 103 cases of scleroderma. Am. J. Med. Sci.180, 95-112 Patterson, J.W. (2003). Panniculitis. In: Bologna JL et al. (Hrsg) Dermatology, Mosby London New York Toronto. 1551-1552 Perez, N.B., Bernad, B., Narváez, J., Valverde, J. (2006). Erythema nodosum and lung cancer. Joint Bone Spine. 73, 336-337 Person, J.R., Su, W.P. (1981). Morphea profunda: a new concept and a histopathologic study of 23 cases. Am J Dermatopathol. 3, 251-260 Peroni, A., Zini, A., Braga,V., Colato, C., Adami, S., Girolomoni, G. (2008). Druginduced morphea: report of a case induced by balicatib and review of the literature. J.. Am Acad. Dermatol. 59, 125-129 Peterson, L.S, Nelson, A.M., Su W.P., Mason, T., O`Fallon, W.M., Gabriel, S.E. (1997). The epidemiology of Morphea (Localized Scleroderma) in Olmsted County 1960-1993. J. Rheumatol. 24, 73-80 Peterson, P.S., Nelson, A.M., Su, W.P. (1995). Classification of morphea (localized scleroderma). Mayo. Clin. proc. 70, 1068-1076 Pezzutto, A., Behm, F., Callard, R.E, Clark, E.A., Genetet, N., Goodall, A.H, et al. B22.3. Flow cytometry analysis of the B-cell blind panel: joint report. In: Knapp, W., Dörken, B., Gilks, W.R, Rieber, E.P., Schmidt, R.E., Stein, H., et al., editors. (1989).Leucocyte typing IV. White cell differentiation antigens. Proceedings of the 4th International Workshop and Conference.Vienna, Austria. Oxford, New York, Tokyo: Oxford University Press. 2, 165- 174 74 Pfeifer, V. (1892). Über einen Fall von Herdweiser Atrophie des subkutanen Fettgewebes. Dts. Arch Klein. 50, 438-449 Pink, A., Barker, J. (2012). Erythema nodosum. Br. J. Hosp. Med. (Lond). 73, 5052 Psychos, D.N., Voulgari, P.V., Skopouli, F.N., Drosos, A.A., Moutsopoulos, H.M. (2000). Erythema nodosum: the underlying conditions. 19, 212-216 Reich, S., Altmeyer, P., Kreuter, A. (2007) Kollagenosen. Ein Ratgeber für Patienten. Requena, L., Yus, E.S. (2001). Panniculitis. Part I. Mostly septal panniculitis. J. Am. Acad. Dermatl. 45, 163-183 Requena, L., Sánchez Yus, E. (2001). Panniculitis. Part II. Mostly lobular panniculitis. J. Am. Acad. Dermatol. 45, 325-361 Requena, L. (2008). Normal subcutaneous fat, necrosis of adipocytes and classification of the panniculitides. Semin. Cutan. Med. Surg. 26, 66-70 Requena, L. Yus, E.S. (2008). Erythema nodosum. Dermatol. Clin. 26, 425-438 Requena, L. Requena, C. ( 2002). Erythema nodosum. Dermatol. Online. 8, 1-4 Requena, L., Sánchez, Y. E. (2007). Erythema nodosum. Semin. Cutan. Med Surg. 26, 114-125 Rodnan, G.P., Lipinski, E., Rabin, B.S., Reichlin, M. (1977). Eosinophilia and serologic abnormalities in linear localized scleroderma. Arthritis Rheum. 20, 133 Rojas-Villarraga, A., Restrepo J.F. et al (2006). Paniculitis y eritema nodoso. Un estudio de correlación clínico-biológica. Revista olombiana de Reumatologia. 4, 253-263 75 Salmon-Her, V., Serpier, H., Nawrocki, B. (1996). Expression of interleukin4 in scleroderma skin specimens and scleroderma fibroblast cultures. Arch. Dermatol 132, 802-806 Sánchez, Y. E., Sanz Vico, M.D., de Diego, V. (1989). Miescher's radial granuloma. A characteristic marker of erythema nodosum. Am. J. Dermatopathol.11, 434442 Sato, S., Ihn, H., Soma, Y., Igarashi, A., Tamaki, T., Kikuchi,K., Ishibashi, Y., Takehara, K. (1993). Antihistone antibodies in patients with localized scleroderma. Arthritis Rheum. 36, 1137-1141 Sato, S., Ihn, H., Soma, Y., Shimozuma, M., Shishiba, T., Takehara, K. (1993). A case of systemic sclerosis with anticentromere, antitopoisomerase I, and antiU1RNP antibodies. J. Rheumatol. 20, 1961-1963 Sato, S., Fujimoto, M., Kikuchi ,K., Ihn, H., Tamaki, K., Takehara, K. (1996). Soluble CD4 and CD8 in serum from patients with localized scleroderma. Arch. Dermatol. Res. 288, 358-362 Sato, S., Kodera, M., Hasegawa, M., Fujimoto, M., Takerhara, K. (2004). Clinical and Laboratory Investigations. Antinucleosome antibody is a major autoantibody in localized scleroderma. British Journal of Dermatology .151, 1182–1188 Sato, S. (2006). B cell abnormalities and autoantibody production in systemic sclerosis. Deparment of Dermatology. 29, 73-84 Scharffetter, K., Wlaschek, M., Hogg, A., Bolsen, K., Schothorst, A., Goerz, G., Krieg, T., Plewig, G. (1991). UVA irradiation induces collagenase in human dermal fibroblasts in vitro and in vivo. Arch.Dermatol.Res. 283, 506-511 Schachter, R.K. (1989). Localized scleroderma. Curr.Opin. Rheumatol. 1, 505-511 76 Schiebler, T.H., Schmidt, W., Zilles, K. (1999). Allgemeine Anatomie des Abwehrsystems. In: Anatomie . 8. Auflage . Berlin ; Heidelberg ; New York : SpringerVerlag. 171-186 Segura, S., Requena, L. (2008). Anatomy and histology of normal subcutaneous fat, necrosis of adipocytes, and classification of the panniculitides. Dermatol Clin. 26, 419-424 Silman, A., Jannini, S., Symmons, D., Bacon, P. (1988). An epidemiological study of scleroderma in the West Midlands. Br. J. Rheumatol. 27, 286-290 Silman, A.J., Black, C. (1988). Increased incidence of spontaneous abortion and infertility in women with scleroderma before disease onset: a controlled study. Ann. Rheum. Dis. 47, 441-444 Sommer, A., Gambichler, T., Bacharach-Buhles, M., von Rothenburg, T., Altmeyer, P., Kreuter, A. (2006). Clinical and serological characteristics of progressive facial hemiatrophy: a case series of 12 patients. J. Am. Acad. Dermatol. 54, 227-233 Steen, V.D., Medsger, T.A. (2000). Severe organ involvement in systemic sclerosis with diffuse scleroderma. Arthritis Rheuma. 43, 2437-2444 Stefanaki, C., Stefanaki, K., Kontochristopoulos, G., Antoniou, C., Stratigos, A., Nicolaidou, E., Gregoriou, S., Katsambas, A. (2008). Topical tacrolimus 0,1% ointment in the treatment of localized scleroderma. An open label clinical and histological study, Journal of Dermatology. 35, 712-718 Stege, H., Berneburg, M., Humke, S. (1997). High-dose UVA1 radiation therapy for localized scleroderma. J. Am. Acad. Dermatol. 36, 938-944 Stein, B., Rahmsdorf, H.J., Steffen, A., Litfin, M., Herrlich, P. (1989). UV-induced damage is a intermediate step in UV-induced expression of human immunodeficiency virus type 1, collagenase, c-fos and metallothionein. Mol. Cell. Biol. 9, 5169-5181 77 Stummvoll, G. H., Aringer, M., Gisar, J., Steiner, C.W., Smolen, J.S., Knobler, R.,Graninger, W.B. (2004). Increased transendothelial migration of scleroderma lymphocytes. Ann. Rheum. Dis. 63, 569-574 Su, W.P., Green, S.L. (1986). Bullous morphea profunda. Am. J. Dermatopathol. 8, 144-147 Su, W.P., Person, J.R. (1981). Morphea profunda. A new concept and a histopathologic study of 23 cases. Am. J. Dermatopathol. 3, 251-260 Sunderkötter, C., Kuhn, A., Hunzelmann, N., Beissert, S. (2006). Phototherapy: a promising treatment option for skin sclerosis in scleroderma? Rheumatology. 45, 52-54 Sung, J.J., Chen, T.S., Gilliam, A.C., McCalmont, T.H., Gilliam, A.E. (2011). Clinicohistopathological correlations in juvenile localized scleroderma: studies on a subset of children with hypopigmented juvenile localized scleroderma due to loss of epidermal melanocytes. J. Am. Acad. Dermatol. 65, 364-373 Takehara, K., Moroi, Y., Nakabayashi, Y., Ishibashi, Y. (1983). Antinuclear antibodies in localizied scleroderma. J. Am. Acad Dermtol.26, 612-616 Takehara, K., Sato, S. (2005). Localized scleroderma is an autoimmune disorder. Rheumatology. 44, 274-279 Tedder, T.F., Engel, P. (1994). CD20: a regulator of cell-cycle progression of B lymphocytes. Immunology 15, 450-454 Ter Poorten, M.C., Thiers, B.H. (2002). Panniculitis. Dermatol. Clin. 20, 421- 433 Tuffanelli, D. L., Winkelmann, R. R. (1955). Systemic scleroderma. Arch. Dermatol. 84, 359-371 78 Toledano, C., Rabhi, S., Kettaneh, A., Fabre, B., Fardet, L., Tiev, K.P., Cabane, J. (2009). Localized scleroderma: a series of 52 patients. Eur. J. Inter. Med. 20, 331336 Tollefson, M.M., Witman, P.M. (2007). En coup de sabre morphea and ParryRomberg syndrome: a retrospective review of 54 patients. J. Am. Acad. Dermatol. 56, 257-263 Tomb, R., Soutou, B., Chehadi, S. (2009). Plasma cell panniculitis: a histopathological variant of morphea profunda. Ann. Dermatol. Venereol. 136, 256259 Tomimura, S., Ogawa, F., Iwata, Y., Komura, K., Hara, T., Muroi, E., Takenaka, M., Shimizu, K., Hasegawa, M., Fujimoto, M., Sato, S. (2008). Autoantibodies against matrix metalloproteinase-1 in patients with localized scleroderma. J Dermatol Sci. 52, 47-54 Torrelo, A., Suarez, J., Comenero, I., Azorin, D., Perera, A., Zambrano, A. (2006). Deep morphea after vaccination in two young children. Pediatr. Dermatol. 23, 484487 Uziel, Y., Krafchik, B.R., Silvermann, E.D, Thorner, P.S., Laxer, R.M. (1994). Localized scleroderma in childhood: a report of 30 cases. Semin. Arthritis. Rheum. 23, 328-340 Uziel, Y., Feldman, B.M., Krafchik, B.R., Yeung, R.S., Laxer, R.M. (2000). Methotrexate and corticosteroid therapy for pediatric localized scleroderma. J. Pediatr. 136, 91-95 Vierra, E., Cunningham, B.B. (1999). Morphea and localized scleroderma in children. Semin. Cutan. Med. Surg. 18, 210-225 Warnke, R.A., Pulford, K.A..F, Pallesen, G., Ralfkiaer, E., Brown, D.C., Gatter, K.C. (1989). Diagnosis of myelomonocytic and macrophage neoplasms in routine79 ly processed tissue biopsies with monoclonal antibody KP1. Am. J. Pathol. 135, 1089-1095 White, B. (1996). Immunpathogenesis of systemic sclerosis. Rheum. Dis. Clin. North AM. 22, 695-708 White, J.W. Jr., Winkelmann, R.K. (1998). Weber- Christian panniculitis: a review of 30 cases with this diagnosis. J. Am. Acad. Dermatol. 39, 56-62 Winkelmann, R.K., Frigas, E. (1986). Eosinophilic panniculitis: a clinicopathologic study. J. Cutan. Pathol. 13, 1-12 Xie,Y., Zang, X., Wakasugi, S., Makino, T., Inou, Y., Ihn,H. (2008). Immunhistochemical characterization of the cellular infiltrate in localized sclerodermie. Int. J. Dermatol. 47, 438-42 Yamane, K., Ihn, H., Kubo, M., Kuwana, M., Asano, Y., Yazawa, N., Tamaki, K. (2001). Anti- U1 RNP antibodies in patients with localized scleroderma. Arch. Dermatol. Res. 293, 455-459 Zhou, L-J., Tedder, T.F. CD20 workshop panel report. In: Schlossman SF, Boumsell L, Gilks W, Harlan JM, Kishimoto T, Morimoto C (1995). Leukocyte typing V. White cell differentiation antigens. Proceedings of the 5th International Workshop and Conference; 1993 Nov 3-7; Boston, USA. Oxford, New York, Tokyo: Oxford University Press. 511-514 Zulian, F., Vallongo, C., Woo, P., Russo, R., Ruperto, N., Harper, J., Espada, G., Corona, F., Mukamel, M., Vesely, R., Musiej-Nowakowska, E., Chaitow, J., Ros, J., Apaz, MT., Gerloni, V., Mazur-Zielinska, H., Nielsen, S., Ullman, S., Horneff, G., Wouters, C., Martini, G., Cimaz, R., Laxer, R., Athreya, B.H. (2005). Localized scleroderma in childhood is not just a skin disease. Arthritis Rheum. 52, 28732881 Zulian, F. (2004). Systemic Manifestations in Localized Scleroder- ma.Rheumatology reports. Curr. Rheumatol. Rep. 6, 417-424 80 Zulian, F., Vallongo, C., de Oliveira, S.K, Punaro, M.G., Ros, J., Mazur-Zielinska, H., Galea, P., Da Dalt, L., Eichenfield, L.F. (2006) Congenital localized scleroderma. J. Pediatr. 149, 248-251 Zulian, F., Athreya, B.H., Laxer, R., Nelson, A.M., Feitosa de Oliveira, S.K., Punaro, M.G., Cuttica, R., Higgins, G.C., Van Suijlekom-Smit ,L.W., Moore, T.L., Lindsley, C., Garcia-Consuegra, J., Esteves Hilário, M.O., Lepore, L., Silva ,C.A., Machado, C., Garay, S.M., Uziel ,Y., Martini, G., Foeldvari, I., Peserico, A., Woo, P, Harper J. ( 2006). Juvenile localized scleroderma: clinical and epidemiological features in 750 children. An international study.Rheumatology (Oxford). 45, 614-620 81 Danksagung Besonderer Dank gilt Herrn Professor Dr. med. A. Kreuter für die Überlassung des Themas, die exzellente Betreuung und konstruktive fachliche Unterstützung während des gesamten Zeitraumes. Die Zusammenarbeit war für mich in vielfältiger Hinsicht beeindruckend. Herrn PD Dr. med. T. Gamblicher danke ich für seine Hilfestellung bei der statistischen Auswertung. Herrn Dr. N. Othlinghaus danke ich für die Unterstützung während der praktischen Arbeiten sowie der histologischen Begutachtung. Desweiteren bedanke ich mich bei Herrn Professor Dr. M. Stücker für die histologische Begutachtung. Ein ganz besonderes Dankeschön möchte ich Frau S. Richter und Frau Pantz für die professionelle Betreuung und Erstellung der histologischen Präparate aussprechen. Meinen persönlichen Dank möchte ich abschließend meinen Eltern für die langjährige und bereitwillige Unterstützung während meines gesamten Lebensweges sowie bei Frau Nike Wendker, Frau Lena Ventker und Herrn Marco Hautmann aussprechen, die mich während dieser Zeit, vor allem in der Schlussphase, auf so wunderbare Weise motiviert und unterstützt haben. Lebenslauf Persönliche Daten Name Cisewski Vorname Melanie Geburtsdatum/-ort 14.03.1982 in Marl Staatsangehörigkeit deutsch Familienstand ledig Religionszugehörigkeit römisch-katholisch Ausbildung Schulausbildung 08/1988–07/1992 Harkortgrundschule, Marl 08/1992–06/2001 Gymnasium im Loekamp, Marl Abschluss Allgemeine Hochschulreife Hochschulstudium 10/2001–12/2008 Studium der Humanmedizin an der Ruhr Universität Bochum 10/2001-10/2004 Vorklinik an der Ruhr Universität Bochum 10/2004–12/2008 Klinischer Studienabschnitt 12/2008 Staatsexamen, Approbation Berufliche Tätigkeit Seit 02/2009 Assistenzärztin, Innere Medizin, Klinikum Leverkusen