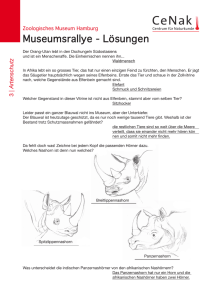
Tierexperimentelle Untersuchungen der Wirkung
Werbung

Tierexperimentelle Untersuchungen der Wirkung immunmodulierender Therapien von Enzephalomyelitiden auf das Immunsystem Dissertation zur Erlangung des Grades eines Doktors der Naturwissenschaften der Fakultät für Biologie der Ruhr-Universität Bochum angefertigt in der Abt. für Medizinische Mikrobiologie/Arbeitsgruppe Prof. Falkenberg vorgelegt von Maike Rieks aus Bochum Bochum 2002 Meinem Vater Karl-Heinz Rieks (* 12.03.1931, † 02.07.1982 an MS), dessen zu kurzes Leben und zu langes Sterben mir stets Motivation und Kraftquell war; und meiner Tochter, Nadia Rieks (* 27.08.1987), die ihren Großvater nie kennenlernen durfte. INHALTSVERZEICHNIS Seite A. Abbildungs- und Tabellenverzeichnis B. Abkürzungsverzeichnis I. EINLEITUNG 1 1. Allgemein 1 2. Zielsetzung 10 II. MATERIAL UND METHODEN 12 1. Material 12 1.1. Geräte 12 1.2. Häufig verwendete Puffer 12 1.2.1. Hepes-Puffer Lösung 12 1.2.2. Phosphate buffered saline (PBS) 12 1.2.3. NH4 CL-Tris-Lyse-Puffer 13 1.2.4. Puffer und Substrate für den Anti-Cop-AK-ELISA 13 1.2.5. Puffer und Lösungen für die histologischen Färbungen 13 1.2.6. Sonstige Puffer 14 1.3. Lösungen und Chemikalien 14 1.3.1. Lösungen für die intrazelluläre Zytokin-Färbung 14 1.3.2. Verschiedene Proteine und Peptide 15 1.3.3. Lösungen für die TUNEL-Methode 15 1.3.4. Verschiedene Färbelösungen 15 1.3.5. Sonstige Lösungen und Chemikalien 15 1.4. Antikörper (-konjugate) 16 1.5. Testsysteme 18 1.6. Verbrauchsmaterialien 18 1.7. Software 18 2. Methoden 19 2.1. Durchflusszytometrie 19 2.2. Apoptotischer Zelltod 20 2.2.1. Allgemeiner Teil 20 2.2.2. TdT-mediated dUTP nick end labeling (TUNEL) Methode 20 2.2.3. Annexin V/Propidiumjodid Methode 21 2.3. Isolierung mononukleärer, peripherer Blutzellen mit Hilfe eines Dichtegradienten 22 2.4. Intrazelluläre Zytokinmessung 23 2.5. Bestimmung von Oberflächenmarkern 24 2.6. Messung der Konzentration löslicher Zytokinmoleküle 26 2.7. Anti-Cop-1-AK-ELISA 26 2.8. Gewinnung von Zellen, Geweben und Organen der Maus für histologische und zellbiologische Untersuchungen 27 2.8.1. Blutabnahme bei Mäusen 27 2.8.2. Herstellung einer Milzzellsuspension 28 2.8.3. Herstellung einer Suspension von Lymphknotenzellen 28 2.8.4. Präparation des Gehirns 28 2.8.5. Präparation des Rückenmarks 28 2.8.6. Herstellung eines Rückenmarkshomogenats 29 2.9. Färbung von Gefrierschnitten aus Mäusehirnpräparaten 29 2.9.1. Hämalaun/Eosin-Färbung 29 2.9.2. Immunhistologische Färbung 30 2.10. Färbung nach Pappenheim 30 2.11. In vitro Stimulation peripherer humaner Blutzellen 31 2.12. Skala zur Bewertung der EAE-Symptome bei Mäusen 31 2.13. 3 H-Thymidin-Proliferationsassay 32 3. Statistik 33 III. PATIENTEN UND VERSUCHSTIERE 34 1. Patienten des in vitro Stimulationsversuchs mit Cop-1 – Vergleich MS-Patienten und gesunde Probanden 34 2. Patienten der Untersuchungen während der Therapie mit Cop-1 35 3. Versuchstiere 37 IV. ERGEBNISSE 38 1. Untersuchung verschiedener Modelle der murinen experimentellen autoimmunen Enzephalomyelitis 38 1.1. Klinische Merkmale bei an EAE erkrankten Mäusen 38 1.2. EAE bei Mäusen des Inzuchtstammes BALB/c 40 1.3. EAE bei Mäusen des Inzuchtstammes C57BL/6 42 1.4. EAE bei Mäusen des Inzuchtstammes SJL/J 43 1.4.1. EAE-Induktion mit PLP-Peptid 43 1.4.2. EAE-Induktion mit MBP-Peptid 44 1.4.3. EAE-Induktion mit Rückenmarkshomogenat 45 1.5. Vergleich der EAE-Modelle 46 2. Vergleich immunologischer Eigenschaften der verschiedenen Mäusestämme 47 3. Untersuchung der Wirkung von Lipo-X auf verschiedene Komponenten des Immunsystems 3.1. Untersuchungen mit an EAE erkrankten Mäusen 3.1.1. 3.2. In vitro Versuche mit Lipo-X 55 56 Untersuchungen der Zellproliferation sowie des apoptotischen Zelltods von Leukozyten nach Stimulation mit Lipo-X 3.2.2. 52 Ergebnisse des Therapieversuchs mit Lipo-X bei Mäusen des Inzuchtstammes SJL/J nach Krankheitsinduktion mit MBP-Peptid 3.2.1. 50 Ergebnisse des Blindversuchs mit Lipo-X bei Mäusen des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid 3.1.3. 50 Ergebnisse des Therapieversuchs mit Lipo-X bei Mäusen des Inzuchtstammes BALB/c nach Krankheitsinduktion mit PLP-Peptid 3.1.2. 50 56 Untersuchung der Zytokinproduktion von Leukozyten nach Stimulation mit Lipo-X 3.3. Untersuchungen der Wirkung von Lipo-X auf das Immunsystem naiver Mäuse 58 60 4. Untersuchung der Wirkung von Cop-1 auf verschiede ne Komponenten des Immunsystems 67 4.1. In vitro Versuche mit Cop-1 67 4.1.1. Untersuchungen des apoptotischen Zelltods nach Stimulation mit Cop-1 67 4.1.2. Untersuchung der Zytokinproduktion von Leukozyten nach Stimulation mit Cop-1 68 4.2. Untersuchungen der Wirkung von Cop-1 auf das Immunsystem naiver Mäuse 69 4.2.1. Untersuchungen der Wirkung von Cop-1 auf das Immunsystem von Mäusen des Inzuchtstammes BALB/c 4.2.2. Untersuchungen der Wirkung von Cop-1 auf das Immunsystem von Mäusen des Inzuchtstammes C57BL/6 4.2.3. 4.3. Therapieversuche mit Cop-1 bei an EAE erkrankten Mäusen 4.4. Untersuchungen des Immunsystems von an EAE erkrankten Mäusen 81 84 86 Untersuchungen des Immunsystems bei SJL/J-Mäusen nach EAE-Induktion mit PLP-Peptid 4.4.2. 78 Therapieversuch mit Cop-1 bei SJL/J-Mäusen nach Induktion mit MBP 87-99 -Peptid 4.4.1. 76 Therapieversuch mit Cop-1 bei SJL/J-Mäusen nach Induktion mit PLP 139-151 -Peptid 4.3.4. 76 Therapieversuch mit 1 mg Cop-1 bei BALB/c-Mäusen nach Induktion mit PLP 139-151 -Peptid 4.3.3. 75 Therapieversuch mit 100 µg Cop-1 bei BALB/c-Mäusen nach Induktion mit PLP 139-151 -Peptid 4.3.2. 71 Untersuchungen der Wirkung von Cop-1 auf das Immunsystem von Mäusen des Inzuchtstammes SJL/J 4.3.1. 69 87 Untersuchungen des Immunsystems bei SJL/J-Mäusen nach EAE-Induktion mit MBP-Peptid 90 4.5. Untersuchung der Wirkung von Cop-1 auf humane periphere Blutzellen von MS-Patienten 4.5.1. 92 In vitro Stimulation humaner Leukozyten von MS-Patienten und gesunden Probanden 4.5.1.1. Untersuchung des apoptotischen Zelltods nach in vitro Stimulation mit Cop-1 92 92 4.5.1.2. Untersuchung der Zytokin-Produktion humaner Leukozyten nach in vitro Stimulation mit Cop-1 4.5.2. 93 Untersuchung an humanen peripheren Leukozyten von MS-Patienten unter Cop-1-Therapie 94 4.5.2.1. Untersuchung des apoptotischen Zelltods humaner Leukozyten unter Cop-1-Therapie 94 4.5.2.2. Untersuchung der Zytokin-Produktion humaner Leukozyten unter Cop-1-Therapie 96 4.5.2.3. Untersuchung verschiedener Lymphozytenpopulationen und Aktivierungsmarker unter Cop-1-Therapie 98 4.5.2.4. Vergleich der immunologischen Parameter unter Berücksichtigung des Krankheitsverlaufs 100 V. DISKUSSION 102 1. Untersuchung verschiedener EAE-Modelle 102 2. Versuche mit Lipo-X 104 2.1. Therapieversuche mit Lipo-X 104 2.2. In vitro Versuche mit Lipo-X 105 2.3. Untersuchung der Wirkung von Lipo-X bei naiven Mäusen 106 3. Versuche mit Cop-1 107 3.1. In vitro Versuche mit Cop-1 107 3.2. Untersuchung der Wirkung von Cop-1 bei naiven Mäusen 109 3.3. Therapieversuche mit Cop-1 bei an EAE erkrankten Mäusen 109 3.4. Untersuchung der Wirkung von Cop-1 bei an EAE erkrankten Mäusen 110 3.5. Untersuchung der Wirkung von Cop-1 im Blut von MS-Patienten 112 VI. ZUSAMMENFASSUNG 114 VII. LITERATURVERZEICHNIS 117 SUMMARY 125 DANKSAGUNG LEBENSLAUF A. ABBILDUNGS- UND TABELLENVERZEICHNIS Abb.: Titel 1 Verschiedene Verlaufsformen der Multiplen Sklerose 2 2 Pathomechanismus bei Multipler Sklerose (aus: Giovannoni 1996) 3 3 Gesunde Maus (im Vordergrund) und an EAE erkrankte SJL-Maus (im Hintergrund) 4 Seite 38 Charakteristische Beinhaltung einer an EAE erkrankten Maus (A) und einer gesunden Maus (B) 39 5 HE-Färbung eines Gehirnschnitts einer SJL-Maus im akuten Krankheitsschub 40 6 Darstellung des Krankheitsverlaufs von BALB/c-Mäusen, die nach Injektion von MOG- oder MBP-Peptid an EAE erkrankten 7 Darstellung des Krankheitsverlaufs von BALB/c-Mäusen, die nach Injektion von PLP-Peptid an EAE erkrankten 8 43 Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit PLP 139-151 -Peptid – Tier 7-13 12 43 Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit PLP 139-151 -Peptid – Tier 1-6 11 42 Darstellung des Krankheitsverlaufs von C57BL/6-Mäusen nach Krankheitsinduktion mit PLP 139-151 -Peptid 10 41 Darstellung des Krankheitsverlaufs von BALB/c-Mäusen, die nach Injektion von PLP-Peptid (s.c.) und Pertussis Toxin (i.p.) an EAE erkrankten 9 41 44 Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit MBP-Peptid 45 13 Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit Rückenmarkshomogenat in Emulsion mit CFA (SCH= spinal cord homogenate) 14 45 Darstellung der aus der Summe der täglichen Behinderungsgrade errechneten Gesamtbehinderungsindizes (cumulative disease index – CDI) der einzelnen Versuchstiere. Dargestellt sind die Einzelwerte und der Median 15 Prozentualer Anteil der T-Lymphozyten im Blut, in der Milz und in den Lymphknoten von Mäusen verschiedener Inzuchtstämme 16 49 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/cMäusen ohne Behandlung 19 48 Prozentualer Anteil CD8-positiver Lymphozyten im Blut, in der Milz und in den Lymphknoten von Mäusen verschiedener Inzuchtstämme 18 48 Prozentualer Anteil der T-Helfer-Zellen im Blut, in der Milz und in den Lymphknoten von Mäusen verschiedener Inzuchtstämme 17 46 50 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/cMäusen, die am Tag 0 (= Tag der EAE-Induktion) erstmalig mit Lipo-X behandelt worden waren 20 51 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/cMäusen, die am Tag 5 nach EAE-Induktion erstmalig mit Lipo-X behandelt worden waren 21 51 Darstellung des ‚cumulative disease index’ – CDI der Tiere der drei Versuchsgruppen des Therapieversuchs mit Lipo-X in BALB/c-Mäusen. Einzelwerte und Median 22 Darstellung der Krankheitsverläufe bei an EAE erkrankten Tieren, die mit PBS behandelt worden waren 23 52 53 Darstellung der Krankheitsverläufe bei an EAE erkrankten Tieren, die mit Lipo-X (ab Tag –9) behandelt worden waren 54 24 Darstellung des aus der Summe der täglichen Behinderungsgrade errechneten CDI der Tiere der beiden Versuchsgruppen des Blindversuchs 25 CDI der einzelnen Versuchstiere nach Krankheitsinduktion mit MBP-Peptid und Therapie mit Lipo-X. Einzelwerte und Median. 26 54 55 Messung des 3 H-Thymidin-Einbaus nach Inkubation von LymphknotenZellen (A) und Milz-Zellen (B) mit PLP-Peptid und Lipo-X (Medium 1 = Kontrolle nur Kulturmedium; Medium 2 = Kontrolle mit PLP-Peptid) 27 57 Messung des 3 H-Thymidin-Einbaus nach Inkubation von LymphknotenZellen (A) und Milz-Zellen (B) mit Con A und Lipo-X (Medium 1 = Kontrolle nur Kulturmedium; Medium 2 = Kontrolle mit Con A) 28 Interferon-γ Konzentration im Zellkulturüberstand von murinen peripheren Blutzellen nach Stimulation mit Lipo-X 29 59 TNF-α Konzentration im Zellkulturüberstand von murinen peripheren Blutzellen nach Stimulation mit Lipo-X 30 57 59 Prozentualer Anteil der T-Lymphozyten im Blut, in der Milz und der Peritoneal (PEC)-Zellsuspension am 1., 3. und 5. Tag nach der ersten i.p. Injektion von Lipo-X 31 60 Prozentualer Anteil der B-Lymphozyten im Blut, in der Milz und der Peritoneal-Zellsuspension am 1., 3. und 5. Tag nach der ersten i.p. Injektion von Lipo-X 32 Wirkung der intraperitonealen Injektion von Lipo-X auf die StreuEigenschaften der durch Peritoneal-Spülung gewonnenen Zellpopulationen 33 61 62 Ausstrich der PEC einer unbehandelten, adulten SJL-Maus, Färbung nach Pappenheim. Einige Monozyten sind mit roten Pfeilen gekennzeichnet 63 34 Ausstrich der PEC einer adulten SJL-Maus nach intraperitonealer Injektion von Lipo-X, Färbung nach Pappenheim. Einige Granulozyten sind mit roten Pfeilen gekennzeichnet. 35 64 Prozentualer Anteil der Monozyten im Blut, in der Milz- und in der Peritoneal-Zellsuspension am 1., 3. und 5. Tag nach der ersten i.p. Injektion mit Lipo-X 36 64 Prozentualer Anteil der Granulozyten im Blut, in der Milz- und in der Peritoneal-Zellsuspension am 1., 3. und 5. Tag nach der ersten i.p. Injektion mit Lipo-X 37 65 Prozentualer Anteil Interferon-γ produzierender Lymphozyten im Blut, in der Milz- und in der PEC-Zellsuspension am 1., 3. und 5. Tag nach der ersten i.p. Injektion mit Lipo-X 38 Darstellung der Annexin V bzw. Propidiumjodid markierten Lymphozyten nach 24-stündiger Inkubation mit Cop-1 39 67 TNF-α Konzentration im Zellkulturüberstand von murinen Milzzellen nach Stimulation mit Cop-1 40 65 69 Prozentualer Anteil der B-Lymphozyten in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von BALB/c-Mäusen nach s.c. Injektion von 100 µg Cop-1 41 Prozentualer Anteil der B-Lymphozyten in der Milz von BALB/c-Mäusen nach s.c. Injektion von 100 µg Cop-1 42 70 70 Prozentualer Anteil CD8-positiver Lymphozyten in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von BALB/c-Mäusen nach s.c. Injektion von 100 µg Cop-1 43 71 Prozentualer Anteil der B-Lymphozyten im Blut, in der Milz und in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 1 mg Cop-1 72 44 Prozentualer Anteil der CD8-positiven Lymphozyten im Blut, in der Milz und in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 1 mg Cop-1 45 Prozentualer Anteil IFN-γ- bzw. IL-4-produzierender Lymphozyten in den Milzen von C57BL/6-Mäusen nach s.c. Injektion von 1 mg Cop-1 46 72 73 Prozentualer Anteil CD8-positiver Lymphozyten in den drainierenden, inguinalen Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 100 µg Cop-1 47 74 Gesamtanzahl der Leukozyten in den nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 100 µg Cop-1 48 74 Prozentualer Anteil Th-Zellen in den drainierenden, inguinalen Lymphknoten von SJL/J-Mäusen nach s.c. Injektion von 100 µg Cop-1, Einzelwerte und Median 49 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen ohne Behandlung (Kontrollgruppe) 50 77 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen nach Therapie mit 100 µg Cop-1 an Alu adsorbiert 52 77 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen nach Therapie mit 100 µg Cop-1 in PBS 51 75 77 Darstellung der aus der Summe der täglichen Behinderungsgrade errechneten CDI jedes der Tiere der drei Versuchsgruppen des Vorversuchs mit 100 µg Cop-1. Dargestellt sind die Einzelwerte sowie der Median. 53 78 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen ohne Behandlung (Kontrollgruppe) 79 54 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/cMäusen nach Behandlung mit 1 mg Cop-1/CFA am Tag –9 55 Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/cMäusen nach Behandlung mit 1 mg Cop-1/Alu am Tag –9 56 79 80 Darstellung des aus der Summe der täglichen Behinderungsgrade errechneten CDI jedes Tieres der drei Versuchsgruppen des Therapieversuchs mit 1 mg Cop-1. Dargestellt sind die Einzelwerte sowie der Median. 57 80 Darstellung der Krankheitsverläufe der mit Cop-1/CFA-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid 58 81 Darstellung der Krankheitsverläufe der mit Cop-1/Alu-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid 59 82 Darstellung der Krankheitsverläufe der mit Cop-1/PBS-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid 60 Darstellung der Krankheitsverläufe der unbehandelten Versuchstiere nach Induktion der EAE mit PLP-Peptid 61 83 Darstellung der Krankheitsverläufe der unbehandelten Versuchstiere des Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid 63 83 CDI der Tiere der verschiedenen Therapiegruppen nach Induktion der EAE in SJL/J-Mäusen mit PLP-Peptid 62 82 84 Darstellung der Krankheitsverläufe der mit Cop-1/CFA-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid 84 64 Darstellung der Krankheitsverläufe der mit Cop-1/Alu-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid 65 85 Darstellung der Krankheitsverläufe der mit Cop-1/PBS-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid 66 85 CDI der Tiere der verschiedenen Therapiegruppen nach Induktion einer EAE in SJL/J-Mäusen mit MBP-Peptid. Dargestellt sind die Einzelwerte, der Median sowie die mit dem Mann-Whitney U-Test berechneten p-Werte. Signifikanzen sind mit * gekennzeichnet. 67 CD4/CD8-Ratio im peripheren Blut der an PLP-induzierter EAEerkrankten Tiere 68 86 87 Korrelation zwischen dem prozentualen Anteil an T-Helfer-Zellen im peripheren Blut von an EAE erkrankten Mäusen und dem CDI jedes einzelnen Tieres 69 88 Korrelation zwischen dem prozentualen Anteil CD8-positiver Zellen im peripheren Blut von an EAE erkrankten Mäusen und dem CDI jedes einzelnen Tieres. Dargestellt sind die Einzelwerte pro Versuchstier. 70 Prozentualer Anteil der NK-Zellen im peripheren Blut der an MBPinduzierter EAE erkrankten Tiere. Einzelwerte, Median und Signifikanzen. 71 90 Korrelation zwischen dem prozentualen Anteil NK-Zellen im peripheren Blut von an EAE erkrankten Mäusen und dem CDI jedes einzelnen Tieres 72 89 91 Prozentualer Anteil apoptotischer T-Helfer-Zellen von MS-Patienten und gesunden Probanden nach in vitro Stimulation mit Cop-1. Einzelwerte und Median. 92 73 Im linken der beiden Diagramme ist der prozentuale Anteil IL-10 produzierender Lymphozyten nach 48-stündiger Stimulation mit Cop-1 dargestellt, im rechten Diagramm der prozentuale Anteil IL-10 produzierender T-Helfer-Zellen. Dargestellt sind jeweils die Einzelwerte und der Median. 74 93 Prozentualer Anteil apoptotischer Lymphozyten im peripheren Blut von MS-Patienten vor Beginn der Therapie und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1. Dargestellt sind die Einzelwerte sowie der jeweilige Median. 75 95 Prozentualer Anteil apoptotischer T-Helfer-Zellen im peripheren Blut von MSPatienten vor Beginn der Therapie und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1. Dargestellt sind die Einzelwerte sowie der jeweilige Median. 76 95 Prozentualer Anteil TNF-α-produzierender Lymphozyten aus dem peripheren Blut von MS-Patienten vor Therapiebeginn und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Copaxone® 77 96 Prozentualer Anteil IL-4 produzierender Lymphozyten aus dem peripheren Blut von MS-Patienten vor Therapiebeginn und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1 78 97 Prozentualer Anteil aktivierter T-Lymphozyten aus dem peripheren Blut von MS-Patienten vor Beginn der Therapie und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1 99 Tabelle Nr. Titel 1 Verwendete Antikörper/-Konjugate 2 Schema für die Versuchsansätze für die durchflusszytometrische Seite 16 Charakterisierung peripherer Blutzellen von MS-Patienten und gesunden Probanden nach intrazellulärer Zytokin-Färbung 24 3 Schema intrazelluläre Zytokinfärbung bei Mäuselymphozyten 4 Schema für die Versuchsansätze für die durchflusszytometrische 24 Charakterisierung peripherer Blutzellen sowie Milz- und Lymphknotenzellen von Mäusen 5 Schema für die Versuchsansätze für die durchflusszytometrische Charakterisierung peripherer Blutzellen von MS-Patienten 6 25 Skala zur Bewertung von Krankheitssymptomen bei an EAE erkrankten Mäusen 7 25 31 Ein- und Ausschlusskriterien der offenen Phase III Therapie -Studie mit Copaxone® 34 8 Daten der Probanden des in vitro-Stimulationsversuchs mit Cop-1 35 9 Daten der mit Copaxone® behandelten Patienten 36 10 Zusammenfassung der ‚Expanded Disability Status Scale’ (EDSS) zur Bewertung der klinischen Symptome bei MS-Patienten nach Kurtzke. 11 12 36 Die bei Mäusen des Inzuchtstammes BALB/c eingesetzten Peptide bzw. Proteine 40 MHC-Haplotyp der verwendeten Mäusestämme 47 B. ABKÜRZUNGSVERZEICHNIS AICD Activation-induced cell death AK Antikörper APL altered peptide ligand CD cluster of differentiation CDI cumulative disease index COP-1 Copolymer-1 EAE experimentelle autoimmune Enzephalomyelitis EDSS expanded disability status scale ELISA enzyme-linked immunosorbent assay FACScan® fluorescence activated cell analyser FITC Fluoreszeinisothiozyanat FSC forward light scatter HE Hämalaun-Eosin HLA human leucocyte antigen Ig Immunglobulin IFN Interferon IL Interleukin i.p. intraperitoneal MBP basisches Myelinprotein MHC Haupthistokompatibilitätskomplex MS Multiple Sklerose min Minute MOG Myelin Oligodendrozyten Glykoprotein PEC peritoneal exudate cells PBL periphere Blutlymphozyten PBMC peripheral blood mononuclear cells PBS phosphate buffered saline PE Phykoerythrin PE-Cy5 Phykoerythrin Zyanin-5 PI Propidiumjodid PLP Proteolipidprotein PT Pertussis Toxin RPMI Rockwell Park Memorial Institute Medium s.c. subkutan SSC sideward light scatter TCR T-Zell-Rezeptor TGF Transforming Growth Factor TNF Tumor Nekrose Faktor TUNEL TdT-mediated dUTP nick end labeling I. Einleitung I. Einleitung 1. Allgemein Der Begriff ‚Enzephalomyelitis’ beschreibt Entzündungen des zentralen Nervensystems unter besonderer Beteiligung der die Nervenbahnen umhüllenden Myelinscheide. Die wohl bekannteste Form der humanen Enzephalomyelitis ist die ‚Enzephalomyelitis disseminata’ (E.d.), besser bekannt unter dem Namen ‚Multiple Sklerose’. Die Multiple Sklerose (MS) ist eine chronische, inflammatorische, demyelinisierende Erkrankung des zentralen Nervensystems (ZNS) mit bis heute unbekannter Ätiologie. Im Rahmen der chronischen Entzündung im Bereich des ZNS kommt es zu Autoimmunreaktionen gegen Bestandteile der die Axone umhüllenden Myelinscheide sowie gegen verschiedene andere Proteine des ZNS. Die Begriffe ‚Enzephalomyelitis disseminata’ und ‚Multiple Sklerose’ beschreiben bereits zwei wichtige Merkmale der Erkrankung. Zum einen die Entzündungs(= Enzephalomyelitis) und Entmarkungsherde (= Sklerose) im zentralen Nervensystem, zum anderen das zeitlich und/oder räumlich wiederholte Auftreten dieser Entzündungsplaques (= disseminata bzw. multiple). Die Multiple Sklerose ist mit einer Prävalenz von 50 bis 200 Erkrankungen pro 100.000 Einwohnern die häufigste neurologische Erkrankung junger Erwachsener in Europa und damit von besonderer sozialer wie ökonomischer Bedeutung. Die Erstmanifestation der Erkrankung liegt meist um das 30. Lebensjahr herum, es sind aber auch Formen der kindlichen MS bekannt. Frauen erkranken deutlich häufiger an MS als Männer (~ im Verhältnis 2:1). Epidemiologische und genetische Studien haben bewiesen, dass eine genetische Prädisposition die Wahrscheinlichkeit, an Multipler Sklerose zu erkranken, deutlich erhöht (Olerup 1991, Epplen 1997, Kurtzke 2000). Neben der genetischen Komponente, die vor allem den HLA-Typ und verschiedene immunrelevante sowie Myelin-assoziierte Gene betrifft, scheinen aber auch Umweltfaktoren, wie virale oder bakterielle Vorerkrankungen, Ernährungsgewohnheiten und psychosozialer Stress, zumindest bei der Auslösung der Erkrankung, eine Rolle zu spielen. Vor allem der Zusammenhang zwischen MS und viralen bzw. bakteriellen Erregern (z.B. über molekulare Mimikry) wurde und wird intensiv untersucht (Gran 1999, Regner 2001). Ein direkter Zusammenhang konnte aber bis heute nicht festgestellt werden. Die MS ist eine Erkrankung mit äußerst heterogenem Verlauf, der nicht prognostisch differenziert werden kann. In Abbildung 1 sind die häufigsten Verlaufsformen der Multiplen Sklerose dargestellt. Es kommen jedoch auch alle Mischformen vor. Ähnlich heterogen und bis heute nicht prognostizierbar ist die Lebenserwartung der MS-Patienten. Diese reicht von ‚normaler’ Lebenserwartung bei benignen Formen bis zum Tod durch MS nach nur wenigen Jahren (2-10) nach Erstmanifestation der Erkrankung. Häufige Frühsymptome der Erkrankung sind Sensibilitätsstörungen in den oberen und unteren Extremitäten, Gleichgewichtsstörungen, Optikusneuritis und Doppelbilder. Im weiteren Verlauf der Erkrankung findet man bei vielen Patienten fortschreitende Lähmungen der unteren, später auch der oberen Extremitäten, Blasen- und Darmstörungen, Visus- und Augenmotalitätsstörungen, Erschöpfungszustände (Fatigue) und Spastiken. 1 schubförmiger, vollständig remittierender Verlauf neurologische Defizite neurologische Defizite I. Einleitung schubförmiger, unvollständig remittierender Verlauf primär chronisch progredienter Verlauf Zeit neurologische Defizite neurologische Defizite Zeit sekundär chronisch progredienter Verlauf chronisch progredienter Verlauf mit Schüben Zeit neurologische Defizite neurologische Defizite Zeit chronisch progredienter Verlauf mit Schüben & Plateau Zeit Zeit Abb. 1: Verschiedene Verlaufsformen der Multiplen Sklerose In Abbildung 2 sind die derzeit favorisierten Pathomechanismen für die Entstehung der Multiplen Sklerose dargestellt. Myelin- oder Glia-spezifische T-Zellen werden aufgrund bisher ungeklärter Vorgänge in der Peripherie aktiviert und migrieren mit Hilfe von Adhäsionsmolekülen durch die BlutHirn-Schranke ins ZNS (Prat 2002). Hier werden die autoreaktiven T-Zellen durch Antigenkontakt reaktiviert, und es kommt zur Produktion und Ausschüttung zahlreicher Zytokine. Diese ZytokinAusschüttung setzt eine ganze Kaskade von Reaktionen in Gang (Abb.2). Zum einen kommt es durch die Ausschüttung von sogenannten proinflammatorischen Th1-typischen Zytokinen zur Aktivierung von Effektorzellen. Diese Zellen, vor allem Makrophagen oder Mikroglia, sind in der Lage direkt die die Nervenfasern umhüllende Myelinscheide zu zerstören. Ferner kommt es zur lokalen Sezernierung toxischer Zytokine (TNF-α, -β), die auch direkt toxisch auf Oligodendrozyten wirken, die dann nicht mehr in der Lage sind, die Myelinhülle neu zu bilden (Woodroofe 1995, Selmaj 1991). Zum anderen führt die Sezernierung von sogenannten antiinflammatorischen Th2-typischen Zytokinen, wie IL-4 und IL-5, zur Aktivierung von B-Zellen, die wiederum Myelin-spezifische Antikörper produzieren. Diese Antikörper bewirken über Komplementaktivierungs- und Opsonierungsprozesse die weitere 2 I. Einleitung Zerstörung der Myelinscheide (Archelos 2000). Die im ZNS aufgrund der beschriebenen Entzündungsreaktionen produzierten Zytokine bewirken wiederum die Aktivierung der Endothelzellen der Blut-Hirn-Schranke, was zur vermehrten Expression von Adhäsionsmolekülen auf der Oberfläche der Endothelzellen führt. Dies wiederum erleichtert die Migration aktivierter T-Zellen aus der Peripherie ins ZNS. Seabrook konnte 1998 zeigen, dass die in der Zerebrospinal-Flüssigkeit (Liquor cerebrospinalis; CSF) befindlichen Lymphozyten tatsächlich Teil des normalen, rezirkulierenden Lymphozyten-Pools sind (Seabrook 1998). Abb. 2: Pathomechanismus bei Multipler Sklerose (aus: Giovannoni 1996) 3 I. Einleitung Im weiteren Verlauf der Erkrankung kommt es durch die fortschreitende Zerstörung der Myelinscheide und die Aufnahme der Myelinfragmente u.a. durch Makrophagen zum sogenannten ‚Epitope spreading’ (McRae 1995, Vanderlugt 2000). ‚Epitope spreading’ bedeutet, dass im Laufe der Entzündungsreaktion zu den ursprünglich wenigen Ziel-Antigenen immer neue hinzukommen. Ein häufig verwendetes Tiermodell für die MS ist die experimentelle ‚autoimmune’ oder ‚allergische’ Enzephalomyelitis (EAE), die durch die Injektion von ZNS-Antigenen in Tiere verschiedener Spezies ausgelöst werden kann. Bereits 1933 hat Thomas Rivers in Affen mit bis zu 85 Injektionen eines Extraktes aus Kaninchenhirn eine entzündliche Erkrankung im Gehirn der Versuchstiere ausgelöst. Dies war die Geburtsstunde der experimentell allergischen Enzephalomyelitis (Rivers 1933). 1947 wurde erstmals eine EAE mit nur einer einzigen Injektion von Gehirngewebe in Freund’schem Adjuvans ausgelöst. In den 80er Jahren setzte sich dann aufgrund des hinzugewonnenen Wissens um zelluläre Immunologie der Begriff der ‚autoimmunen’ statt der ‚allergischen’ Enzephalomyelitis durch. In letzter Zeit wird allerdings wieder diskutiert, ob bei einigen EAE-Modellen nicht doch Antikörper-vermittelte Prozesse eine entscheidende Bedeutung haben (Weiner 2001). Am häufigsten wird die EAE in Nagern, vor allem in Mäusen und Ratten, aber auch in Meerschweinchen sowie in nicht-humanen Primaten (Marmoset-Äffchen Callithrix jacchus) untersucht (Wekerle 1994, Genain 2001, McFarland 2001). Abhängig von der Spezies und dem zur Krankheitsinduktion eingesetzten Antigen lassen sich unterschiedliche Krankheitsverläufe in den Versuchstieren erzeugen. Zu den zur Induktion der EAE eingesetzten Autoantigenen gehören das Myelin basische Protein (MBP), das Myelin Oligodendrozyten Glykoprotein (MOG), das Proteolipid Protein (PLP), Myelinassoziiertes Glykoprotein (MAG), Myelin-assoziiertes Oligodendrozyten basisches Protein (MOBP) sowie S-100 (Wekerle 1994, Holz 2000). Die verschiedenen EAE-Modelle unterscheiden sich sowohl bezüglich ihres symptomatischen Verlaufs als auch immunpathologisch. Die Heterogenität der EAEModelle spiegelt recht gut die ebenfalls sehr heterogenen Krankheitsverläufe bei der Multiplen Sklerose wieder (siehe Abb.1). Es gibt jedoch kein einzelnes EAE-Modell, das wirklich der MS entspricht. In Zell-Transfer-Versuchen konnte durch Transfer von T-Lymphozyten, die gegen die oben genannten Autoantigene gerichtet waren, EAE in gesunden Versuchstieren ausgelöst werden (Friedman 1992). Weitergehende Untersuchungen haben gezeigt, dass die Injektion von Zellen autoreaktiver T-HelferZell-Klone, die spezifisch für die oben genannten Antigene sind und die T-Helfer 1 (Th1) typische Zytokine sezernieren, im Versuchstier eine EAE auslöste, wohingegen die Injektion von Zellen eines autoreaktiven Th-Zell-Klons derselben Spezifität, die Th2 typische Zytokine sezernieren, nicht zur Auslösung der EAE führte (Ando 1989, Martin 1995). Durch vorausgehende Immunisierung mit Zellen eines dieser Th2-Zell-Klone konnte die anschließende Auslösung einer EAE durch Injektion von Zellen eines T-Zell-Klons derselben Spezifität, aber des Th1-Typs, verhindert werden (Martin 1995). 4 I. Einleitung Dies deutet darauf hin, dass proinflammatorische Zytokine vom Th1-Typ, dazu gehören Interferon γ (IFNγ), Interleukin-2 (IL-2) und Tumor Nekrose Faktor α (TNFα), sowie antiinflammatorische Zytokine vom Th2-Typ (IL-4, IL-5, IL-10, Transforming Growth Factor β) eine wichtige Rolle in der Pathogenese und im Verlauf einer EAE und damit wahrscheinlich auch bei der MS spielen. In diesem Zusammenhang wird die vermehrte Produktion von Zytokinen des Th1-Typs eher als ungünstig für den Krankheitsverlauf angesehen, die von Zytokinen des Th2-Typs eher als günstig. Eine eindeutige Einteilung in ‚gute’ (Th2-) und ‚schlechte’ (Th1-typische Zytokine) ist aber sicherlich nicht möglich (Martin 1998). Zytokine wirken sowohl autokrin als auch parakrin, d.h. Th1-typische Zytokine stimulieren einerseits die Produktion von weiteren Th1-Zytokinen und hemmen andererseits die Produktion von Th2typischen Zytokinen. Diese reziproken Regulationsmechanismen gibt es ebenfalls bei Th2-typischen Zytokinen (Maggi 1992). Auf diese Art und Weise verändern Zytokine über die direkte Wirkung auf einzelne Zellen hinaus das Mikromilieu der Zellen und beeinflussen so auch indirekt die Immunantwort (O’Garra 1998). In verschiedenen Studien wurden Zytokine bezüglich ihrer Eignung als Marker von Krankheitsaktivität und zur Prognose von Krankheitsschüben bei der MS untersucht (Maimone 1991, Rieckmann 1995). Zytokine des Th1-Typs fördern vor allem die T-zelluläre Immunantwort, wohingegen Zytokine des Th2-Typs verstärkt die B-zelluläre und damit humorale Immunantwort stimulieren. Es konnte gezeigt werden, dass die Konzentration von proinflammatorischen Zytokinen im Blut vor Beginn bzw. während eines Krankheitsschubes und die Konzentration von antiinflammatorischen Zytokinen im Blut im bzw. nach einem Schub erhöht ist (Chofflon 1992, Correale 1995). Ähnliche Befunde ergaben sich jedoch auch im Rahmen von Infekten, so dass die Untersuchung von Zytokinen zwar möglicherweise zur Therapiekontrolle geeignet ist, aber für prognostische Aussagen zu unspezifisch zu sein scheint. Die während eines akuten Schubes bei der MS bzw. der EAE ablaufende Entzündungsreaktion wird durch verschiedene Mechanismen reguliert. Einer der in diesem Zusammenhang diskutierten Prozesse ist der apoptotische Zelltod von an der Entzündungsreaktion beteiligten Leukozyten (Tan 1994). Verschiedene Untersuchungen haben gezeigt, dass autoreaktive T-Lymphozyten im ZNS nach Abflauen des Entzündungsprozesses eines apoptotischen Zelltodes sterben. 30-50 Prozent der TZellen in einer Läsion von an EAE erkrankten Tieren sind in der Phase der Remission apoptotisch (Bauer 1999). Michael Pender postulierte 1998, dass die MS die Folge des genetisch bedingten Fehlens des ‚activation-induced cell death’ (AICD) bei autoreaktiven T-Zellen ist (Pender 1998). Viele Jahre lang galt die immunsuppressive Therapie der MS mit Substanzen wie Azathioprin, Cyclosporin-A oder Cyclophosphamid als wichtigste Behandlungsstrategie. Auch die LangzeitTherapie mit Kortikosteroiden war üblich. Heute werden Kortikosteroide in erster Linie zur Behandlung des akuten Krankheitsschubes kurzfristig in hohen Dosierungen eingesetzt. In den letzten Jahren hat sich immer mehr die Erkenntnis durchgesetzt, dass eine Therapie mit immunmodulierenden 5 I. Einleitung Substanzen, wie Interferon-β, Cop-1 oder intravenösen Immunglobulinen vielversprechendere Resultate zeigt. Die genauen Wirkungen dieser Substanzen scheinen jedoch sehr komplex zu sein und sind bis heute nur unzureichend bekannt. Mit den derzeit zur Therapie der MS zur Verfügung stehenden Substanzen kann die MS nicht geheilt werden. Sie bieten dennoch die Möglichkeit, die Krankheitsverläufe bei vielen Patienten abzuschwächen und sie damit deutlich länger in einer Phase mit hoher Lebensqualität zu halten (Martin 2001). Lipo-X Bei dem in dieser Arbeit verwendeten Lipo-X handelt es sich um ein Liponsäurederivat, dessen genaue Struktur aus patentrechtlichen Gründen hier nicht genannt werden darf. Liponsäure wurde 1953 von Reed und Gunsalus erstmalig in kristalliner Form aus Leberextrakten gewonnen. Sie besteht aus acht Kohlenstoff-Atomen und wirkt als eines der Koenzyme bei der oxidativen Dekarboxylierung von Pyruvat und anderen α-Ketosäuren im Zitronensäurezyklus. α-Liponsäure, ein Lipoamid, ist ein wesentlicher Bestandteil biologischer Membranen und ein wichtiger Kofaktor der mitochondrialen Dehydrogenase. In Säugetierzellen wird α-Liponsäure leicht in die reduzierte Form, die Dihydroliponsäure, konvertiert. Beide, α- und Dihydroliponsäure, haben in vitro und in vivo antioxidative Wirkung (Sen 1996). Ein wichtiger Effekt der Liponsäurederivate ist der Anstieg der intrazellulären Konzentration von Glutathion (Busse 1992). Ferner werden freie Sauerstoffradikale, die an der Pathogenese zahlreicher Erkrankungen beteiligt sind, von Liponsäurederivaten neutralisiert. Seid einigen Jahren wird die Wirkung von Liponsäurederivaten auf verschiedene Komponenten des Immunsystems genauer untersucht. Über die Redox-Regulation des Transkriptionsfaktors Nuclear Factor-kappa B (NF-κB) wirkt α-Liponsäure auf die Signaltransduktion und Expression immunrelevanter Gene (Suzuki 1995). Die orale Gabe von Liponsäure führt in immunsuppremierten Mäusen zur Wiederherstellung sowohl der Antikörper-vermittelten Immunantwort als auch der THelfer Zell-Aktivität (Ohmori 1986). α-Liponsäure wird seid einigen Jahren erfolgreich in der Therapie von Patienten eingesetzt, die an diabetischer peripherer Neuropathie erkrankt sind (Ziegler 1997, Biewenga 1997). Weiterhin scheint die Therapie mit α-Liponsäure bzw. Liponsäurederivaten bei verschiedenen Erkrankungen, bei denen oxidative Schädigungen eine entscheidende Rolle spielen, recht effektiv zu wirken. Hierzu gehören neben Diabetes auch neurodegenerative Erkrankungen und HIV-Infektionen (Packer 1997, Baur 1991). Auch bei der Multiplen Sklerose und der experimentellen autoimmunen Enzephalomyelitis spielen Sauerstoffradikale eine wichtige Rolle (siehe Abbildung 2). Sie sind sowohl direkt an der Zerstörung der Myelinscheide beteiligt als auch indirekt an der Aktivierung von Makrophagen, die dann wiederum an der Zerstörung der Myelinscheide mitwirken können (Van der Goes 1998). Auch die Wirkung der Blut-Hirn-Schranke wird durch Sauerstoffradikale beeinträchtigt und damit durchlässiger 6 I. Einleitung für die Passage von aktivierten T-Lymphozyten (Rubanyi 1988). Erste in vitro-Untersuchungen haben gezeigt, dass diese Wirkung von Sauerstoffradikalen auf Myelinbestandteile und die Aktivität von Makrophagen durch die Gabe von Liponsäurederivaten inhibiert werden kann (Van der Goes 1998). Außerdem wird die Konzentration von intrazellulärem Glutathion, einem der wichtigsten Antioxidantien im menschlichen Gehirn, von Liponsäurederivaten beeinflusst und deren Wirkung verstärkt (Busse 1992). Die supprimierende Wirkung von Liponsäure auf NF-κB und damit indirekt auf die durch NF-κB kontrollierten Gene lässt ebenfalls eine Therapie mit Liponsäurederivaten bei an EAE erkrankten Tieren sinnvoll erscheinen. Nach Krankheitsinduktion mit MOG wurde in NF-κBdefizienten Mäusen ein signifikant leichterer Verlauf der EAE und eine geringere Entzündungsaktivität im ZNS beobachtet als bei den entsprechenden Wildtyp-Mäusen (Hilliard 1999). Copolymer-1 Die Geschichte von Copolymer-1 (Cop-1) begann im Jahre 1968 am Weizmann-Institut of Science (Rehovot, Israel) (Teitelbaum 1971). Ruth Arnon, Dvora Teitelbaum und Michael Sela versuchten mit Hilfe verschiedener synthetischer Copolymere, die in ihrer Aminosäuresequenz dem MBP ähnelten, eine EAE in Versuchstieren auszulösen. Allerdings war keines der eingesetzten Copolymere dazu in der Lage, aber einige und dazu gehörte auch das Copolymer Nr.1, vermochten überraschenderweise die Induktion einer EAE in den Versuchstieren nach Injektion von MBP zu inhibieren. 27 Jahre später (1995) wurde Cop-1 unter dem Namen Copaxone® in den USA als Therapeutikum der schubförmig verlaufenden MS zugelassen. Seit dem Jahr 2001 ist Copaxone® endlich auch in Deutschland zur Behandlung der MS freigegeben. Copolymer-1 (Cop-1), auch unterm dem Namen Glatiramerazetat bekannt, ist ein Gemisch aus Polypeptiden, die aus 4 natürlich vorkommenden L-Aminosäuren in zufälliger Abfolge synthetisiert werden. Zur Synthese werden folgende Aminosäuren in dem prozentualen Verhältnis eingesetzt, in dem sie im MBP vorliegen: L-Glutamin 14,1 %, L-Tyrosin 9,5 %, L-Alanin 42,7 % und L-Lysin 33,8 %. Cop-1 besteht also aus einem Gemisch hochpolarer, hydrophiler Moleküle mit einem mittleren Molekulargewicht zwischen 4.700 und 13.000 Dalton. Zur Injektion wird Cop-1 als steriles, lyophilisiertes Pulver angeboten, das pro 20 mg Ampulle zusätzlich 40 mg Mannitol enthält. Zum Gebrauch wird es in 1 ml Aqua ad injectabile aufgelöst und täglich einmal subkutan injiziert. Verschiedene klinische Studien mit Cop-1 als Therapeutikum bei schubförmiger MS haben eine positive Wirkung von Cop-1 auf die Schubhäufigkeit und Krankheitsprogredienz gezeigt (Johnson 1995 und 1998). Diese Verbesserungen sind bei Patienten mit geringer Behinderung besonders deutlich. MS-Patienten mit chronisch-progredientem Krankheitsverlauf profitieren nicht in diesem Maße von einer Cop-1 Therapie (Pöhlau 1996). Generell wird Copaxone® eine sehr gute Verträglichkeit bescheinigt (Korczyn 1996). Die häufigsten unerwünschten Arzneimittelreaktionen sind vorübergehende Hautreaktionen an der Injektionsstelle wie Rötung, Schwellung, Juckreiz, Verhärtung und leichte Schmerzen. Gelegentlich kommt es, 7 I. Einleitung vermutlich durch versehentliche intravenöse Injektion in kleine Hautvenen, zu systemischen Postinjektionsreaktionen wie Flush, Dyspnoe und Engegefühl in der Brust. Die Mechanismen, über die Cop-1 wirkt, sind nur zum Teil bekannt. Im Tierversuch zeigte sich, dass Cop-1 als MBP-Analogon keine enzephalitogene Wirkung besitzt, mit Cop-1 also keine EAE im Versuchstier ausgelöst werden kann (Teitelbaum 1997). Bei mit Cop-1 vorbehandelten Tieren (Mäuse, Ratten, bis zu Primaten) führte die Injektion von MBP oder anderen enzephalitogenen Substanzen nicht mehr zur Auslösung einer EAE (Teitelbaum 1997). Diese Resistenz konnte durch den Transfer von T-Zellen aus den Lymphknoten der mit Cop-1 behandelten Mäuse auf naive Mäuse übertragen werden, was auf die Übertragung suppressorisch wirkender T-Zellen schließen lässt (Teitelbaum 1997). Auch die orale Gabe von Cop-1 führt bei Versuchstieren zu erhöhter Resistenz gegen die Induktion einer EAE (Weiner 1999, Teitelbaum 1999). Diese Ergebnisse werden derzeit in Studien mit MSPatienten überprüft. Studien haben gezeigt, dass Cop-1-Moleküle mit MBP (einem der möglichen Autoantigene bei der MS) um die Bindung an das MHC II-Molekül konkurrieren, wobei Cop-1 offenbar MBP viel leichter aus der MHC-Bindung verdrängt als umgekehrt (Teitelbaum 1992, Racke 1992). Eine der Antigenpräsentation vorausgehende Phagozytose und Prozessierung durch Antigen präsentierende Zellen ist, wie eine Untersuchung gezeigt hat, weder bei Cop-1 noch bei MBP notwendig (FridkisHareli 1994). Verschiedene Untersuchungen haben gezeigt, dass monoklonale Antikörper gegen MBP auch mit Cop-1 kreuzreagieren (Teitelbaum 1991) und dass Cop-1 spezifische T-Zellen des Th2-Typs mit MBP kreuzreagieren und eine EAE supprimieren können (Aharoni 1997). Man nimmt an, dass Cop-1 im Komplex mit MHC von MBP-spezifischen autoreaktiven T-Zellen erkannt wird (FridkisHareli 1994). Aufgrund der vergleichsweise geringen Größe der Cop-1-Moleküle scheint diese Bindung jedoch keine Aktivierung, sondern möglicherweise einen Zellzyklus-Arrest oder die Apoptose dieser autoreaktiven T-Zellen zu bewirken. Weitere tierexperimentelle Untersuchungen haben gezeigt, dass die Immunisierung mit Cop-1 durch die verstärkte Produktion von Zytokinen des Th2-Typs immunmodulierend wirkt. Diese sind in der Lage Entzündungsreaktionen abzuschwächen bzw. zu beenden. Im Tiermodell bewirkt Cop-1 damit ähnliche Veränderungen wie sogenannte ‚altered peptid ligands’ (APL). Dies sind Peptide von Autoantigenen (z.B. PLP-Peptid), die aufgrund des Austausches einer einzigen Aminosäure keine enzephalitogene Wirkung mehr haben und die nicht mehr die Produktion von Th1-typischen Zytokinen stimulieren, sondern die Produktion Th2-typischer Zytokine anregen und im Tiermodell die Auslösung eine EAE verhindern können. Der sogenannte Th2-Shift bewirkt gleichzeitig eine Stimulation der Antikörperproduktion im Versuchstier. Die Tatsache, dass 100 % aller mit Cop-1 behandelten Patienten im Laufe der Behandlung Antikörper gegen Cop-1 produzieren, scheint sich nicht negativ, möglicherweise sogar positiv auf den Krankheitsverlauf auszuwirken. Eine im Verlauf der Behandlung verstärkte Produktion von anti-Cop-1-Antikörpern kann Folge des ‘Th2-Shifts’ sein, der u. a. zu einer Steigerung der 8 I. Einleitung humoralen Immunantwort führt. Die erhöhte Konzentration von spezifischen gegen Cop-1 gerichteten Antikörpern kann somit Zeichen einer Immunmodulation infolge der Cop-1 Therapie sein (Brenner 2001). Auf diese Weise ist die verstärkte Produktion von gegen Cop-1 gerichteten Antikörpern als möglicher Indikator für ein Ansprechen der Therapie mit Cop-1 zu sehen. Es ist allerdings auch vorstellbar, dass gegen Cop-1 gerichtete Antikörper einen direkten Einfluss auf die Wirksamkeit von Cop-1 haben. So könnte durch die Bindung von Cop-1 an spezifische Antikörper zu AntigenAntikörper-Komplexen der natürliche Abbau von Cop-1 vermindert werden. Die Cop-1-AntikörperKomplexe würden somit eine Art Depot darstellen. 9 I. Einleitung 2. Zielsetzung Ziel der vorliegenden Arbeit ist es, die bis heute nur unzureichende Therapie von Patienten mit Multipler Sklerose zu verbessern. Hierzu sollten in tierexperimentellen Versuchen die Wirkung von zwei verschiedene Therapieformen auf das Immunsystem untersucht werden. Als Grundlage für weitere Untersuchungen sollte in der vorliegenden Arbeit daher zunächst versucht werden, mit Hilfe verschiedener Agenzien experimentelle autoimmune Enzephalomyelitis in Mäusen zu induzieren. Da aus der Literatur bekannt ist, dass der Krankheitsverlauf bei den verschiedenen EAE-Modellen, abhängig vom eingesetzten Mäusestamm und der zur Krankheitsinduktion verwandten Substanz, sehr unterschiedlich sein kann, erschien es sinnvoll, mehrere Modelle zu etablieren. Mit Hilfe solcher EAEModelle sollte es dann möglich sein, die Wirkmechanismen verschie dener, bei Patienten angewandter Therapieformen zu untersuchen. Bei Lipo-X handelt es sich um ein Liponsäurederivat, dessen Wirkung auf die EAE bzw. MS bisher noch nicht untersucht wurde. Die Ergebnisse einiger Untersuchungen deuten daraufhin, dass Liponsäurederivate möglicherweise zur Behandlung der Multiplen Sklerose und der experimentellen autoimmunen Enzephalomyelitis geeignet sein könnten. Ein Ziel der vorliegenden Arbeit war es daher, zunächst die Wirksamkeit von Lipo-X bei der Behandlung von an EAE erkrankten Mäusen zu untersuchen. Nach Möglichkeit sollten diese Versuche mit unterschiedlichen EAE-Modellen durchgeführt werden. Falls die Therapieversuche mit Lipo-X eine Verbesserung des Krankheitsverlaufs oder eine schlechtere Induzierbarkeit der Erkrankung in Mäusen ergeben, sollte in weiteren Versuchen die Wirkungsweise von Lipo-X genauer untersucht werden. Sowohl mit Hilfe von in vitro- als auch in vivo-Untersuchungen sollte die Wirkung von Lipo-X auf zelluläre wie auf humorale Komponenten des Immunsystems analysiert werden. Hierbei sollte das Hauptaugenmerk auf mögliche Veränderungen der an der Immunantwort beteiligten Zellpopulationen sowie auf eine mögliche Beeinflussung des Zytokin-Netzwerks gelegt werden. Die klinische Wirksamkeit von Cop-1 bei der Behandlung der MS ist bewiesen. Jedoch führt die Therapie mit Copaxone® nicht bei jedem individuellen Patienten zu einer Besserung der Krankheitssymptomatik. Um eine Subtypisierung der Patienten, bezogen auf das Ansprechen auf die Therapie mit Copaxone®, zu ermöglichen, müssten die während der Behandlung mit Cop-1 ablaufenden Vorgänge besser bekannt sein. Im Rahmen der im folgenden näher beschriebenen Versuche sollten die bis heute nur unzulänglich verstandenen Wirkmechanismen von Cop-1 untersucht werden und mit Hilfe einer neuen Applikationstechnik versucht werden, Ansätze zur Therapieverbesserung zu schaffen. Neben in vitro-Untersuchungen sollte zur Aufklärung der Wirkung von Cop-1 auf das Immunsystem auch begleitende Untersuchungen von peripheren Blutzellen während der Therapie mit Cop-1 bei an EAE erkrankten Mäusen sowie MS-Patienten durchgeführt werden. Von speziellem Interesse ist die Wirkung von Cop-1 auf das Zytokin-Netzwerk. In diesem 10 I. Einleitung Zusammenhang sollte die Wirkung der Behandlung mit Cop-1 auf die Produktion der verschiedenen proinflammatorisch (z.B. INF-γ, IL-2, TNF-α) bzw. antiinflammatorisch wirkenden Zytokine (z.B. IL-4, IL-10) untersucht werden. Die Produktion von Antikörpern wird in starkem Maße von Zytokinen beeinflusst; vor allem die Zytokine des Th2-Typs stimulieren Plasmazellen zur verstärkten Antikörper-Sezernierung. Da die Entstehung von Cop-1-spezifischen Antikörpern nach heutigem Wissensstand keine negativen, möglicherweise sogar positive Auswirkungen auf den Krankheitsverlauf hat, könnte die Produktion von gegen Cop-1 gerichteten Antikörpern evtl. in Abhängigkeit von der Klassen- bzw. SubklassenZugehörigkeit eine wichtige Funktion im Rahmen der immunologischen Wirkung von Cop-1 haben. Ein Ziel der vorliegenden Arbeit ist es daher, die Entstehung von gegen Cop-1 gerichteten Antikörpern während der Behandlung mit Cop-1 zu verfolgen und, wenn möglich, mit der Wirksamkeit der Therapie zu korrelieren. Für die Bestimmung der gegen Cop-1 gerichteten Antikörper muss ein ELISA-Testsystem entwickelt werden. Nach den derzeit gültigen Vorstellungen zur Wirksamkeit von Cop-1 wird in autoreaktiven T-Zellen, die spezifisch mit enzephalitogenen Substanzen wie MBP reagieren, durch die Bindung von Cop-1 im Komplex mit MHC möglicherweise der Prozess eines ‚activation-induced cell death’ (AICD) ausgelöst, und der apoptotische Zelltod eingeleitet. Ein weiteres Ziel dieser Arbeit ist daher die Aufklärung der Frage, ob es infolge der Therapie bzw. der Stimulation mit Cop-1 zu verstärktem apoptotischen Zelltod bei Lymphozyten kommt. Von der Annahme ausgehend, dass in diesem Zusammenhang die Apoptose in Lymphozyten über den Prozess des AICD ausgelöst wird, erscheint es interessant, die Aktivierung von Lymphozyten vor und während der Cop-1-Therapie zu untersuchen. Zusammengefasst sind die wesentlichen Ziele der vorliegenden Arbeit zum einen die Etablierung von für weitere Untersuchungen geeigneten Tiermodellen für entzündliche ZNS-Erkrankungen (Enzephalomyelitiden), zum anderen die Untersuchung der Wirkungsweise eines bereits bekannten Therapeutikums sowie der Versuch ein neue Substanz zur Behandlung von Enzephalomyelitiden auf seine Wirksamkeit zu überprüfen. 11 II. Material und Methoden II. Material und Methoden 1. Material 1.1. Geräte Minifuge RF Heraeus Sterilbank Laminair Typ HB 2460 Heraeus Zeiss Mikroskop Standard Carl Zeiss, Oberkochen Neubauer Zählkammer Brand CO2 -Begasungsbrutschrank B 5060 EK CO2 Heraeus FACScan Becton Dickinson ELISA-Reader Millenia Kinetic Analyzer Molecular Devices ELISA-Photometer EAR 400 AT SLT Zentrifuge 5402, F45-18-11 Eppendorf Kryostat HM 560 Microm Fluoreszenzmikroskop Eclipse E600 Nikon Digitalkamera DXM 1200 Nikon Wallac Microbeta beta-counter Wallac 1.2. Häufig verwendete Puffer 1.2.1. Hepes-Puffer Lösung: - HEPES (10 mM) Sigma-Aldrich - NaCl (150 mM) Merck - CaCl2 (2,4 mM) Merck - KCl (5 mM) Merck - MgCl2 (1mM) Merck 1.2.2. Phosphate buffered saline (PBS): Eine 20fach konzentrierte Stammlösung wird wie folgt hergestellt: 3 M NaCl 0,04 M KH2 PO4 0,2 M Na2 HPO4 x 2 H2 O werden mit A. bidest auf 1000 ml aufgefüllt. Der pH-Wert der Gebrauchslösung (Stammlösung 1:20 verdünnt) liegt bei 7,4. 12 II. Material und Methoden 1.2.3. NH4 Cl-Tris-Lyse-Puffer: Lösung I : 20,594 g Tris in 1l A. bidest lösen, mit 1N HCl auf pH 7,65 einstellen, Lösung II: 8,3 g NH4 Cl in 1l A. bidest lösen, 9 Teile der Lösung II und 1 Teil der Lösung I mischen, falls notwendig den pH auf 7,2 nachstellen. 1.2.4. Puffer und Substrate für den Anti-Cop-AK-ELISA: a) Beschichtungspuffer (0,05 M Bicarbonatpuffer): Lösung A: 5,3 g/l NaHCO3 (0,05 M) Lösung B: 4,2 g/l Na2 CO3 (0,05 M) Lösung A wird vorgelegt, durch Titration mit Lösung B wird ein pH von 9,5 eingestellt. b) Waschpuffer: PBS mit 0,05% (W/V) Tween 20 c) Nachbeschichtungspuffer: Waschpuffer mit 1 % (W/V) Magermilchpulver d) Substratpuffer (0,05 M Citratpuffer, pH 5,0): 0,5 g / 50 ml C6 H8 O7 x 1 H2 O (0,05 M) 0,9 g / 100 ml NaH2 PO4 x 2 H2 O (0,05 M) Der pH-Wert wird mit 1 N NaOH auf 5,0 einstellt. e) Substratlösung: Zur Herstellung der Substratlösung für POD – konjugierte Antikörper werden 0,8 mg/ml Urea Hydrogen Peroxid 0,8 mg/ml ortho-Phenylendiamin Dihydrochlorid (OPD) unmittelbar vor dem Auftragen in Substratpuffer gelöst. 1.2.5. Puffer und Lösungen für die histologischen Färbungen a. Färbelösung zur Markierung toter Zellen: 5 % Trypanblau – Gebrauchslösung in PBS 13 II. Material und Methoden b. Hämalaun/Eosin-Färbung: Mayers Hämalaun Merck Eosin-Lösung: 0,5 % (w/v) Eosin Merck 0,1 % Essigsäure 1.2.6. Sonstige Puffer Hanks balanced salt solution (HBSS) - Pufferlösung: HBSS (Nr. H-4891) Sigma-Aldrich NaHCO3 (350 mg/l) Sigma-Aldrich 1.3. Lösungen und Chemikalien 1.3.1. Lösungen für die intrazelluläre Zytokin-Färbung - Fixativ-Lösung für die intrazelluläre Zytokin-Färbung: 1 % Paraformaldehyd in HBSS-Pufferlösung Hölzel Diagnostics - Permeabilisierungs-Lösung für die intrazelluläre Zytokin-Färbung: 1 % Saponin-Lösung in HBSS-Puffer Hölzel Diagnostics - Cytofix/Cytoperm® BD/PharMingen - Perm/Wash® BD/PharMingen - Dimethylformamid (DMF) Sigma-Aldrich - Phorbol-12-Myristat-13-Azetat (PMA) (in DMF gelöst; Endkonzentration: 10 ng/ml) Sigma-Aldrich - Ionomyzin (in DMF gelöst; Endkonzentration:1 µM) Sigma-Aldrich - Monensin (in DMF gelöst; Endkonzentration: 3 µM) Sigma-Aldrich - Brefeldin A (in DMSO gelöst; Endkonz.: 10 µg/ml) Sigma-Aldrich Tiefgefrorene Aliquots von PMA, Ionomyzin, Monensin (in DMF) oder Brefeldin A (in DMSO) werden unmittelbar vor dem Gebrauch mit Kulturmedium (ohne PBS) 1:10 verdünnt, so dass die o.g. Endkonzentrationen erreicht wird. 14 II. Material und Methoden 1.3.2. Verschiedene Proteine und Peptide - Rinderserumalbumin (BSA; Nr. A-9306) Sigma-Aldrich - Basisches Myelinprotein (MBP), bovine (M-1891) Sigma-Aldrich - MBP 87-99 Peptid, bovine (H-1964) Sigma-Aldrich - Copaxone (Copolymer-1, Glatiramerazetat) Gry Pharma/Teva - Myelin Oligodendrozyten Glykoprotein (MOG) 35-55 Peptid, rat/mouse Sigma-Aldrich - Proteolipidprotein (PLP) 139-151 Peptid ‚serine‘ HSLGKWLGHPDKF Biosource Int. - Humanes rekombinantes IL-2 Chiron - Concanavalin A Sigma-Aldrich 1.3.3. Lösungen für die TUNEL-Methode - Permeabilisierungs-Lösung für die TUNEL-Methode: 0,1% Triton X-100 in 0,1 % Natriumcitrat Sigma-Aldrich - Fixierungs-Lösung für die TUNEL-Methode: 4% Paraformaldehyd in PBS, pH 7,4 Sigma-Aldrich 1.3.4. Verschiedene Färbelösungen - Trypanblau (Nr. 15250-012) Gibco BRL/Life Technologies - May-Grünwald-Lösung Merck (eosinsaures Methylenblau in Methanol/Glycerin 2:1) - Giemsa-Lösung (Stammlösung) Merck (Azur II sowie eosinsaures Azur II in Methanol/Glycerin 1:1) - Giemsa-Gebrauchslösung (1/2 h verwendbar) 1:40 mit A.bidest verdünnt 1.3.5. Sonstige Lösungen und Chemikalien - Zellkulturmedium: - RPMI 1640 (Nr. 21875-035) Gibco BRL/Life Technologies - 5-10 % foetales Rinderserum (FBS bzw. FCS ) Gibco BRL/Life Technologies 15 II. Material und Methoden - Ficoll Separating Solution; Dichte 1,077 g/ml Biochrom - Magermilchpulver Humana - Aluminiumhydroxid (Rehydra-Gel HPA) Reheis Inc. - Heparin (Liquemin® N7500) Hoffmann-La Roche - Komplettes Freund’sches Adjuvans (CFA) mit 0,05% Mycobacterium butyricum Difco - Pertussis Toxin (PT) from Bordetella pertussis Sigma-Aldrich - Lysing Solution Becton Dickinson - CellWash Becton Dickinson - FACS Flow Becton Dickinson - Tween 20 (Polyoxyethylensorbitanmonolaurat) Serva - Ortho-phenylendiamin Dihydrochlorid (OPD) Sigma-Aldrich - Urea Hydrogen Peroxid Sigma-Aldrich - Ketamin 10 % Medistar - Xylazin 2 % Medistar Alle hier nicht aufgeführten Chemikalien wurden, wenn nötig im höchsten Reinheitsgrad, von den Firmen Merck, Sigma-Aldrich oder Riedel de Ha¸n bezogen. 1.4. Antikörper (-konjugate) Tabelle Nr. 1 Verwendete Antikörper/-Konjugate Antikörperspezifität Herkunft/Klon Markierung Firma Antikörper für die intrazelluläre Zytokinfärbung bei humanen Leukozyten: Anti-Human-IL-2 Maus PE Becton Dickinson (BD) Anti-Human-IL-4 Maus PE BD Anti-Human-INFγ Maus FITC BD Anti-Human-IL-10 Maus Biotin Hölzel Diagnostics Anti-Human-TNFα Maus FITC Hölzel Diagnostics Anti-Human-TGFβ1,2,3 Maus Ohne Genzyme Anti-Maus IgG Ratte PE BD Anti-Human-CD4 Maus PE-Cy5 Coulter-Immunotech Isotypen-Kontrolle IgG2a Maus FITC BD Isotypen-Kontrolle IgG1 Maus PE BD Isotypen-Kontrolle IgG1 Maus PE-Cy5 Coulter-Immunotech 16 II. Material und Methoden Antikörper für die Markierung von Oberflächenantigenen auf humanen Leukozyten: Anti-Human-CD3 Maus PerCP BD Anti-Human-CD4 Maus FITC BD Anti-Human-CD8 Maus FITC BD Anti-Human-CD69 Maus PE BD Isotypen-Kontrolle IgG1 Maus FITC BD Isotypen-Kontrolle IgG1 Maus PE BD Isotypen-Kontrolle IgG1 Maus PerCP BD Antikörper für die intrazelluläre Zytokinfärbung bei murinen Leukozyten: Anti-Murine-IL-4 Fluoreszein AgFa Anti-Murine-INFγ PE BD PharMingen Antikörper für die Markierung von Oberflächenantigenen auf murinen Leukozyten: Anti-T-Zellen 59AD2.2 Fluoreszein AgFa Anti-B-Zellen RA3-6B2 Fluoreszein AgFa Anti-CD4-Zellen H129-19 Fluoreszein AgFa Anti-CD8-Zellen 53-6.72 Fluoreszein AgFa Anti-NK-Zellen 14B11 Fluoreszein AgFa Anti-Granulozyten RB68C5 Fluoreszein AgFa Meerrettich- Sigma Antikörper für den Anti-Cop-AK-ELISA Polyklonaler anti-Maus Ziege IgG, IgA, IgM peroxidase (POD) Polyklonaler anti-Maus Ziege POD Nordic Ziege POD Nordic Ziege POD Nordic Ziege POD Nordic Ziege POD Nordic IgM Polyklonaler anti-Maus IgG1 Polyklonaler anti-Maus IgG2a Polyklonaler anti-Maus IgG2b Polyklonaler anti-Maus IgG3 17 II. Material und Methoden Zur indirekten Markierung für den biotinylierten anti-IL-10-AK wurde zusätzlich Streptavidin-PE konjugiert (Hölzel Diagnostics) eingesetzt. 1.5. Testsysteme - Annexin V/Propidiumjodid-Testkit Bender MedSystems - In Situ Cell Death Detection Kit, Fluoreszein Boehringer Mannheim/Roche - Vector M.O.M. Immunodetection Kit/Peroxidase Vector Laboratories - Cytometric Bead Array (CBA) Kit, Mouse Th1/Th2 Cytokine CBA Pharmingen/BD Biosciences 1.6. Verbrauchsmaterialien Kabavette Probenröhrchen zur Blutentnahme: - Volumen 10 ml, Gerinnungshemmer Lithium-Heparinat Kabe - Volumen 3 ml, Gerinnungshemmer EDTA Kabe - Volumen 10 ml, Serumröhrchen Kabe Blue Max Conical Tubes, 50 ml Falcon/Becton Dickinson FACS Probenröhrchen (Falcon 2052) Falcon/Becton Dickinson 24-Flat-Bottom-Well-Platten für die Gewebekultur Greiner 96-Flat-Bottom-Well-Platten für die Gewebekultur Falcon/Becton Dickinson 96er-Rundboden-Platten für die Gewebekultur Greiner 96-Flat-Bottom-Well-Platten für den ELISA (35/3912) Falcon/Becton Dickinson Drahtgewebe 1.4301 (Leinenbindung) W 0,080 mm, d 0,050 mm, 200 mesh Körner/Drahtgewebe 1.7. Software Software Durchflusszytometrie: CellQuest® BD Bioscience BD Cytometric Bead Array Software BD Bioscience Software Fluoreszenzmikroskopie: ACT1 Nikon 18 II. Material und Methoden Statistische Berechnungen: SPSS 10.0 für Windows SPSS Inc. Prism GraphPad Software 2. Methoden 2.1. Durchflusszytometrie Mit Hilfe der Durchflusszytometrie ist die Charakterisierung von verschiedenen Zellen einer Einzelzellsuspension möglich. Die im Durchflusszytometer angewandte sog. hydrodynamische Fokussierung der Zellen bewirkt die Passage einzelner Zellen durch den Strahl eines Argon-IonenLasers (λ = 488 nm). Über ein komplexes, optisches System werden bei dem in der vorliegenden Arbeit eingesetzten FACScan® fünf verschiedene Parameter abgeleitet. Zum einen werden die Streulicht (scatter) Eigenschaften jeder Zelle bestimmt. So erlaubt die Messung des vorwärts gestreuten Lichts (forward scatter - FSC) eine Aussage über die jeweilige Größe der Zelle, die Messung des seitwärts gestreuten Lichts (sideward scatter - SSC) eine Aussage über die Struktur (Oberflächenfaltung, Granularität) der einzelnen Zelle . Allein durch die Analyse der Streulichteigenschaften bei Messungen der Leukozyten des peripheren Bluts können in den meisten Fällen Granulozyten, Monozyten und Lymphozyten unterschieden werden. Die zusätzliche Markierung der Zellen mit Fluoreszenzfarbstoffen ermöglicht die Messung weiterer bis zu drei verschiedener Parameter. Hierzu sind entsprechende geeignete Farbstoffe nötig. Die Fluorochrome müssen ein Excitationssspektrum haben, das die Anregung bei 488 nm, der Wellenlänge des Lasers, ermöglicht. Die Differenz zwischen Absorptions- und Emissionsmaximum, der Stoke’sche Shift, ist für jeden Fluoreszenzfarbstoff charakteristisch. Die im FACScan eingebauten Photodetektoren ermöglichen die Messung folgender Emissionsspektren: ⇒ Fluoreszenz 1 (FL1): λ = 515-545 nm (geeigneter Fluoreszenzfarbstoff: Fluoreszein) ⇒ FL2: λ = 564-606 nm (geeigneter Fluoreszenzfarbstoff: Phykoerythrin (PE)) ⇒ FL3: λ > 650 nm (geeignete Fluoreszenzfarbstoffe: PE Zyanin 5 (PE-Cy5) und Peridinin Chlorophyll Protein (PerCP). Um die Autofluoreszenz der Zellen sowie die durch unspezifische Bindung Fluorochrom-konjugierter Antikörper entstehende Hintergrundfluoreszenz von der durch die spezifische Bindung dieser Antikörper entstehenden und dadurch eigentlich interessanten Fluoreszenz der Zellen zu unterscheiden, ist es notwendig, eine jeweils passende Isotypen-Kontrolle durchzuführen. Für eine passende Isotypen-Kontrolle setzt man idealerweise einen Antikörper ein, der bezogen auf den eigentlichen Fluorochrom-markierten AK der gleichen AK-Klasse bzw. Subklasse angehört, die gleiche Fluorochrommarkierung trägt und vom gleichen Hersteller kommt. 19 II. Material und Methoden Mit Hilfe dieser Negativkontrolle kann nun am Durchflusszytometer die Hintergrundfluoreszenz als negativ definiert werden. 2.2. Apoptotische r Zelltod 2.2.1. Allgemeiner Teil Die Apoptose, auch der programmierte Zelltod genannt, stellt den physiologischen Tod aller Zellen dar. Seitdem immer deutlicher wird, dass für gesundes Leben auch der physiologische und damit geordnete Tod bestimmter Zellen notwendig ist und bei Ausbleiben oder einer Fehlregulation dieses festgelegten Prozesses Krankheiten entstehen, rückt die Apoptose immer mehr in das Interesse der Wissenschaft. Die Apoptose spielt nicht nur bei der Gestalt- und Formentwicklung eines Embryos eine wichtige Rolle, sondern auch bei der Regenerationsfähigkeit verschiedener Organe, wie Leber, Niere, Gebärmutter. In der vorliegenden Arbeit gilt das besondere Augenmerk dem physiologischen Zelltod von Lymphozyten. Die Apoptose aktivierter Zellen des Immunsystems – activation induced death (AID) – ist einer der wichtigsten Wege zur Regulation und Beendigung eines Entzündungsprozesses. Die Kenntnisse über die verschiedenen morphologischen und biochemischen Veränderungen einer Zelle während der Apoptose ermöglichen ein mittlerweile breites Spektrum an Methoden der Analyse des apoptotischen Zelltodes. Wichtig ist hierbei die Unterscheidung der Apoptose von pathologischen Prozessen wie der Nekrose. 2.2.2. TdT-mediated dUTP nick end labeling (TUNEL) Methode Bei der TUNEL-Methode (= terminal deoxynucleotidyl transferase (TdT)-mediated desoxy Uridintriphosphat (dUTP) nick end labeling) wird die im Verlauf der Apoptose einsetzende, charakteristische DNA-Fragmentierung erfasst (Sgonc 1994). Als Folge der Spaltung genomischer DNA entstehen während der Apoptose Doppelstrang-Fragmente (Mono- und Oligonukleosomen) sowie Einzelstrangbrüche. Solche DNA Strangbrüche können identifiziert werden, indem mit Hilfe einer enzymatischen Reaktion (hier: TdT) modifizierte Nukleotide (hier: dUTP) an das freie 3‘OHEnde des DNA-Fragments gebunden werden. Die Fluorochrom-Markierung (hier: Fluoreszein) der verwendeten Nukleotide ermöglicht eine anschließende fluoreszenz-mikroskopische oder durchflusszytometrische Messung der gebundenen Nukleotide und damit der DNA-Strangbrüche. 20 II. Material und Methoden Durchführung: Die wie unter II.2.3. beschrieben isolierten PBMC werden auf eine Zellkonzentration von 2x106 Zellen/ml eingestellt. 100 µl dieser Zellsuspension werden in ein steriles FACS-Röhrchen gegeben und 100 µl der Fixierungslösung dazugegeben, gut durchmischt und bei Raumtemperatur 1 h lang inkubiert. Zur Entfernung der Fixierungslösung werden die Zellen anschließend zweimal mit PBS gewaschen, d.h. bei 110 g 10 min lang zentrifugiert, dekantiert und mit PBS aufgefüllt. Nach dem zweiten Zentrifugationsschritt werden die Zellen in 100 µl der Permeabilisierungslösung resuspendiert und zwei Minuten lang auf Eis inkubiert. Anschließend werden die Zellen erneut, wie oben beschrieben, zweimal mit PBS gewaschen und im Anschluß daran das Zellpellet mit 50 µl der TUNEL-Reaktions-Lösung (enthalten im In Situ Cell Death Detection Kit) resuspendiert und 60 min lang im Brutschrank bei 37°C und 7 % CO2 inkubiert. Nach zweimaligem Waschen mit PBS werden die Zellen in 500 µl PBS resuspendiert und im Durchflusszytometer gemessen. Zur Kontrolle wird eine Negativprobe (nur Bindungspuffer ohne TUNEL-Reaktions-Lösung) sowie eine Positivprobe (vorherige Inkubation mit DNAse) mitgeführt. 2.2.3. Annexin V/Propidiumjodid Methode Die Annexin V/Propidiumjodid-Methode beruht auf der Beobachtung, dass rasch nach der ApoptoseInduktion Phosphatidylserin von der inneren Seite der Plasmamembran auf die Zelloberfläche transloziert wird (Martin 1995). Exponiert an der Oberfläche der apoptotischen Zelle kann Phosphatidylserin mit Annexin V markiert werden, einem kalziumabhängigen, phospholipidbindenden Protein mit hoher Affinität zu Phosphatidylserin (Zhang 1997). Da im Rahmen einer Nekrose die Zellmembran durchlässig wird und Annexin V an Phosphatidylserine auf der zytoplasmatischen Seite der Membran binden kann, ist es notwendig, zeitgleich mit der AnnexinMarkierung die Integrität der Zellmembran zu überprüfen. Dies geschieht mit der Markierung von DNA durch Propidiumjodid (PI) (Vermes 1995). Somit haben apoptotische Zellen im Durchflusszytometer ein positives Signal für Annexin V und zugleich ein negatives Signal für Propidiumjodid, während nekrotische Zellen für beide Marker positiv sind (Van den Eijnde 1997). Die Markierung von Annexin V mit einem Fluorochrom (hier: FITC), sowie die Tatsache, dass PI selbst stark fluoreszierend ist, ermöglicht die Fluoreszenz-mikroskopische oder durchflusszytometrische Messung der mit dieser Methode bearbeiteten Zellen. Durchführung: Da Erythrozyten Annexin V in starkem Maße binden, kann diese Methodik nur mit einer Erythrozytenfreien Zellsuspension durchgeführt werden. Daher ist es notwendig, zunächst eine Zellisolation, z.B. mittels Dichtegradienten bzw. eine Erythrozyten-Lyse durchzuführen. 100 µl der Erythrozytenfreien Zellsuspension, die ca. 2x106 Zellen/ml enthält, werden einmalig mit HEPES- 21 II. Material und Methoden Puffer gewaschen (Waschschritt wie oben beschrieben). Anschließend werden die Zellen in 200 µl HEPES-Puffer resuspendiert. 10 µl Annexin V Fluoreszein-konjugiert und 20 µl Propidiumjodid werden hinzugegeben und 20 Minuten lang im Dunkeln inkubiert. Im selben Schritt kann ferner ein weiterer AK, der gegen Moleküle auf der Oberfläche der Zellen gerichtet ist (hier: z.B. anti-CD4-AK) und einen geeigneten Fluoreszenzfarbstoff trägt (hier z.B. PE-Cy5), dazugegeben werden. Nach einmaligem Waschen mit HEPES-Puffer, zur Entfernung nicht gebundener AK- bzw. Annexin V- und PI-Moleküle, werden die Zellen in 500 µl HEPES-Lösung resuspendiert und durchflusszytometrisch gemessen. 2.3. Isolierung mononukleärer, peripherer Blutzellen mit Hilfe eines Dichtegradienten (nach Jacobs 1996) Für die Isolierung mononukleärer Zellen aus dem peripheren Blut von Probanden wird diesen Vollblut entnommen (Menge je nach Versuchsansatz) und Lithium-Heparinat zur Gerinnungshemmung dazugegeben. Unter sterilen Bedingungen wird zunächst Ficoll-Lösung (hier: 20 ml) in ein 50 ml Kunststoff-Röhrchen gegeben und das frisch entnommene Blut (hier: 20 ml) vorsichtig darüber geschichtet. Die zwei Flüssigkeiten dürfen sich hierbei nicht mischen. Das 50 ml Röhrchen wird anschließend in der Zentrifuge ungebremst 20 Minuten lang bei 2000 U/min (≈ 700 g) zentrifugiert. Aufgrund der unterschiedlichen Dichte der verschiedenen Zellpopulationen bilden sich während der Zentrifugation folgende Schichten aus: im Sediment, finden sich Erythrozyten und Granulozyten, direkt darüber befindet sich die wässrige, durchsichtige Schicht mit der Ficoll-Lösung und auf ihr der dünne, weißlich schimmernde Interphase-Ring mit den peripheren mononukleären Blutzellen (PBMC). In der anschließenden obersten Schicht des Plasmas befinden sich kleinste Partikel wie Thrombozyten. Zur Isolierung der PBMC wird der Interphase-Ring vorsichtig unter sterilen Bedingungen abgesaugt und in ein mit Kulturmedium gefülltes 50 ml Röhrchen gegeben. Der nachfolgende Waschschritt dient der Entfernung von in der Zellsuspension verbliebenen FicollResten. Hierzu wird das Röhrchen bei 1200 U/min 10 Minuten lang zentrifugiert, der Überstand verworfen, das Sediment in Zellkulturmedium resuspendiert und ein weiteres Mal bei 1200 U/min 10 Minuten lang zentrifugiert. Nach Dekantieren des Überstandes werden die Zellen in einer definierten Menge (z.B. 1 ml) Kulturmedium resuspendiert und die Zelldichte mittels Neubauerzählkammer bestimmt. Bestimmung der Zelldichte Zur Bestimmung der Zelldichte wird eine repräsentative Probe (10 µl) der Zellsuspension entnommen und mit 190 µl Trypanblau-Lösung vermischt. Trypanblau dringt in tote Zellen ein, so dass mittels dieser Färbung eine Aussage über die Vitalität der Zellen und damit über die Qualität der Präparation 22 II. Material und Methoden getroffen werden kann. Die Zellen werden mittels einer Neubauer-Zählkammer gezählt. Die Anzahl der Zellen pro ml ergibt sich aus folgender Formel: Anzahl gezählter Zellen x Verdünnungsfaktor (hier: 20) x 104 = Zellen/ml Zellsuspension. 2.4. Intrazelluläre Zytokinmessung Durch die durchflusszytometrische Messung intrazellulärer Zytokine in peripheren Blutzellen ist die Analyse individueller Zytokin-produzierender Zellen auf Einzelzellniveau (Jung 1993) bei gleichzeitiger Charakterisierung der Zelle möglich. Um ein im Durchflusszytometer messbares Fluoreszenzsignal zu erzeugen, ist es notwendig, die Zytokin-Produktion der Zellen zunächst unspezifisch zu stimulieren (hier: mit PMA und Ionomyzin) und gleichzeitig die Sekretion der Zytokine zu inhibieren (hier: mit Monensin bzw. Brefeldin A). Die anschließende Fixierung und Permeabilisierung (hier: mit Saponin) der Zellen ermöglicht die intrazelluläre Markierung der von der Zelle synthetisierten und im Golgi-Apparat akkumulierten Zytokine mit Fluorochrom-konjugierten spezifischen Antikörpern. Ein großer Vorteil dieser Methode ist die gleichzeitige Charakterisierung der Zelle über geeignete, spezifisch gegen bestimmte Oberflächenstrukturen gerichtete, Fluorochrom-markierte AK (hier: antiCD4-AK zur Markierung von T-Helfer Zellen) bei Einsatz eines Mehrfarben-Durchflusszytometers. Mit Hilfe dieser Methode können Angaben über den Prozentsatz oder die Anzahl Zytokinproduzierender Zellen eines bestimmten Zelltyps gemacht werden, jedoch nicht Angaben über die Menge des von der Zelle produzierten Zytokins. Durchführung: In dieser Arbeit wurden intrazelluläre Zytokinfärbungen mit Vollblut, isolierten PBMC, Milz- und Lymphknotenzellsuspensionen sowie mit Peritoneal-Zellen durchgeführt. Je 200 µl einer 1-2 x 106 Zellen/ml enthaltenden Zellsuspension werden pro Ansatz in jeweils ein steriles FACS-Röhrchen gegeben, je 2 µl der Stimulatoren PMA und Ionomyzin (siehe II.1.3.1.), sowie 2 µl Monensin bei humanen Zellen bzw. 2 µl Brefeldin A bei murinen Zellen hinzugegeben (siehe II.1.3.1.), gut durchmischt und fünf Stunden lang im Brutschrank bei 37°C und 5 % CO2 inkubiert. Die Zellen werden dann zweimal, wie oben beschrieben, mit HBSS gewaschen, das Zellpellet anschließend in 1 ml eiskaltem Fixativ (1% Paraformaldehyd-Lösung) resuspendiert und fünf Minuten lang bei 4°C inkubiert. Es folgen zwei weitere Waschschritte mit HBSS. Die Zellen werden anschließend in 100 µl Permeabilisierungs-Lösung (siehe II.1.3.1.) resuspendiert und mindestens 30 Minuten lang inkubiert. Die jeweiligen spezifischen AK werden zu den Proben gegeben. Der Ansatz wird gut durchmischt und 30 Minuten lang im Dunkeln bei 4°C inkubiert. Es folgt ein weiterer Waschschritt mit HBSS zur 23 II. Material und Methoden Entfernung nicht gebundener AK. Die Zellen werden anschließend in 500 µl HBSS resuspendiert und durchflusszytometrisch gemessen. Tabelle Nr. 2 Schema für die Versuchsansätze für die durchflusszytometrische Charakterisierung peripherer Blutzellen von MS-Patienten und gesunden Probanden nach intrazellulärer Zytokin-Färbung Versuchs - Verwendeter AK-Menge Fluorochrom- ansatz Antikörper 1. Isotypen-Kontrolle IgG2a 10 µl FITC Isotypen-Kontrolle IgG1 10 µl PE Isotypen-Kontrolle IgG1 5 µl PE-Cy5 Anti-INF-γγ -mAK 10 µl FITC Anti-IL-4-mAK 10 µl PE Anti-CD4-mAK 5 µl PE-Cy5 Anti-TNF-α α -mAK 2 µl FITC Anti-IL-10-mAK 2 µl Biotin Streptavidin 2 µl PE Anti-CD4-mAK 5 µl PE-Cy5 Anti-IL-2-mAK 10µl FITC Anti-TGF-β β -mAK 1 µl ----- Ratte-anti-Maus IgG mAK 10 µl PE Anti-CD4-mAK 5 µl PE-Cy5 2. 3. 4. Markierung Tabelle Nr. 3 Schema intrazelluläre Zytokinfärbung bei Mäuselymphozyten AK-Spezifität Negativkontrolle Probe AK-Menge Fluorochrom-Markierung - - - 1. IL-4 1 µl Fluoreszein 2. INF-γγ 5 µl Phycoerythrin 2.5. Bestimmung von Oberflächenmarkern Mit Hilfe Fluorochrom-konjugierter spezifischer AK ist es möglich periphere Blutzellen aufgrund ihrer auf der Zelloberfläche befindlichen Moleküle genauer zu charakterisieren. Da die starke Eigenfluoreszenz von Erythrozyten die durchflusszytometrische Messung stört, müssen die 24 II. Material und Methoden Erythrozyten zunächst durch Lyse oder Zellisolierung vor der Messung am FACScan® entfernt werden. Durchführung: In dieser Arbeit wurde die Markierung von Zelloberflächenmolekülen mit Blutzellen, Milz- und Lymphnotenzellsuspensionen und Peritoneal-Zellen durchgeführt. Die Zellen der jeweiligen Zellsuspension werden mit den jeweiligen AK (siehe Tabelle Nr.1) gemischt und 20 Minuten lang im Dunkeln bei Raumtemperatur (RT) inkubiert. Anschließend wird 1 ml der zuvor 1:10 mit A. bidest verdünnten Lysing Solution dazugegeben, gemischt und 10 Minuten lang im Dunkeln bei RT inkubiert. Die Zellen werden zweimal mit CellWash, wie oben beschrieben, gewaschen, in 500 µl CellWash resuspendiert und innerhalb der nächsten 24 h durchflusszytometrisch gemessen. Tabelle Nr. 4 Schema für die Versuchsansätze für die durchflusszytometrische Charakterisierung peripherer Blutzellen sowie Milz- und Lymphknotenzellen von Mäusen Versuchs - AK-Spezifität AK-Menge Farbstoffe Ansatz 1. - - - 2. T-Zellen 0,5 µl Fluoreszein 3. B-Zellen 0,5 µl Fluoreszein 4. CD4-Zellen 1,0 µl Fluoreszein 5. CD8-Zellen 1,0 µl Fluoreszein 6. nur NK-Zellen 1,0 µl Fluoreszein teilweise Tabelle Nr. 5 Schema für die Versuchsansätze für die durchflusszytometrische Charakterisierung peripherer Blutzellen von MS-Patienten Versuchs - AK-Spezifität AK-Menge Farbstoffe Ansatz 1. Isotypen- 10 µl FITC/PE/PE-Cy5 kontrolle 2. CD3/CD4/CD69 10 µl FITC/PE/PE-Cy5 3. CD3/CD8/CD69 10 µl FITC/PE/PE-Cy5 25 II. Material und Methoden 2.6. Messung der Konzentration löslicher Zytokinmoleküle Die Bestimmung der Konzentration löslicher Zytokinmoleküle (hier: IL-2, IL-4, IL-5, TNF-α, IFN-γ) erfolgt im Zellkulturüberstand sowie im murinen Plasma mit Hilfe eines Cytometric Bead Arrays (CBA). In diesem Test werden fünf Sorten unterschiedlich stark fluoreszierender Kunststoffkügelchen (Beads) verwendet die jeweils mit spezifischen Antikörpern gegen IL-2, IL-4, IL-5, IFN-γ und TNF-α markiert sind. Die fünf verschiedenen Bead-Populationen werden vermischt und können im Durchflusszytometer im Messbereich von Fluoreszenz 3 voneinander unterschieden werden. Die Beads werden zusammen mit der zu analysierenden Probe sowie einem PE-konjugierten Zweitantikörper inkubiert. Die anschließend im Durchflusszytometer im PE-Messbereich (Fluoreszenz 2) bestimmte Fluoreszenzintensität der jeweiligen Beads ist proportional zur Menge des gebundenen Zytokins. Auf diese Weise lassen sich in Proben mit geringem Volumen (50 µl) gleichzeitig bis zu fünf verschiedene Zytokine bestimmen. Mit Hilfe entsprechender Standards bekannter Konzentration lassen sich die Zytokinkonzentrationen der jeweiligen Proben quantifizieren (Detektionslimit ca. 20 pg/ml). Der Test wird wie vom Hersteller empfohlen durchgeführt. Die Auswertung der Daten erfolgt mit Hilfe der speziellen BD Cytometric Bead Array Software. 2.7. Anti-Cop-1-AK-ELISA (Enzyme – Linked – Immunosorbent – Assay) Der ELISA bietet die Möglichkeit, Antigen-Antikörper-Bindungen über eine nachgeschaltete enzymatische Reaktion, die mit einem Farbumschlag gekoppelt ist, photometrisch messbar zu machen. Beim hier verwendeten Indirekten ELISA wird das Antigen (hier: Cop-1) direkt adsorbtiv an die feste Phase von 96-Depot-Flachbodenplatten gebunden. Die zu testenden Plasmen werden in drei Verdünnungsstufen (1:10; 1:30; 1:100) aufgetragen. Es wurden jeweils Doppelbestimmungen durchgeführt. Als Positivkontrolle bzw. Standard dient ein Maus-anti-Cop-1-Mischplasma, als Negativkontrolle Mausnormal-Mischplasma (MNP). Der Nachweis spezifisch gebundener Antikörper erfolgt durch Peroxidase-konjugierte, polyklonale Ziegen-Antikörper gegen Maus-Immunglobuline (IgG, IgM, IgA), bzw. polyklonalen Ziegen-AK gegen Maus-Ig der Subklasse IgM, IgG1, IgG2a, IgG2b und IgG3. Durchführung: - Beschichtung mit 100 µl des in Beschichtungspuffer gelösten Antigens (1 µg Cop-1) pro Depot, Inkubation 1h lang bei 37°C 26 II. Material und Methoden - 3 x Waschen mit 200 µl Waschpuffer pro Depot - Nachbeschichtung mit 200 µl Nachbeschichtungspuffer pro Depot, Inkubation 30 min lang bei 37°C - 3 x Waschen mit 200 µl Waschpuffer pro Depot - Auftragen der Plasmen je 100 µl der in Nachbeschichtungspuffer verdünnten Proben pro Depot, Inkubation 1 h lang bei 37°C - 3 x Waschen mit 200 µl Waschpuffer pro Depot - Auftragen des 100 µl pro Depot, in Nachbeschichtungspuffer verdünnt (1:3.000 Zweitantikörpers polyvalenter AK, 1:10.000 verdünnt; die anti IgG1, IgG2a, IgG2b, IgG3, IgM-Antikörper werden jeweils 1:3.000 verdünnt), Inkubation 1 h lang bei 37°C - 3 x Waschen mit 200 µl Waschpuffer pro Depot - Substratauftrag 100 µl OPD-Substrat in Substratpuffer pro Depot, Inkubation 1 h lang bei RT - Photometrische Messung des Substratumsatzes bei 450 nm in einem 8-Kanal-ELISA-Platten-Photometer. 2.8. Gewinnung von Zellen, Geweben und Organen der Maus für histologische und zellbiologische Untersuchungen 2.8.1 Blutabnahme bei Mäusen Die Blutentnahme bei lebenden Mäusen erfolgt durch Punktion des Plexus retroorbitalis mittels einer Pasteurpipette. Das Blut wird in ein Reagenzglas mit 3 Tropfen 20 %iger Heparinlösung gegeben. Anschließend wird 20 Minuten lang bei 2.000g zentrifugiert, der Überstand (= Plasma) abgenommen und bei –20°C gelagert. Aus dem Sediment können noch Blutzellen z.B. zur durchflusszytometrischen Analyse entnommen werden. 27 II. Material und Methoden 2.8.2. Herstellung einer Milzzellsuspension Die Maus wird schmerzfrei durch Ether getötet und die Milz entnommen. Die Milz wird in ein Gefäß mit ca. 5 ml PBS überführt und die Zellen aus dem Bindegewebssack herausgedrückt. Die Zellsuspension wird anschließend durch ein feinmaschiges Stahlnetz in ein Zentrifugenröhrchen filtriert um das Bindegewebe von den Einzelzellen zu trennen. Die Anzahl der in der Zellsuspension enthaltenen Leukozyten kann nun mit Hilfe einer Neubauer-Zählkammer bestimmt werden. Unter Berücksichtigung des Gesamtvolumens der Zellsuspension kann die Anzahl der in der Milz enthaltenen Zellen bestimmt werden. 2.8.3. Herstellung einer Suspension von Lymphknotenzellen Nach dem Töten der Maus werden die zu untersuchenden Lymphknoten entnommen und in ein Gefäß mit PBS gegeben. Analog zur Herstellung einer Milzzellsuspension (siehe II.2.8.2.) wird mit dem Lymphknoten verfahren. Die Anzahl der im Lymphknoten enthaltenen Leukozyten wird mit Hilfe einer Neubauer-Zählkammer bestimmt. 2.8.4. Präparation des Gehirns Um das Gehirn und das Rückenmark frei von Leukozyten zu erhalten, ist es notwendig, das betäubte Tier mit einer Waschlösung zu perfundieren. Hierzu wird die Maus zunächst betäubt, wobei darauf zu achten ist, dass der Kreislauf stabil bleibt. Zur Betäubung wird dem Tier pro 40 g Körpergewicht 0,15 ml folgender Lösung intraperitoneal injiziert: 0,4 ml Ketamin (10 %ig) + 0,1 ml Xylazin (2 %ig) + 1 ml PBS. Der Brustkorb wird geöffnet und das Herz freigelegt. Um den Abfluss des Blutes und der Perfusionslösung zu ermöglichen, wird ein kleiner Schnitt in den rechten Vorhof des Mäuseherzens gemacht. In den linken Ventrikel wird von der Herzspitze aus eine feine Kanüle hineingeschoben. Mit einem leichten, gleichbleibenden Druck wird nun die Perfusionslösung (hier: PBS) injiziert. Es wurden 50-100 ml PBS pro Tier perfundiert. Während der Perfusion stirbt das Versuchstier schmerzfrei. Anschließend wird das Gehirn präpariert, sofort in Tissue Tek® eingebettet und schockgefroren. Die Lagerung erfolgt bei -80°C. Von den Gehirnpräparaten werden 10 µm dicke Gefrierschnitte bei -20°C bis -25°C hergestellt. 2.8.5. Präparation des Rückenmarks Nach Perfusion des Versuchstiers, wie unter II.2.8.4. beschrieben, wird die Wirbelsäule freipräpariert und auf der einen Seite im Lendenbereich, auf der anderen Seite im Schulterbereich durchtrennt. Mit 28 II. Material und Methoden Hilfe einer 10 ml Spritze und einer Kanüle wird nun das Rückenmark aus dem Rückenmarkskanal herausgepresst. Für spätere Gefrierschnitte wird das Rückenmark in Tissue Tek® eingebettet, sofort schockgefroren und bei -80°C gelagert. Von den Rückenmarkspräparaten werden 10-12 µm dicke Gefrierschnitte bei -20°C bis -25°C hergestellt. 2.8.6. Herstellung eines Rückenmarkshomogenats Das, wie unter II.2.8.5. beschrieben, präparierte Rückenmark wird in eine mit ca. 3 ml PBS gefüllte Petrischale gegeben und mechanisch zerkleinert. Die Zellsuspension wird mit Hilfe einer Pipette gleichmäßig suspendiert. 2.9. Färbung von Gefrierschnitten aus Mäusehirnpräparaten 2.9.1. Hämalaun/Eosin – Färbung Bei dieser Färbemethode werden der Kernfarbstoff Hämatoxilin und der Plasmafarbstoff Eosin kombiniert. Folgende Anfärbungen sind zu beobachten: - Zellkerne: blau bis schwarz, - eosinophile Granula: orange bis rot, - Kollagenfasern: orange bis rot, - Erythrozyten: orange, - Zytoplasma: schwach orange. Durchführung: Die auf Objektträgern befindlichen Gefrierschnitte werden wie folgt gefärbt: - 100-200 µl Hämalaun auf das Präparat pipettieren, 3 min lang inkubieren, - mit A. bidest spülen, - 2 min lang in Leitungswasser inkubieren, - 200-300 µl Eosin-Lösung auf das Präparat geben, 1 min lang inkubieren, - 1-2 mal mit A. bidest spülen, - anschließend trocknen lassen. Das fertige Präparat wird mit einem Tropfen Vitro-Clud und einem Deckgläschen versehen und lichtmikroskopisch untersucht. 29 II. Material und Methoden 2.9.2. Immunhistologische Färbung a. Direkte Immunfluoreszenz Bei der direkten Immunfluoreszenz wird zur Anfärbung bestimmter Zellstrukturen ein spezifischer Antikörper verwendet, der direkt mit einem Fluorochrom markiert ist . Durchführung: - 10 min lang mit Aceton fixieren - nach Trocknen des Gewebeschnitts 50-100 µl des direkt markierten Antikörpers (hier: anti-CD4 bzw. anti-CD8 Fluoreszein-konjugiert, Verdünnung 1:100 in PBS) auftragen - 20 min lang bei Raumtemperatur in einer feuchten Kammer im Dunkeln inkubieren - dreimal mit PBS waschen - Objektträger um den Schnitt herum trocknen, mit 50 %iger Glyzerin-Lösung bedecken und unter einem Deckglas einschließen. b. Indirekte Immunfluoreszenz Bei der indirekten Immunfluoreszenz erfolgt die Anfärbung der zu untersuchenden Zellstrukturen mit Hilfe von spezifischen Antikörpern, die nicht direkt mit Fluorochromen markiert sind, deren Bindung an die Antigenstrukturen in einem zweiten Schritt mit Hilfe z.B. eines Fluorochrom-markierten Zweitantikörpers nachgewiesen wird. In der vorliegenden Arbeit wurde ein biotin-markierter Erstantikörper (hier: anti-CD8) eingesetzt, dessen Bindung anschließend mit PE-konjugiertem Streptavidin nachgewiesen wurde. Die Präparation erfolgt analog zur Durchführung der direkten Immunfluoreszenz, jedoch erfolgt ein weiterer Färbeschritt nach dem dreimaligen Waschen mit PBS. Hierbei wird 50-100 µl des PEkonjugierten Streptavidins (Verdünnung 1:100 in PBS) auf den Gewebeschnitt aufgetragen, 20 min lang bei RT im Dunkeln in einer feuchten Kammer inkubiert und anschließend dreimal mit PBS gewaschen. 2.10. Färbung nach Pappenheim Die Zellen werden durch den Alkohol, der sich in der May-Grünwald-Lösung befindet, fixiert. Durch die Zugabe von A. bidest fällt der Farbstoff aus. Die unterschiedliche Anfärbung verschiedener Zellen und Zellstrukturen beruht u.a. auf der unterschiedlichen Affinität der Farbstoffe zu den in der Zelle vorhandenen makromolekularen Substanzen. 30 II. Material und Methoden So färben sich die DNA des Kerns, RNA der Nukleoli und die RNA des zytoplasmatischen Raumes mit basischen Farbstoffen (Methylenblau, Azur II) an, während die Proteine des Zytoplasmas und das Hämoglobin mit sauren Farbstoffen (Eosin) reagieren. Durchführung: - 5 min lang May-Grünwald-Lösung (konzentriert) einwirken lassen - 5 min lang die gleiche Menge A. bidest einwirken lassen - Zwischenspülen mit A. bidest - 5 min lang Giemsa-Gebrauchslösung (1:40 mit A. bidest) - Spülen mit A. bidest Das Präparat schräg stellen und lufttrocknen lassen. 2.11. In vitro-Stimulation peripherer humaner Blutzellen Für die in vitro-Stimulationsversuche werden die wie oben beschrieben isolierten PBMC auf eine Konzentration von 2 x 105 Zellen/ml mit Zellkulturmedium eingestellt. Je 2 ml der Zellsuspension werden anschließend in 24-Depot-Gewebekulturplatten pipettiert und entweder ohne Zusatz von Protein (Negativkontrolle), mit Copaxone (1µg/ml), MBP (2 µg/ml) oder BSA (2 µg/ml) 48 Stunden lang im Brutschrank bei 37°C und 5 % CO2 inkubiert. Die Proteine werden einmalig zu Beginn der Inkubationszeit zugegeben. Im Anschluß an diese spezifische Stimulation der Zellen wird die Bestimmung der Apoptoserate (mittels Annexin V/Propidiumjodid Methode; siehe II.2.2.3.) bzw. die Bestimmung intrazellulärer Zytokine (siehe II.2.4.) durchgeführt. 2.12. Skala zur Bewertung der EAE-Symptome bei Mäusen Die klinischen Symptome der an EAE erkrankten Tiere werden mit Hilfe der unten stehenden Skala bewertet. Die Tiere werden bis ca. 30-40 Tage nach Induktion der Erkrankung täglich untersucht. Die Summe der täglich erhobenen Werte ergibt den sogenannten ‚cumulative disease index’ (CDI). Tabelle Nr. 6 Skala zur Bewertung von Krankheitssymptomen bei an EAE erkrankten Mäusen 0,5 Muskulatur allgemein schwächer, oder Schwanzmuskulatur schwächer/schlaff oder Gangart unbeholfen 1,0 Völlig geschwächte Schwanzmuskulatur oder ataktische Gangart 1,5 Völlig geschwächte Schwanzmuskulatur und unbeholfener Gang oder schlechteres 31 II. Material und Methoden Umdrehen aus der Rückenlage 2,0 Eingeschränkter Gang – Probleme beim Umdrehen aus der Rückenlage – eingeschränkte Mobilität der Hinterbeine 2,5 Wie 2,0 und mindestens ein Fuß schleift, aber noch keine vollständige Lähmung – Gewicht liegt schon auf den Vorderbeinen 3,0 Völlige Lähmung eines oder beider Hinterbeinen 3,5 Wie 3,0 und leichte Schwäche der Vorderbeine 4,0 Wie 3,0 und Schwächung der Vorderbeine (Bewegung noch möglich) – Allgemeinzustand schlechter 4,5 Völliger Mobilitätsverlust (alle Beine gelähmt) – allgemeiner Zustand schlecht 5,0 Sterben (evtl. einschläfern) 2.13. 3 H-Thymidin-Proliferationsassay Mit Hilfe des 3 H-Thymidin-Proliferationsassays ist es möglich die Proliferation von Zellen unter bestimmten Zellkulturbedingungen zu analysieren. Hierzu wird 3 H-Thymidin dem Kulturmedium zugesetzt und während der Proliferationsphase der Zellen als Nukleotid eingebaut. Die anschließend gemessene Stärke der Radioaktivität ist proportional zur Menge des eingebauten 3 H-Thymidins und damit proportional zur Proliferationsrate. Sechs Wochen alten, weiblichen SJL-Mäusen wird subkutan 200 µg PLP 139-151 -Peptid in den Oberschenkel injiziert. 10 Tage später werden die Tiere schmerzfrei getötet, die drainierenden Lymphknoten sowie die Milz entnommen und wie oben beschrieben (siehe II.2.8.2-3.) eine Zellsuspension aus Lymphknoten- bzw. Milzzellen hergestellt. Aus der Milzzellsuspension werden mittels Dichtegradienten (siehe II.2.3.) PBMC isoliert. Anschließend werden pro Depot jeweils 2 x 105 Lymphknotenzellen sowie aus der Milz isolierte PBMC in einer 96-Depot-Gewebekulturplatte mit Rundboden 72 Stunden lang in Zellkulturmedium (RPMI + 10 % FCS + Glutamin) bei 37ºC und 5 % CO2 inkubiert. Dem Medium wird zuvor entweder 10 µg PLP 139-151 -Peptid/ml oder 2 µg Concanavalin A/ml sowie Lipo-X in verschiedenen Konzentrationen wie folgt hinzugegeben: - Ansatz 1: Kontrolle Kulturmedium ohne Zusatz, - Ansatz 2: 10 µg PLP-Peptid, - Ansatz 3: 10 µg PLP-Peptid + 1 mg Lipo-X pro ml, - Ansatz 4: 10 µg PLP-Peptid + 0,2 mg Lipo-X pro ml, - Ansatz 5: 10 µg PLP-Peptid + 0,0004 mg Lipo-X pro ml, - Ansatz 6: 2 µg Con A pro ml, - Ansatz 7: 2 µg Con A pro ml + 1 mg Lipo-X pro ml, - Ansatz 8: 2 µg Con A pro ml + 0,2 mg Lipo-X pro ml, 32 II. Material und Methoden - Ansatz 9: 2 µg Con A pro ml + 0,0004 mg Lipo-X pro ml. Nach der 72-stündigen Inkubation wird pro Depot 0,5 µCi 3 H-Thymidin hinzugegeben, 16 Stunden lang bei 37ºC und 5 % CO2 inkubiert und die Zellen anschließend geerntet. Mit einem Wallac Microbeta beta-counter wird anschließend die Anzahl der radioaktiven Zerfälle (‚counts’) pro Depot bestimmt. 3. Statistik Für die statistische Berechnung wurde SPSS®-Software genutzt. Eingesetzt wurden folgende nicht parametrischen Tests: - der Wilcoxon-Rank-Test, - Mann-Whitney U Test - Student T-Test - Pearson Korrelationstest. 33 III. Patienten und Versuchstiere III. Patienten und Versuchstiere 1. Patienten des in vitro-Stimulationsversuchs mit Cop-1 – Vergleich MS-Patienten und gesunde Probanden Zur Durchführung der unter II.2.11. beschriebenen in vitro-Stimulationsversuche wurde 15 Patienten mit schubförmig verlaufender Multipler Sklerose einmalig Blut abgenommen. Alle 15 Patienten nahmen an der in der Neurologischen Uniklinik am St. Josef-Hospital Bochum durchgeführten offenen Phase III Therapie -Studie mit Copaxone teil (siehe Tab. 7). Tabelle Nr. 7 Ein- und Ausschlusskriterien der offenen Phase III Therapie -Studie mit Copaxone® Einschlusskriterien Ausschlusskriterien Alter der Patienten: 18-60 Jahre Schwangerschaft oder Stillzeit Geschlecht: männlich und weiblich möglich, Innere oder psychiatrische Erkrankungen, die die Frauen nur mit zuverlässiger Methode zur Fähigkeiten des Patienten zur Konzeptionsverhütung Einverständniserklärung beeinträchtigen Klinisch oder laborunterstützt gesicherte, Unfähigkeit, sich die Medikation selbst subkutan schubförmige remittierende Multiple Sklerose zu injizieren Bei Studienbeginn darf der Wert auf der Therapie mit Kortikosteroiden oder ‚Expanded Disability Status Scale’ (EDSS-Wert; adrenokortikotropem Hormon (ACTH) innerhalb siehe Tabelle) nicht größer als 6,0 sein der letzten 30 Tage vor Beginn der Therapie mit Copaxone® Krankheitssymptome können nicht durch andere Therapie mit Interferonen, anderen Erkrankungen begründet sein Prüfmedikamenten und/oder immunsuppressive Behandlung mit einer Chemotherapie oder einer Bestrahlung von lymphoidem Gewebe innerhalb Schriftliche Einverständniserklärung des Patienten der letzten 90 Tage vor Beginn der Therapie mit Copaxone® Den Patienten wurde das für die in vitro-Stimulationsversuche benötigte Blut nach Einschluss in die Therapiestudie, jedoch vor der ersten Injektion von Copaxone, abgenommen. Um Alters- und Geschlechtsbedingte immunologische Unterschiede auszuschließen, wurden 15 gesunde Probanden gleichen Alters und Geschlechts ausgewählt (siehe Tab. 8). 34 III. Patienten und Versuchstiere Folgende Ausschlusskriterien galten für die gesunden Probanden: - Anamnestisch überlieferte Krankheiten mit vermuteter bzw. nachgewiesener immunologischer Implikation, typischerweise aus dem allergischen, rheumatischen und dermatologischen Formenkreis wie auch chronisch entzündliche Darmerkrankungen, - Anamnestisch überlieferte Krankheiten unbekannter Ätiologie, - Einnahme von möglicherweise immunmodulierend wirkenden Medikamenten. Sowohl für Patienten als auch für gesunde Probanden galt weiterhin folgendes Ausschlusskriterium: - Klinisch manifeste, akute Infektionen zum Zeitpunkt der Blutabnahme, wie auch im Zeitraum von sechs Wochen vor bis zwei Wochen nach der Blutabnahme. Tabelle Nr. 8 Daten der Probanden des in vitro-Stimulationsversuchs mit Cop-1 MS Patienten Gesunde Probanden Alter 21-43 Jahre; ∅ 33,3 Jahre 21-43 Jahre; ∅ 33 Jahre Geschlecht 10 Frauen; 5 Männer 10 Frauen; 5 Männer Im Rahmen des in vitro-Stimulationsversuchs wurden die peripheren Blutzellen der MS-Patienten und gesunden Probanden mit Copaxone stimuliert und anschließend die Zytokin-Produktion (IL-2, IL-4, IL-10, INF-γ, TNF-α, TGF-β) sowie die Apoptoserate der Lymphozyten mittels Annexin V/PITechnik bestimmt. 2. Patienten der Untersuchung während der Therapie mit Cop-1 Im Rahmen der hier beschriebenen Verlaufsuntersuchung wurde das periphere Blut von 19 Patienten (siehe Tab. 9) mit schubförmig verlaufender MS untersucht. Alle 19 Patienten nahmen an der offenen Phase III Therapie Studie mit Copaxone in der neurologischen Uniklinik am St. Josef-Hospital Bochum teil. Zusätzlich zu den für die Therapiestudie geltenden Ein- und Ausschlusskriterien (siehe Tab. 7) durften die Patienten innerhalb eines Monats vor Therapiebeginn keine Infektionen oder andere Erkrankungen durchgemacht haben. Den Patienten wurde vor Therapiebeginn sowie im Abstand von 6 Wochen während des ersten Jahres der Therapie mit Copaxone für die Untersuchungen Blut abgenommen. 35 III. Patienten und Versuchstiere Tabelle Nr. 9 Daten der mit Copaxone® behandelten Patienten 19 Patienten Alter Geschlecht (in Jahren) (w = weiblich; EDSS EDSS (Studienbeginn) m = männlich) Verteilung Durchschnitt 22 - 44 12 w; 7 m (nach 1.Jahr Therapie mit Copaxone) 1,0 – 5,5 1,5 - 5,0 2,4 2,3 34,9 Tabelle Nr. 10 Zusammenfassung der ‚Expanded Disability Status Scale’ (EDSS) zur Bewertung der klinischen Symptome bei MS-Patienten nach Kurtzke (1983). Skalen-Wert Befund 0 ohne Befund 1 Keine Behinderung, abnorme Untersuchungsbefunde 2 Minimale Behinderung 3 Mäßiggradige Behinderung 4 Gehfähig ohne Hilfe mindestens 500 m 5 Gehfähig ohne Hilfe mindestens 200 m 6 Gehhilfe nötig um 100 m zu gehen 7 Rollstuhlpflicht (weniger als 5 m gehfähig) 8 Bett oder Rollstuhl, Hilfe bei der Körperpflege 9 Hilflos bettlägeriger Patient; erhaltene Kommunikations- und Essfähigkeit 10 Tod infolge Multiple Sklerose Folgende immunologische Parameter wurden bei diesen Patienten analysiert: - Der prozentuale Anteil IL-2, IL-4, IL-10, INF-γ, TNF-α, TGF-β produzierender Zellen, - die Apoptoserate der Lymphozyten, - der Anteil CD4-positiver T-Zellen, CD8-positiver T-Zellen und der jeweilige Aktivierungsgrad dieser Zelltypen. 36 III. Patienten und Versuchstiere 3. Versuchstiere Als Versuchstiere dienten Mäuse der Inzuchtstämme C3H/HeN, BALB/cJ Bom und SJL/N Bom der Firma M&B A/S (Dänemark) sowie SJL/J der Fa. Janvier (Frankreich). Die in den EAE-Versuchen eingesetzten Mäuse waren bei Krankheitsinduktion mindestens 6 und maximal 9 Wochen alt und weiblichen Geschlechts. 37 IV. Ergebnisse IV. Ergebnisse 1. Untersuchung verschiedener Modelle der murinen experimentellen autoimmunen Enzephalomyelitis Zur Untersuchung der immunologischen Wirkmechanismen von Cop-1 und Lipo-X war es zunächst notwendig ein bzw. mehrere geeignete Tiermodelle zu etablie ren. Hierzu wurden verschiedene EAEinduzierende Substanzen in Mäusen verschiedener Inzuchtstämme auf ihre Enzephalitogenität getestet. 1.1. Klinische Merkmale bei an EAE erkrankten Mäusen Die ersten Symptome einer Erkrankung mit einer experimentellen autoimmunen Enzephalomyelitis sind häufig Schwanzlähmungen und unsicherer Gang (Behinderungsgrad 0,5-1,5). Im weiteren Verlauf der Erkrankung kommt es zur leichten bis vollständigen Lähmung der hinteren Extremitäten (2-3,5). Aufsteigend sind bei einer weiteren Krankheitsverschlechterung auch die vorderen Extremitäten der Tiere betroffen (4-4,5). Dies kann zum Tod des Tieres führen (5). Kurz vor und zu Beginn eines akuten Krankheitsschubes beobachtet man häufig einen starken Gewichtsverlust. Das Fell der Tiere wird struppig und der Allgemeinzustand mit zunehmendem Behinderungsgrad schlechter. Häufig ist während der Lähmung der hinteren Extremitäten auch eine ausgeprägte Inkontinenz zu beobachten. Abb. 3: Gesunde Maus (im Vordergrund) und an EAE erkrankte SJL-Maus (im Hintergrund) 38 IV. Ergebnisse In Abb. 3 ist eine gesunde SJL-Maus mit normaler Schwanzhaltung und gutem Allgemeinzustand gezeigt sowie eine an EAE erkrankte Maus. Die EAE-Maus ist gut durch das struppige Fell, die gekrümmte Körperhaltung sowie die Schwanzlähmung zu erkennen. A B Abb. 4: Charakteristische Beinhaltung einer an EAE erkrankten Maus (A) und einer gesunden Maus (B) Ein weiteres, frühes Kennzeichen einer EAE-Erkrankung ist die in Abb. 4 dargestellte Beinhaltung der Mäuse. Hält man die Tiere am Schwanz, so streckt eine gesunde Maus reflexhaft ihre Hinterläufe nach außen (B). Eine EAE-Maus hingegen fasst häufig mit ihren Vorderbeinen an die zusammengelegten Hinterläufe (A). Zur besseren Darstellung der Krankheitssymptome sind im Anhang dieser Arbeit auf CD folgende Digitalfilme zu finden: - EAE 1,0 => ataktische Gangart - EAE 2,0-2,5 => eingeschränkte Mobilität der Hinterbeine - EAE 3 => starke Lähmung der Hinterbeine - EAE 4-4,5. => völliger Mobilitätsverlust. In Abb. 5 ist beispielhaft ein HE-gefärbter Gehirnschnitt einer an EAE erkrankten SJL-Maus im akuten Krankheitsschub dargestellt. Deutlich zu erkennen ist ein Entzündungsplaque (weißer Pfeil), der typischerweise in der Nähe eines Gefäßes liegt (schwarzer Pfeil). Mittels Fluoreszenzfärbung konnte festgestellt werden, dass es sich bei den meisten der im Entzündungsplaque befindlichen Lymphozyten vor allem um T-Helfer-Zellen handelte. 39 IV. Ergebnisse Abb. 5: HE-Färbung eines Gehirnschnitts einer SJL-Maus im akuten Krankheitsschub (mit einem schwarzen Pfeil gekennzeichnet ist ein Gefäß, mit einem weißen Pfeil gekennzeichnet ein Entzündungsplaque) 1.2. EAE bei Mäusen des Inzuchtstammes BALB/c Sechs bis acht Wochen alten, weiblichen Mäusen des Inzuchtstammes BALB/c wurde subkutan in die Flanke eines der in Tabelle Nr. 11 aufgeführten Peptide jeweils in Emulsion mit komplettem Freund’schem Adjuvans (CFA) gespritzt. Tabelle Nr. 11 Die bei Mäusen des Inzuchtstammes BALB/c eingesetzten Peptide bzw. Proteine Abkürzung Peptid/Protein Konzentration N MOG Myelin Oligodendrozyten Glykoprotein 35-55 Peptid 100 µg in 100 µl CFA 4 MBP Basisches Myelin Protein 87-99 Peptid 50 µg in 100 µl CFA 2 PLP Proteolipid Protein 139-151 Peptid ,Serin’ 100 µg in 100 µl CFA 4 40 IV. Ergebnisse PLP+PT s.o. 100 µg in 100 µl CFA + 4 je 200 ng Pertussis Toxin (i.p. Tag 0 und 2) Die Tiere aller Versuchsgruppen wurden jeden Tag untersucht und unter zu Hilfenahme der unter II.2.12. beschriebenen Skala zur Bewertung der EAE-Symptome bei Mäusen der Behinderungsgrad beurteilt. In den nachfolgenden Diagrammen ist der Krankheitsverlauf der einzelnen Versuchstiere bis zum Tag 30-35 nach Krankheitsinduktion dargestellt. MOG-T.4 MOG-T.3 MOG-T.2 Auslösung der EAE Behinderungsgrad 3 2 1 MOG-T.1 MBP-T.1 MBP-T.2 0 0 5 10 15 20 25 30 Tage Abb. 6: Darstellung des Krankheitsverlaufs von BALB/c-Mäusen, die nach Injektion von MOGoder MBP-Peptid an EAE erkrankten Wie in Abb. 6 dargestellt, zeigten die an MOG-induzierter EAE erkrankten Tiere einen leichteren Krankheitsverlauf als die an MBP-induzierter EAE erkrankten Versuchstiere. Keines der an MOGinduzierter EAE erkrankten Tiere zeigte hierbei eine Krankheitsaktivität die über einen Behinderungsgrad von 1,0 hinausging, ein Tier zeigte überhaupt keine Krankheitssymptome. Bei den an MBP-induzierter EAE erkrankten Tieren lag der höchste Behinderungsgrad bei 1,5. Das Tier zeigte damit deutliche motorische Einschränkungen im Bereich der hinteren Extremitäten. PLP-T.4 PLP-T.3 PLP-T.2 Auslösung der EAE Behinderungsgrad 3 2 1 PLP-T.1 0 0 5 10 15 20 25 30 Tage Abb. 7: Darstellung des Krankheitsverlaufs von BALB/c-Mäusen, die nach Injektion von PLPPeptid an EAE erkrankten 41 IV. Ergebnisse Abbildung 7 zeigt den Krankheitsverlauf der BALB/c-Mäuse nach EAE-Induktion mit PLP 139-151 Peptid. Die Krankheitsinduktion mit PLP-Peptid bewirkte einen schubförmigen Krankheitsverlauf. D.h. nach ca. 9-12 Tagen zeigten sich erste Krankheitssymptome, die zunächst stärker wurden und nach ca. 25-35 Tagen wieder zurückgingen. Der bei dieser Krankheitsinduktion bei BALB/c-Mäusen erreichte maximale Behinderungsgrad lag bei 2,0, was deutliche Lähmungserscheinungen der hinteren Extremitäten bedeutet. Die PLP-induzierte EAE zeigte damit die schwersten Krankheitssymptome der bei BALB/c-Mäusen getesteten Substanzen. Um den Krankheitsverlauf nach Induktion mit subkutan applizierten Substanzen unspezifisch zu verstärken, wird häufig eine zusätzliche, intraperitoneale Injektion mit Pertussis Toxin am Tag 0 und Tag 2 nach Krankheitsinduktion vorgenommen. In der vorliegenden Arbeit wurde diese zusätzliche Injektion von Pertussis Toxin (PT) bei PLP-induzierter EAE eingesetzt. PLP+PT-T.4 PLP+PT-T.3 PLP+PT-T.2 Auslösung der EAE Behinderungsgrad 3 2 1 PLP+PT-T.1 0 0 5 10 15 20 25 30 Tage Abb. 8: Darstellung des Krankheitsverlaufs von BALB/c-Mäusen, die nach Injektion von PLPPeptid (s.c.) und Pertussis Toxin (i.p.) an EAE erkrankten Wie in Abbildung 8 dargestellt unterschieden sich die Krankheitsverläufe der Mäuse mit zusätzlicher Pertussis Toxin Injektion nicht deutlich von denen der Tiere, denen nur PLP injiziert wurde. 1.3. EAE bei Mäusen des Inzuchtstammes C57BL/6 Sieben weiblichen, 6-8 Wochen alten Mäusen des Inzuchtstammes C57BL/6 wurde am Tag 0 100 µg des PLP 139-151 -Peptids in 100 µl CFA subkutan injiziert. Die Mäuse wurden täglich untersucht. Wie in Abb. 9 dargestellt, zeigte sich bei den Mäusen dieses Inzuchtstammes in den 35 Tagen nach Krankheitsinduktion nahezu keine Krankheitsaktivität. Die Tiere wurden noch sieben Monate lang weiter beobachtet, zeigten aber auch später keine deutlichen Krankheitssymptome. 42 Behinderungsgrad IV. Ergebnisse 1.Tier 2.Tier 3.Tier 4.Tier 5.Tier 6.Tier 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 7.Tier 1.0 0.5 0.0 0 5 10 15 20 25 30 35 Tage nach Injektion Abb. 9: Darstellung des Krankheitsverlaufs von C57BL/6-Mäusen nach Krankheitsinduktion mit PLP139-151 -Peptid 1.4. EAE bei Mäusen des Inzuchtstammes SJL/J 1.4.1. EAE-Induktion mit PLP-Peptid 13 weiblichen, sieben Wochen alten Mäusen des Inzuchtstammes SJL/J wurden jeweils 100 µg des PLP 139-151 -Peptids in 100 µl CFA subkutan in die Flanke injiziert. Die Tiere wurden bis zum 35. Tag nach Krankheitsinduktion täglich untersucht. Wie in den Abb. 10 und 11 dargestellt, erkrankte ein großer Teil der Tiere 10 bis 18 Tage nach Krankheitsinduktion schwer. Das am schwersten erkrankte Tier (Nr. 6) musste am 19. Tag bei einem Behinderungsgrad von 4,5 aus ethischen Gründen getötet werden. Das Tier litt unter einer Tetraplegie und war nicht mehr zur Nahrungsaufnahme fähig. Tier getötet 1.Tier 2.Tier 3.Tier 4.Tier 5.Tier 6.Tier Behinderungsgrad 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 0 5 10 15 20 25 30 35 Tage nach Injektion Abb. 10: Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit PLP139-151 -Peptid – Tier 1-6 43 IV. Ergebnisse 7.Tier 8.Tier 9.Tier 10.Tier 11.Tier 12.Tier 13.Tier Behinderungsgrad 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 0 5 10 15 20 25 30 35 Tage nach Injektion Abb. 11: Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit PLP139-151 -Peptid – Tier 7-13 Die Krankheit nahm bei den SJL/J -Mäusen nach EAE-Induktion mit PLP-Peptid einen meist primär schubförmigen Verlauf. Der erste Krankheitsschub begann mit sichtbaren Krankheitssymptomen um den Tag 10-18. Je nach individuellem Krankheitsverlauf verbesserten sich die Symptome nach einem unterschiedlich langen Zeitraum. Die Tiere zeigten zum Teil noch einen weiteren, meist milder verlaufenden zweiten Schub mit häufig nicht vollständiger Remission. Danach blieben die Tiere für einen längeren Zeitraum ohne neue, sichtbare Krankheitssymptome. Nach fünf bis sieben Monaten verschlechterte sich der Gesundheitszustand der Tiere schleichend und chronisch progredient und führte bei einigen Tieren sogar zum Tod (nicht dargestellt). 1.4.2. EAE-Induktion mit MBP-Peptid 6 weiblichen, sieben Wochen alten Mäusen des Inzuchtstammes SJL/J wurden jeweils 50 µg des MBP-Peptids in 100 µl CFA subkutan in die Flanke injiziert. Die Tiere wurden bis zum 38. Tag nach Krankheitsinduktion täglich untersucht. In Abb. 12 ist der Krankheitsverlauf der einzelnen Tiere dargestellt. 44 Behinderungsgrad IV. Ergebnisse 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 Tier 1 Tier 2 Tier 3 Tier 4 Tier 5 Tier 6 0 5 10 15 20 25 30 35 40 Abb. 12: Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit MBP-Peptid Die an MBP-induzierter EAE erkrankten SJL/J-Mäuse zeigten die ersten Krankheitssymptome bereits wenige Tage nach Krankheitsinduktion. Der Krankheitsverlauf war jedoch deutlich milder als bei den SJL-Mäusen, die an PLP-induzierter EAE erkrankt waren. Die Krankheitssymptome bildeten sich meist völlig zurück, und es konnte auch nach einigen Monaten kein chronisch progredienter Krankheitsverlauf beobachtet werden. 1.4.3. EAE-Induktion mit Rückenmarkshomogenat 5 weiblichen, sieben Wochen alten Mäusen des Inzuchtstammes SJL/J wurden jeweils 200 µl einer Emulsion aus CFA und Rückenmarkshomogenat (siehe II.2.8.6.) subkutan auf zwei verschiedene Stellen verteilt in die Flanke injiziert. Die Tiere wurden täglich bis zum 36. Tag nach Krankheitsinduktion untersucht. In Abb. 13 ist der Krankheitsverlauf der einzelnen Tiere dargestellt. Behinderungsgrad 5.0 4.5 5.Tier 4.Tier 3.Tier 2.Tier 1.Tier 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 0 5 10 15 20 25 30 35 Tage nach Injektion Abb. 13: Darstellung des Krankheitsverlaufs von SJL/J-Mäusen nach Krankheitsinduktion mit Rückenmarkshomogenat in Emulsion mit CFA (SCH = spinal cord homogenate) 45 IV. Ergebnisse Die Tiere zeigten ca. 10-15 Tage nach Krankheitsinduktion erste Symptome. Die Krankheit verlief schubförmig mit remittierendem Verlauf und der maximale Behinderungsgrad lag bei 2,5. 1.5. Vergleich der EAE-Modelle Um eine bessere Aussage über die jeweilige Krankheitsaktivität der verschieden induzierten EAEModelle in den drei Inzuchtstämmen treffen zu können, wurde der sogenannte ‚cumulative disease index’ (CDI) berechnet und in Abb. 14 für alle untersuchten Modelle dargestellt. Der CDI stellt die Summe der täglichen Behinderungsgrade (siehe II.2.12.) der ersten 34 Tage nach Krankheitsinduktion dar. 100 CDI 75 50 25 0 SJL/PLP SJL/SCH SJL/MBP C57BL6/PLP BALB/c-PLP BALB/c-PLP+PT BALB/c-MBP BALB/c- MOG Abb. 14: Darstellung der aus der Summe der täglichen Behinderungsgrade errechneten Gesamtbehinderungsindizes (cumulative disease index – CDI) der einzelnen Versuchstiere. Dargestellt sind die Einzelwerte und der Median. Die Darstellung der CDI in Abb. 14 zeigt, dass die in Mäusen des Inzuchtstammes SJL/J induzierten Formen der EAE zur stärksten Krankheitsaktivität führen. In C57BL/6-Mäusen konnte mit PLP nur eine sehr gering ausgeprägte EAE induziert werden, und auch in BALB/c-Mäusen war der Krankheitsverlauf in allen vier Fällen deutlich milder als bei SJL-Mäusen. Aufgrund dieser Ergebnisse wurden alle weiteren EAE-Versuche mit weiblichen SJL/J-Mäusen durchgeführt. Da sich die drei hier untersuchten, verschieden induzierten Modelle in ihren Krankheitsverläufen zum Teil erheblich unterscheiden: - PLP-Peptid-Induktion: primär schubförmig remittierend, sekundär chronisch progredient, - SCH-Induktion: schubförmig, - MBP-Peptid-Induktion: monophasisch schubförmig remittierend, wurden in den folgenden Versuchen mehrere dieser Modelle verwendet. 46 IV. Ergebnisse 2. Vergleich immunologischer Eigenschaften der verschiedenen Mäusestämme Die unter IV.1. beschriebenen Ergebnisse der Versuche zur Induktion einer EAE in Tieren verschiedener Mäusestämme zeigten, dass die Stärke der Erkrankung nicht nur von der auslösenden Substanz abhängt, sondern ebenso vom eingesetzten Mäusestamm. Die Mäuse der verschiedenen Inzuchtstämme unterscheiden sich genetisch bezüglich ihres MHCHaplotyps (siehe Tabelle Nr. 12), aber auch bezüglich einer nicht genau definierten Anzahl anderer genetisch-bedingter Eigenschaften. Tabelle Nr. 12 MHC-Haplotypen der verwendeten Mäusestämme Mäusestamm MHCHaplotyp SJL/J H-2s C57BL/6 H-2b BALB/c H-2d C3H/He H-2k Die Vermutung, dass der MHC-Haplotyp der Mäuse bei der Stärke der Krankheitsaktivität eine wichtige Rolle spielt, liegt nahe, da es auch bei Untersuchungen mit MS-Patienten ähnliche Ergebnisse gibt, die auf einen Zusammenhang zwischen Erkrankung und MHC-Typ hindeuten (Epplen 1997). Neben diesen genetischen Faktoren, die für die Schwere der Erkrankung von Bedeutung sein könnten, spielt sowohl bei der EAE als auch bei der Multiplen Sklerose das Immunsystem in jeder Phase der Erkrankung eine entscheidende Rolle. Daher wurden im folgenden zunächst vergleichende Untersuchungen des Immunsystems der Mäuse der verschiedenen Inzuchtstämme durchgeführt. Hierzu wurde jeweils 4-5 unbehandelten, gleichaltrigen, weiblichen Tieren der Inzuchtstämme SJL/J, BALB/c, C57BL/6 und C3H/HeN Blut abgenommen, die Milz sowie ein inguinaler Lymphknoten entnommen, die darin enthaltenen Lymphozyten gewonnen und mit spezifischen, monoklonalen Antikörpern (gegen T-, B-, CD4- und CD8-Zellen) angefärbt (siehe II.2.5.). Die prozentuale Anteil der einzelnen Lymphozytensubpopulationen wurde im Durchflusszytometer bestimmt. 47 IV. Ergebnisse periphere Blutzellen Lymphknotenzellen Milzzellen % Lymphozyten 100 75 50 25 0 SJL/J-PB Balb/c-PB C57Bl/6-PB C3H/NeH-PB SJL/J-Milz Balb/c-Milz C57Bl/6-Milz C3H/NeH-Milz SJL/LK Balb/LK C57Bl/6-LK C3H/NeH-LK Abb. 15: Prozentualer Anteil der T-Lymphozyten im Blut, in der Milz und in den Lymphknoten von Mäusen verschiedener Inzuchtstämme In Abb. 15 sind die prozentualen Anteile der T-Lymphozyten im Blut, in der Milz und im Lymphknoten einzelner Mäuse der verschiedenen Inzuchtstämme als Einzelwerte mit Median dargestellt. Es ist deutlich zu sehen, dass SJL/J-Mäuse vor allem im Blut, aber auch in der Milz, einen höheren Anteil von T-Lymphozyten hatten als die Tiere der drei anderen Inzuchtstämme. C57BL/6Mäuse, in denen es wie unter IV.1. beschrieben kaum möglich war eine EAE-Erkrankung zu induzieren, hatten dagegen im Vergleich zu den Mäusen der anderen Stämme einen besonders geringen Anteil von T-Lymphozyten in allen drei Kompartimenten. Im Vergleich zu den C57BL/6Tieren war der prozentuale Anteil der T-Lymphozyten im Blut von SJL-Mäusen im Mittel um 172 % , in der Milz um 119 % und im Lymphknoten um 22,5 % höher. Lymphknotenzellen Milzzellen periphere Blutzellen % Lymphozyten 75 50 25 0 SJL/J-PB Balb/c-PB C57Bl/6-PB C3H/NeH-PB SJL/J-Milz Balb/c-Milz C57Bl/6-Milz C3H/NeH-Milz SJL/J-LK Balb/c-LK C57Bl/6-LK C3H/NeH-LK Abb. 16: Prozentualer Anteil der T-Helfer-Zellen im Blut, in der Milz und in den Lymphknoten von Mäusen verschiedener Inzuchtstämme In Abb. 16 ist der prozentuale Anteil CD4-positiver Lymphozyten (= T-Helfer-Zellen, Th -Zellen) im Blut, in der Milz und in den Lymphknoten der Mäuse der vier verschiedenen Inzuchtstämme dargestellt. C57BL/6-Mäuse hatten in allen drei Kompartimenten den geringsten Anteil an T-HelferZellen. Im Vergleich dazu hatten SJL-Mäuse im Blut einen um 248 % und in der Milz einen um 135 % höheren Anteil T-Helfer-Zellen. Der prozentuale Anteil von Th -Zellen im Blut und in der Milz der 48 IV. Ergebnisse Tiere der Inzuchtstämme BALB/c und C3H/HeN lag zwischen dem der SJL- und C57BL/6-Mäuse. Im Lymphknoten war der Anteil der T-Helfer-Zellen bei SJL-, BALB/c- und C3H/HeN-Mäusen ähnlich hoch. Nur C57BL/6-Mäuse hatten auch hier einen wesentlich geringeren Anteil an Th -Zellen. % Lymphozyten Lymphknotenzellen Milzzellen periphere Blutzellen 40 30 20 10 0 SJL/J-PB Balb/c-PB C57Bl/6-PB C3H/NeH-PB SJL/J-Milz Balb/c-Milz C57Bl/6-Milz C3H/NeH-Milz SJL/J-LK Balb/c-LK C57Bl/6-LK C3H/NeH-LK Abb. 17: Prozentualer Anteil CD8-positiver Lymphozyten im Blut, in der Milz und in den Lymphknoten von Mäusen verschiedener Inzuchtstämme Wie in Abb. 17 dargestellt, war der prozentuale Anteil CD8-positiver Lymphozyten im Blut von SJLMäusen um mehr als 100% höher als der Anteil CD8-positiver Lymphozyten im Blut der Tiere der drei anderen Inzuchtstämme. In den Milzen war der Anteil an CD8-Zellen bei allen vier Mäusestämmen vergleichbar hoch. In den Lymphknoten war der Anteil CD8-positiver Lymphozyten bei Tieren der Stämme SJL und C57BL/6 sowie der, der Stämme BALB/c und C3H/HeN, jeweils vergleichbar hoch, aber bei SJL und C57BL/6 deutlich höher als bei den anderen beiden Stämmen. Ferner wurde der prozentuale Anteil an B-Lymphozyten im Blut, in der Milz und in den Lymphknoten von Tieren der vier Mäusestämme untersucht (Daten nicht dargestellt). Im Vergleich zu dem prozentualen Anteil an B-Lymphozyten von SJL-Mäusen lag der Anteil der B-Lymphozyten im Blut von C57BL/6-Mäusen um 53,5 %, in der Milz um 47 % und im Lymphknoten um 102 % höher. BALB/c-Mäuse hatten ebenfalls einen relativ hohen Anteil an B-Lymphozyten in allen drei Kompartimenten, wohingegen C3H/HeN eher einen geringeren Anteil an B-Lymphozyten aufwiesen. Zusammenfassend lässt sich sagen, dass sich die Mäuse der verschiedenen Inzuchtstämme in der Zusammensetzung der Lymphozytenpopulationen der Immunorgane Blut, Milz und Lymphknoten stark voneinander unterscheiden. Die besonders schwer an EAE erkrankenden Tiere des SJL-Stammes hatten deutlich mehr T-Lymphozyten, insbesondere mehr CD4-positive, aber auch CD8-positive Lymphozyten, und deutlich weniger B-Lymphozyten als die Tiere des C57BL/6-Stammes, in denen gar nicht oder nur schwer eine EAE induziert werden konnte. BALB/c-Mäuse lagen sowohl in der Schwere der EAE-Symptome als auch in der prozentualen Verteilung von T-, B-, CD4- und CD8Zellen zwischen SJL- und C57BL/6-Mäusen. 49 IV. Ergebnisse 3. Untersuchung der Wirkung von Lipo-X auf verschiedene Komponenten des Immunsystems Zunächst wurde untersucht, ob Lipo-X eine Wirkung auf die Auslösung oder die Schwere des Krankheitsverlaufs der EAE in Mäusen hat. 3.1. Untersuchungen mit an EAE erkrankten Mäusen 3.1.1. Ergebnisse des Therapieversuchs mit Lipo-X bei Mäusen des Inzuchtstammes BALB/c nach Krankheitsinduktion mit PLP-Peptid Pro Versuchsgruppe wurden jeweils vier weiblichen, sechs bis acht Wochen alten Mäusen des Inzuchtstammes BALB/c am Tag 0 zur Krankheitsinduktion 100 µg PLP 139-151 -Peptid in Emulsion mit CFA subkutan in die Flanke injiziert. Folgende Versuchsgruppen wurden gebildet: 1. keine Therapie = Kontrollgruppe, 2. ab Tag 0 jeden 2. Tag, 2 mg Lipo-X in 200 µl PBS gelöst i.p. injiziert, 3. ab Tag 5 jeden 2. Tag, 2 mg Lipo-X in 200 µl PBS gelöst i.p. injiziert. Die Tiere aller Versuchsgruppen wurden jeden Tag bis zum 37. Tag nach Krankheitsinduktion untersucht und mit Hilfe der unter II.2.12. beschriebenen Skala zur Quantifizierung der EAESymptome bei Mäusen der Behinderungsgrad beurteilt. In den folgenden Diagrammen sind die täglich gemessenen Behinderungsgrade dargestellt. 2.0 Tier 1 Behinderungsgrad Tier 2 Tier 4 1.5 1.0 0.5 0.0 0 5 10 15 20 25 30 35 40 Tage nach Krankheitsinduktion Abb. 18: Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen ohne Behandlung 50 IV. Ergebnisse Tier 3 dieser Versuchsgruppe starb am zweiten Tag nach Auslösung der EAE, ohne irgendwelche Krankheitssymptome gezeigt zu haben. Die übrigen drei Tiere zeigten deutliche Krankheitsmerkmale bis zu einem maximalen Behinderungsgrad von 1,5. Behinderungsgrad 2.0 Tier 1 Tier 2 Tier 3 1.5 Tier 4 1.0 0.5 0.0 0 5 10 15 20 25 30 35 40 Tage nach Krankheitsinduktion Abb. 19: Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen, die am Tag 0 (= Tag der EAE-Induktion) erstmalig mit Lipo-X behandelt worden waren Behinderungsgrad 2.0 Tier 1 Tier 2 Tier 3 Tier 4 1.5 1.0 0.5 0.0 0 5 10 15 20 25 30 35 40 Tage nach Krankheitsinduktion Abb. 20: Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen, die am Tag 5 nach EAE-Induktion erstmalig mit Lipo-X behandelt worden waren Die in Abb. 19 und 20 dargestellten Krankheitsverläufe nach Therapie mit Lipo-X zeigen, dass ebenfalls alle Versuchstiere an einer EAE erkrankten. Um einen besseren Vergleich zwischen den drei Versuchsgruppen ziehen zu können, wurde der sogenannte ‚cumulative disease index’-CDI berechnet und in Abb. 21 dargestellt. 51 IV. Ergebnisse 30 20 C DI 10 0 Kontrollgruppe Lipo-X Tag 0 Lipo-X Tag 5 Abb. 21: Darstellung des ‚cumulative disease index’-CDI der Tiere der drei Versuchsgruppen des Therapieversuchs mit Lipo-X in BALB/c-Mäusen. Einzelwerte und Median Wie Abb. 21 zeigt, ist der CDI der Tiere der Kontrollgruppe deutlich höher, als derjenige der Tiere, die mit Lipo-X ab dem Tag 0 behandelt worden waren. Diese Differenz ist nach Berechnung mit dem Mann-Whitney U-Test nur knapp nicht signifikant (p=0,057). Der Median der CDI der mit Lipo-X ab Tag 5 behandelten Tiere ist zwar auch niedriger als der Median der Kontrollgruppe, die Einzelwerte sind aber stärker gestreut (p=0,229). Dieses deutet daraufhin, dass ein möglichst frühzeitiger Therapiebeginn sich positiv auf die Therapie mit Lipo-X auswirkt, und das diese Therapie einen durchaus positiven Effekt auf den Krankheitsverlauf und die Schwere der Erkrankung bei an EAE erkrankten BALB/c-Mäusen hat. 3.1.2. Ergebnisse des Blindversuchs mit Lipo-X bei Mäusen des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid Aufgrund der unter IV.3.1.1. beschriebenen Ergebnisse des Therapieversuchs mit BALB/c-Mäusen wurde ein weiterer Therapieversuch mit PLP-induzierter EAE bei SJL/J-Mäusen durchgeführt. Das Modell der PLP-induzierten EAE in SJL-Mäusen wurde ausgewählt, da dieses Modell, wie in IV.1.4. dargestellt, die schwersten Krankheitsverläufe aller in dieser Arbeit untersuchten EAE-Modelle zeigte. Um eine subjektive Beeinflussung der Beurteilung der Krankheitsaktivität durch den Operator auszuschließen, wurde ein sogenannter Blindversuch durchgeführt. D.h. den Tieren einer Versuchsgruppe wurde eine unbekannte Substanz A, den Tieren einer anderen Versuchsgruppe eine unbekannte Substanz B intraperitoneal appliziert. Die Person, welche die Versuchstiere untersuchte, wusste auf diese Art und Weise nicht, welches Tier welche Substanz bekommen hatte. In diesem Versuch wurde ein prophylaktischer Ansatz gewählt, d.h. die Versuchstiere bekamen je 200 µl der Substanz A oder B bereits erstmalig neun Tage (Tag –9) vor Induktion der EAE intraperitoneal appliziert. Bis zum Ende des Untersuchungszeitraums am Tag 34 nach EAE-Induktion wurde den 52 IV. Ergebnisse Tieren jeden zweiten Tag Substanz A oder B appliziert. Am Tag 0 wurde die EAE durch subkutane Injektion von 100 µg PLP 139-151 -Peptid in Emulsion mit CFA induziert. In den nachfolgenden Diagrammen (Abb. 22 und 23) sind die Krankheitsverläufe der einzelnen Tiere der Versuchsgruppen bis zur Entblindung am Tag 34 nach Auslösung der EAE dargestellt. Behinderungsgrad 5 4 3 Tier 1 Tier 2 Tier 3 Tier 4 Tier 5 2 PLP/CFA Injektion s.c. 1 0 -10 -5 0 5 Behinderungsgrad 5 4 3 Tier 9 Tier 8 Tier 7 Tier 6 2 10 15 20 25 30 35 20 25 30 35 Versuchstage PLP/CFA Injektion s.c. 1 0 -10 -5 0 5 10 15 Versuchstage Abb. 22: Darstellung der Krankheitsverläufe bei an EAE erkrankten Tieren, die mit PBS behandelt worden waren Am 34. Tag nach Krankheitsinduktion wurde der Versuch entblindet: Substanz A = PBS, Substanz B = Lipo-X in PBS gelöst. Wie in Abb. 22 und 23 dargestellt ist der Krankheitsverlauf bei den mit Lipo-X behandelten Versuchstieren deutlich schwächer, als bei denen der Kontrolltiere. 53 IV. Ergebnisse Behinderungsgrad 5 Tier 5 Tier 4 Tier 3 Tier 2 Tier 1 4 3 2 1 0 -10 -5 Tier 6 Tier 7 Tier 8 Tier 9 Tier 10 5 Behinderungsgrad PLP/CFA Injektion s.c. 4 3 2 0 5 10 15 20 25 30 35 Versuchstage PLP/CFA Injektion s.c. 1 0 -10 -5 0 5 10 15 20 25 30 35 Versuchstage Abb. 23: Darstellung der Krankheitsverläufe bei an EAE erkrankten Tieren, die mit Lipo-X (ab Tag –9) behandelt worden waren Im folgenden Diagramm (Abb. 24) ist der CDI jedes einzelnen Versuchstiers dargestellt. Es zeigt sich ein deutlicher Unterschied bezüglich des CDI zwischen den mit PBS und den mit Lipo-X behandelten Tieren. Acht von zehn Versuchstiere, die mit Lipo-X behandelt worden waren, zeigten keinerlei Symptome einer EAE. CDI 25 20 15 verstorben am Tag 3 10 5 0 -5 PBS Lipo-X Abb. 24: Darstellung des aus der Summe der täglichen Behinderungsgrade errechneten CDI der Tiere der beiden Versuchsgruppen des Blindversuchs 54 IV. Ergebnisse Der CDI der mit Lipo-X behandelten Versuchstiere war statistisch signifikant niedriger als der CDI der mit PBS behandelten Tiere (p = 0,003, im Mann-Whitney U-Test). Ein Tier der Gruppe A (PBS; Tier Nr. 10) verstarb am Tag 3 nach Auslösung der EAE während der Ethernarkose. Da es sich in diesem Fall nicht um eine Wirkung der Substanz Lipo-X handeln kann, wurde das Tier bei der statistischen Berechnung nicht mit berücksichtigt. 3.1.3. Ergebnisse des Therapieversuchs mit Lipo-X in Mäusen des Inzuchtstammes SJL/J nach Krankheitsinduktion mit MBP-Peptid Im Folgenden wurde die therapeutische Wirksamkeit von Lipo-X in SJL-Mäusen nach Krankheitsinduktion mit MBP 87-99 -Peptid untersucht. Hierzu wurden 12 weiblichen, sieben Wochen alten Mäusen des Inzuchtstammes SJL/J jeweils 50 µg MBP-Peptid in 100 µl Emulsion mit CFA subkutan in die Flanke injiziert. Vier Tage später wurden sechs dieser Tiere das erstemal 2 mg Lipo-X in 200 µl PBS intraperitoneal injiziert. Die Lipo-X-Injektion wurde jeden 2. Tag wiederholt und die Tiere 35 Tage lang täglich untersucht. 40 CDI 30 20 10 0 Kontrolle Lipo -X Abb. 25: CDI der einzelnen Versuchstiere nach Krankheitsinduktion mit MBP-Peptid und Therapie mit Lipo-X; Einzelwerte und Median Wie in Abb. 25 dargestellt war der mittlere CDI der mit Lipo-X behandelten Tiere deutlich, aber nicht signifikant niedriger (p=0,065; Mann-Whitney U-Test) als der mittlere CDI der nicht therapierten Kontrolltiere. Zusammenfassend ist zu sagen, dass es in drei unterschiedlichen EAE-Modellen (1. PLP-Induktion in BALB/c-Mäusen, 2. PLP-Induktion in SJL-Mäusen, 3. MBP-Induktion in SJL-Mäusen) als Folge der Therapie mit Lipo-X zu einer Verbesserung der Krankheitssymptome bzw. zur Verhinderung der Entstehung von Krankheitssymptomen kam. 55 IV. Ergebnisse 3.2. In vitro Versuche mit Lipo-X Die unter IV.3.1. dargestellten Ergebnisse der Therapieversuche belegen die Wirksamkeit von Lipo-X bei der Behandlung der experimentellen autoimmunen Enzephalomyelitis. Im Folgenden wurde nun untersucht, ob und in wie weit die therapeutische Wirkung von Lipo-X auf immunologische Mechanismen zurückzuführen ist. 3.2.1. Untersuchungen der Zellproliferation sowie des apoptotischen Zelltods von Leukozyten nach Stimulation mit Lipo-X Sowohl die EAE als auch die MS gelten als T-Zell-vermittelte Autoimmunerkrankungen. Immunologische Parameter spielen sowohl bei der Auslösung als auch bei der Manifestation sowie Remission der Erkrankungen eine wichtige Rolle. Nach heutiger Lehrmeinung wird davon ausgegangen, dass in der Peripherie aktivierte Leukozyten ins zentrale Nervensystem gelangen und hier eine Entzündungsreaktion gegen ZNS-Komponenten einleiten. Im Rahmen der Gegenregulation eines Entzündungsprozesses spielt die Apoptose von Leukozyten eine wichtige Rolle. Im Folgenden wurde daher untersucht, ob und in wie weit Lipo-X eine Wirkung auf die Proliferation und Apoptose von Leukozyten hat. a. Proliferationsassay mit 3 H-Thymidin Mit Hilfe des 3 H-Thymidin-Proliferationsassays (siehe II.2.13.) wurde die Proliferation von Lymphknoten- und Milzzellen nach spezifischer Stimulation mit PLP-Peptid bzw. nach unspezifischer Stimulation mit Con A sowie die Wirkung von Lipo-X in verschiedenen Konzentrationen auf die Proliferation der Zellen analysiert. In Abb. 26 sind die Ergebnisse des Versuchs nach Inkubation mit dem PLP 139-151 -Peptid dargestellt. Es fällt auf, dass die Wirkung von Lipo-X auf die Proliferation der Zellen nach Stimulation mit PLPPeptid konzentrationsabhängig ist. Nach Inkubation der Lymphknoten- bzw. der Milzzellen mit 1 mg Lipo-X pro ml Kulturmedium wird die Proliferation der PLP-spezifischen Zellen gehemmt, wohingegen nach Inkubation mit den niedrigeren Konzentrationen Lipo-X die Proliferationsrate der PLP-spezifischen Zellen sehr deutlich ansteigt. 56 7000 3000 6000 2500 5000 2000 4000 H-Thymidine 3500 1500 2000 3 1000 3000 3 H-Thymidin IV. Ergebnisse 1000 500 0 0 Medium1 Medium2 1 mg/ml 0,2 mg/ml Medium1 0,004 mg/ml Medium2 1 mg/ml 0,2 mg/ml 0,004 mg/ml Lipo -X Lipo-X PLP (10 µg/ml) PLP (10 µg/ml) B A Abb. 26: Messung des 3 H-Thymidin-Einbaus nach Inkubation von Lymphknoten-Zellen (A) und Milz-Zellen (B) mit PLP-Peptid und Lipo-X (Medium 1 = Kontrolle nur Kulturmedium; 25000 40000 20000 H-Thymidine (counts) 50000 30000 10000 3 20000 15000 3 H-Thymidine uptake (counts) Medium 2 = Kontrolle mit PLP-Peptid) 10000 5000 0 0 Medium1 Medium2 1 mg/ml 0,2 mg/ml 0,004 mg/ml Medium1 Lipo -X Medium2 1 mg/ml 0,2 mg/ml 0,004 mg/ml Lipo-X ConA (2 µg/ml) ConA (2 µg/ml) A B Abb. 27: Messung des 3 H-Thymidin-Einbaus nach Inkubation von Lymphknoten-Zellen (A) und Milz-Zellen (B) mit Con A und Lipo-X (Medium 1 = Kontrolle nur Kulturmedium; Medium 2 = Kontrolle mit Con A) Wie in Abb. 27 dargestellt, ist auch die Wirkung von Lipo-X auf die Proliferation von unspezifisch mit Con A aktivierten Zellen konzentrationsabhängig. Nach Inkubation der Lymphknoten- und Milzzellen mit Lipo-X in der höchsten hier eingesetzten Konzentration (1 mg/ml) wurde eine sehr deutliche Hemmung der Proliferation der mit Con A stimulierten Zellen beobachtet. Nach Inkubation mit den niedrigeren Konzentrationen von Lipo-X (0,2 bzw. 0,0004 mg/ml) gab es einen leichten 57 IV. Ergebnisse Anstieg der Proliferationsrate der mit Con A-stimulierten Lymphknotenzellen und eine leichte Hemmung der Proliferation der Milzzellen nach Stimulation mit Con A. b. Messung des apoptotischen Zelltods mittels Annexin V/Propidiumjodid-Technik und TUNELMethode Je 2 x 105 Zellen einer, wie unter II.2.8.2. beschrieben, hergestellten Milzzellsuspension (Milz einer adulten, weiblichen SJL/J-Maus) wurden in 1 ml RPMI-Medium mit 5 % FCS 24 bzw. 48 h lang im Brutschrank bei 37°C und 5 % CO2 in sterilen FACS-Röhrchen inkubiert. Die im folgenden aufgeführten Mengen von Lipo-X wurden den Ansätzen zugesetzt: - Medium-Kontrolle: ohne Lipo-X, - 0,1 µg, 0,5 µg, 2 µg, 10 µg, 50 µg sowie 200 µg Lipo-X pro Ansatz. Nach 24 und 48 Stunden wurde mit Hilfe der Annexin V/Propidiumjodid-Methode (siehe II.2.2.3.) sowie mittels TUNEL-Methode (siehe II.2.2.2.) der Anteil derjenigen Milzzellen bestimmt, die apoptotisch wurden. In beiden Fällen konnte weder nach 24 noch nach 48 Stunden Inkubation mit Lipo-X eine Zunahme oder Abnahme des prozentualen Anteils apoptotischer Lymphozyten in der Zellsuspension im Vergleich zur Mediumkontrolle (Daten nicht dargestellt) beobachtet werden. 3.2.2. Untersuchung der Zytokinproduktion von Leukozyten nach Stimulation mit Lipo-X Zytokine vermitteln zahlreiche Interaktionen zwischen den Zellen des Immunsystems. Bei der Vermittlung des Entzündungsprozesses bei einer Enzephalomyelitis scheinen sie von entscheidender Bedeutung zu sein. Aus diesem Grund wurde die Wirkung von Lipo-X auf die Zytokin-Produktion von Leukozyten in vitro untersucht. Je 50 µl Vollblut einer weiblichen adulten SJL-Maus wurden 24 bzw. 48 h lang in 1 ml Kulturmedium (RPMI+5 % FCS) zusammen mit Lipo-X in folgenden Konzentrationen im Brutschrank (37 C, 7 % CO2 ) inkubiert: ohne Lipo-X (Mediumkontrolle), 0,1 µg, 0,5 µg, 2 µg, 10 µg, 50 µg bzw. 200 µg. Anschließend wurde mit Hilfe eines CBA-Testsystems (siehe II.2.6.) die Konzentration von Interleukin-2 (IL-2), IL-4, IL-5, TNF-α und IFN-γ im Zellkulturüberstand bestimmt. Die Konzentration der Th2-typischen Zytokine IL-4 und IL-5 blieb in allen Ansätzen, sowohl nach 24 als auch nach 48 Stunden Inkubation unverändert, unterhalb des Detektionslimits des Testsystems (10 pg/ml)(Daten nicht dargestellt). Ferner wurde nach Inkubation mit Lipo-X in keinem der Versuchsansätze eine erhöhte Konzentration des auch als T-Zell-Wachstumsfaktor bekannten IL-2 gemessen. 58 IV. Ergebnisse 20 pg/ml 15 10 5 0 o. Dex 0,1 µg 0,5 µg 2 µg 10 µg 50 µg 200 µg o. Dex 0,1 µg 0,5 µg 2 µg 10 µg 50 µg 200 µg 48 h 24 h Abb. 28: Interferon-γγ Konzentration im Zellkulturüberstand von murinen peripheren Blutzellen nach Stimulation mit Lipo-X In Abb. 28 sind die nach 24- bzw. 48-stündiger Inkubation mit Lipo-X im Zellkulturüberstand gemessenen IFN-γ Konzentrationen dargestellt. Nach 24-stündiger Inkubation mit 0,1 µg, 0,5 µg und 2 µg Lipo-X war zwar ein leichter Anstieg der IFN-γ Konzentration zu beobachten, diese Werte lagen jedoch alle in der Nähe des Detektionslimits des Testsystems. 100 pg/ml 75 50 25 0 o. Dex 0,1 µg 0,5 µg 2 µg 10 µg 24 h 50 µg 200 µg o. Dex 0,1 µg 0,5 µg 2 µg 10 µg 50 µg 200 µg 48 h Abb. 29: TNF-α α Konzentration im Zellkulturüberstand von murinen peripheren Blutzellen nach Stimulation mit Lipo-X Wie in Abb. 29 dargestellt, stieg die TNF-α Konzentration im Kulturüberstand peripherer Blutzellen nach 24-stündiger Inkubation mit 0,1 µg, 0,5 µg, 2 und 10 µg Lipo-X im Vergleich zur TNF-α Konzentration der Mediumkontrolle deutlich an. Bei höheren Konzentrationen (50 und 200 µg) von 59 IV. Ergebnisse Lipo-X kam es allerdings zu einer Abnahme der TNF-α Konzentration. Nach 48 h stieg die TNF-α Konzentration im Versuchsansatz ohne Zugabe von Lipo-X, nur mit Kulturmedium (RPMI+5 % FCS) auf 75 pg/ml an. Der Zellkulturüberstand des Versuchsansatzes mit 10 µg Lipo-X enthielt nach 48 h noch mehr TNF-α als die Mediumkontrolle, alle anderen Ansätze lagen jedoch deutlich darunter. Vor allem die mit 200 µg Lipo-X inkubierten Zellen produzierten deutlich weniger TNF-α als die nur mit Kulturmedium inkubierten Zellen. 3.3. Untersuchungen der Wirkung von Lipo-X auf das Immunsystem naiver Mäuse Um die Wirkungsweise von Lipo-X auf Komponenten des Immunsystems besser zu verstehen sind neben den in vitro-Untersuchungen auch in vivo-Untersuchungen von Interesse. Im Folgenden sind die Ergebnisse der immunologischen Untersuchungen an gesunden adulten Mäusen dargestellt, denen Lipo-X injiziert worden war. Insgesamt 15 weiblichen SJL-Mäusen wurden jeweils 2 mg Lipo-X in 200 µl PBS gelöst intraperitoneal an den Tagen 0, 2 und 4 injiziert. Jeweils einen Tag nach der Lipo-X-Injektion (1. Tag, 3. Tag und 5. Tag nach der 1. Lipo-X-Injektion) wurden 5 Tiere getötet, Blut und Milz entnommen und eine Peritoneal-Spülung durchgeführt. Zur Kontrolle dienten drei gleichaltrige SJL-Mäuse, denen keinerlei Substanz injiziert wurde. Wie unter II.2.5. beschrieben, wurden in den gewonnenen Zellsuspensionen (Blut, Milzzellsuspension, Peritoneal Exudate Cells) der prozentuale Anteil T-, B-, CD4- und CD8-Zellen, sowie Granulozyten und Monozyten durchflusszytometrisch bestimmt. % Lymphozyten 80 60 40 20 0 Blut/Kontr. Blut/1.Tag Blut/3.Tag Blut/5.Tag Milz/Kontr. Milz/1.Tag Milz/3.Tag Milz/5.Tag PEC/Kontr. PEC/1.Tag PEC/3.Tag PEC/5.Tag Abb. 30: Prozentualer Anteil der T-Lymphozyten im Blut, in der Milz- und der Peritoneal (PEC)-Zellsuspension am 1., 3. und 5. Tag nach der ersten i.p. Injektion von Lipo-X. Dargestellt sind die Einzelwerte, sowie der jeweilige Median In Abb. 30 ist der prozentuale Anteil der T-Lymphozyten nach intraperitonealer Injektion von Lipo-X dargestellt. Bereits einen Tag nach der ersten Lipo-X-Injektion war ein Anstieg des prozentualen Anteils der T-Lymphozyten in der durch Peritoneal Spülung gewonnenen Zellsuspension zu beobachten. Im Vergleich zum Anteil der T-Lymphozyten der Kontrolltiere stieg der Anteil der T- 60 IV. Ergebnisse Lymphozyten der am ersten Tag nach der ersten Lipo-X Injektion gewonnenen Peritoneal Exudate Cells (PEC) im Mittel um 86,8 % an, nach drei Tagen um 66,7 % und nach fünf Tagen um 121,4 %. % Lymphozyten 100 75 50 25 0 Blut/Kontr. Blut/1.Tag Blut/3.Tag Blut/5.Tag Milz/Kontr. Milz/1.Tag Milz/3.Tag Milz/5.Tag PEC/Kontr. PEC/1.Tag PEC /3.Tag PEC/5.Tag Abb. 31: Prozentualer Anteil der B-Lymphozyten im Blut, in der Milz- und PeritonealZellsuspension am 1., 3. und 5. Tag nach der ersten i.p. Injektion von Lipo-X Wie in Abb. 31 dargestellt, war der prozentuale Anteil der B-Lymphozyten in der durch Peritoneal Spülung gewonnenen Zellsuspension erheblich höher als im Blut und in der Milz von SJL-Mäusen. Initial, d.h. einen Tag nach der ersten Lipo-X-Injektion, sank der Anteil der B-Lymphozyten bei den PEC, stieg aber nach drei bzw. fünf Tagen wieder an. Der prozentuale Anteil CD4-positiver Lymphozyten blieb im Blut und in der Milz der mit Lipo-X behandelten Tiere im Vergleich zu dem der Kontrolltiere unverändert (Daten nicht dargestellt). Allerdings stieg der Anteil der Th -Zellen bei den PEC von 6,4 % (angegeben ist jeweils der Mittelwert) bei den Kontrolltieren auf 12,2 % am ersten Tag nach der ersten Lipo-X-Injektion, 10,6 % am dritten Tag und 14,5 % am fünften Tag. Auch bei dem prozentualen Anteil an CD8-Zellen fanden sich in den drei Kompartimenten keinerlei Unterschiede, jedoch fiel auf, dass bei allen Versuchstieren, einschließlich der Kontrolltiere, der Anteil CD8-positiver Lymphozyten bei den Peritonealzellen mit ca. 2 % äußerst niedrig war (Daten nicht dargestellt). Während der durchflusszytometrischen Messung der mittels Peritoneal Spülung gewonnenen Leukozyten fiel bei der Auftragung der gemessenen Vorwärts- und Seitwärtsstreuung des Lichts durch die Zellen, bei denen Größe und Granularität der gemessenen Leukozyten erfasst werden, eine deutliche Veränderung der Zellpopulationen auf. In Abb. 32 sind die Streulichteigenschaften der PEC der Kontrolltiere (A) sowie der Versuchstiere nach einem (B) und nach fünf Tagen (C) nach der ersten Lipo-X-Injektion dargestellt (SSC/FSC, die jeweils links aufgetragenen Diagramme). 61 IV. Ergebnisse rot gefaerbte Zellen R1 A. Kontrolle B. 1. Tag nach i.p. Injektion R2 gruen gefaerbte Zellen C. 5. Tag nach i.p. Injektion Abb. 32: Wirkung der intraperitonealen Injektion von Lipo-X auf die Streu-Eigenschaften der durch Peritoneal-Spülung gewonnenen Zellpopulationen In der rechten Spalte wurde die jeweilige Fluoreszenzintensität der Zellen nach Markierung mit dem Fluoreszein-markierten anti-Granulozyten Antikörpern dargestellt. Bei den unbehandelten Kontrolltieren (A) fand sich im Peritoneum eine Zellpopulation (rot gefärbt) bestehend aus großen, kompakten bzw. granulären Zellen, die durch den verwendeten Antikörper schwach markiert wurden. Fünf Tage (C) nach der ersten Injektion war der Anteil dieser Zellen erheblich zurückgegangen 62 IV. Ergebnisse zugunsten einer Population deutlich kleinerer granulärer Zellen (grün gefärbt). Diese Zellen wurden von dem Anti-Granulozyten-Antikörper stark markiert. Am ersten Tag nach der ersten Injektion mit Lipo-X (B) konnten beide Zellpopulationen, sowohl in der Darstellung der Streulichteigenschaften als auch nach Fluoreszenzmarkierung, nachgewiesen werden. Der verwendete Antikörper markiert das Molekül Ly6G, das sich u.a. in geringen Mengen auf der Oberfläche von Eosinophilen und Monozyten findet und in großen Mengen auf der Zelloberfläche von basophilen und neutrophilen Granulozyten. Zur weiteren Charakterisierung der PEC wurde eine Färbung nach Pappenheim durchgeführt (siehe II.2.10). Abb. 33: Ausstrich der PEC einer unbehandelten adulten SJL-Maus, Färbung nach Pappenheim. Einige Monozyten sind mit roten Pfeilen gekennzeichnet In Abb. 33 ist ein Ausstrich der durch Peritoneal Spülung gewonnenen Zellen einer unbehandelten Maus nach Pappenheim-Färbung dargestellt. Man sieht zahlreiche kleine, schwarz gefärbte, mononukleäre Zellen, bei denen es sich um Lymphozyten handelt, sowie wenige große, schwarz gefärbte, mononukleäre Zellen (=Monozyten). Vereinzelt fanden sich ferner violett gefärbte, kleine Zellen, bei denen es sich um Granulozyten handelt. 63 IV. Ergebnisse Abb. 34: Ausstrich der PEC einer adulten SJL-Maus nach intraperitonealer Injektion von Lipo-X, Färbung nach Pappenheim. Einige Granulozyten sind mit roten Pfeilen gekennzeichnet In Abb. 34 ist ein nach Pappenheim gefärbter Ausstrich von PEC einer Maus nach Injektion von LipoX dargestellt. Deutlich erkennbar ist der große Anteil violett gefärbter Granulozyten. Die quantitative Auswertung des Anteils der Monozyten und Granulozyten erfolgte durch Analyse der durchflusszytometrischen Daten (siehe Abb. 35 und 36). 40 % 30 20 10 0 Blut/Kontr. Blut/1.Tag Blut/3.Tag Blut/5.Tag Milz/Kontr. Milz/1.Tag Milz/3.Tag Milz/5.Tag PEC/Kontr. PEC/1.Tag PEC/3.Tag PEC/5.Tag Abb. 35: Prozentualer Anteil der Monozyten im Blut, in der Milz- und in der PeritonealZellsuspension am 1. ,3. und 5. Tag nach der ersten i.p. Injektion mit Lipo-X 64 IV. Ergebnisse 30 % 20 10 0 Blut/Kontr. Blut/1.Tag Blut/3.Tag Blut/5.Tag Milz/Kontr. Milz/1.Tag Milz/3.Tag Milz/5.Tag PEC/Kontr. PEC/1.Tag PEC/3.Tag PEC/5.Tag Abb. 36: Prozentualer Anteil der Granulozyten im Blut, in de r Milz- und in der Peritoneal Zellsuspension am 1. ,3. und 5. Tag nach der ersten i.p. Injektion mit Lipo-X Der prozentuale Anteil der Monozyten im Peritoneum von Versuchstieren nahm, wie in Abb. 35 dargestellt, nach peritonealer Injektion von Lipo-X deutlich ab. Diese Wirkung des Lipo-X war bereits am ersten Tag nach der ersten Injektion sichtbar, wurde aber im Laufe der Zeit immer deutlicher. Die Abnahme des Anteils der Monozyten nach Injektion von Lipo-X war nach fünf Tagen signifikant (p=0,036). Noch beeindruckender war die in Abb. 36 dargestellte Zunahme des prozentualen Anteils der Granulozyten im Peritoneum von Versuchstieren nach Injektion von Lipo-X. Der Anteil der Granulozyten erhöhte sich von im Mittel 0,33 % bei den Kontrolltieren auf 3,15 % am ersten Tag (p=0,036), 14,33 % am dritten Tag (p=0,057) und 16,41 % (p=0,036) am fünften Tag nach der ersten Lipo-X-Injektion. Neben der durchflusszytometrischen Untersuchung der verschiedenen Zellpopulationen wurde eine intrazelluläre Zytokin-Färbung der aus dem Blut, der Milz und dem Peritoneum der Kontrolltiere bzw. der Versuchstiere nach Lipo-X-Injektion gewonnenen Zellen durchgeführt (siehe II.2.4.). % Lymphozyten 15 10 5 0 Blut/Kontr. Blut/1.Tag Blut/3.Tag Blut/5.Tag Milz/Kontr. Milz/1.Tag Milz/3.Tag Milz/5.Tag PEC/Kontr. PEC/1.Tag PEC/3.Tag PEC/5.Tag Abb. 37: Prozentualer Anteil Interferon-γγ produzierender Lymphozyten im Blut, in der Milzund in der PEC-Zellsuspension am 1. ,3. und 5. Tag nach der ersten i.p. Injektion mit Lipo-X. Einzelwerte und Median 65 IV. Ergebnisse Es wurde jeweils der Anteil der Interferon-γ- (Abb. 37) sowie der Interleukin-4- (Daten nicht dargestellt) produzierenden Lymphozyten ermittelt. Der prozentuale Anteil IL-4-produzierender Zellen nach Lipo-X-Injektion unterschied sich in allen drei Immunorganen nicht von dem der Kontrolltiere. Wie in Abb. 37 dargestellt, stieg der Anteil der IFN-γ produzierenden Lymphozyten sowohl in der Milz als auch bei den PEC nach Injektion von Lipo-X an. 66 IV. Ergebnisse 4. Untersuchung der Wirkung von Cop-1 auf verschiedene Komponenten des Immunsystems Die therapeutische Wirkung von Cop-1 (Copolymer-1, Glatiramerazetat, Copaxone®) bei der Behandlung der Multiplen Sklerose ist bekannt und in Patienten-Studien bewiesen. Cop-1 ist in mehreren Ländern bereits als Medikament zur Therapie der schubförmig verlaufenden Multiplen Sklerose zugelassen. Aus diesem Grunde wurden zunächst keine Therapie -Versuche mit Cop-1 bei an EAE erkrankten Tieren durchgeführt, sondern das Hauptaugenmerk auf die bisher nur in Ansätzen verstandene immunologische Wirkungsweise von Cop-1 gesetzt. 4.1. In vitro Versuche mit Cop-1 In in vitro-Untersuchungen wurde die Wirkung einer Stimulation mit Cop-1 auf die Apoptoserate sowie auf die Zytokinproduktion von Leukozyten analysiert. 4.1.1. Untersuchungen des apoptotischen Zelltodes nach Stimulation mit Cop-1 Einer adulten weiblichen Maus des Inzuchtstammes SJL/J wurde die Milz steril entnommen und eine Milzzellsuspension hergestellt (siehe II.2.8.2). Je 1 x 106 Leukozyten wurden in 1 ml RPMI-Medium mit 5 % FCS 24 h lang im Brutschrank bei 37 ºC, 5 % CO2 und 98 % Luftfeuchtigkeit inkubiert. Folgende Konzentrationen an Cop-1 wurden hinzugegeben: 1. Medium-Kontrolle ohne Cop-1 Zugabe, 2. 0,5 µg Cop-1, 3. 2 µg Cop-1, 4. 10 µg Cop-1. Mit Hilfe der Annexin V/Propidiumjodid-Methode (siehe II.2.2.3.) wurde nach 24 h der apoptotische Zelltod der Lymphozyten analysiert. Prozentualer Anteil Annexin V markierter Zellen nach 24h Inkubation Prozentualer Anteil Propidiumjodid markierter Zellen nach 24h Inkubation 30 % Lymphozyten % Lymphozyten 100 75 50 25 0 ohne Zusatz 0,5 µg Cop 2 µg Cop 10µg Cop 20 10 0 ohne Zusatz 0,5 µg Cop 2 µg Cop 10µg Cop Abb. 38: Darstellung der Annexin V bzw. Propidiumjodid markierten Lymphozyten nach 24stündiger Inkubation mit Cop-1 67 IV. Ergebnisse Wie in Abb. 38 dargestellt, war der Anteil Annexin V-positiver Zellen bereits nach 24 Stunden bei der Mediumkontrolle sehr hoch und nach Inkubation mit Cop-1 in den verschiedenen Konzentrationen nicht signifikant verändert. Der prozentuale Anteil Propidiumjodid-markierter Zellen hingegen stieg nach Inkubation mit Cop-1 in Abhängigkeit von der Cop-1-Konzentration deutlich an. Propidiumjodid ist ein DNA-Farbstoff, der nekrotische Zellen, deren Zellmembran beschädigt ist, markiert. Da die apoptotischen Zellen (Annexin V-positiv, Propidiumjodid-negativ) in dieser Zellkultur nicht oder kaum phagozytiert werden können, geht die Apoptose der Zellen in eine Nekrose mit Integritätsverlust der Zellmembran über. Der Anstieg des Anteils Propidiumjodid markierter Zellen lässt daher keinen eindeutigen Schluss darauf zu, ob es sich hierbei um Zellen handelt, die eines nekrotischen oder apoptotischen Zelltodes gestorben sind. Interessant ist je doch das der Anteil toter Lymphozyten nach Inkubation mit Cop-1 deutlich zunimmt. 4.1.2. Untersuchungen der Zytokinproduktion von Leukozyten nach Stimulation mit Cop-1 Die Ergebnisse verschiedener Studien (Miller 1998, Neuhaus 2000) deuten daraufhin, dass Cop-1 eine Wirkung auf die Produktion von Zytokinen hat. Aus diesem Grund wurde zunächst in einem in vitroExperiment der Einfluss von Cop-1 auf die Produktion verschiedener Zytokine durch Leukozyten untersucht. Je 50 µl Vollblut einer weiblichen adulten SJL-Maus wurden 24 bzw. 48 h lang in 1 ml Kulturmedium (RPMI + 5 % FCS) zusammen mit folgenden Konzentrationen an Cop-1 im Brutschrank (37°C, 98 % Luftfeuchtigkeit, 5 % CO2 ) inkubiert: ohne Cop-1 (Mediumkontrolle), mit 0,5 µg, 2 µg bzw. 10 µg Cop-1. Anschließend wurde mit Hilfe eines CBA-Testsystems (siehe II.2.6.) die Konzentration von Interleukin-2 (IL-2), IL-4, IL-5, TNF-α und IFN-γ im Zellkulturüberstand bestimmt. In Abb. 39 sind die Ergebnisse der Messung der TNF-α-Konzentration nach Stimulation von Vollblut mit Cop-1 dargestellt. Bereits nach 24 h stieg die Konzentration von TNF-α in Abhängigkeit von der eingesetzten Menge Cop-1 im Vergleich zu derjenigen der Mediumkontrolle deutlich an. Auch nach 48 Stunden war dieser Effekt noch zu beobachten, nur dass hier die Mediumkontrolle eine deutlich höhere Konzentration von TNF-α aufwies. 68 IV. Ergebnisse 300 pg/ml 200 100 0 o. Cop - 24h 0,5 µg - 24 h 2 µg - 24h 10 µg - 24 h o. Cop - 48h 0,5 µg - 48h 2 µg - 48h 10 µg - 48h Abb. 39: TNF-α α Konzentration im Zellkulturüberstand von murinen Milzzellen nach Stimulation mit Cop-1 Die Konzentration der Th2-typischen Zytokine IL-4 und IL-5 sowie der Th1-typischen Zytokine IL-2 und IFN-γ blieb sowohl in der Mediumkontrolle als auch bei allen eingesetzten Cop-1Konzentrationen nach 24 und 48 Stunden Inkubation unverändert unterhalb des Detektionslimits des Testsystems (5-10 pg/ml)(Daten nicht dargestellt). 4.2. Untersuchungen der Wirkung von Cop-1 auf das Immunsystem naiver Mäuse Um die Wirkung der subkutanen Injektion von Cop-1 auf zelluläre Komponenten des Immunsystems zu untersuchen, wurde Mäusen verschiedener Inzuchtstämme (BALB/c, C57BL/6, SJL/J), die sich, wie unter IV.2. beschrieben, zum Teil erheblich in der Verteilung der Lymphozytenpopulationen in den Immunorganen unterscheiden, Cop-1 injiziert und im Abstand von einigen Tagen Blut, drainierende Lymphknoten und Milz entnommen. Die anschließend hergestellten Zellsuspensionen (siehe II.2.8.1.bis 3.) wurden durchflusszytometrisch untersucht. Es wurde jeweils der Anteil von T-, B- und NK-Zellen sowie von CD4- und CD8-positiven Lymphozyten bestimmt (siehe II.2.5.). Im Folgenden sind die wichtigsten Ergebnisse dieser Untersuchungen zusammengefasst. 4.2.1. Untersuchungen der Wirkung von Cop-1 auf das Immunsystem von Mäusen des Inzuchtstammes BALB/c Insgesamt 12 weiblichen adulten Mäusen des Inzuchtstammes BALB/c wurden je 100 µg Cop-1 subkutan in den Oberschenkel injiziert. Wie Vorversuche gezeigt haben (hier nicht dargestellt) ist bei subkutaner Injektion in den Oberschenkel der inguinale Lymphknoten der diesen Bereich drainierende. Aus diesem Grunde wurde bei den im Folgenden dargestellten Experimenten der jeweilige inguinale und damit der den Inokulationsbereich drainierende Lymphknoten entnommen. 69 IV. Ergebnisse Jeweils drei Tiere wurden einen, drei, sechs bzw. acht Tage nach Injektion von Cop-1 getötet, Blut, Milz und der drainierende Lymphknoten entnommen und die jeweiligen Lymphozytenpopulationen durchflusszytometrisch bestimmt. Außerdem wurden drei unbehandelte Kontrolltiere (Tag 0) untersucht. % Lymphozyten 40 30 20 10 0 Tag 0 Tag 1 Tag 3 Tag 6 Tag 8 Abb. 40: Prozentualer Anteil der B-Lymphozyten in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von BALB/c-Mäusen nach s.c. Injektion von 100 µg Cop-1 Wie in Abb. 40 dargestellt, stieg der prozentuale Anteil der B-Lymphozyten in den drainierenden Lymphknoten am ersten und dritten Tag nach Injektion von Cop-1 deutlich an, fiel aber am achten Tag nach der Injektion wieder ab. % Lymphozyten 75 50 25 0 Tag 0 Tag 1 Tag 3 Tag 6 Tag 8 Abb. 41: Prozentualer Anteil der B-Lymphozyten in der Milz von BALB/c-Mäusen nach s.c. Injektion von 100 µg Cop-1 70 IV. Ergebnisse Auch in der Milz der BALB/c-Mäuse stieg der Anteil der B-Lymphozyten am ersten, dritten und sechsten Tag nach der Injektion von Cop-1 an (siehe Abb. 41). Nach acht Tagen ging der Anteil der BLymphozyten wieder auf das Ausgangsniveau zurück. % Lymphozyten 30 20 10 0 Tag 0 Tag 1 Tag 3 Tag 6 Tag 8 Abb. 42: Prozentualer Anteil CD8-positiver Lymphozyten in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von BALB/c-Mäusen nach s.c. Injektion von 100 µg Cop-1 Im Blut der BALB/c-Mäuse nahm dagegen initial, am ersten und dritten Tag nach der Injektion, der Anteil der B-Lymphozyten ab (Daten nicht dargestellt). Dies legt die Vermutung nahe, dass der Anstieg des Anteils der B-Lymphozyten in Milz und Lymphknoten zumindest teilweise auf eingewanderte Zellen zurückzuführen ist. Der prozentuale Anteil der CD8-Zellen in den Lymphknoten nahm am ersten und dritten Tag nach der Injektion von Cop-1 deutlich ab, stieg jedoch am Tag 8 nach der Injektion wieder an (siehe Abb. 42 ). Im Blut und in der Milz der Mäuse war keine dementsprechende Veränderung zu beobachten. Der prozentuale Anteil der T-Lymphozyten nahm in Milz und Lymphknoten etwas ab, was auf die Abnahme des Anteils der CD8-positiven Lymphozyten zurückzuführen ist. Der Anteil CD4-positiver Lymphozyten blieb unverändert (Daten nicht dargestellt). 4.2.2. Untersuchungen der Wirkung von Cop-1 auf das Immunsystem von Mäusen des Inzuchtstammes C57BL/6 Um zu untersuchen, ob der unter IV.4.2.1. beschriebene Effekt einer Injektion mit Cop-1 auch bei Tieren anderer Inzuchtstämme mit anderen immunologischen Eigenschaften zu finden ist, wurde ein ähnlicher Versuch nochmals mit C57BL/6-Mäusen durchgeführt. In Mäusen dieses Inzuchtstammes konnte nahezu keine EAE induziert werden (siehe IV.1.2.). In diesem Versuch wurden verschiedene Konzentrationen von Cop-1 injiziert. 71 IV. Ergebnisse a. Nach subkutaner Injektion von 1 mg Cop-1 Sieben weiblichen, adulten Mäusen des Inzuchtstammes C57BL/6 wurden je 1 mg Cop-1 subkutan in den Oberschenkel injiziert. Nach drei bzw. sechs Tagen wurden die Tiere getötet, Blut, Milz und Lymphknoten entnommen und, wie unter II.2.8. beschrieben, präpariert. Der Anteil der T-, B- und NK-Zellen sowie der CD4- und CD8-positiven Lymphozyten wurde durchflusszytometrisch ermittelt. Mit fünf unbehandelten Kontrolltiere wurde ebenso verfahren (hier: Tag 0). 75 PB Milz % Lymphozyten LK 50 25 0 Tag 0 Tag 3 Tag 6 Tag 0 Tag 3 Tag 6 Tag 0 Tag 3 Tag 6 Abb. 43: Prozentualer Anteil der B-Lymphozyten im Blut, in der Milz und in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 1 mg Cop-1 Ähnlich wie in dem vorher beschriebenen Versuch mit BALB/c-Mäusen stieg der Anteil der BLymphozyten in den Lymphknoten von C57BL/6-Mäusen initial nach drei Tagen an, nahm aber nach sechs Tagen wieder ab. Anders als bei BALB/c-Mäusen nahm jedoch der Anteil der B-Lymphozyten in der Milz von C57BL/6-Mäusen ab, und im Blut zu (Abb. 43). 40 PB Milz % Lymphozyten LK 30 20 10 0 Tag 0 Tag 3 Tag 6 Tag 0 Tag 3 Tag 6 Tag 0 Tag 3 Tag 6 Abb. 44: Prozentualer Anteil der CD8-positiven Lymphozyten im Blut, in der Milz und in dem nahe der Injektionsstelle liegenden, inguinalen Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 1 mg Cop-1 72 IV. Ergebnisse Wie in Abb. 44 dargestellt, ging der prozentuale Anteil CD8-positiver Lymphozyten in den Lymphknoten der C57BL/6-Mäuse drei Tage nach subkutaner Injektion von 1 mg Cop-1 sehr deutlich zurück. Nach sechs Tagen war jedoch wieder ein leichter Anstieg zu beobachten. Dies entspricht in etwa dem auch in den Lymphknoten von BALB/c-Mäusen beobachteten Effekt. Der Anteil der T- und Th-Zellen in den drainierenden Lymphknoten der C57BL/6-Mäuse fiel am dritten Tag nach der Injektion von Cop-1 zunächst ab und lag am sechsten Tag wieder auf dem Niveau der T- und Th-Zellen in den LK der unbehandelten Kontrolltiere. Alle weiteren erhobenen Werte blieben nahezu unverändert. Neben der Analyse der Lymphozytensubpopulationen wurde bei den in diesem Versuch gewonnenen Zellen eine intrazelluläre Zytokinfärbung durchgeführt (siehe II.2.4.). Es wurde der prozentuale Anteil Interferon-γ- und Interleukin-4-produzierender Lymphozyten durchflusszytometrisch bestimmt. Im peripheren Blut und in den drainierenden Lymphknoten fanden sich keine Veränderungen bezüglich des Anteils IFN-γ- und IL-4-produzierender Zellen (Daten nicht dargestellt). In der Milz von C57BL/6 bewirkte die Injektion von 1 mg Cop-1 jedoch einen Rückgang der Produktion des Th1typischen Zytokins IFN-γ und einen gleichzeitigen Anstieg der Produktion des Th2-typischen Zytokins IL-4 (siehe Abb. 45). INF-γ IL-4 0.75 5 0.50 4 0.25 3 Tag 0 Tag 3 Tag 6 Tag 0 Tag 3 Tag 6 % IL-4 produzierender Lymphozyten % INFγ produzierender Lymphozyten 6 0.00 Abb. 45: Prozentualer Anteil IFN-γγ - bzw. IL-4-produzierender Lymphozyten in den Milzen von C57BL/6-Mäusen nach s.c. Injektion von 1 mg Cop-1 b. Nach subkutaner Injektion von 100 µg Cop-1 Insgesamt 16 weiblichen adulten C57BL/6-Mäusen wurden 100 µg Cop-1 subkutan in den Oberschenkel injiziert und nach 1, 3, 6, 8 oder 14 Tagen (Kontrolltiere = Tag 0) jeweils die Milz, der drainierende Lymphknoten sowie Blut entnommen. Wie oben beschrieben wurde aus den daraus 73 IV. Ergebnisse gewonnenen Zellsuspensionen durchflusszytometrisch der Anteil der verschiedenen Lymphozytensubpopulationen bestimmt. Der prozentuale Anteil der B-Lymphozyten in den Lymphknoten der C57BL/6-Mäuse nach Injektion von 100 µg Cop-1 nahm initial leicht ab und stieg anschließend wieder auf das Niveau des Anteils der B-Lymphozyten der Kontrolltiere (Daten nicht dargestellt). % Lymphozyten 40 30 20 10 0 Tag 0 Tag 1 Tag 3 Tag 6 Tag 8 Tag 14 Abb. 46: Prozentualer Anteil CD8-positiver Lymphozyten in dem drainierenden, inguinalen Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 100 µg Cop-1 Ähnlich wie bei den vorherigen Versuchen mit BALB/c- und C57BL/6-Mäusen nahm auch nach der subkutanen Injektion von 100 µg Cop-1 bei C57BL/6-Mäusen der Anteil der CD8-positiven Lymphozyten in den drainierenden Lymphknoten bis zum dritten Tag stark ab und anschließend langsam wieder zu (siehe Abb. 46). Zu Beachten ist allerdings, dass es sich bei den oben beschriebenen Effekten um den prozentualen Anteil der jeweiligen Zellen handelt und damit eine Aussage über die Verteilung der jeweiligen Zellpopulationen im jeweiligen Organ gibt. Wie in der folgenden Abbildung 47 gezeigt, nahm die Anzahl der Leukozyten in den Lymphknoten drei Tage nach der Injektion von Cop-1 auf 13 x 106 Leukozyten (Mittelwert) zu. Die mittlere Anzahl der Leukozyten in den Lymphknoten der Kontrolltiere (Tag 0) lag dagegen nur bei 1,93 x 106 Leukozyten. x 10 Zellen 15 6 10 5 0 Tag 0 Tag 1 Tag 3 Tag 6 Tag 8 Tag 14 Abb. 47: Gesamtanzahl der Leukozyten in den nahe der Injektionsstelle liegenden, inguinalem Lymphknoten von C57BL/6-Mäusen nach s.c. Injektion von 100 µg Cop-1 74 IV. Ergebnisse Die Anzahl der Leukozyten in der Milz der Versuchstiere blieb von der Cop-Injektion nahezu unbeeinflusst (o. Abb.). 4.2.3. Untersuchungen der Wirkung von Cop-1 auf das Immunsystem von Mäusen des Inzuchtstammes SJL/J In Mäusen des Inzuchtstammes SJL/J war nach subkutaner Injektion von 100 µg Cop-1 in den Oberschenkel in den drainierenden Lymphknoten keine wesentliche Veränderung des prozentualen Anteils der B-Lymphozyten zu beobachten. Der Anteil CD8-positiver Lymphozyten nahm am ersten Tag nach der Injektion von Cop-1 ab, stieg anschließend aber wieder auf das Niveau der CD8positiven Lymphozyten im Lymphknoten der Kontrolltiere an (Daten nicht dargestellt). % Lymphozyten 60 50 40 Tag 0 Tag 1 Tag 3 Tag 6 Tag 8 Abb. 48: Prozentualer Anteil der Th-Zellen in den drainierenden inguinalen Lymphknoten von SJL/J-Mäusen nach s.c. Injektion von 100 µg Cop-1, Einzelwerte und Median Wie in Abb. 48 dargestellt, war in den Lymphknoten von SJL/J-Mäusen eine Abnahme der CD4positiven Lymphozyten (Th-Zellen) ab dem dritten Tag nach der Injektion von Cop-1 zu beobachten. Allerdings lagen die Einzelwerte zum Teil weit auseinander. Zusammenfassend kann man sagen, dass Cop-1 bei den Tieren aller verwendeten Inzuchtstämme eine Wirkung auf den Anteil CD8-positiver Lymphozyten hat. Ein Effekt auf den Anteil der BLymphozyten war vor allem in den Mäusen der Inzuchtstämme zu beobachten, die ohnehin einen hohen Anteil an B-Lymphozyten haben. 75 IV. Ergebnisse 4.3. Therapieversuche mit Cop-1 bei an EAE erkrankten Mäusen Um zu untersuchen, inwieweit sich die unter IV.4.2. beschriebenen Veränderungen im Immunsystem auf die Krankheitsverläufe von an EAE erkrankten Tieren auswirken, wurden Therapieversuche mit Cop-1 bei an EAE erkrankten Mäusen sowie begleitende immunologische Untersuchungen durchgeführt. Cop-1 (Copaxone®, Glatiramerazetat) wird Patienten zur Therapie der Multiplen Sklerose täglich in wässriger Lösung subkutan injiziert. Die tägliche subkutane Injektion über mehrere Jahre ist für die Patienten häufig äußerst unangenehm und führt bei einigen Patienten trotz guten Ansprechens auf die Behandlung mit Cop-1 sogar zum Abbruch der Therapie. Um dieses für die Patienten unangenehme Applikationsverfahren zu verbessern, ist es vorstellbar, dass die Applikation von Cop-1 in Depotform größere Abstände zwischen den Injektionen bei gleicher Wirksamkeit ermöglicht. Aluminiumhydroxid-Gel (hier: Alu) wird in Vakzinen zur Adsorption der Vakzine-Antigene verwendet. Der Adjuvans-Effekt von Alu in Vakzinen ist vor allem auf die Depot-Wirkung zurückzuführen. Proteine werden von Alu adsorbiert und anschließend aus dem Depot wieder freigesetzt. Um zu untersuchen, ob die Depotwirkung durch Adsorption an Alu auch ein geeignetes Mittel darstellt, um die Therapie mit Cop-1 zu optimieren, wurde in den folgenden Versuchen nicht nur Cop-1 in wässriger Lösung, sondern auch an Alu adsorbiert eingesetzt. 4.3.1. Therapieversuch mit 100 µg Cop-1 bei BALB/c-Mäusen nach Induktion mit PLP139-151-Peptid Im folgenden Versuch wurde weiblichen, 7 Wochen alten Mäusen des Inzuchtstammes BALB/c 100 µg PLP-Peptid in Emulsion mit CFA subkutan in die Flanke injiziert. Drei Tage später wurden jeweils vier Tiere folgendermaßen behandelt: 1. ohne Therapie, 2. 100 µg Cop-1 in PBS s.c., 3. 100 µg Cop-1 an Aluminiumhydroxid (Alu) adsorbiert (1:1) s.c. Die Tiere aller Versuchsgruppen wurden jeden Tag insgesamt 38 Tage lang untersucht und mit Hilfe der unter II.2.12. beschriebenen Skala zur Bewertung der EAE Symptome bei Mäusen wurde der Behinderungsgrad beurteilt. In den folgenden Diagrammen sind die täglich gemessenen Behinderungsgrade dargestellt. Tier Nr. 3 der in Abb. dargestellten Kontrollgruppe starb am fünften Tag nach Krankheitsinduktion, ohne irgendwelche Krankheitsmerkmale entwickelt zu haben. 76 IV. Ergebnisse Tier 1 Tier 2 2 Tier 4 100 µg PLP in CFA s.c. Behinderungsgrad 3 1 0 0 5 10 15 20 25 30 35 40 Tage Abb. 49: Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen ohne Behandlung (Kontrollgruppe) Tier 1 Tier 2 Tier 3 Tier 4 1 100 µg COP-1 in PBS s.c. 2 100 µg PLP in CFA s.c. Behinderungsgrad 3 0 0 5 10 15 20 25 30 35 40 Tage Abb. 50: Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen nach Therapie mit 100 µg Cop-1 in PBS Tier 1 Tier 2 Tier 3 1 Tier 4 100 µg COP-1/ Alu s.c. 2 100 µg PLP in CFA s.c. Behinderungsgrad 3 0 0 5 10 15 20 25 30 35 40 Tage Abb. 51: Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen nach Therapie mit 100 µg Cop-1 an Alu adsorbiert 77 IV. Ergebnisse Die in den Abb. 49 bis 51 dargestellten Krankheitsverläufe der Tiere der verschiedenen Versuchsgruppen zeigten keine wesentlichen Unterschiede. 30 CDI 20 10 0 Kontrollgruppe Cop-1/PBS Cop-1/Alu Abb. 52: Darstellung der aus der Summe der täglichen Behinderungsgrade errechneten CDI jedes der Tiere der drei Versuchsgruppen des Vorversuchs mit 100 µg Cop-1. Dargestellt sind die Einzelwerte sowie der Median. Der Vergleich der in Abb. 52 dargestellten CDI-Werte der Tiere der verschiedenen Versuchsgruppen zeigte keine Verbesserung der Krankheitssymptome durch eine Therapie mit Cop-1. Aufgrund der oben dargestellten Ergebnisse des Versuchs wurde bei den folgenden Versuchen eine deutlich höhere Konzentration Cop-1 eingesetzt. 4.3.2. Therapieversuch mit 1 mg Cop-1 bei BALB/c-Mäusen nach Induktion mit PLP139-151 Peptid In diesem Versuch wurde den Versuchstieren mit jeweils 1 mg Cop-1 eine wesentlich höhere Dosis Cop-1 injiziert als im vorherigen Versuch (100 µg Cop-1). In dem folgenden Versuch wurde 1 mg Cop-1 zum einen in Emulsion mit CFA zum anderen an Alu adsorbiert den Mäusen subkutan injiziert. Es wurde ein prophylaktischer Ansatz gewählt, d.h. den Tieren wurde zunächst Cop-1 (am Tag –9) injiziert und erst neun Tage später (Tag 0) die EAE durch subkutane Injektion von 200 µg PLP 139-151 Peptid in Emulsion mit CFA in die Flanke der Tiere induziert. Je 7 bzw. 8 weibliche, 6-8 Wochen alte Mäuse des Inzuchtstammes BALB/c wurden pro Versuchsgruppe eingesetzt. 78 IV. Ergebnisse Behinderungsgrad 3 Tier 1 Tier 2 2 Tier 3 Tier 4 200 µg PLP in CFA s.c. 1 Behinderungsgrad 0 -10 3 -5 0 5 10 15 20 25 Blutabnahme 30 Tage Tier 5 Tier 6 2 Tier 7 200 µg PLP in CFA s.c. 1 0 -10 -5 0 5 10 15 20 25 30 Tage Blutabnahme Abb. 53: Darstellung des Krankheitsverlaufs bei an EAE erkrankten BALB/c-Mäusen ohne Behandlung (Kontrollgruppe) Behinderungsgrad 3 Tier 1 Tier 2 2 Tier 3 Tier 4 1 1 mg Cop-1 in CFA s.c. Behinderungsgrad 0 -10 3 200 µg PLP in CFA s.c. -5 0 5 10 15 20 25 Blutabnahme 30 Tage Tier 5 Tier 6 2 Tier 7 Tier 8 1 1 mg Cop-1 in CFA s.c. 0 -10 200 µg PLP in CFA s.c. -5 0 5 10 15 20 25 Blutabnahme 30 Tage Abb. 54: Darstellung des Krankheitsverlaufs bei an EAE erkrankten Balb/c-Mäusen nach Behandlung mit 1 mg Cop-1/CFA am Tag -9 79 IV. Ergebnisse Überraschenderweise zeigen die Krankheitsverläufe der mit Cop-1 in Emulsion mit CFA behandelten Tiere in Abb. 54 einen eher schwereren Krankheitsverlauf als die der unbehandelten Tiere (Abb.53). Behinderungsgrad 3 Tier 1 Tier 2 2 Tier 3 Tier 4 1 1 mg Cop-1 in Alu s.c. Behinderungsgrad 0 -10 3 200 µg PLP in CFA s.c. -5 0 5 10 15 20 25 Blutabnahme 30 Tage Tier 8 Tier 7 2 Tier 6 Tier 5 1 1 mg Cop-1 in Alu s.c. 0 -10 200 µg PLP in CFA s.c. -5 0 5 10 15 20 25 Blutabnahme 30 Tage Abb. 55: Darstellung des Krankheitsverlaufs bei an EAE erkrankten Balb/c-Mäusen nach Behandlung mit 1 mg Cop-1/Alu am Tag –9 CDI 20 15 10 5 0 Kontrollgruppe Cop-1/CFA Cop-1/Alu Abb. 56: Darstellung des aus der Summe der täglichen Behinderungsgrade errechneten CDI jedes Tieres der drei Versuchsgruppen des Therapieversuchs mit 1 mg Cop-1. Dargestellt sind die Einzelwerte sowie der Median. Die statistische Berechnung (Mann-Whitney U-Test) ergab einen signifikant schlechteren Krankheitsverlauf bei den Tieren, die mit Cop-1 in Emulsion mit CFA behandelt worden waren, im 80 IV. Ergebnisse Vergleich zu demjenigen der unbehandelten Tiere (p=0,021). Der CDI der mit Cop-1/Alu behandelten Tiere unterschied sich nicht signifikant von dem der Tiere der Kontrollgruppe (p=0,463). Dieses Ergebnis ist sehr überraschend, da die Wirksamkeit von Cop-1 sowohl bei der Therapie der Multiplen Sklerose als auch in EAE-Versuchen bewiesen wurde. Möglicherweise hat CFA alleine bereits eine enzephalitogene Wirkung. 4.3.3. Therapieversuch mit Cop-1 bei SJL/J-Mäusen nach Induktion mit PLP139-151 -Peptid Im folgenden Versuch wurde die Wirkung von Cop-1 auf die Krankheitssymptome von an EAE erkrankten Mäusen des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid untersucht, da dieses EAE-Modell im Vorversuch (siehe IV.1.) im Vergleich zu den anderen Modellen die schwersten Krankheitsverläufe gezeigt hatte. Weiblichen, 7 Wochen alten Mäusen des Inzuchtstammes SJL/J wurden am Tag 0 zur Auslösung der EAE 100 µg PLP 139-151 -Peptid in Emulsion mit CFA subkutan in die Flanke injiziert. Die Tiere wurden neun Tage zuvor folgendermaßen behandelt: 1. ohne Therapie, Kontrollgruppe, N = 13, 2. 1 mg Cop-1 in Emulsion mit CFA, s.c., N = 6, 3. 1 mg Cop-1 an Alu adsorbiert (1:1), s.c., N = 6, 4. 1 mg Cop-1 in PBS am Tag –9, s.c., + 100 µg Cop-1 in PBS s.c. am Tag 5, N = 6. Die Tiere wurden anschließend 35 Tage lang täglich untersucht und der Behinderungsgrad ermittelt. In Abb. 57 bis 60 sind die Krankheitsverläufe der einzelnen Tiere dargestellt. 1.Tier 2.Tier 3.Tier 4.Tier 5.Tier 6.Tier Behinderungsgrad 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 -10 -5 1 mg Cop-1 in CFA s.c. 0 5 10 15 20 100 µg PLP in CFA s.c. 25 30 35 Tage nach Injektion Abb. 57: Darstellung der Krankheitsverläufe der mit Cop-1/CFA-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid 81 Behinderungsgrad IV. Ergebnisse 1.Tier 2.Tier 3.Tier 4.Tier 5.Tier 6.Tier 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 -10 -5 1 mg Cop -1 an Alu s.c. 0 5 10 15 20 25 30 35 Tage nach Injektion 100 µg PLP in CFA s.c. Abb. 58: Darstellung der Krankheitsverläufe der mit Cop-1/Alu-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid 1.Tier 2.Tier 3.Tier 4.Tier 5.Tier 6.Tier Behinderungsgrad 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 -10 1 mg Cop-1 in PBS s.c. -5 0 100 µg PLP in CFA s.c. 5 10 15 20 100 µg Cop-1 in PBS s.c. 25 30 35 Tage nach Injektion Abb. 59: Darstellung der Krankhe itsverläufe der mit Cop-1/PBS-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Krankheitsinduktion mit PLP-Peptid In den dargestellten Krankheitsverläufen (siehe Abb. 57 bis 60) der Tiere der verschiedenen Versuchsgruppen konnten keine deutlichen Unterschiede in der Schwere der Erkrankung nachgewiesen werden. Der Mittelwert der einzelnen CDI-Werte der Tiere der unbehandelten Kontrollgruppe liegt mit 25,42 deutlich über dem der mit Cop/CFA-behandelten Tiere (MW = 13,25), dem der mit Cop/Alu behandelten Tiere (15,5) sowie dem der mit Cop/PBS behandelten Tiere (19,92). Die statistische Berechnung unter Verwendung des nicht-parametrischen Mann-Whitney U-Tests und des t-Tests ergab aber keinerlei statistisch signifikanten Unterschiede beim Vergleich der CDI-Werte der jeweiligen Gruppen (siehe Abb. 61). 82 IV. Ergebnisse Tier getötet 1.Tier 2.Tier 3.Tier 4.Tier 5.Tier 6.Tier 5.0 Behinderungsgrad 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 -10 -5 0 5 10 15 20 25 30 35 Tage nach Injektion 7.Tier 8.Tier 9.Tier 10.Tier 11.Tier 12.Tier 13.Tier 5.0 Behinderungsgrad 4.5 4.0 3.5 3.0 2.5 2.0 1.5 100 µg PLP in CFA s.c. 1.0 0.5 0.0 -10 -5 0 5 10 15 20 25 30 35 Tage nach Injektion 100 µg PLP in CFA s.c. Abb. 60: Darstellung der Krankheitsverläufe der unbehandelten Versuchstiere nach Induktion der EAE durch PLP-Peptid 100 CDI 50 50 25 0 o.Therapie Cop/CFA Cop/Alu Cop/PBS Einzelwerte + Mittelwert (nicht signifikant nach t-Test und Mann-Whitney U-Test) Abb. 61: CDI der Tiere der verschiedenen Therapiegruppen nach Induktion einer EAE in SJL/J-Mäusen mit PLP-Peptid 83 IV. Ergebnisse 4.3.4. Therapieversuch mit Cop-1 bei SJL/J-Mäusen nach Induktion mit MBP87-99 -Peptid Da es in den bisherigen Versuchen nicht gelungen war, den bereits beschriebenen therapeutischen Effekt von Cop-1 in einem der murinen EAE-Modelle nachzuweisen, wurde in dem folgenden Versuch ein EAE-Modell gewählt, in dem die therapeutische Wirksamkeit von Cop-1 bereits mehrfach bewiesen worden war. Je 6 weiblichen, 7 Wochen alten Mäusen des Inzuchtstammes SJL/J wurden am Tag 0 zur Auslösung der EAE 100 µg MBP-Peptid in Emulsion mit CFA subkutan in die Flanke injiziert. Die Tiere wurden neun Tage zuvor folgendermaßen behandelt: 1. ohne Therapie, Kontrollgruppe, 2. 1 mg Cop-1 in Emulsion mit CFA, s.c., 3. 1 mg Cop-1 an Alu adsorbiert (1:1), s.c., Behinderungsgrad 4. je 100 µg Cop-1 in PBS am Tag –9, am Tag –4 und am Tag 4, s.c., . 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 -10 Tier Tier Tier Tier Tier Tier -5 1 2 3 4 5 6 0 5 10 15 20 25 30 35 40 Abb. 62: Darstellung der Krankheitsverläufe der unbehandelten Versuchstiere des Behinderungsgrad Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 Cop/CFA 1.0 s.c. 0.5 0.0 -10 Tier 6 Tier 5 Tier 4 Tier 3 Tier 2 Tier 1 MBP/CFA s.c. 0 10 20 30 40 Abb. 63: Darstellung der Krankheitsverläufe der mit Cop/CFA-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid 84 IV. Ergebnisse Wie in Abb. 62 zu erkennen, war der Krankheitsverlauf der nach Krankheitsinduktion mit MBP- Behinderungsgrad Peptid erkrankten Tiere wesentlich milder als der nach Krankheitsinduktion mit PLP-Peptid. 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 Cop/Alu 1.0 s.c. 0.5 0.0 -10 Tier 6 Tier 5 Tier 4 Tier 3 Tier 2 Tier 1 MBP/CFA s.c. 0 10 20 30 40 Abb. 64: Darstellung der Krankheitsverläufe der mit Cop/Alu-behandelten Versuchstiere des Behinderungsgrad Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 Cop/PBS 1.0 s.c. 0.5 0.0 -10 Tier 6 Tier 5 Tier 4 Tier 3 Tier 2 Tier 1 Cop/PBS MBP/CFA Cop/PBS s.c. s.c. s.c. 0 10 20 30 40 Abb. 65: Darstellung der Krankheitsverläufe der mit Cop/PBS-behandelten Versuchstiere des Inzuchtstammes SJL/J nach Induktion der EAE mit MBP-Peptid Die in Abb. 62 bis 65 dargestellten Krankheitsverläufe der an EAE erkrankten Tiere zeigten nach Behandlung mit Cop-1 unabhängig von der Applikationsform (mit CFA, mit Alu oder in PBS) einen deutlich milderen Verlauf als die unbehandelten Kontrolltiere. In Abb. 66 sind die CDI-Werte der Tiere der verschiedenen Therapiegruppen gegeneinander aufgetragen. Mit Hilfe des nicht-parametrischen Mann-Whitney U-Tests wurde berechnet, ob die CDIWerte der Therapiegruppen sich signifikant von denen der Kontrollgruppe unterscheiden. Sowohl die mit Cop-1/CFA (p=0,015) als auch die mit Cop/PBS-behandelten Tiere (p=0,026) hatten einen signifikant milderen Krankheitsverlauf als die unbehandelten an EAE erkrankten Tiere. Bei den mit Cop/Alu-behandelten Tieren lag der mittlere CDI mit 5,33 ebenfalls deutlich aber nicht signifikant 85 IV. Ergebnisse unter dem der unbehandelten Kontrolltiere (mittlerer CDI=14,92). Für dieses EAE-Modell konnte somit die therapeutische Wirksamkeit von Cop-1 bewiesen werden. CDI * p = 0,026 p = 0,093 40 * p = 0,015 30 20 10 0 Cop/CFA Cop/Alu Cop/PBS o. Therapie Abb. 66: CDI der Tiere der verschiedenen Therapiegruppen nach Induktion einer EAE in SJL/J-Mäusen mit MBP-Peptid. Dargestellt sind die Einzelwerte, die Mittelwerte sowie die mit dem Mann-Whitney U-Test berechneten p-Werte. Signifikanzen sind mit * gekennzeichnet. 4.4. Untersuchungen des Immunsystems von an EAE erkrankten Mäusen Im Folgenden wurde die Wirkung der Therapie mit Cop-1 auf das Immunsystem von an einer EAE erkrankten Versuchstieren untersucht. Hierzu wurde den jeweiligen Versuchstieren durch Punktion des retroorbitalen Plexus Blut abgenommen. Die Gerinnung wurde durch Zugabe von Heparin unterbunden. Die Leukozyten der Versuchstiere wurden, wie unter II.2.5. beschrieben, mit Hilfe von spezifischen, Fluorochrom-markierten Antikörpern durchflusszytometrisch analysiert. Außerdem wurde durch Zentrifugation (300xg) des Blutes Plasma gewonnen und zur späteren Bestimmung von anti-Cop-1-AK bei –20°C eingefroren. Die Antikörpertiter (anti-Cop-1-AK) der Plasmen der Versuchstiere wurden später im ELISA bestimmt (siehe II.2.7.). Mit Hilfe Klassen-spezifischer bzw. Subklassen-spezifischer Zweitantikörper wurden die AK-Klassen und -Subklassen der Anti-Cop-1Titer analysiert. 86 IV. Ergebnisse 4.4.1. Untersuchungen des Immunsystems bei SJL-Mäusen nach EAE-Induktion mit PLP-Peptid Den in IV.4.3.3. beschriebenen Versuchstieren wurde 30 Tage nach Induktion der EAE durch subkutane Injektion des PLP 139-151 -Peptids in CFA Blut abgenommen. Unmittelbar danach wurde je 20 µl des heparinisierten Blutes in FACS-Röhrchen pipettiert und mit Hilfe spezifischer, Fluorochrom-markierter Antikörper gefärbt und folgende Zellpopulationen im Durchflusszytometer untersucht (siehe II.2.5.): - T-Lymphozyten, - B-Lymphozyten, - CD4-positive Lymphozyten (= T-Helfer-Zellen), - CD8-positive Lymphozyten, - Granulozyten. Ferner wurde der CD4/CD8-Quotient berechnet, im Folgenden CD4/CD8-Ratio genannt. In Abb. 67 ist der CD4/CD8-Quotient des Blutes der einzelnen Tiere der jeweiligen Versuchsgruppen sowie dreier gleichaltriger, unbehandelter, gesunder Tiere dargestellt. Im Vergleich zur CD$/CD8Ratio der Kontrollgruppe der unbehandelten, an EAE erkrankten Tiere stieg die CD4/CD8-Ratio im Blut der mit Cop/CFA- und Cop/Alu-behandelten Tiere statistisch signifikant an (p=0,005; p=0,003). Die Veränderung der CD4/CD8-Ratio ist auf einen starken Anstieg des prozentualen Anteils an THelfer-Zellen und auf einen leichten Rückgang des Anteils CD8-positiver Lymphozyten zurückzuführen. p=0,003* 3.0 p=0,005* 2.5 2.0 1.5 o.Therapie Cop-CFA Cop-Alu Cop-PBS SJL-Kontrolle Abb. 67: CD4/CD8-Ratio im peripheren Blut der an PLP-induzierter EAE erkrankten Tiere Der prozentuale Anteil der T- und B-Lymphozyten sowie der Granulozyten im Blut der Tiere der einzelnen Versuchsgruppen unterschied sich nicht (Daten nicht dargestellt). Um zu untersuchen, ob es einen Zusammenhang zwischen dem Vorkommen bestimmter Leukozyten und der Schwere der Erkrankung gibt, wurden im Folgenden die jeweiligen prozentualen Anteile der 87 IV. Ergebnisse T-, B-, Th- und CD8-positiven Lymphozyten sowie Granulozyten gegen den CDI des jeweiligen Tieres aufgetragen und mittels Pearson-Korrelationstest mögliche Korrelationen berechnet. Cop-CFA Cop-Alu Cop-PBS o. Therapie 70 % Lymphozyten 65 60 55 50 45 0 10 20 30 40 50 CDI Korrelationskoeffizient r = -0,4989, p=0,0069 ⇒ signifikante negative Korrelation Abb. 68: Korrelation zwischen dem prozentualen Anteil an T-Helfer-Zellen im peripheren Blut von an EAE erkrankten Mäusen und dem CDI jedes einzelnen Tieres Für T- und B-Lymphozyten sowie Granulozyten ergaben sich keine Korrelationen mit dem CDI der Tiere (o. Abb.). In Abb. 68 sind die prozentualen Anteile der Th-Zellen im peripheren Blut der Versuchstiere gegen den CDI der Tiere aufgetragen. Es ist eine deutliche Korrelation zwischen diesen Werten zu erkennen, die sich auch im Korrelationskoeffizienten r = - 0,4989 und im Signifikanzniveau p=0,0069 widerspiegelt. Es handelt sich hierbei um eine negative Korrelation, d.h. je größer der prozentuale Anteil Th-Zellen im peripheren Blut der Mäuse ist, desto niedriger der CDI der Tiere und umgekehrt. Wie in Abb. 69 zu sehen, korreliert auch der prozentuale Anteil der CD8-positiven Lymphozyten signifikant mit dem CDI der Versuchstiere (r = 0,5147; p = 0,0051). Hierbei handelt es sich jedoch um eine positive Korrelation, was bedeutet, dass die Tiere mit dem höchsten CDI auch den größten Anteil CD8-positiver Lymphozyten im peripheren Blut haben. 88 IV. Ergebnisse Cop/CFA Cop/Alu Cop/PBS o. Therapie 32.5 % Lymphozyten 30.0 27.5 25.0 22.5 20.0 17.5 0 10 20 30 Korrelationskoeffizient r = 0,5147, p=0,0051 ⇒ signifikante Korrelation 40 50 CDI Abb. 69: Korrelation zwischen dem prozentualen Anteil CD8-positiver Zellen im peripheren Blut von an EAE erkrankten Mäusen und dem CDI jedes einzelnen Tieres. Dargestellt sind die Einzelwerte pro Versuchstier. Die Rolle von anti-Cop-1-AK im Blut von an EAE erkrankten Versuchstieren wurde bisher nicht untersucht. Im folgenden Experiment sollte daher untersucht werden, ob es einen Zusammenhang zwischen der Schwere der Erkrankung, und damit dem Ansprechen auf die Therapie und dem Auftreten von Antikörpern gegen Cop-1 im Blut von Versuchstieren gibt. Zu diesem Zweck wurde zunächst ein anti-Cop-1-AK-ELISA entwickelt (siehe II.2.7.). Als Standard wurde eine Probe mitgeführt, die aus einem Pool von anti-Cop-1-AK enthaltenden Plasmaproben bestand. Es wurde jeweils die Verdünnungsstufe jeder Plasmaprobe bestimmt, bei der, der Standard eine optische Dichte von 1,0 (bei IgG3 und IgM OD von 0,5) hatte und auf diese Weise der AK-Titer definiert. Die Antikörper der verschiedenen Klassen und Subklassen unterscheiden sich nicht nur morphologisch, sondern auch funktionell. Um eine zusätzliche Aussage darüber treffen zu können zu welchen AKKlassen und -Subklassen die anti-Cop-1-AK zuzuordnen sind, wurden folgende Zweitantikörper (Detektionsantikörper) verwendet: - polyvalenter Antikörper gegen IgM, IgG, IgA, - Antikörper gegen IgM, - AK gegen IgG1, - AK gegen IgG2a, - AK gegen IgG2b und - AK gegen IgG3. 89 IV. Ergebnisse Die gemessenen Antikörpertiter wurden mit dem CDI des jeweiligen Tieres korreliert, um zu untersuchen ob ein Zusammenhang zwischen Antikörperproduktion und der Schwere der Erkrankung besteht. Es fanden sich keinerle i Korrelationen zwischen der Produktion von anti-Cop-1-AK, gleichgültig welcher AK-Klasse oder Subklasse, und dem CDI der jeweiligen Versuchstiere (Daten nicht dargestellt). Insgesamt waren die Antikörpertiter der Tiere auch innerhalb der einzelnen Versuchsgruppen zum Teil sehr unterschiedlich hoch. 4.4.2. Untersuchungen des Immunsystems bei SJL/J-Mäusen nach EAE-Induktion mit MBP-Peptid Den in IV.4.3.4. beschriebenen Versuchstieren wurde 24 Tage nach Induktion der EAE durch subkutane Injektion des MBP 87-99 -Peptids in CFA Blut abgenommen. Unmittelbar danach wurde je 20 µl des heparinisierten Blutes in FACS-Röhrchen pipettiert und mit Hilfe spezifischer, Fluorochrom-markierter Antikörper gefärbt und die unter IV.4.4.1. aufgeführten Zellpopulationen sowie der prozentuale Anteil der NK-Zellen im Durchflusszytometer untersucht. Der Vergleich der prozentualen Anteile der T- und B-Lymphozyten, CD4- und CD8-positiver Lymphozyten sowie Granulozyten zeigte keine signifikanten Unterschiede zwischen den Tieren der verschiedenen Versuchsgruppen (o. Abbildung). Nur der prozentuale Anteil der NK-Zellen war bei den mit Cop-1 behandelten Tieren signifikant erhöht (Cop/CFA: p=0,004, Cop/Alu: p=0,002, Cop/PBS: p=0,026; Mann-Whitney U-Test) (Abb. 70). 30 p=0,004* p=0,002* % Lymphozyten p=0,026* 20 10 0 Cop/CFA Cop/Alu Cop/PBS o. Therapie Abb. 70: Prozentualer Anteil der NK-Zellen im peripheren Blut der an MBP-induzierter EAE erkrankten Tiere. Einzelwerte, Median und Signifikanzen. 90 IV. Ergebnisse Um auch hier zu untersuchen, ob es einen Zusammenhang zwischen dem Vorkommen bestimmter Leukozyten und der Schwere der Erkrankung gibt, wurden im Folgenden die jeweiligen prozentualen Anteile der T-, B-, NK-, Th- und CD8-positiven Lymphozyten sowie der Granulozyten gegen den CDI des jeweiligen Tieres aufgetragen und mittels Pearson-Korrelationstest mögliche Korrelationen berechnet. Wie in Abb. 71 dargestellt, korrelierte der prozentuale Anteil der NK-Zellen mit der Schwere der Erkrankung des jeweiligen Versuchstieres (Korrelationskoeffizient r = -0,4154, Signifikanz p = 0,0487). Hierbei handelte es sich wiederum um eine negative Korrelation, d.h. je höher der prozentuale Anteil der NK-Zellen im Blut der Versuchstiere ist, desto niedriger der CDI und umgekehrt. 30 % Lymphozyten Cop/CFA Cop/Alu Cop/PBS o. Therapie 20 10 0 0 10 20 30 Korrelationskoeffizient r = -0,4154, p = 0,0487 40 CDI ð Signifikante negative Korrelation Abb. 71: Korrelation zwische n dem prozentualen Anteil der NK-Zellen im peripheren Blut von an EAE erkrankten Mäusen und dem CDI jedes einzelnen Tieres Alle anderen Zelltypen (T-, B-, Th- und CD8-positive Lymphozyten, Granulozyten) zeigten keine Korrelation mit dem CDI der Tiere (o. Abbildung). Die Titer der anti-Cop-Antikörper der verschiedenen Klassen und Subklassen wurden aus dem Plasma der Tiere dieser Versuchsgruppen bestimmt und mit dem CDI der jeweiligen Tiere korreliert. Es war keinerlei Korrelation zwischen Antikörpertiter und der Schwere der Erkrankung bei den Versuchstieren vorhanden (Daten nicht dargestellt). 91 IV. Ergebnisse 4.5. Untersuchung der Wirkung von Cop-1 auf humane periphere Blutzellen von MS-Patienten 4.5.1. In vitro Stimulation humaner Leukozyten von MS-Patienten und gesunden Probanden Nach der Untersuchung immunologischer Wirkmechanismen von Cop-1 in in vitro-Versuchen mit murinen Leukozyten (IV.4.1.) wurde in den im Folgenden dargestellten in vitro-Versuchen die Wirkung der Stimulation mit Cop-1 auf Leukozyten von Multiple Sklerose Patienten und gesunden Probanden untersucht. 4.5.1.1. Untersuchungen des apoptotischen Zelltods nach in vitro Stimulation mit Cop-1 Von je 15 Patienten und gesunden Probanden wurde Blut abgenommen und Heparin zur Gerinnungshemmung dazugegeben. Mittels Dichtegradientenzentrifugation (siehe II.2.3.) wurden die peripheren mononukleären Blutzellen (PBMC) gewonnen und mit Hilfe einer Neubauerzählkammer die Anzahl der isolierten PBMC bestimmt. Je 2 x 105 Zellen/ml wurden in 24-Depot Mikrotiterplatten in 2 ml Kulturmedium (RPMI + 5 % FBS) 48 Stunden lang im Brutschrank bei 37°C, 5 % CO2 und 98 % Luftfeuchtigkeit inkubiert. Den Zellsuspensionen wurde zuvor jeweils 2 µg Cop-1 zugegeben. Nach 48 Stunden wurden die Zellen in FACS-Röhrchen überführt, einmal mit HEPES-Puffer (siehe II.1.2.1.) gewaschen und anschließend mit Hilfe der Annexin V/Propidiumjodid-Methode die Zellen angefärbt (siehe II.2.2.3.). Parallel zur Annexin V- und Propidiumjodid-Färbung wurden die Zellen mit einem PE-Cy5-konjugierten anti-CD4 Antikörper markiert. Auf diese Weise konnte die Apoptoserate der T-Helfer-Zellen im Durchflusszytometer bestimmt werden. 30 % T-Helfer Zellen 25 20 15 10 5 0 MS-Patienten Gesunde Probanden Abb. 72: Prozentualer Anteil apoptotischer T-Helfer-Zellen von MS-Patienten und gesunden Probanden nach in vitro Stimulation mit Cop-1. Einzelwerte und Median. 92 IV. Ergebnisse Mit Hilfe des nicht-parametrischen Mann-Whitney U-Tests wurden die in Abb. 72 dargestellten Apoptoseraten nach Stimulation mit Cop-1 bei T-Helfer-Zellen von MS-Patienten mit denen von ThZellen gesunder Probanden verglichen. Der Anteil an apoptotischen T-Helfer-Zellen nach in vitro Stimulation mit Cop-1 war bei den aus dem Blut von MS-Patienten isolierten Zellen statistisch signifikant (p=0,021) höher als bei den Zellen aus dem Blut gesunder Probanden. 4.5.1.2. Untersuchung der Zytokin-Produktion humaner Leukozyten nach in vitro Stimulation mit Cop-1 Wie unter IV.4.5.1.1. beschrieben wurden die PBMC von gesunden Probanden und MS-Patienten isoliert und 48 h lang mit Cop-1 in vitro stimuliert. Nach 48-stündiger Inkubation mit Cop-1 wurde durch intrazellulärer Färbung die Produktion folgender Zytokine analysiert: INF-γ, TNF-α, TGF-β, IL-2, IL-4 und IL-10 (siehe II.2.4.). Durch die gleichzeitige Markierung von CD4-Molekülen auf der Oberfläche der Leukozyten konnte 12.5 11 9 7 5 % T-Helfer Zellen % Lymphozyten der Anteil der Zytokin-produzierenden T-Helfer-Zellen im Durchflusszytometer bestimmt werden. 2 1 0 MS-Patienten Gesunde Probanden 10.0 7.5 5.0 2 1 0 MS-Patienten Gesunde Probanden Abb. 73: Im linken der beiden Diagramme ist der prozentuale Anteil IL-10 produzierender Lymphozyten nach 48-stündiger Stimulation mit Cop-1 dargestellt, im rechten Diagramm der prozentuale Anteil IL-10 produzierender T-Helfer-Zellen. Dargestellt sind jeweils die Einzelwerte und der Median. Nur der prozentuale Anteil IL-10 produzierender Lymphozyten war bei den aus dem Blut von MSPatienten isolierten Zellen höher als bei den von gesunden Probanden stammenden Blutzellen. Der Unterschied war nach Berechnung mit dem nicht-parametrischen Mann-Whitney U-Test signifikant (p=0,03). Der Anteil IL-10-produzierender T-Helfer-Zellen war zwar bei MS-Patienten nach Cop-1Stimulation im Vergleich zum Anteil der Zellen der gesunden Probanden erhöht (siehe Abb. 73), dieser Effekt war aber statistisch nicht signifikant. 93 IV. Ergebnisse Der prozentuale Anteil aller weiteren mittels intrazellulärer Färbung bestimmter Zytokinproduzierender Zellen (IFN-γ, TNF-α, TGF-β, IL-2 und IL-4) nach Stimulation mit Cop-1 unterschied sich nicht bei den aus Patientenblut und von gesunden Probanden stammenden Zellen (Daten nicht dargestellt). 4.5.2. Untersuchung an humanen peripheren Leukozyten von MS-Patienten unter Cop-1-Therapie Neben den begleitenden immunologischen Untersuchungen zur Therapie mit Cop-1 bei an EAE erkrankten Tieren sind auch die begleitenden immunologischen Untersuchungen bei mit Cop-1 (Copaxone®) behandelten Patienten mit Multipler Sklerose für das Verständnis der Wirkmechanismen von Cop-1 von großer Bedeutung. Daher wurde 19 MS-Patienten (siehe III.) vor Therapiebeginn und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Therapiebeginn mit Copaxone® peripheres Blut abgenommen und untersucht. 4.5.2.1. Untersuchung des apoptotischen Zelltods humaner Leukozyten unter Cop-1-Therapie Das den Patienten abgenommene Blut wurde zur Gerinnungshemmung heparinisiert, mittels Dichtegradienten die PBMC isoliert (siehe II.2.3.) und anschließend der prozentuale Anteil apoptotischer Zellen mittels TUNEL-Technik durchflusszytometrisch bestimmt (siehe II.2.2.2.). Im Folgenden ist der prozentuale Anteil von apoptotischen Lymphozyten und T-Helfer-Zellen im peripheren Blut von MS-Patienten vor und während der Therapie mit Cop-1 dargestellt. Mittels TUNEL-Methodik wurde die mit der Apoptose einhergehende DNA-Fragmentierung der Zellen erfasst. Der mit dieser Methodik gemessene prozentuale Anteil apoptotischer Lymphozyten war in Woche 30 und 36 leicht und in Woche 42 (p=0,047) und 48 (p=0,05) statistisch signifikant höher als vor Therapiebeginn (siehe Abb. 74). Die statistischen Berechnungen wurden mit dem WilcoxonRank-Test durchgeführt. Gleichzeitig mit der Anfärbung der Zellen durch die TUNEL-Methode können die Zellen durch spezifische Fluorochrom-markierte Antikörper genauer charakterisiert werden. Im vorliegenden Versuch wurden die Zellen zusätzlich mit einem PE-Cy5-konjugierten anti-CD4-AK sowie mit einem PE-konjugierten anti-CD8-AK markiert. 94 IV. Ergebnisse p=0,05 * % Lymphozyten 7.5 p=0,047 5.0 2.5 0.0 Vorher 6 12 18 24 30 36 42 48 Wochen Therapie mit Copaxone Median * signifikant nach Wilcoxon-test (p < 0,05) Abb. 74: Prozentualer Anteil apoptotischer Lymphozyten im peripheren Blut von MS-Patienten vor Beginn der Therapie und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1. Dargestellt sind die Einzelwerte sowie der jeweilige Median. * * 10.0 % T-Helfer Zellen * * 7.5 p=0,036 p=0,008 p=0,049 p=0,041 5.0 2.5 0.0 Vorher 6 12 18 24 30 36 42 48 Wochen Therapie mit Copaxone Median * signifikant nach Wilcoxon-Test (p < 0,05) Abb. 75: Prozentualer Anteil apoptotischer T-Helfer-Zellen im peripheren Blut von MSPatienten vor Beginn der Therapie und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1. Dargestellt sind die Einzelwerte sowie der jeweilige Median. Der prozentuale Anteil apoptotischer Th -Zellen war nach 30, 36, 42 und 48 Wochen Therapie mit Cop1 signifikant höher als vor Beginn der Therapie (siehe Abb.75). Berechnet wurde diese Statistik mit Hilfe des nicht-parametrischen Wilcoxon-Rank-Tests. Der prozentuale Anteil der mittels TUNEL-Methodik erfassten apoptotischen CD8-positiven Lymphozyten zeigte einen signifikanten Abfall des Anteils apoptotischer Zellen nach 12 Wochen 95 IV. Ergebnisse Therapie. Alle weiteren Werte zeigten keine Veränderungen im Vergleich zum Ausgangswert (Daten nicht dargestellt). 4.5.2.2. Untersuchung der Zytokin-Produktion humaner Leukozyten unter Cop-1-Therapie Vor Therapiebeginn und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Therapiebeginn mit Copaxone® wurde den 19 MS-Patienten peripheres Blut abgenommen, zur Gerinnungshemmung heparinisiert und mittels Dichtegradienten die PBMC isoliert (siehe II.2.3.). Anschließend wurde der prozentuale Anteil Zytokin-produzierender Zellen mittels intrazellulärer Zytokinfärbung (siehe II.2.4.) bestimmt. Parallel zur Färbung mit den die Zytokine markierenden Antikörpern wurden PE-Cy5konjugierte anti-CD4-AK zur Charakterisierung der T-Helfer-Zellen eingesetzt. Im Folgenden sind die Ergebnisse der intrazellulären Zytokin-Messungen bei Lymphozyten und Th -Zellen aus dem Blut der mit Copaxone behandelten MS-Patienten dargestellt. Die Produktion folgender Zytokine wurde durchflusszytometrisch bestimmt: INF-γ, TNF-α, TGF-β, IL-2, IL-4, IL-10. Die statistischen Berechnungen wurden jeweils mit dem nicht-parametrischen Wilcoxon-Rank-Test durchgeführt. a) IL-2- produzierende Lymphozyten 24 und 30 Wochen nach Therapiebeginn war der prozentuale Anteil IL-2-produzierender Lymphozyten signifikant höher als vor Therapiebeginn. Alle anderen Werte zeigten keine statistisch signifikanten Veränderungen (Daten nicht dargestellt). b) TNF-α α -produzierende Lymphozyten * p=0,041 % Lymphozyten 30 20 10 0 Vorher 6 Wochen 12 Wochen 18 Wochen 24 Wochen 30 Wochen 36 Wochen 42 Wochen 48 Wochen Therapie mit Cop-1 Abb. 76: Prozentualer Anteil TNF-α α -produzierender Lymphozyten aus dem peripheren Blut von MS-Patienten vor Therapiebeginn und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Copaxone® 96 IV. Ergebnisse Der prozentuale Anteil TNF-α-produzierender Zellen stieg während der Therapie mit Cop-1 leicht an, war nach 24 Wochen statistisch signifikant erhöht und fiel dann wieder leicht ab (siehe Abb. 76). c) IL-4-produzierende Lymphozyten * p = 0,035 * p = 0,047 * p = 0,002 % Lymphozyten 10.0 * p = 0,034 7.5 5.0 * p = 0,020 * p = 0,021 2.5 0.0 Baseline 6 12 18 24 30 36 42 48 Wochen Therapie mit Copaxone median * signifikant nach Wilcoxon-Test (p < 0,05) Abb. 77: Prozentualer Anteil IL-4 produzierender Lymphozyten aus dem peripheren Blut von MS-Patienten vor Therapiebeginn und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1 Die deutlichsten Veränderungen auf der Zytokinebene zeigten sich im Anstieg des Anteils IL-4produzierender Lymphozyten. IL-4 gilt als Th2-typisches Zytokin. Sechs (p=0,021), 12 (p=0,020), 18 (p=0,034), 24 (p=0,002), 36 (p=0,047) und 42 Wochen (p=0,035) nach Beginn der Therapie mit Cop-1 war der prozentuale Anteil IL-4-produzierender Lymphozyten signifikant höher als vor Therapiebeginn (siehe Abb. 77). Die statistischen Berechnungen wurden mit dem Wilcoxon-RankTest durchgeführt. d) IL-10-produzierende Lymphozyten Nach 24 Wochen Therapie mit Cop-1 zeigte sich ein signifikanter Anstieg des prozentualen Anteils IL-10-produzierender Lymphozyten im Vergleich zum Wert vor Therapiebeginn (o. Abb.). Alle anderen Werte zeigten keine statistisch signifikanten Veränderungen. e) TGF-β β -produzierende Lymphozyten Es fand sich zu keinem Zeitpunkt während des ersten Jahres Therapie mit Cop-1 eine signifikante Veränderung des Anteils TGF-β-produzierender Lymphozyten (o. Abb.). 97 IV. Ergebnisse f) INF-γγ -produzierende T-Helfer-Zellen Verglichen mit dem Wert vor Beginn der Therapie war zu keinem Zeitpunkt während des ersten Jahres Therapie mit Cop-1 ein signifikant veränderter Prozentsatz INF-γ-produzierender Th -Zellen zu erkennen (o. Abb.). g) IL-2- produzierende T-Helfer-Zellen Der prozentuale Anteil der IL-2-produzierender Th -Zellen stieg in Woche 24 und 30 nach Therapiebeginn im Vergleich zum Wert vor der Therapie signifikant an (o. Abb.). Alle anderen Werte zeigten keine statistisch signifikanten Veränderungen. h) TNF-α α -produzierende T-Helfer-Zellen Nur nach 42 Wochen Therapie mit Cop-1 zeigte sich ein statistisch signifikanter Abfall TNF-αproduzierender T-Helfer-Zellen (o. Abb.). Zu allen anderen Zeitpunkten fanden sich keine Veränderungen im Vergleich zum Ausgangswert. i) IL-4-produzierende T-Helfer-Zellen Der prozentuale Anteil IL-4-produzierender Th -Zellen stieg in Woche 24 und 42 nach Therapiebeginn im Vergleich zum Wert vor der Therapie signifikant an (o. Abb.). Alle anderen Werte zeigten keine statistisch signifikanten Veränderungen. j) IL-10-produzierende T-Helfer-Zellen Verglichen mit dem Wert vor Beginn der Therapie war zu keinem Zeitpunkt während des ersten Jahres Therapie mit Cop-1 ein signifikant veränderter Prozentsatz IL-10-produzierender Th -Zellen zu beobachten (o. Abb.). k) TGF-β β -produzierende T-Helfer-Zellen Zu keinem Zeitpunkt während der Therapie mit Cop-1 fand sich ein signifikant veränderter Prozentsatz TGF-β-produzierender Th -Zellen im Vergleich zu den Werten vor Therapiebeginn (o. Abb.). 4.5.2.3. Untersuchung verschiedener Lymphozytenpopulationen und Aktivierungsmarker unter Cop-1-Therapie Vor Therapiebeginn und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Therapiebeginn mit Copaxone® wurde den 19 MS-Patienten peripheres Blut abgenommen, zur Gerinnungshemmung EDTA zugesetzt und anschließend mittels spezifischer, Fluorochrom-konjugierter AK verschiedene 98 IV. Ergebnisse Zellpopulationen charakterisiert (siehe II.2.5.). Mit Hilfe der Dreifarben-Durchflusszytometrie wurden folgende Zelltypen markiert: - CD3-Markierung = T-Lymphozyten, - CD3 + CD4-Markierung = T-Helfer-Zellen, - CD3 + CD8-Markierung = CD8-positive T-Lymphozyten (Zytotoxische T-Lymphozyten), - CD3 + CD69-Markierung = aktivierte T-Lymphozyten, - CD3 + CD4 + CD69-Markierung = aktivierte Th-Zellen, - CD3 + CD8 + CD69-Markierung = aktivierte, zytotoxische T-Lymphozyten. Bei dem Molekül CD69 handelt es sich um ein in einer sehr frühen Phase der Aktivierung einer Zelle auf der Oberfläche exprimiertes Molekül, das auch unter dem Namen ‚activation-induced molecule’ (AIM) bekannt ist (Ziegler 1994). 42 Wochen nach Beginn der Therapie mit Cop-1 stieg der Anteil der T-Helfer-Zellen im Blut von MSPatienten signifikant im Vergleich zum Ausgangswert an (p=0,011). Der Anteil der CD8-positiven TLymphozyten im peripheren Blut von MS-Patienten ging nach 6 (p=0,002), 30 (p=0,008), 42 (p=0,049) und 48 Wochen (p=0,011) Therapie mit Cop-1 statistisch signifikant zurück (Daten nicht dargestellt). Die statistischen Berechnungen wurden unter Verwendung des Wilcoxon-Rank-Tests durchgeführt. * p=0,036 * p=0,020 * p=0,039 * p=0,013 p=0,05 * p=0,004 % T-Lymphozyten 20 15 10 5 0 Vorher 6 12 18 24 30 36 42 48 Wochen Therapie mit Copaxone median * signifikant nach Wilcoxon-Test (p < 0,05) Abb. 78: Prozentualer Anteil aktivierter T-Lymphozyten aus dem peripheren Blut von MSPatienten vor Beginn der Therapie und 6, 12, 18, 24, 30, 36, 42 und 48 Wochen nach Beginn der Therapie mit Cop-1 99 IV. Ergebnisse Wie in Abb. 78 dargestellt, war 6 , 12, 18, 24 und 48 Wochen nach Beginn der Therapie mit Cop-1 verglichen mit dem Wert vor Therapiebeginn ein Anstieg des prozentualen Anteils aktivierter TLymphozyten zu beobachten. In Woche 36 war der Wert fast signifikant (p=0,05; Signifikanzniveau p<0,05). Verglichen mit dem Wert vor Beginn der Therapie stieg der prozentuale Anteil aktivierter Th -Zellen in Woche 48 signifikant an. Zu allen anderen Messzeitpunkten waren die gemessenen Werte nicht signifikant verändert (Daten nicht dargestellt). Der prozentuale Anteil aktivierter CD8-positiver T-Lymphozyten im Blut von MS-Patienten änderte sich während der Therapie mit Cop-1 nicht (o. Abb.). 4.5.2.4. Vergleich der immunologischen Parameter unter Berücksichtigung des Krankheitsverlaufs Die oben dargestellten Ergebnisse beziehen sich immer auf die bei allen 19 Patienten erhobenen Messwerte. Um zu untersuchen, ob es einen Zusammenhang zwischen den immunologischen Veränderungen und dem Ansprechen auf die Therapie mit Cop-1 gibt, wurden die Patienten in zwei Gruppen aufgeteilt. Zum einen in die Gruppe von Patienten, die während der einjährigen Therapie mit Cop-1 keinen Krankheitsschub hatten und sich klinisch nicht verschlechterten, und zum anderen in die Gruppe der Patienten, die entweder mindestens einen Krankheitsschub hatten, oder eine deutlich klinische Verschlechterung zeigten. Die klinische Verschlechterung oder Verbesserung wurde mit Hilfe des ‚expanded disability status scale’ (EDSS) unmittelbar vor Therapiebeginn und nach 6 bzw. 12 Monaten Therapie mit Copaxone® gemessen (Kurtzke 1983). Von den insgesamt 19 MS-Patienten hatten während des Beobachtungszeitraumes 4 Patienten mindestens einen Krankheitsschub, 7 Patienten verschlechterten sich klinisch um mindestens einen Punkt auf der EDS-Skala und 9 Patienten hatten weder einen Krankheitsschub, noch eine Verschlechterung der Krankheitssymptome und galten daher als stabil oder gebessert unter Cop-1-Therapie. Die statistische Signifikanz möglicher immunologischer Veränderungen wurde daher für alle in IV.4.5.2.1. bis 3. analysierten Parameter noch einmal für die zwei Patientengruppen: - 10 Patienten mit sichtbaren klinischen Verschlechterungen, - 9 Patienten mit stabilem oder verbessertem Krankheitsverlauf, getrennt berechnet. Wegen der kleinen Gruppen (10 bzw. 9 Patienten) war ein statistisch signifikanter Unterschied eigentlich kaum zu erwarten Bei den 9 Patienten, deren Krankheitssymptome unter Therapie mit Cop-1 stabil blieben oder sich besserten wurde ein signifikanter Anstieg apoptotischer Th-Zellen nach 30 (p=0,038) bzw. 42 (p=0,021) Wochen Therapie mit Copaxone® beobachtet. Nach 36 und 48 Wochen Therapie war zwar auch ein Anstieg der mittleren Apoptoserate zu beobachten, dieser Anstieg war jedoch statistisch nicht 100 IV. Ergebnisse signifikant. Bei der Messung der Proben aller 19 Patienten (siehe Abb.) war der Anstieg der Apoptoserate der T-Helfer-Zellen sowohl nach 30, 36, 42 und 48 Wochen signifikant gewesen. Auch bei den 10 Patienten, die unter Cop-1 Therapie einen Krankheitsschub hatten oder/und deren Krankheitssymptome sich verschlechterten war ein Anstieg der Apoptoserate von T-Helfer-Zellen im peripheren Blut der MS-Patienten nach 30, 36, 42 und 48 Wochen zu beobachten. Dieser Anstieg war aber zu keinem Zeitpunkt signifikant (Daten nicht dargestellt). Außerdem stieg bei den 9 Patienten, deren Krankheitssymptome sich unter Cop-Therapie besserten oder stabil blieben, der Anteil der IL-4-produzierenden Lymphozyten nach 6 (p=0,026), 24 (p=0,008), 36 (p=0,021) und 42 Wochen (p=0,028) signifikant an. Ein signifikanter Anstieg des Anteils der IL-4produzierenden Lymphozyten war bei den Patienten, die Krankheitsschübe hatten oder deren Krankheitssymptome sich verschlechterten, nicht zu beobachten (Daten nicht dargestellt). Bei den 9 Patienten, die gut auf die Cop-1 Therapie ansprachen, war außerdem ein Anstieg des prozentualen Anteils aktivierter T-Lymphozyten zu beobachten. Dieser Anstieg war nach 24 (p=0,028), 36 (p=0,013) und 48 (p=0,012) Wochen Therapie mit Cop-1 statistisch signifikant (o.Abb). Bei den Patienten, deren Krankheitssymptome sich unter der Therapie verschlechterten, stieg der Anteil aktivierter T-Lymphozyten im peripheren Blut ebenfalls an, war aber nur nach 6 Wochen Therapie (p=0,028) signifikant gestiegen (Daten nicht dargestellt). 101 V. Diskussion V. Diskussion 1. Untersuchung verschiedener EAE-Modelle Eines der Ziele der vorliegenden Arbeit ist die Etablierung von murinen EAE-Modellen, die anschließend für weitere Untersuchungen eingesetzt werden können. Ein für immunologische, pathologische oder therapeutische Untersuchungen geeignetes EAE-Modell muss bestimmte Kriterien erfüllen. Zum einen ist es notwendig, dass eine möglichst große Anzahl der Versuchstiere nach Krankheitsinduktion wirklich an einer EAE erkrankt (Prävalenz > 80 %) zum anderen muss der individuelle Krankheitsverlauf so schwer sein, dass Unterschiede im Krankheitsverlauf auch tatsächlich deutlich werden (maximaler Behinderungsgrad > 2,0). Leichte Krankheitssymptome bis zu einem Behinderungsgrad von 1,0 sind häufig schwierig zu differenzieren (siehe Tab. 6). Bei den unter IV.1. beschriebenen Versuchen zur Etablierung verschiedener EAE-Modelle zeigte sich, dass die Tiere, abhängig von dem verwendeten Mäusestamm und der zur Krankheitsinduktion eingesetzten Substanz, unterschiedlich schwere Krankheitssymptome entwickelten. Auch der Anteil der Tiere einer Gruppe, bei denen nach Krankheitsinduktion Krankheitssymptome auftraten, variierte in den verschiedenen EAE-Modellen stark. Wie unter IV.1.5. beschrieben, entwickeln die Tiere der verschiedenen Inzuchtstämme unterschiedlich starke Krankheitssymptome. So zeigen C57BL/6Mäuse nach Krankheitsinduktion mit PLP 139-151 -Peptid so gut wie keine Behinderungen, BALB/cMäuse erkranken leicht, jedoch SJL/J-Mäuse zeigten deutlich stärkere Krankheitssymptome. Allerdings ist zu berücksichtigen, dass in C57BL/6-Mäusen nur mit einem Peptid versucht wurde eine EAE auszulösen. Möglicherweise, und Ergebnisse anderer Studien deuten darauf hin (Sun 2001, Okuda 2002), ist es mit anderen Substanzen auch in C57BL/6 möglich eine EAE mit deutlichen Krankheitssymptomen auszulösen. Für diese sehr unterschiedlichen Schweregrade der Erkrankung können verschiedene Mechanismen verantwortlich sein. Die Mäuse der einzelnen Inzuchtstämme unterscheiden sich bezüglich ihrer Major Histokompatibilitätskomplex-Gene (MHC) und besitzen unterschiedliche H-2 Haplotypen (H-2 = MHC der Maus)(siehe Tab. 12). Verschiedene Studien haben gezeigt, dass beim Menschen ein direkter Zusammenhang zwischen der Expression bestimmter Typen des ,human leukocyte antigen’ (HLA)-Typ (HLA = MHC des Menschen) und der Wahrscheinlichkeit, an Multipler Sklerose zu erkranken, besteht (Olerup 1991, Epplen 1997). Dies legt die Vermutung nahe, dass auch bei den an EAE erkrankten Mäusen der H-2-Haplotyp bei der Krankheitsinduktion und der Schwere der Krankheitssymptome eine Rolle spielt. Über die Bindung von MHC-Peptid-Komplexen an T-ZellRezeptoren während der Antigenpräsentation sind die MHC-Moleküle entscheidend an der Auslösung und Manifestation einer Immunantwort beteiligt. Möglicherweise sind einige MHC-Haplotypen stärker an der Aktivierung autoreaktiver T-Zellen beteiligt als andere (Das 2000). Auch die Bindung 102 V. Diskussion von Myelin-spezifischen Peptiden in die MHC-Spalte ist möglicherweise bei einigen MHCHaplotypen häufiger und/oder stärker als bei anderen Haplotypen. Darüber hinaus können aber neben dem H-2-Haplotyp der Mäuse auch noch andere Faktoren für die unterschiedliche Schwere der Erkrankungen bei den verschiedenen Mäusestämmen verantwortlich bzw. beteiligt sein. Da sowohl bei der EAE als auch bei der MS Lymphozyten und hier speziell TLymphozyten eine wichtige Rolle spielen, wurde in der vorliegenden Arbeit die T-/B-Zell-Ratio bei Mäusen der verschiedenen Mäusestämme im Blut, in der Milz und in den Lymphknoten bestimmt. Wie unter IV.2. dargestellt, unterscheidet sich überraschenderweise der Anteil der verschiedenen Lymphozytensubpopulationen von einem Mäusestamm zum anderen stark. Die stark auf die Induktion einer EAE reagierenden SJL/J-Mäuse haben einen deutlich höheren Anteil an T- als an B-Zellen, wohingegen die auf eine EAE-Induktion schwächer reagierenden C57BL/6- und BALB/c-Mäuse einen deutlich höheren Anteil an B- als an T-Lymphozyten haben. Da die EAE als T-Zell-vermittelte Erkrankung gilt, d.h. da die Erkrankung durch den Transfer von T-Zellen von erkrankten auf gesunde Mäuse übertragbar ist, nicht jedoch durch den Transfer von Antikörpern, spricht einiges dafür, dass neben dem MHC auch die unterschiedliche Zusammensetzung der Zellpopulationen in den Immunorganen der Versuchstiere eine Rolle bei der Pathogenese und Manifestation der Erkrankung spielt. Interessanterweise lassen sich EAE-Modelle, bei denen eine stärkere Beteiligung von Antikörpern beschrieben ist, z.B. MOG-induzierte EAE, eher bzw. auch in C57BL/6-Mäusen, also Tieren mit einer niedrigen T-/B-Zell-Ratio, induzieren (Okuda 2002). Diese EAE-Typen werden in einigen Arbeiten als experimentelle allergische Enzephalomyelitiden bezeichnet und von den experimentellen autoimmunen Enzephalomyelitiden auf Grund der stärkeren Beteiligung von Antikörpern, vor allem bei der Antikörper-vermittelten Demyelinisierung, unterschieden (Wekerle 1994, Weiner 2001). Es zeigte sich im Verlauf der Arbeit, dass von den getesteten EAE-Modellen, die folgenden aufgrund ihrer Prävalenz und der Schwere der Erkrankung für die weiteren Versuche geeignet sind: 1. Die Krankheitsinduktion mit PLP 139-151 -Peptid bei weiblichen SJL/J-Mäusen ergibt einen primär schubförmig remittierenden und sekundär chronisch progredienten Verlauf. 2. Die Krankheitsinduktion mit MBP 87-99 -Peptid bei weiblichen SJL/J-Mäusen ergibt einen monophasischen, remittierenden Verlauf. 3. Die Krankheitsinduktion mit Rückenmarkshomogenat bei weiblichen SJL/J-Mäusen ergibt einen eher chronischen Krankheitsverlauf mit Schüben. 4. Die Krankheitsinduktion mit PLP 139-151 -Peptid und mit MBP 87-99 -Peptid bei weiblichen BALB/cMäusen ergibt jeweils einen leichten, schubförmig remittierenden Krankheitsverlauf. Bezogen auf ihre Krankheitssymptome konnten schwere Verläufe einer EAE in dieser Form nur in SJL/J-Mäusen beobachtet werden. Für weitere Untersuchungen erscheint es aber sinnvoll, auch Tiere eines Inzuchtstammes mit einem anderen H-2-Haplotyp und einer anderen T-/B-Zell-Ratio einzusetzen. Zudem spiegeln diese sehr unterschiedlichen Krankheitsverläufe in etwa die Breite der 103 V. Diskussion Krankheitsverläufe bei der Multiplen Sklerose wieder, so dass es in jedem Fall sinnvoll ist neue Therapiekonzepte auf ihre Wirksamkeit in verschiedenen EAE-Modellen zu testen. 2. Versuche mit Lipo-X 2.1. Therapieversuche mit Lipo-X Bei dem in der vorliegenden Arbeit verwendeten Lipo-X handelt es sich um ein Liponsäurederivat. Einige der in verschiedenen Arbeiten beschriebenen Effekte von Liponsäurederivaten in in vitro bzw. in vivo Untersuchungen suggerieren, dass diese auch für die Therapie der EAE geeignet sein könnten (Ohmori 1986, Biewenga 1997, Packer 1997). Unter IV.3.1. sind die Ergebnisse der im Verlauf dieser Arbeit durchgeführten Therapieversuche mit Lipo-X bei verschiedenen EAE-Modellen beschrieben. Die Ergebnisse des unter IV.3.1.1. beschriebenen Therapieversuchs mit BALB/c-Mäusen nach Krankheitsinduktion mit PLP 139-151 -Peptid zeigen einen leichteren Krankheitsverlauf bei den mit LipoX behandelten Tieren als bei den unbehandelten Tie ren. Dieser Effekt ist allerdings nicht signifikant. Diese Versuchstiere wurden am Tag 0 bzw. am Tag 5 nach Krankheitsinduktion erstmalig mit Lipo-X behandelt. Da die ersten Krankheitssymptome bereits 3-8 Tage nach Krankheitsinduktion auftreten, könnte die Zeitspanne zwischen Therapiebeginn und Krankheitsmanifestation einfach zu kurz gewählt worden sein, um einen signifikanten Effekt zu erzielen. Daher wurde im nächste Versuch ein prophylaktisches Therapiekonzept gewählt und die Therapie mit Lipo-X bereits neun Tage vor Krankheitsinduktion begonnen (siehe IV.3.1.2.). Für diesen Versuch, der als Blindversuch durchgeführt wurde, wurde das EAE-Modell gewählt, das sich in den Vorversuchen als das mit dem schwersten Krankheitsverlauf erwiesen hatte (PLP 139-151 -Peptid induzierte EAE in SJL/J). Nur zwei von zehn Tiere zeigen nach der prophylaktischen Behandlung mit Lipo-X überhaupt noch Krankheitssymptome und diese waren auch nur sehr leicht (siehe Abb. 24). Die Krankheitsaktivität der mit Lipo-X behandelten Tiere ist in diesem Versuch statistisch signifikant niedriger als bei der unbehandelter Kontrolltiere. Auch in dem dritten EAE-Modell, mit MBP 87-99 -Peptid in SJL/J-Mäusen, zeigte sich ein milderer Krankheitsverlauf bei den mit Lipo-X behandelten Tieren. Dieser Effekt war jedoch statistisch nicht signifikant. Auch diese Tiere wurden erst vier Tage nach Krankheitsinduktion erstmalig behandelt. Eine „prophylaktische“ Behandlung kommt beim Menschen zwar nicht infrage, da unbekannt ist, wer wann an MS erkranken wird. Trotzdem geben die sehr guten (und signifikanten) Ergebnisse dieses Versuchs einen Hinweis darauf, dass Lipo-X eine therapeutische Wirkung hat. In diesem Sinn sind auch die – zwar nicht signifikante, aber doch deutlichen – Verbesserungen im therapeutischen Ansatz durchaus als positiv zu werten. Im weiteren Verlauf der Arbeit wurde untersucht auf welche Art und 104 V. Diskussion Weise Lipo-X auf Komponenten des Immunsystems, die bei der Pathogenese der Erkrankung eine entscheidende Rolle spielen, wirkt. 2.2. In vitro Versuche mit Lipo-X In verschiedenen in vitro Versuchen wurden die Auswirkungen einer Stimulation mit Lipo-X auf die Zellen des Immunsystems untersucht (siehe IV.3.2.). Die wichtigsten Ergebnisse der in vitroUntersuchungen sind erstens die Hemmung der Proliferation von spezifisch und unspezifisch stimulierten Lymphknoten- und Milzzellen durch hohe Konzentrationen von Lipo-X, sowie der Anstieg der Proliferationsrate von PLP-spezifisch stimulierten Zellen nach Inkubation mit geringeren Dosierungen von Lipo-X. Zum zweiten die Tatsache, dass nach in vitro Stimulation mit Lipo-X der prozentuale Anteil apoptotischer Lymphozyten unverändert bleibt und drittens der Befund, dass die Stimulation mit Lipo-X nicht zur Produktion der folgenden Zytokine führt: IL-2, IL-4, IL-5 und IFN-γ. Allerdings ist bei geringen Konzentrationen von Lipo-X nach 24 Stunden ein leichter Anstieg der TNF-α-Produktion sowie bei höheren Konzentrationen von Lipo-X ein leichter Abfall der TNF-αProduktion peripherer Blutzellen nach 24 und 48 Stunden Inkubation zu finden (siehe Abb. 29). Die Tatsache, dass Lipo-X in niedrigeren Konzentrationen im in vitro Versuch andere Ergebnisse zeigt als nach Gabe von hochdosiertem Lipo-X, lässt sich damit erklären, das die Hauptwirkungen von Liponsäurederivaten nach Aufnahme in die Zelle intrazellulär ablaufen (Packer 1995, Sen 1996). In niedrigen Konzentrationen zeigt Lipo-X möglicherweise über extrazelluläre Mechanismen bzw. Bindung an die Zelle nur stimulierende Effekte. Die oben genannten Ergebnisse deuten daraufhin, dass die Hemmung der Proliferation von Lymphozyten durch die Gabe von Lipo-X in hohen Dosierungen nicht über den Mechanismus der Auslösung des apoptotischen Zelltods der Zellen läuft, sondern über andere zellregulierende Vorgänge. Die Wirkung von Liponsäurederivaten auf den Transkriptionsfaktor NF-κB wurde verschiedentlich beschrieben (Suzuki 1995, Packer 1995). Die DNA-Bindungsaktivität von NF-κB wird von alpha-Liponsäure inhibiert, was wiederum hemmend auf die von NF-κB aktivierten Gene wirkt. So gehört u.a. das TNF-α-Gen zu den Genen, die durch Bindung von NF-κB in der PromotorRegion aktiviert werden (Suzuki 1995). Dies erklärt die hemmende Wirkung von hochdosiertem Lipo-X auf die TNF-α-Produktion von peripheren Blutzellen. TNF-α wiederum wirkt aktivierend auf NF-κB, so dass durch die Inhibierung der TNF-α-Produktion wiederum ein aktivierendes Signal für NF-κB wegfällt. Neben der Wirkung auf das TNF-α-Gen beeinflusst NF-κB auch zahlreiche andere Gene der Zellregulation, u.a. verschiedene an der Aktivierung von Zellen beteiligte Gene (Hilliard 1999). Demzufolge lässt sich auch die proliferationshemmende Wirkung von Lipo-X auf Lymphozyten über die Wirkung auf den Transkriptionsfaktor NF-κB erklären. Diese Hemmung der Proliferation setzt 105 V. Diskussion nicht zwingend die Apoptose der Zelle voraus, es ist eher vorstellbar, dass die Zellen anergisch werden. In in vitro Versuchen mit Ratten Thymozyten wurde gezeigt, dass Liponsäurederivate in der Lage sind, die Induktion von Apoptose u.a. durch Freisetzung von Kortikosteroiden zu unterbinden (Packer 1995). Da NF-κB über die Regulation der Gene verschiedener im Immunsystem wirkender Komponenten (z.B.: TNF-α als Oligodendrozyten-toxischer Faktor, Adhäsionsmoleküle bei der Migration durch die Blut-Hirn-Schranke) bei der Pathogenese und Manifestation von Enzephalomyelitiden eine wichtige Rolle spielt, lässt sich der beobachtete positive therapeutische Effekt von Lipo-X auf die EAE über diesen Wirkmechanismus gut erklären. 2.3. Untersuchung der Wirkung von Lipo-X bei naiven Mäusen Um die Wirkmechanismen von Lipo-X nicht nur in vitro sondern auch in vivo zu untersuchen, wurden die unter IV.3.3. beschriebenen Versuche durchgeführt. Nach intraperitonealer Injektion von 2 mg Lipo-X (jeden 2. Tag) wurden periphere Blutzellen, Milzzellen sowie durch Peritoneal Lavage gewonnene Zellen von ansonsten unbehandelten Mäusen durchflusszytometrisch untersucht. Die wichtigsten Ergebnisse dieser Untersuchungen sind zum einen, dass sich in der Milz und im peripheren Blut der Mäuse nach Injektion von Lipo-X keine nennenswerten Verschiebungen in den Anteilen der einzelnen Leukozytensubpopulationen finden, und zum anderen, dass wesentliche Verschiebungen der prozentualen Anteile der verschiedenen Leukozytenpopulationen bei den ‚Peritoneal Exudate Cells’ (PEC) beobachtete werden konnten. Zum einen ist ein verhältnismäßig geringer Anstieg des Anteils an T-Lymphozyten bei den PEC nach i.p. Injektion von Lipo-X zu erkennen. Wesentlich deutlicher ist allerdings die starke Abnahme des Anteils an Monozyten und die enorme Zunahme des Anteils an Granulozyten in der durch Peritoneal Lavage gewonnenen Zellsuspension nach Injektion von Lipo-X (siehe Abb. 32). Dieser Effekt wird im zeitlichen Verlauf immer stärker. Die Monozyten und Granulozyten wurden zum einen mit Hilfe einer PappenheimFärbung im Ausstrich von PEC (siehe Abb. 33 und 34) und zum anderen durchflusszytometrisch mit Hilfe eines monoklonalen Antikörpers, der spezifisch gegen das Molekül Ly6G auf der Oberfläche dieser Zellen gerichtet ist, differenziert (siehe Abb. 35 und 36). Monozyten tragen nur relativ wenige dieser Moleküle auf der Zelloberfläche, wohingegen Granulozyten die Ly6G-Moleküle in einer um ein Vielfaches höheren Dichte auf ihrer Zelloberfläche exprimieren. Bei der durchflusszytometrischen Messung findet man entsprechend der Menge der an die Ly6G-Moleküle auf der Zelloberfläche gebundenen Fluorochrom-konjugierten, monoklonalen Antikörper ein schwächeres (= Monozyten) oder stärkeres Fluoreszenzsignal (= Granulozyten) der einzelnen Zellen. Die Färbung der PEC nach Pappenheim bietet die Möglichkeit die Zellen aufgrund ihrer Morphologie zu differenzieren. Da Monozyten nur noch in der Lage sind, sich in Makrophagen oder dendritische Zellen, aber nicht in 106 V. Diskussion Granulozyten weiter zu entwickeln, liegt die Vermutung nahe, dass es sich bei den ursprünglich als Monozyten identifizierten Zellen in Wirklichkeit um sog. ‚Granulocyte Macrophage Colony Forming Cells’ (GMCFC) handelt. Diese Vorläuferzellen sind in der Lage sich entweder in Monozyten oder in Granulozyten weiter zu entwickeln. Sie expremieren ebenfalls in geringem Umfang das Molekül Ly6G auf ihrer Zelloberfläche und zeichnen sich morphologisch durch einen großen Zellkern aus. Unter dem Einfluss von Lipo-X kommt es demzufolge in vivo zur Entwicklung von Granulozyten aus Vorläuferzellen. Die Rolle von Granulozyten während einer Enzephalomyelitis ist derzeit nicht verstanden. Es gibt erste Berichte darüber, dass zumindest bei einigen Enzephalomyelitiden auch Granulozyten an der Entzündungsreaktion innerhalb des ZNS beteiligt sind und vor allem über die von ihnen produzierten Chemokine den Krankheitsverlauf negativ beeinflussen (McColl 1998, Nygardas 2000). Ob die in den Versuchen dieser Arbeit beobachtete Anreicherung von Granulozyten im Peritoneum ein spezifisch für die Wirkung von Lipo-X in der Peritonealhöhle auftretendes Phänomen ist, oder ob es auch bei anderen Applikationsversuchen zur Verstärkung des Granulozyten-Anteils in verschiedenen Organen/Geweben kommt, ist noch unklar. 3. Versuche mit Cop-1 Copolymer-1 (Cop-1), auch als Glatiramerazetat oder Copaxone® bekannt, ist ein randomisiert synthetisiertes Gemisch aus Polypeptiden, das seid einigen Jahren zur Therapie der schubförmig verlaufenden Multiplen Sklerose zugelassen ist, dessen genaue Wirkmechanismen aber nur unzureichend bekannt sind. Da nur ein Teil der damit behandelten Patienten von der Therapie mit Cop-1 profitiert, ist es notwendig, mehr über die genaue Wirkungsweise von Cop-1 zu erfahren, um zukünftig möglicherweise über eine Subtypisierung der Patienten diese gezielter behandeln zu können. Unter IV.4. sind die Ergebnisse der in vitro- und in vivo-Untersuchungen der Wirkung von Cop-1 auf verschiedene Komponenten des Immunsystems dargestellt. 3.1. In vitro Versuche mit Cop-1 Die interessantesten Ergebnisse nach in vitro Stimulation mit Cop-1 sind die Wirkung von Cop-1 zum einen auf den Zelltod von Lymphozyten (siehe IV.4.1.1.) und zum anderen auf die Produktion verschiedener Zytokine durch periphere Blutzellen (siehe IV.4.1.2.). Mit Hilfe der Annexin V/ Propidiumjodid-Technik wurde nach 24-stündiger Stimulation mit Cop-1 der prozentuale Anteil toter Zellen bestimmt. Diese Technik erlaubt prinzipiell die Unterscheidung derjenigen toten Zellen, die eines apoptotischen Zelltodes sterben und aufgrund der Umstrukturierung im Bereich der Zellmembran Annexin V binden, von denjenigen toten Zellen, die „nekrotisch“ sterben und keine 107 V. Diskussion intakte Zellmembran mehr haben und daher sowohl Annexin V als auch Propidiumjodid binden (Van den Eijnde 1997). Über die Phosphatidylserine, die an der Oberfläche apoptotischer Zellen zu finden sind und an die Annexin V bindet, binden in vivo phagozytierende Zellen an die apoptotischen Zellen und entfernen diese, ohne dass es zur Freisetzung intrazellulärer Zellbestandteile kommt. In Zellkulturversuchen, in denen keine oder kaum professionelle phagozytierende Zellen vorhanden sind, gehen auch apoptotische Zellen einen ‚nekrotischen Weg’, d.h. die Zellmembranen werden durchlässig und Zellbestandteile gelangen in das umgebende Medium. Daher ist die Unterscheidung von Zellen, die eines apoptotischen Zelltodes sterben von denen, die eines „nekrotischen“ Zelltodes sterben in Zellkulturversuchen häufig nicht eindeutig vorzunehmen. Die in Abb. 38 dargestellten Ergebnisse der durchflusszytometrischen Analyse des Anteils der nach in vitro Stimulation mit Cop-1 sterbenden Lymphozyten, zeigen keine Veränderungen bezüglich des Prozentsatzes der Annexin-Vpositiven Zellen, aber einen deutlichen Anstieg der Propidiumjodid-positiven Zellen. Der Anteil Propidiumjodid-positiver Zellen steigt sehr deutlich mit der Konzentration des eingesetzten Cop-1 an. Aus diesen Ergebnissen lässt sich die Aussage ableiten, dass Cop-1 in Lymphozyten den Zelltod induziert. Ob dieser allerdings apoptotischer oder nekrotischer Art ist, ist mit diesem Versuch nicht eindeutig zu klären. Der in diesem Versuch gemessene Anteil sterbender Lymphozyten kann sich nicht ausschließlich aus autoreaktiven myelinspezifischen Lymphozyten zusammensetzen, da dieser Versuch mit Milzzellen naiver Mäuse durchgeführt wurde und hier nicht mit einem entsprechenden Anteil an autoreaktiven myelinspezifischen Lymphozyten zu rechnen ist. In verschiedenen Studien wird über einen sog. ‚Th1/Th2-Shift’ unter Stimulation mit Cop-1 berichtet (Neuhaus 2000, Miller 1998). Die Annahme liegt also durchaus nahe, dass es sich bei den als Folge der Stimulation mit Cop1 sterbenden Zellen um Lymphozyten mit Th1-typischem Zytokinmuster handelt und auf diese Weise eine Verschiebung der Th1/Th2-Ratio in Richtung der T-Helfer-Zellen mit Th2-typischen Zytokinmuster bewirkt wird. Dagegen sprechen allerdings die unter IV.4.1.2. beschriebenen Ergebnisse der Analyse der von peripheren Blutzellen produzierten Zytokine. Diese Ergebnisse zeigen keine Veränderungen der Konzentration der Th1-typischen Zytokine IL-4 und IL-5 sowie der Th2typischen Zytokine IFN-γ und IL-2 (alle unterhalb des Detektionslimits). Die Produktion von TNF-α aber steigt unter Stimulation mit Cop-1 erheblich an (siehe Abb. 39). Da bei diesen Stimulationsversuchen peripheres Blut eingesetzt wurde, sind auch Monozyten, die in deutlich stärkerem Maße TNF-α produzieren als Lymphozyten, in der Zellkultur vorhanden. Dies gibt Grund zu der Annahme, dass die gesteigerte Produktion von TNF-α in erster Linie auf die Wirkung von Cop1 auf Monozyten zurückzuführen ist. Auf eine Veränderung der Th1/Th2-Ratio kann aus den Ergebnissen dieses Versuchs nicht geschlossen werden. 108 V. Diskussion 3.2. Untersuchung der Wirkung von Cop-1 bei naiven Mäusen Neben den in vitro Versuchen wurden auch in vivo Untersuchungen zur Aufklärung der Wirkmechanismen von Cop-1 durchgeführt. Bei den unter IV.4.2. dargestellten Untersuchungen wurde gesunden unbehandelten Versuchstieren (SJL/J-, BALB/c-, C57BL/6-Mäuse) Cop-1 subkutan injiziert und anschließend verschiedene Leukozytenpopulationen im peripheren Blut, in der Milz und in den drainierenden Lymphknoten durchflusszytometrisch untersucht. Auffällig ist, dass bei den Tieren aller eingesetzten Mäusestämme am ersten bis dritten Tag nach Injektion von Cop-1 in den Lymphknoten der jeweiligen Tiere der prozentuale Anteil CD8-positiver Lymphozyten geringer wird. Der Anteil der B-Zellen steigt bei den Tieren der Mäusestämme, die ohnehin einen relativ hohen Anteil an B-Zellen haben, nach Injektion von Cop-1 an. Die Ergebnisse sind allerdings nicht eindeutig, was darauf hinweisen könnte, dass die Wirkmechanismen, über die Cop-1 auf das Immunsystem der Mäuse wirkt, sich in den verschiedenen Inzuchtstämmen unterscheiden (siehe IV.2.). 3.3. Therapieversuche mit Cop-1 bei an EAE erkrankten Mäusen Die unter IV.4.3. dargestellten Ergebnisse der Therapieversuche mit Copaxone® sind, abhängig vom eingesetzten Mäusestamm und von der zur Krankheitsinduktion eingesetzten Substanz, durchaus unterschiedlich. Mäuse des Inzuchtstammes BALB/c zeigen nach Krankheitsinduktion mit PLP 139-151 Peptid während der Therapie mit Cop-1 keine Abschwächung der Krankheitssymptome. Hierbei ist allerdings zu beachten, dass BALB/c-Mäuse generell einen relativ leic hten Krankheitsverlauf zeigen (siehe IV.1.2.). Bei weiblichen Mäusen des Inzuchtstammes SJL/J konnten die Symptome der EAE, wie in Abb. 61 und 66 dargestellt, sowohl nach der Krankheitsinduktion mit PLP- als auch mit MBPPeptid, nach dem prophylaktischen Einsatz von Cop-1 deutlich abgeschwächt werden. Dieser Effekt war nach Krankheitsinduktion mit MBP-Peptid signifikant. Diese Ergebnisse weisen daraufhin, dass es einen Zusammenhang zwischen eingesetztem Mäusestamm und dem Ansprechen auf eine Therapie mit Cop-1 gibt. Ein wichtiger, bereits beschriebener Effekt von Cop-1 ist die Bindung an den MHCKomplex und die Verdrängung von MBP-Peptiden aus der Spalte der MHC-kodierten Rezeptoren (Teitelbaum 1992, Racke 1992). Möglicherweise ist diese Wirkungsweise von Cop-1 dafür verantwortlich, dass die Tiere verschiedener Mäusestämme, die sich bezüglich ihres MHC-Haplotyps unterscheiden, unterschiedlich gut auf die Therapie mit Cop-1 ansprechen. Wie Fusco im Jahre 2001 zeigen konnte, scheint es auch beim Menschen einen Zusammenhang zwischen MHC-Typ und dem Ansprechen auf die Therapie mit Cop-1 zu geben (Fusco 2001). Neben dem MHC-Haplotyp könnte aber auch die bei den verschiedenen Mäusestämmen sehr unterschiedliche Zusammensetzung der Lymphozytenpopulation aus den verschiedenen Subpopulationen bei der Wirkung von Cop-1 eine 109 V. Diskussion Rolle spielen. Wenn Cop-1 in erster Linie auf T-Lymphozyten wirkt, könnte dies erklären, warum in den eher B-Zell-dominierten Mäusestämmen (BALB/c) (siehe IV.2.) die Immunantwort durch Cop-1 gar nicht oder nicht so stark beeinflusst werden kann. Beide Ansätze, sowohl die Abhängigkeit der Wirkung einer Therapie mit Cop-1 vom MHC-Haplotyp als auch von der individuellen Verteilung der Lymphozytenpopulationen, könnten aber genauso gut nebeneinander wirken und in Zukunft die Möglichkeit zu einer Subtypisierung der Patienten bieten. Ein weiteres Ergebnis dieser Therapieversuche mit Cop-1 bei an EAE erkrankten Tieren ist, dass die Wirkung von Cop-1 bei Tieren, deren Erkrankung mit einem MBP-Peptid induziert wurde, größer ist als bei Tieren, bei denen die Erkrankung durch Injektion eines PLP-Peptids erzeugt wurde. Da Cop-1 ursprünglich als Analogon zum MBP entwickelt wurde (Teitelbaum 1971) überrascht dieses Ergebnis nicht. Offensichtlich wirkt Cop-1 zwar nicht ausschließlich, aber doch am stärksten auf eine MBPspezifische EAE. In diesem Zusammenhang ist es interessant, dass es bei MS-Patienten im Verlauf der Erkrankung zum sog. ‚epitope spreading’ kommt. D.h. zu der anfangs eher geringen Anzahl von als Autoantigene wirkenden Proteinen bzw. Peptiden kommen im Laufe der Erkrankung vor allem als Folge von Phagozytoseprozessen, weitere Autoantigene hinzu (McRae 1995, Vanderlugt 2000). Patienten, die vor allem eine anti-MBP spezifische Entzündungsreaktion haben, profitieren möglicherweise stärker von der Therapie mit Copaxone® als Patienten, die vor allem eine Autoimmunreaktion gegen andere ZNS-Komponenten haben. Auch das genaue Verständnis für den Effekt des ‚epitope spreadings’ könnte in Zukunft dazu beitragen, Patienten aufgrund der Identifizierung der individuellen autoreaktiven, ZNS-spezifischen T-Lymphozyten genauer zu typisieren. 3.4. Untersuchung der Wirkung von Cop-1 bei an EAE erkrankten Mäusen Eine wichtige Erkenntnis, die aus den Ergebnissen der unter IV.4.4. beschriebenen Versuche gezogen werden kann, ist, dass Cop-1-spezifische Antikörper, unabhängig von ihrer Klassen- und Subklassenzugehörigkeit, offensichtlich keine Rolle bei der Therapie mit Cop-1 spielen. Dieses Ergebnis unterstützt die bereits unter V.3.3. postulierte Annahme, dass Cop-1 weniger auf BLymphozyten, sondern eher auf T-Lymphozyten wirkt. Ein weiteres interessantes Ergebnis der unter IV.4.4. beschriebenen Versuche ist die Korrelation zwischen dem CDI, als Bewertungsgrad der Krankheitsaktivität, und dem prozentualen Anteil der CD4- bzw. CD8-positiven Lymphozyten im peripheren Blut von SJL/J-Mäusen, die nach Krankheitsinduktion mit dem PLP 139-151 -Peptid an einer EAE erkrankt sind. Hier zeigen die CD4positiven, also die T-Helfer-Zellen, eine negative Korrelation zum CDI (Abb. 68). D.h. je stärker die Erkrankung, desto geringer der Anteil der T-Helfer-Zellen im peripheren Blut der Mäuse. Da sich auch in den Entzündungsplaques im ZNS der Mäuse (siehe IV.1.1.) in erster Linie T-Helfer-Zellen 110 V. Diskussion finden, liegt die Vermutung nahe, das der geringer werdende Anteil an CD4-Zellen in der Peripherie auf die Migration dieser Zellen ins ZNS zurückzuführen ist. Wird der Anteil der T-Helfer-Zellen in der Peripherie niedriger, wirkt sich dies automatisch auf den prozentualen Anteil der CD8-positiven Zellen aus. Allerdings erscheint es etwas fraglich, ob die Menge der ins ZNS einwandernden T-HelferZellen ausreicht, um im peripheren Blut derartige Verschiebung hervorzurufen. Da es aber während einer EAE zur verstärkten Expression von Adhäsionsmolekülen kommt, auch aber nicht nur im Bereich der Blut-Hirn-Schranke, ist es möglich, dass T-Helfer-Zellen aus dem peripheren Blut nicht nur ins ZNS einwandern, sondern auch in andere Gewebe. Es kann allerdings auch nicht ausgeschlossen werden, dass die Verschiebung der CD4/CD8-Ratio durch die Proliferation der CD8Zellen verursacht wird. Diese Möglichkeit wird durch die Ergebnisse einer Untersuchung von Karandikar et al. unterstützt, die davon berichten, dass die Therapie mit Copaxone® zu einer vermehrten CD8-T-Zell-Immunantwort führt (Karandikar 2002). In einer kürzlich veröffentlichten Arbeit berichtete Jacobsen darüber, dass es in der ‚cerebrospinal fluid (CSF)’ von MS-Patienten zu einer oligoklonalen Expansion von CD8-positiven T-Zellen kam (Jacobsen 2002). Überraschenderweise ist die oben beschriebene Korrelation zwischen CDI und CD4- bzw. CD8positiven Lymphozyten nicht bei SJL/J-Mäusen zu beobachten, die nach Injektion von MBP-Peptid an EAE erkranken. Erklärend ist hier festzustellen, dass die Krankheitsverläufe der PLP-Peptid bzw. MBP-Peptid-induzierten EAE sehr unterschiedlich sind (siehe IV.1.4.) und die jeweilige Blutabnahme daher in verschiedenen Krankheitsphasen lag (PLP-induziert: Remissionsphase; MBP-induziert: akute Phase). Ferner ist der Krankheitsverlauf nach Induktion der EAE mit PLP 139-151 -Peptid wesentlich schwerer als nach Induktion mit dem MBP 87-99 -Peptid. Dies alles zeigt, wie stark sich die verschiedenen EAE-Modelle voneinander unterscheiden und unterstreicht die Notwendigkeit der Differenzierung bzw. der Typisierung der verschiedenen EAE-Modelle und der individuellen MSVerläufe. Außerdem findet sich überraschenderweise bei den SJL/J-Mäusen, die nach Injektion von MBP-Peptid erkrankten, eine statistisch signifikante, negative Korrelation zwischen dem prozentualen Anteil der NK-Zellen im peripheren Blut und dem jeweiligen CDI. Leider konnte bei den entsprechenden Versuchen mit PLP-induzierter EAE bei SJL/J-Mäusen der Anteil der NK-Zellen nicht bestimmt werden, so dass hier kein Vergleich möglich ist. Über die Rolle von NK-Zellen bei Enzephalomyelitiden war lange Zeit wenig bekannt. Einige neuere Untersuchungen haben aber gezeigt, das sowohl in vitro als auch in vivo NK-Zellen an den während einer Enzephalomyelitis ablaufenden Entzündungsprozessen beteiligt sind. In in vitro-Untersuchungen wurde gezeigt, dass NK-Zellen bei der Lyse von den für die Remyelinisierung verantwortlichen Oligodendrozyten beteiligt sind (Morse 2001). Andererseits scheint zumindest ein Teil der NK-Zellen in der Lage zu sein, sog. Th2-typische Zytokine (IL-4, IL-10) zu produzieren und auf diese Weise an der Remission der Krankheitssymptome bei MS-Patienten mitzuwirken (Takahashi 2001). Möglicherweise führt die oben beschriebene Expansion peripherer NK-Zellen im weiteren Verlauf der Erkrankung zur 111 V. Diskussion Migration der NK-Zellen ins ZNS. In den Entzündungsläsionen sind dann möglicherweise die NKZellen bzw. die von ihnen produzierten Zytokine an der Veränderung des herrschenden Mikromilieus beteiligt, was zum Abklingen der Entzündungsreaktion führen kann. 3.5. Untersuchung der Wirkung von Cop-1 im Blut von MS-Patienten Die wichtigsten Ergebnisse der unter IV.4.5. dargestellten Untersuchungen an peripheren Blutzellen von MS-Patienten mit schubförmig remittierendem Krankheitsverlauf beziehen sich auf die Apoptoseauslösende Wirkung von Cop-1, auf den Aktivierungsgrad der T-Lymphozyten sowie auf die Produktion verschiedener Zytokine während der Therapie mit Copaxone®. Wie in Abb. 72 dargestellt, ist der Anteil der apoptotischen T-Helfer-Zellen nach in vitro Stimulation von PBMC mit Cop-1 bei Zellen von MS-Patienten signifikant höher als bei Zellen von gesunden Probanden. Außerdem steigt der prozentuale Anteil der apoptotischen Lymphozyten sowie der apoptotischen T-Helfer-Zellen im peripheren Blut von MS-Patienten nach 30 bzw. 42 Wochen Therapie mit Copaxone® signifikant und fortschreitend an (Abb. 74 und 75). Die Ergebnisse des in vitro Versuchs suggerieren, dass die Stimulation mit Cop-1 die Apoptose von solchen T-Helfer-Zellen bewirkt, die vor allem bei MSPatienten auftreten und im peripheren Blut von gesunden Probanden nur in deutlich geringerem Umfang zu finden sind. Dies trifft auf autoreaktive, ZNS-spezifische Th-Zellen zu. Der Zusammenhang zwischen der Apoptose von T-Lymphozyten, in erster Linie autoreaktiven ZNSspezifischen T-Lymphozyten und der Krankheitsremission ist bereits verschiedentlich für die EAE und die MS beschrieben bzw. diskutiert worden (Pender 1992, McFarland 1995, Gold 1997). Die Frage, wie hoch der Anteil an autoreaktiven, ZNS-spezifischen T-Zellen im peripheren Blut von MSPatienten ist, wurde in verschiedenen Studien untersucht und sehr unterschiedlich beantwortet (Allegretta 1990, Bieganowska 1997). Die Vermutung liegt aber nahe, dass es sich bei den unter in vitro Stimulation mit Cop-1 apoptotisch werdenden Th-Zellen nicht ausschließlich um autoreaktive, ZNS-spezifische Th-Zellen handelt, sondern ebenso um solche die nach Aktivierung eher dazu neigen apoptotisch zu werden als die Zellen der gesunden Probanden. Hier ist möglicherweise der Prozess des sog. ‚activation induced cell death (AICD)’ beteiligt (Budd 2001, Zimmermann 2001). Neben der in vitro beobachteten Apoptose-Induktion verursacht die Therapie mit Cop-1 auch in vivo die Apoptose peripherer Blutlymphozyten und hier speziell der T-Helfer-Zellen. Dieser Effekt wird allerdings erst nach etlichen Wochen (ab der 30. Woche) täglicher, subkutaner Injektion von Copaxone® nachweisbar. Klinische Studien haben gezeigt, dass auch die therapeutische Wirkung von Copaxone® erst nach ca. einem halben Jahr Therapie einsetzt (Johnson 1995 und 1998). Leider ist die Untersuchung der Wirkung einer Langzeittherapie mit Cop-1 auf die verschiedenen Komponenten des Immunsystems bei gesunden Probanden aus ethischen Gründen nicht möglich. Neben der Bestimmung der Apoptoserate von Lymphozyten im peripheren Blut der mit Cop-1 behandelten Patienten wurde 112 V. Diskussion auch der Aktivierungsgrad der Lymphozyten, speziell die Expression von CD69 (auch ‚activation induced molecule – AIM’ genannt) auf der Zelloberfläche, durchflusszytometrisch untersucht. Auch hier findet sich ein z.T. signifikanter Anstieg des prozentualen Anteils aktivierter T-Lymphozyten während der Therapie mit Copaxone®, der im Gegensatz zum Anstieg der Apoptoserate aber bereits erstmalig sechs Wochen nach Therapiebeginn zu beobachten ist. Trotzdem passt auch dieses Ergebnis zu der Annahme, dass Cop-1 in der Lage ist, in Lymphozyten einen ‚activation induced cell deathAICD’ auszulösen. Ein weiteres interessantes Ergebnis der unter IV.4.5. beschriebenen Untersuchungen zur Wirkungsweise von Cop-1 auf das Immunsystem von MS-Patienten ist der in Abb. 77 dargestellte Anstieg des prozentualen Anteils IL-4-produzierender Lymphozyten. Dieser ist vor allem bei Patienten, die eine Stabilisierung oder Besserung der Krankheitssymptome zeigen, besonders deutlich. Dieses Ergebnis unterstützt die auch schon von anderen Arbeitsgruppen postulierte Annahme, dass Cop-1 die verstärkte Produktion von Th-2-typischen, antiinflammatorisch wirkenden Zytokinen induziert (Neuhaus 2000, Miller 1998). Autoreaktive, ZNS-spezifische Zellen, die nach der Aktivierung durch Enzephalitogene wie MBP etc. ein eher Th1-typisches Zytokinmuster zeigen, produzieren nach Stimulation mit Cop-1 Th2-typische Zytokine (Neuhaus 2000). Ähnliche Effekte wurden bei Versuchen mit sog. ‚altered peptide ligands-APL’ beobachtet. APL sind Moleküle die sich von einem ursprünglichen Wildtyp-Molekül nur bezüglich einer oder zweier Aminosäuren, die aber an zentralen, für die Bindung an den T-Zell-Rezeptor (TCR) entscheidenden Stellen liegen, unterscheiden. Die Bindung der APL an die T-Zell-Rezeptoren löst nun in der Wildtyp-spezifischen TZelle z.T. völlig andere Mechanismen aus, als die Bindung des Wildtyp-Moleküls an denselben TCR. So kann z.B. die Bindung eines APL statt zu einer Aktivierung der T-Zelle, zur Anergie der Zelle führen, oder statt zur Produktion von proinflammatorisch wirkenden Zytokinen des Th1-Typs (nach Bindung des Wildtyp-Moleküls), zur Produktion von antiinflammatorisch wirkenden Zytokinen des Th2-Typs (Boutin 1997, Pearson 1997, Tao 1997). Derartige APL sind auch schon in der Behandlung verschiedener Enzephalomyelitiden eingesetzt worden (Kappos 2000). Die Tatsache, dass nach in vitro Stimulation mit Cop-1 bei Lymphozyten aus dem peripheren Blut von unbehandelten MSPatienten der prozentuale Anteil IL-10- produzierender Lymphozyten signifikant höher ist als bei Lymphozyten aus dem peripheren Blut von gesunden Probanden (Abb. 73), weist ebenfalls daraufhin, dass im peripheren Blut von MS-Patienten Zellen vorhanden sind, die nach der Aktivierung mit Cop-1 einen Th1 => Th2-Shift vollziehen. Der Mechanismus, über den Cop-1 auf Lymphozyten wirkt, scheint daher in vielen Bereic hen der Wirkungsweise von APL ähnlich zu sein. 113 VI. Zusammenfassung VI. Zusammenfassung Die vorliegende Arbeit beschäftigt sich mit den immunologischen Wirkmechanismen verschiedener zur Therapie von Enzephalomyelitiden eingesetzter Substanzen. Bei Enzephalomyelitiden handelt es sich um entzündliche Erkrankungen des Zentralen Nervensystems (ZNS) mit Autoimmunreaktionen gegen verschiedene Bestandteile der die Nerven-umhüllenden Myelinscheide. Die häufigste Enzephalomyelitis beim Menschen ist unter dem Namen Multiple Sklerose (MS) bekannt. In der vorliegenden Arbeit wurden zunächst mehrere Modelle der experimentellen autoimmunen Enzephalomyelitis (EAE), einem häufig verwendeten Tiermodell der MS, bei Mäusen untersucht, die sich sowohl bezüglich des verwendeten Mäusestamms (BALB/c, SJL/J, C57BL/6) als auch bezüglich des Krankheits-induzierenden Agens (MOG-, MBP-, PLP-Peptid, Rückenmarkshomogenat) voneinander unterschieden. Es zeigte sich, dass Krankheitsverlauf und Schwere der Erkrankung, abhängig von den verwendeten Inzuchtstämmen, stark variierte. Daraufhin durchgeführte durchflusszytometrische Analysen ergaben deutliche Unterschiede in den verschiedenen Lymphozytensubpopulationen in den lymphatischen Organen der Tiere der verschiedenen Inzuchtstämme. So zeigten Versuchstiere, in deren Lymphorganen ein höherer Anteil an BLymphozyten gefunden wurde, deutlich weniger ausgeprägte Krankheitssymptome und einen insgesamt milderen Krankheitsverlauf als Tiere mit einem höheren Anteil an T-Lymphozyten. Die Tiere der verschiedenen Inzuchtstämme unterscheiden sich in vielen Eigenschaften voneinander. Hervorzuheben ist jedoch der Unterschied bezüglich ihres MHC-Haplotyps (H-2), der nach den vorliegenden Informationen mit Sicherheit an der Ausprägung einer EAE beteiligt ist und möglicherweise auch bei Verlauf und Schwere der Erkrankung eine Rolle spielt. Bei der ersten der in dieser Arbeit auf ihre Wirkung im EAE-Modell untersuchten Substanzen handelt es sich um ein Liponsäurederivat (Lipo-X), das erstmalig in tierexperimentellen Versuchen zur Behandlung einer Enzephalomyelitis eingesetzt wurde. Die Versuche mit Mäusen verschiedener Inzuchtstämme ergaben gute bis sehr gute Therapieerfolge, so dass im weiteren Verlauf der Arbeit die Wirkung von Lipo-X auf die verschiedenen Komponenten des Immunsystems untersucht wurde. Dabei zeigte sich im in vitro Versuch, dass Lipo-X in hohen Dosierungen hemmend auf die Produktion des Tumor Nekrose Faktors-α (TNF-α) und auf die mit Hilfe eines 3 H-Thymidin-Assays bestimmte Proliferation spezifisch bzw. unspezifisch stimulierter Lymphknoten- und Milzzellen wirkt. Beide Effekte können den Krankheitsverlauf von Enzephalomyelitiden positiv beeinflussen. Dieses lässt sich mit der Wirkung von Liponsäurederivaten u.a. auf den Transkriptionsfaktor NF-κB erklären, der wiederum regulatorisch auf die TNF-α-Produktion sowie die Aktivierung und Proliferation verschiedener Zellen wirkt. Nach intraperitonealer Injektion von Lipo-X findet sich im Peritonealraum eine große Anzahl von Granulozyten, die sich höchstwahrscheinlich aus ‚Granulocyte Macrophage Colony Forming Cells’ (GMCFC) nach Stimulation mit Lipo-X entwickelt haben. Welche Rolle diese Granulozyten bei der therapeutischen Wirkung von Lipo-X auf an EAE erkrankte Tiere haben, ist 114 VI. Zusammenfassung noch unklar. Klar ist jedoch, dass die therapeutischen Versuche an Mäusen sowie die in vitroUntersuchungen so interessante Ergebnisse gebracht haben, dass dieses Therapiekonzept unbedingt auch in klinischen Studien bei MS-Patienten weiterverfolgt werden sollte. Im weiteren Verlauf dieser Arbeit wurde die Wirkung von Copolymer-1 (Cop-1, Glatiramerazetat, Copaxone®) auf die verschiedenen Komponenten des Immunsystems untersucht. Bei Cop-1 handelt es sich um ein randomisiert aus vier verschiedenen Aminosäuren (L-Glutamin 14,1 %, L-Tyrosin 9,5 %, L-Alanin 42,7 % und L-Lysin 33,8 %) synthetisiertes Gemisch von Polypeptiden. Cop-1 ist bereits als Medikament zur Behandlung der schubförmig, remittierend verlaufenden MS in verschiedenen Ländern zugelassen. Die Wirkmechanismen sind aber bis heute nur unzureichend bekannt. An Multipler Sklerose erkrankte Patienten zeigen nicht nur in Schwere und Symptomen sehr unterschiedliche Krankheitsverläufe, sie sprechen auch unterschiedlich gut auf die verschiedenen Therapiemöglichkeiten an. So kann eine Therapie, die dem einen Patienten nützt, dem anderen zumindest dadurch schaden, dass mit einer unwirksamen Therapie viel wertvolle Zeit vergeudet wird. Daher ist es dringend notwendig, sinnvolle Subtypisierung der MS-Patienten, z.B. auf genetischer oder immunologischer Ebene, von Nöten um gezielt Patienten mit individuellen Therapienkonzepten zu maximal zu helfen. Die Versuche mit verschiedenen Tiermodellen sollen dazu dienen Typisierungsmethoden, die auch auf Patienten übertragbar sind, zu entwickeln. Die Aufklärung der Wirkmechanismen von Cop-1 könnte eine frühzeitige Subtypisierung der Patienten in ‚NonResponder’ (= kein Ansprechen auf die Therapie) und in ‚Responder’ (= gutes Ansprechen auf die Therapie) ermöglichen und helfen neue wie alte Therapien sinnvoller und optimaler einzusetzen. In den in vitro- und in vivo-Untersuchungen bei Maus und Mensch zeigte sich, dass die deutlichste und vielleicht auch wichtigste Wirkung von Cop-1 die Auslösung des apoptotischen Zelltods von Lymphozyten und speziell von T-Helfer-Zellen ist. Die Apoptose der Zellen wurde mit verschie denen Techniken (TUNEL- und Annexin V/Propidiumjodid-Methode) mit Hilfe eines Durchflusszytometers sowohl in vivo als auch nach in vitro Stimulation muriner und humaner Leukozyten bestimmt. Da während der Therapie mit Cop-1 im peripheren Blut von MS-Patienten auch ein Anstieg des Anteils aktivierter T-Lymphozyten zu finden war, liegt die Vermutung nahe, dass es sich bei der durch Cop-1 ausgelösten Apoptose zumindest teilweise um einen Aktivierungs-induzierten Zelltod (AICD) handelt. Ein weiteres Ergebnisse der in der vorliegenden Arbeit durchgeführten Untersuchungen ist die Wirkung von Cop-1 auf die Produktion verschiedener Zytokine. Die Untersuchung der intrazellulären Zytokinproduktion von Lymphozyten aus dem peripheren Blut von MS-Patienten während einer einjährigen Therapie mit Cop-1 ergab einen signifikanten Anstieg des Anteils IL-4-produzierender Lymphozyten vor allem bei den Patienten, die am stärksten von der Therapie mit Cop-1 profitierten. Die Induktion der Apoptose u.a. von autoreaktiven, ZNS-spezifischen Lymphozyten sowie die verstärkte Produktion antiinflammatorisch wirkender Zytokine scheinen daher wichtige Mechanismen zu sein, über die Cop-1 das Immunsystem moduliert und die Entzündungsreaktion im ZNS hemmt. 115 VI. Zusammenfassung Die tierexperimentellen Untersuchungen der therapeutischen Wirkung von Cop-1 bei an EAE erkrankten Mäusen ergab, dass der Einfluss der Therapie mit Cop-1 auf den Krankheitsverlauf bzw. die Schwere der Erkrankung sowohl vom eingesetzten Inzuchtstamm abhängt als auch von dem zur Krankheitsinduktion verwendeten Peptid. Die in diesen Versuchen gewonnenen Erkenntnisse, nämlich dass Cop-1 in erster Linie bei den Mäuse der Inzuchtstämmen wirkt, die eine höhere T-/B-Zell-Ratio haben, sowie bestimmte H-2-Haplotypen besitzen, bietet möglicherweise erste Ansätze für eine Subtypisierung von MS-Patienten. Mit Hilfe der vorliegenden Arbeit ist es gelungen, die Mechanismen, über die Lipo-X sowie Copolymer-1 auf verschiedene Komponenten des Immunsystems wirken, genauer zu beleuchten und, mit Lipo-X, eine für den späteren therapeutischen Einsatz interessante, neue Therapie zu finden. 116 VII. Literaturverzeichnis VII. Literaturverzeichnis 1. Aharoni R, Teitelbaum D, Sela M, Arnon R. Copolymer 1 induces T cells of the T helper type 2 that crossreact with myelin basic protein and suppress experimental autoimmune encephalomyelitis. Proc. Natl. Acad. Sci. USA 94: 10821-10826. (1997) 2. Ando DG, Clayton GJ, Kono D, et al. Encephalitogenic T-cells in the B10.PL model of experimental allergic encephalomyelitis (EAE) are of the Th1-lymphokine subtype. Cell. Immunol. 124:132-143. (1989) 3. Archelos JJ, Storch MK, Hartung HP. The role of B cells and autoantibodies in multiple sclerosis. Ann. Neurol. 47: 694-706. (2000) 4. Bauer J, Stadelmann C, Bancher C, Jellinger K, Lassmann H. Apoptosis of T lymphocytes in acute disseminated encephalomyelitis. Acta Neuropathol (Berl) 97: 543-546. (1999) 5. Baur A, Harrer T, Peukert M, Jahn G, Kalden JR, Fleckenstein B. Alpha-lipoic acid is an effective inhibitor of human immuno-deficiency virus (HIV-1) replication. Klin. Wochenschr. 69: 722-724. (1991) 6. Biewenga G, Haenen GR, Bast A. The role of lipoic acid in the treatment of diabetic polyneuropathy. Drug Metab. Rev. 29: 1025-1054. (1997) 7. Boutin Y. Distinct biochemical signals characterize agonist- and altered peptide ligand-induced differentiation of naive CD4+ T cells into Th1 and Th2 subsets. J Immunol Dec 15; 159 (12), 5802-9, (1997). 8. Brenner T, Arnon R, Sela M, Abramsky O, Meiner Z, Riven-Kreitman R, Tarcik N, Teitelbaum D. Humoral and cellular immune response to Copolymer 1 in multiple sclerosis patients treated with Copaxone. J. Neuroimmunol. 115: 152-160. (2001) 9. Budd RC. Activation-induced cell death. Curr. Opin. Immunol. 13:356-362. (2001) 10. Busse E, Zimmer G, Schopohl B, Kornhuber B. Influence of α-lipoic acid on intracellular glutathione in vitro and in vivo. Arzneim.-Forsch. 42: 829-831. (1992) 117 VII. Literaturverzeichnis 11. Chofflon M, Juillard C, Juillard P, Gauthier G, Grau GE. Tumor necrosis factor alpha production as a possible predictor of relapse in patients with multiple sclerosis. Eur. Cytokine Netw. 3: 523-531. (1992) 12. Correale J, Gilmore W, McMillan M, Li S, McCarthy K, Le T, Weiner LP. Patterns of cytokine secretion by autoreactive proteolipid protein-specific T cell clones during the course of multiple sclerosis. J. Immunol. 154: 2959-2968. (1995) 13. Das P, Abraham R, David C. HLA transgenic mice as models of human autoimmune disease. Rev. Immunogenet. 2:105-114. (2000) 14. Epplen C, Jäckel S, Santos SJM, D’Souza M, Pöhlau D, Dotzauer B, Sindern E, Haupts M, Rüde KP, Weber F, Stöver J, Poster S, Gehlen W, Malin JP, Przuntek H, Epplen JT. Genetic predisposition to multiple sclerosis as revealed by immunoprinting. Ann. Neurol. 41, 341-352. (1997) 15. Fridkis-Hareli M, Teitelbaum D, Gurevich E, Pecht I, Brautbar C, Kwon OJ, Brenner T, Arnon R, Sela M. Direct binding of myelin basic protein and synthetic copolymer 1 to class II major histocompatibility complex molecules on living antigen-presenting cells – specifity and promiscuity. Proc. Natl. Acad. Sci. USA 91: 4872-4876. (1994) 16. Friedman A, Reshef T, Cohen IR. Induction of experimental autoimmune encephalomyelitis by native myelin basic protein-activated T lymphocyte lines. Eur. J. Immunol. 22: 279-282. (1992) 17. Genain CP, Hauser SL. Experimental allergic encephalomyelitis in the New World monkey Callithrix jacchus. Immunol. Rev. 183:159-172. (2001) 18. Giovannoni G, Hartung HP. The immunopathogenesis of multiple sclerosis and Guillain-Barré syndrome. Curr. Opin. Neurol. 9:165-177. (1996) 19. Giovannoni G, Lai M, Thorpe J, Kidd D, Chamoun V, Thompson AJ, Miller DH, Feldmann M, Thompson EJ. Longitudinal study of soluble adhesion molecules in multiple sclerosis: correlation with gadolinium enhanced magnetic resonance imaging. Neurology 48: 1557-1565. (1997) 20. Gran B, Hemmer B, Vergelli M, McFarland HF, Martin R. Molecular mimicry and multiple sclerosis: degenerate T-cell recognition and the induction of autoimmunity. Ann. Neurol. 45: 559-567. (1999) 118 VII. Literaturverzeichnis 21. Hilliard B, Samoilova EB, Liu TT, Rostami A, Chen Y. Experimental Autoimmune Encephalomyelitis in NF-κB-deficient mice: roles of NF-κB in the activation differentiation of autoreactive T cells. J. Immunol. 163: 2937-2943. (1999) 22. Holz A, Bielekova B, Martin R, Oldstone M. Myelin-Associated Oligodendrocytic Basic Protein: Identification of an encephalitogenic Epitope and Association with Multiple Sclerosis. J. Immunol. 164: 1103-1109. (2000) 23. Jacobs R. Methoden der Immunologie. In: Schedlowski M., Tewes U. (Hrsg.) Psychoneuroimmunologie. Spektrum Akademi. (1996) 24. Jacobsen M, Cepok S, Quak E, Happel M, Gaber R, Ziegler A, Schock S, Oertel WH, Sommer N, Hemmer B. Oligoclonal expansion of memory CD8 (+) T cells in cerebrospinal fluid from multiple sclerosis patients. Brain 125: 538-550. (2002) 25. Johnson KP, Brooks BR, Cohen JA, Ford CC, Goldstein J, Lisak RP, Myers LW, Panitch HS, Rose JW, Schiffer RB, Vollmer T, Weiner LP, Wolinsky JS. Copolymer 1 reduces relapse rate and improves disability in relapsing remitting multiple sclerosis. Results of a phase III multicenter, double blind, placebo-controlled trial. Neurology 45: 1268-1276. (1995) 26. Johnson KP, Brooks BR, Cohen JA, Ford CC, Goldstein J, Lisak RP, Myers LW, Panitch HS, Rose JW, Schiffer RB, Vollmer T, Weiner LP, Wolinsky JS. Extended use of glatiramer acetate (Copaxone) is well tolerated and maintains its clinical effect on multiple sclerosis relapse rate and degree of disability. Copolymer 1 Multiple Sclerosis Study Group. Neurology 45: 1268-76. (1998) 27. Jung T, Schauer U, Heusser C, Neumann C, Rieger C. Detection of intracellular cytokines by flow cytometry. J Immunol Methods 159 (1-2): 197-207. (1993) 28. Kappos L, Comi G, Panitch H, Oger J, Antel J, Conlon P, Steinman L. Induction of a nonencephalitogenic type 2 T helper-cell autoimmune response in multiple sclerosis after administration of an altered peptide ligand in a placebo-controlled, randomized phase II trial. The Altered Peptide Ligand in Relapsing MS Study Group. Nat. Med. 6: 1176-82. (2000) 29. Karandikar NJ, Crawford MP, Yan X, Ratts RB, Brenchley JM, Ambrozak DR, Lovett-Racke AE, Frohmann EM, Stastney P, Donek DC, Komp RA, Racke MK. Glatiramer acetate (Copaxone) therapy induces CD8 (+) T cell response in patients with multiple sclerosis. J. Clin. Invest. 109: 641-649. (2002) 119 VII. Literaturverzeichnis 30. Korczyn AD, Nisipeanu P. Safety profile of copolymer 1, analysis of cumulative experience in the United States and Israel. J. Neurol. 243: 23-26. (1996) 31. Kurtzke JF. Rating neurologic impairment in multiple sclerosis: An expanded disability status scale (EDSS) Neurology 33, 1444-1452. (1983) 32. Kurtzke JF. Multiple sclerosis in time and space – geographic clues to cause. J. Neurovirol. 6: 134-140. (2000) 33. Maggi E, Parronchi P, Manetti R, Simonelli C, Piccinni M-P, Rudiu FS, De Carli M, Ricci M, Romagnani S. Reciprocal Regulatory Effects of IFN-gamma and IL-4 on the in Vitro development of Human Th1 and Th2 Clones. J Immunol 148: 2142-2147. (1992) 34. Maimone D, Gregory S, Arnason BGW, Reder AT. Cytokine levels in the cerebrospinal fluid and serum of patients with multiple sclerosis. J. Neuroimmunol. 32: 67-74. (1991) 35. Martin SJ, Reutelingsperger CP, McGahon AJ, Rader JA, van Schie RC, LaFace DM, Green DR. Early redistribution of plasma membrane phosphatidylserine is a general feature of apoptosis regardless of the initiating stimulus: inhibition by overexpression of Bcl-2 and Abl. J. Exp. Med. 182: 1545-56. (1995) 36. Martin R, McFarland HF. Immunological aspects of experimental allergic encephalomyelitis and multiple sclerosis. Crit. Rev. Clin. Lab. Sci. 32: 121-182. (1995) 37. Martin R, Ruddle NH, Reingold S, Hafler DA. T helper cell differentiation in multiple sclerosis and autoimmunity. Immunology Today 19: 495-498. (1998) 38. Martin R, Sturzebecher CS, McFarland HF. Immunotherapy of multiple sclerosis: where are we? Where should we go? Nat. Immunol. 2:785-788. (2001) 39. McFarland HI, Lobito AA, Johnson MM, Palardy GR, Yee CS, Jordan EK, Frank JA, Tresser N, Genain CP, Mueller JP, Matis LA, Lenardo MJ. Effective antigen-specific immunotherapy in the marmoset model of multiple sclerosis. J. Immunol. 166: 2116-2121. (2001) 40. McRae BL, Vanderlugt CL, DalCanto MC, Miller SD. Functional evidence for epitope spreading in the relapsing pathology of experimental autoimmune encephalomyelitis. J. Exp. Med. 182: 75-85. (1995) 120 VII. Literaturverzeichnis 41. Miller A, Shapiro S, Gershtein R, Kinarty A, Rawashdeh H, Honigman S, Lahat N. Treatment of multiple sclerosis with Copolymer-1 (Copaxone): implicating mechanisms of Th1 to Th2/Th3 immune-deviation. J. Neuroimmunol. 92: 113-121. (1998) 42. Morse RH, Seguin R, McCrea EL, Antel JP. NK cell-mediated lysis of autologous human oligodendrocytes. J. Neuroimmunol. 116: 107-115. (2001) 43. Neuhaus O, Farina C, Yassouridis A, Wiendl H, Then Bergh F, Dose T, Wekerle H, Hohlfeld R. Multiple sclerosis: comparison of copolymer-1-reactive T cell lines from treated and untreated subjects reveals cytokine shift from T helper 1 to T helper 2 cells. Proc. Natl. Acad. Sci. USA 97: 7452-7457. (2000) 44. O’Garra A. Cytokines Induce the Development of Functionally Heterogeneous T Helper Cell Subsets. Immunity 8: 275-282. (1998) 45. Ohmori H, Yamauchi T, Yamamoto I. Augmentation of the antibody response by lipoic acid in mice. II.Restoration of the antibody response in immunosuppressed mice. Jpn. J. Pharmacol. 42: 275280. (1986) 46. Okuda Y, Okuda M, Bernard CC. Gender does not influence the susceptibility of C57BL/6 mice to develop chronic experimental autoimmune encephalomyelitis induced by myelin oligodendrocyte glycoprotein. Immunol. Lett. 81:25-29. (2002) 47. Olerup O, Hillert J.HLA class II-associated genetic susceptibility in multiple sclerosis: A critical evaluation. Tissue Antigens 38, 1-15. (1991) 48. Packer L, Tritschler HJ, Wessel K. Neuroprotection by the metabolic antioxidant alpha-lipoic acid. Free Radic. Biol. Med. 22: 359-378. (1997) 49. Pender MP. Genetically determined failure of activation-induced apoptosis of autoreactive T cells as a cause of multiple sclerosis. Lancet 351: 978-981. (1998) 50. Pöhlau D, Postert T, Hoffmann V, Rieks M, Schimrigk S, Nastos I, Przuntek H. Die Behandlung der Multiplen Sklerose mit Copolymer 1. Nervenheilkunde 15: 110-115. (1996) 51. Prat A, Biernacki K, Lavoie JF, Poirier J, Duquette P, Antel JP. Migration of multiple sclerosis lymphocytes through brain endothelium. Arch. Neurol. 59: 391-397. (2002) 121 VII. Literaturverzeichnis 52. Racke MK, Martin R, McFarland H, Fritz RB. Copolymer-1-induced inhibition of antigenspecific T cell activation: interference with antigen presentation. J. Neuroimmunol. 37: 75-84. (1992) 53. Regner M, Lambert PH. Autoimmunity through infection or immunization? Nat. Immunol. 2: 185-188. (2001) 54. Rieckmann P, Albrecht M, Kitze B, Weber T, Tumani H, Broocks A, Lüer W, Helwig A, Poser S. Tumor Necrosis Factor-alpha messenger RNA expression in patients with relapsing-remitting multiple sclerosis is associated with disease activity. Ann. Neurol. 37, 82-88. (1994) 55. Rivers TM, Sprunt DH, Berry GP. J. Exp. Med., 58: 39-53. (1933) 56. Rubanyi GM. Vascular effects of oxygen-derived free radical. Free Radic. Biol. Med. 4: 107-120. (1988) 57. Seabrook TJ, Johnston M, Hay JB. Cerebral spinal fluid lymphocytes are part of the normal recirculating lymphocyte pool. J. Neuroimmunol. 91: 100-107. (1998) 58. Selmaj K, Raine CS, Faroog M, Norton WT, Brosnan CF. Cytokine Cytotoxicity against Oligodendrocytes. J. Immunol. 147: 1522-1529. (1991) 59. Sen CK, Packer L. Antioxidant and redox regulation of gene transcription. FASEB J 10: 709-720. (1996) 60. Sgonc R, Boeck G, Dietrich H, Gruber J, Recheis H, Wick G. Simultaneous determination of cell surface antigens and apoptosis. Trends in Genetics 10, 41-42. (1994) 61. Sun D, Whitaker JN, Huang Z, Liu D, Coleclough C, Wekerle H, Raine CS. Myelin antigenspecific CD8+ T cells are encephalitogenic and produce severe disease in C57BL/6 mice. J. Immunol. 166: 7579-7587. (2001) 62. Suzuki YJ, Mizuno M, Tritschler HJ, Packer L. Redox regulation of NF-kappa B DNA binding activity by dihydrolipoate. Biochem. Mol. Biol. Int. 36: 241-246. (1995) 63. Takahashi K, Miyake S, Kondo T, Terao K, Hatakenaka M, Hashimoto S, Yamamura T. Natural killer type 2 bias in remission of multiple sclerosis. J. Clin. Invest. 107:23-9. (2001) 122 VII. Literaturverzeichnis 64. Tan EM. Autoimmunity and Apoptosis. J. Exp. Med. 179: 1083-1086. (1994) 65. Tao X, Grant C, Constant S, Bottomly K. Induction of IL-4-producing CD4+ T Cells by antigenic peptides altered for TCR binding. J. Immunol. 158: 4237-4244. (1997) 66. Teitelbaum D, Meshorer A, Hirshfeld T, Arnon R, Sela M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur. J. Immunol. 1: 242-248. (1971) 67. Teitelbaum D, Aharoni R, Sela M, Arnon R. Cross-reactions and specificities of monoclonal antibodies against myelin basic protein and against the synthetic copolymer 1. Proc. Natl. Acad. Sci. USA 88: 9528-9532. (1991) 68. Teitelbaum D, Milo R, Arnon R, Sela M. Synthetic copolymer 1 inhibits human T-cell lines specific for myelin basic protein. Proc. Natl. Acad. Sci. USA 89: 137-141. (1992) 69. Teitelbaum D, Sela M, Arnon R. Copolymer 1 from the laboratory to FDA. Isr. J. Med. Sci. 33:280-284. (1997) 70. Teitelbaum D, Arnon R, Sela M. Immunomodulation of experimental autoimmune encephalomyelitis by oral administration of copolymer 1. Proc. Natl. Acad. Sci. USA 96: 3842-3847. (1999) 71. Trojano M, Avolio C, Ruggieri M, Defazio G, Giuliani F, Paolicelli D, Livrea P. Serum soluble intercellular adhesion molecule -I in MS: relation to clinical and Gd-MRI activity and to rIFN beta-Ib treatment. Multiple Sclerosis 4: 183-187. (1998) 72. Van der Goes A, Brouwer J, Hoekstra K, Roos D, van den Berg TK, Dijkstra CD. Reactive oxygen species are required for the phagocytosis of myelin by macrophages. J. Neuroimmunol. 92: 67-75. (1998) 73. Van den Eijnde SM, Luijsterburg AJ, Boshart L, De Zeeuw CI, van Dierendonck JH, Reutelingsperger CP, Vermeij-Keers C.. In situ detection of apoptosis during embryogenesis with annexin V: from whole mount to ultrastructure. Cytometry 29: 313-320. (1997) 74. Vanderlugt CL, Neville KL, Nikcevich KM, Eagar TN, Bluestone JA, Miller SD. Pathologic Role and Temporal Appearance of Newly Emerging Autoepitopes in Relapsing Experimental Autoimmune Encephalomyelitis. J. Immunol. 164: 670-678. (2000) 123 VII. Literaturverzeichnis 75. Vermes I, Haanen C, Steffens-Nakken H, Reutelingsperger C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. J. Immunol. Methods 184: 39-51. (1995) 76. Weiner HL. Oral tolerance with copolymer 1 for the treatment of multiple sclerosis. Proc. Natl. Acad. Sci. USA 96: 3333-3335. (1999) 77. Weiner HL. The fine line between autoimmune and allergic encephalomyelitis. Nat Immunol 2: 193-194. (2001) 78. Wekerle H, Kojima K, Lannes-Vieira J, Lassmann H, Linington C. Animal Models. Annals of Neurology 36: 47-53. (1994) 79. Woodroofe NM. Cytokine production in the central nervous system. Neurology 45: 6-10. (1995) 80. Zhang G, Gurtu V, Kain SR, Yan G. Early detection of apoptosis using a fluorescent conjugate of annexin V. BioTechniques 23: 525-531. (1997) 81. Ziegler SF, Ramsdell F, Alderson MR. The activation antigen CD69. Stem Cells 12: 456-465. (1994) 82. Ziegler D, Gries FA. Alpha-lipoic acid in the treatment of diabetic peripheral and cardiac autonomic neuropathy. Diabetes 6: 62-66. (1997) 83. Zimmermann KC, Green DR. How cells die: apoptosis pathways. J. Allergy Clin. Immunol. 108: 99-103. (2001) 124 Summary In the present study the effects of immunomodulating therapy of encephalomyelitides on the immune system was investigated. Encephalomyelitides are inflammatoric diseases of the central nervous system (CNS). A most probably autoreactive immune reaction leads to the destruction of the myelin sheet, which covers the nervous fibres. Multiple sclerosis (MS), also named ‘Encephalomyelitis disseminata’, is the well known designation of the human encephalomyelitis disease. As a first step, animal models of multiple sclerosis known as experimental autoimmune encephalomyelitis (EAE) were established in different strains of mice. During the study of these models it was shown that the susceptibility of mice to develop symptoms of EAE was depending on the H-2 haplotype and on the composition of the lymphocyte populations in the immune organs of the animals. The individual course and severity of the disease were depending on the strain of mice as well as on the type of disease-inducing agent used. It is hoped that these observations will results in a better understanding and interpretation of the heterogeneity of the disease in multiple sclerosis patients and lead to the development of individual therapeutic strategies. Using these well-characterized EAE models, it was clearly shown that application of Lipo-X, a lipoic acid derivate, caused inhibition of EAE symptoms. In vitro experiments with high-dose Lipo-X resulted in down regulation of TNF-α production and proliferation of leucocytes after specific and unspecific stimulation. Furthermore, intraperitoneal injection of Lipo-X in mice induced a massive recruitment (and/or proliferation) of the peritoneum with granulocytes from ‘Granulocyte Macrophage Colony Forming Cells’. The significance of granulocytes in EAE and MS is not yet understood adequately. The effect of Lipo-X on TNF-α production and activation or proliferation of leucocytes related to the effect of Lipo-X on the nuclear factor κB (NF-κB). NF-κB promotes the activation of an other immune-relevant genes, e.g. the TNF-α gene and many cell activation genes. It appears that the application of Lipo-X offers an interesting new therapeutic strategy for treatment of patients suffering from multiple sclerosis. Copolymer-1 (Cop-1), also named Glatirameracetate or Copaxone®, is a well known therapeutic agent for the treatment of relapsing remitting multiple sclerosis. The exact mechanism by which Cop-1 exerts its immune-modulating effects on the immune system of MS patients is not sufficiently clear so far. Results of in vitro and in vivo experiments indicate that the induction of apoptotic cell death of lymphocytes, especially T-helper cells, after confrontation with Cop-1, is clearly part of this reaction. The simultaneous up-regulation of activated (CD69-positive) lymphocytes suggested that the inflammatory process is stopped by the induction of apoptosis as a consequence of activation-induced cell death (AICD). Most probably, by this apoptosis-inducing effect of Cop-1 both, CNS-specific autoreactive cells and also uninvolved bystander immune cells are suppressed. Changes in the cytokine network which were also observed after treatment with Cop-1. Under therapy with COP-1, the Th2-typical cytokine Interleukin-4 (IL-4) was up-regulated in the lymphocytes of MS-patients, 125 especially in patients with stable or remitting disease. This effect was seen during Copaxone® therapy for one year. Th2-typical cytokines like IL-4 induce anti-inflammatoric effects, and inhibit the inflammation process in the CNS. In experiments with Cop-1 in different EAE models a therapeutic effect of Cop-1 was seen in mice of the strain SJL/J, but not in BALB/c mice. This observation suggests that the H-2 haplotype interferes with the beneficial effect of therapy with Cop-1. It also is possible that Cop-1 dominantly affects T-lymphocytes and therefore is more efficient in mice with a high ratio of T:B-lymphocytes (for example SJL/J). It is hoped that the results of these experiments will contribute to a better understanding of the mechanism of action of Cop-1 and help to develop methods for subtyping of MS patients in responders and non-responders for each of the currently applied therapy regimens. 126 Mein Dank gilt - Prof. Dr. Falkenberg, für die Betreuung und das Interesse am Fortschreiten der Arbeit, die jahrelange gute Zusammenarbeit und die konstruktive Kritik, - Prof. Dr. Lübbert, für die trotz hoher Arbeitsbelastung bereitwillige Übernahme der Aufgabe des Zweit-Gutachters, - Prof. Dr. Gatermann, für die überhaupt nicht selbstverständliche Überlassung der für die Fertigstellung der Arbeit in der Endphase benötigten Stelle, sowie das freundliche Interesse an der Arbeit, - vor allem Dr. Dieter Pöhlau, der mir die Chance gab, an der Aufklärung der Ursachen der Multiplen Sklerose zu arbeiten und mir damit einen lange gehegten Wunsch erfüllte. Er hat mir während unserer langen Zusammenarbeit diese Arbeit inhaltlich und finanziell ermöglicht und mir dabei immer freundschaftlich zur Seite gestanden, - allen MitarbeiterInnen der AG Falkenberg insbesondere Marcus Peters, Christine Hahnel und Melanie Teller für hilfreiche und interessante Diskussionen und eine überaus angenehme Arbeitsatmosphäre, - der neuroimmunologischen Arbeitsgruppe des St. Josef-Hospitals, insbesondere Nils Brune, mit dem ich pragmatisches Denken geübt habe, Volker Hoffmann, für den anspornenden Wettkampf um den Titel, sowie Miriam Juschka, Iris Spitzer und Nurtac Ari, - Orhan Aktas, von der neuroimmunologischen Arbeitsgruppe der Charité Berlin und ehemaliges Mitglied der neuroimmunologischen Arbeitsgruppe des St. Josef-Hospitals, für die immer kooperative, inhaltlich hoch interessante und wissenschaftlich wie persönlich bereichernde Zusammenarbeit, - dem Institut für Neuroanatomie der RUB, insbesondere Frau Dr. Dorothee Krause-Finkeldey und Dr. Pedro Faustmann, für die interessanten und interessierten Diskussionen in Vergangenheit und Zukunft, - dem Team der Zentralen Versuchstierhaltung der Medizinischen Fakultät der RUB für die Betreuung und Pflege der Versuchstiere, - Claudia Enders und Doris Evertz, die stets wussten, wann sie mich mit Fußball oder Rotwein ablenken oder in Ruhe lassen mussten, - Maike und Oliver Krup, für die ermutigende Art mit der sie ihr neues Leben angehen und mich und andere daran teilhaben lassen, - meiner Mutter, Edith Rieks, die in Ihrer Stärke und Klugheit mir immer wieder Vorbild war und ist, - allen, die in den vergangenen Wochen und Monaten klaglos auf mich verzichtet haben, - und besonders Stefan Collm für seine Liebe, sein Vertrauen und alles das was mein Leben so bereichert hat. Ich habe es ihm nicht immer leicht gemacht. LEBENSLAUF Name: Rieks Vorname: Maike geboren am: 23.09.1966 in Bochum Familienstand: ledig Kinder: Nadia Rieks, geboren am 27.08.1987 Schulbesuch: 1972 bis 1976 Kreyenfeld-Grundschule in Bochum-Werne 1976 bis 1985 Lessing-Gymnasium in Bochum-Langendreer Schulabschluss: Abitur Berufl. Ausbildung: 1985-1988 Ausbildung zur Gärtnerin bei der Stadt Bochum 1988 Gärtner-Gehilfen-Prüfung 1988 bis 1994 Studium der Biologie (Diplom) 1991 Diplomvorprüfung 1993 Diplomhauptprüfung Okt. 1993 bis Juli 1994 Diplomarbeit am Institut für Mikrobiologie und Immunologie zum Thema „Untersuchungen zur Antigenpräsentation” Juli 1994 Diplom im Fach Biologie Berufstätigkeit: Seit 01.08.1994 wissenschaftliche Mitarbeiterin der Ruhr-Universität Bochum: - 01.08.1994 bis 30.06.1998 tätig im Neuroimmunologischen Labor der Neurologischen Universitätsklinik am St. Josef-Hospital Bochum, - seit 01.07.1998 tätig am Institut für Med. Mikrobiologie der RuhrUniversität Bochum, AG Falkenberg, - ab April 2002 am neugegründeten Zentrum für klinische Forschung (ZKF) der Ruhr-Universität Bochum, AG Neuroimmunologie/Neurogenetik.