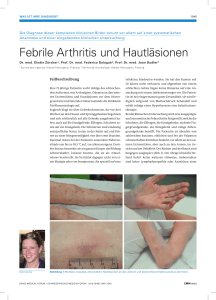
Subreum-Kapseln
Werbung

Subreum-Kapseln 2. Qualitative und quantitative Zusammensetzung 1 Kapsel enthält als Wirkstoff 24 mg immunaktive Fraktionen (Lyophilisat hochmolekularer Zellbestandteile, Hauptmenge mit Molekulargewicht 3 – 300 kD) aus insgesamt 18 ausgewählten Stämmen von Escherichia coli (je 9 Stämme aus der National Collection of Type Cultures, London, NCTC No. der Serie 8000 bzw. 9000 und aus dem Institut Pasteur, Paris, I No. der Serie 0 – 100). Entsprechend dem Herstellungsprozess tragen alle Stämme zur Immunaktivität des Endproduktes bei. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. Darreichungsform Kapseln. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Chronische Polyarthritis. 4.2 Dosierung, Art und Dauer der Anwendung Täglich morgens 1 Kapsel auf nüchternen Magen mit etwas Flüssigkeit. Da eine Besserung des klinischen Bildes im allgemeinen langsam eintritt, häufig erst nach 3 – 6 Monaten, ist eine kontinuierliche Therapie erforderlich. Nach Wirkungseintritt wird entsprechend dem Krankheitsverlauf weiter behandelt. 4.3 Gegenanzeigen Überempfindlichkeit gegen einen Bestandteil des Präparates. In sehr seltenen Einzelfällen können bei Patienten mit Asthma bronchiale Asthmaanfälle auftreten. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Keine bekannt. Das Produkt entspricht den einschlägigen Vorschriften betreffend BSE-Sicherheit. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Bis heute sind keine Wechselwirkungen bekannt. Vorsorglich sollte vor und nach der Behandlung mit Lebendimpfstoffen eine Frist von 2 Wochen eingehalten werden. Die Einnahme von Immunsuppressiva kann die Wirkung von Subreum beeinflussen. Die gleichzeitige Einnahme von Glukokortikoiden, nicht steroidalen Antirheumatika/Antiphlogistika und Analgetika ist möglich. 4.6 Schwangerschaft und Stillzeit Es sind keine schädigenden Wirkungen bekannt. Da keine diesbezüglichen Erfahrungen am Menschen vorliegen, wird abgeraten, Subreum während der Schwangerschaft und/oder Stillperiode zu verabreichen. Diesbezügliche Entscheidungen sollen stets vom Arzt unter entsprechender Nutzen-RisikoAbwägung erfolgen. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Soweit bisher bekannt, beeinflußt Subreum die Reaktionsfähigkeit beim Lenken eines Fahrzeugs oder bei der Arbeit mit Maschinen nicht. 4.8 Nebenwirkungen Gelegentlich kann es zu leichten Störungen im Magen-Darm-Trakt kommen; in seltenen Fällen können allergische Hautreaktionen auftreten. In sehr seltenen Einzelfällen wurde – wie auch bei einigen Basistherapeutika – zu Beginn der Therapie eine vorübergehende Verstärkung der Gelenkschmerzen beobachtet, die ohne Unterbrechung der Subreum-Therapie durch Dosisanpassung der Schmerzmittel bzw. Entzündungshemmer abgefangen werden konnte. 4.9 Überdosierung Keine spezifischen Maßnahmen bekannt. Untersuchungen zeigten, daß bis zu 6fach höhere Dosierungen keine Unverträglichkeitserscheinungen hervorriefen. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Die chronische Polyarthritis wird zwar als Störung des Immunsystems gesehen, doch ist auch heute noch das äthiopathologische Wissen über diese Krankheit weitgehend lückenhaft. Die meisten therapeutischen Ansätze entwickelten sich daher empirisch. Auch von Subreum ist es nicht möglich, den Wirkungsmechanismus zu erklären. Alle Untersuchungen (in vitro, in vivo, tierexperimentell und am Menschen) zeigen jedoch, daß Subreum auf die wesentlichen, spezifischen und unspezifischen Reaktionen des Immunsystems regulierend wirkt. Im unspezifischen Immunsystem stimuliert Subreum in vitro die Phagozytosekapazität von Makrophagen durch Stimulierung der metabolischen und funktionellen Aktivität sowie der Kapazität zur Präsentation von Antigenen. Weiters ist der immunmodulierende Effekt von Subreum durch die Produktion und Freisetzung von Lymphokinen, sowie durch die Aktivierung der T- und B-Zellen und der natürlichen Killerzellen (NK-Zellen) experimentell belegt. Im Tiermodell zeigt Subreum einen signifikanten entzündungshemmenden Effekt auf die durch Freud-Adjuvans verursachte Arthritis der Ratte. Es wirkt immundepressiven Effekten von Immunsuppressiva und von verschiedenen Antibiotika entgegen und hat bei normalen und immungeschwächten Tieren eine Schutzwirkung gegen Infektionen. Untersuchungen zeigen, daß der erste Kontakt mit dem Immunsystem im Bereich der Peyerschen Plaques erfolgt. So wurde z.B. eine signifikante Steigerung der interstinalen IgA-Sekretion festgestellt, die den Durchschnitt von Antigenen vermindert. Außerdem zeigten Untersuchungen an der Ratte nach oraler Verabreichung einen signifikanten Anstieg der Migration von aktivierten T-Suppressorzellen aus den Peyerschen Plaques zu den peripheren Lymphknoten. Bei Patienten mit chronischer Polyarthritis wurde unter Therapie mit Subreum ein signifikanter Anstieg der vor Therapiebeginn stark verminderten autologen gemischten Lymphozyten-Reaktion festgestellt. Dieser Test ist repräsentativ für Aktivierung, Proliferation und Differenzierungsfähigkeit der T-Zellen. Die bei Patienten mit chronischer Polyarthritis bekannte starke Verminderung dieser Reaktion wird auf die defekten Funktionen der T-Suppressor-Zellen zurückgeführt, sodaß die Beeinflussung dieser Reaktion unter Therapie mit Subreum auf eine Wiederherstellung bzw. Normalisierung der T-Suppressor-Zellfunktion hinweist. Die klinische Wirkung von Subreum kommt möglicherweise über die Induktion einer “oralen Toleranz” gegen das oder die pathogene(n) Antigen(e) zustande, da die in Subreum enthaltenen Peptide bzw. Epitope mit hoher Wahrscheinlichkeit eine strukturelle Ähnlichkeit mit den Epitopen der pathogenen Antigene (z.B. Streßproteine) besitzen, ohne selbst auto-immunogen zu sein (tolerogene Peptide). Dieser Induktion der “oralen Toleranz” liegt unter anderem eine Aktivierung der körpereigenen Suppressor-Mechanismen zugrunde (Aktivierung der T-Suppressor-Zellen). 5.2 Pharmakokinetische Eigenschaften Für pharmakokinetische Untersuchungen von komplexen biologischen Extrakten stehen keine geeigneten experimentellen Modelle beim Menschen zur Verfügung. Im Tierversuch (Ratte) wurde jedoch nach oraler Verabreichung eine 50%ige Resorption der C-14 markierten Fraktionen mit einem Molekulargewicht von mehr als 30kD gefunden. Die maximale Plasmakonzentration wurde nach ca. 4 Stunden erreicht, die Plasma-Halbwertszeit betrug ca. 33 Stunden. 5.3 Präklinische Daten zur Sicherheit Studien der Fortpflanzungsfunktionen beim Tier haben kein Risiko für den Fötus feststellen lassen. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Magnesiumstearat, Magnesiumsilikat, Mannitol, vorgelatinierte Stärke. 6.2 Inkompatibilitäten Keine bekannt. 6.3 Dauer der Haltbarkeit 36 Monate. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über Raumtemperatur (bis 25° C) lagern. 6.5 Art und Inhalt des Behältnisses Blisterstreifen mit insgesamt 30 Kapseln im Überkarton. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung (und sonstige Hinweise zur Handhabung) Arzneimittel sind sorgfältig aufzubewahren und vor Kindern zu sichern. 7. Inhaber der Zulassung: Nycomed Pharma, Wien. 8. Zulassungsnummer: 2–00211 9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung: 26. Februar 1998. 10. Stand der Information: Juli 2007. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. PKZ: 30 ST * (EKO: N) [89.30]