Rechts oder Links – das ist die Frage: Chiralität in der Chemie
Werbung

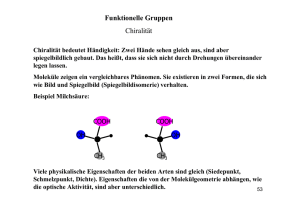
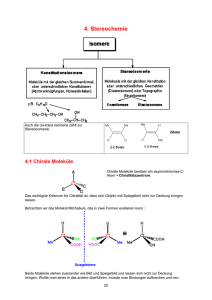
Rechts oder Links – das ist die Frage: Chiralität in der Chemie Studium Generale Wintersemester 2012/13 Prof. Dr. Wolfgang Weigand Institut für Anorganische und Analytische Chemie der Friedrich-Schiller-Universität Jena, Humboldtstraße 8, D-07743 Jena, Germany lichtung manche meinen lechts und rinks kann man nicht velwechsern werch ein illtum (Ernst Jandl, 1925-2000) Beispiele aus Kunst, Natur etc. selten häufig Historische Entwicklung „Was kann wohl meiner Hand oder meinem Ohr ähnlicher, und in allen Stücken gleicher sein, als ihr Bild im Spiegel? Und dennoch kann ich eine solche Hand, als im Spiegel gesehen wird, nicht an die Stelle ihres Urbildes setzen …“ I. Kant, Prolegomena zu einer jeden künftigen Metaphysik die als Wissenschaft wird auftreten können, bey Johann Friedrich Hartknoch, Riga, 1783 Was heißt Chiralität? Chiralität (griechisch: Hand): Der Begriff Chiralität wurde vor über hundert Jahren von Lord Kelvin geprägt. Danach ist jede geometrische Figur chiral, wenn Bild und Spiegelbild nicht zur Deckung gebracht werden können. Chirale Objekte enthalten keine Elemente der Reflexion wie Spiegelebene (s, S1), Inversionszentrum (i, S2) oder Drehspiegelachse (Sn). Deshalb bilden chirale Objekte, wie die Hand, stets zwei inkongruente Spiegelbildformen, die als Enantiomere bezeichnet werden. Nach Lord Kelvin sind zwei rechte (oder zwei linke) Hände homochiral, während rechte und linke Hand heterochiral sind. Symmetrieachsen Cn (Drehachse; n =2,3,4 u.s.w) Symmetrieebenen σ (Spiegelebene) Symmetriezentren i (Inversionspunkt) Drehspiegelachsen Sn William Thomson, Lord Kelvin * 26. Juni 1824 in Belfast, Nordirland; † 17. Dezember 1907 in Netherhall bei Largs, Schottland 1846 bis 1899 Professor für theoretische Physik in Glasgow Forschungsgebiete: Elektrizitätslehre undThermodynamik (Carnotschen Wärmetheorie, Einheit „Kelvin“) 1852 Gemeinsam mit James Prescott Joule entdeckte er den Joule-Thomson-Effekt 1857 den magnetischen AMR-Effekt. 1867 entwickelte Thomson das harmonische Verfahren zur Berechnung der Gezeiten und konstruierte 1872 die erste Gezeitenrechenmaschine. Ein chemisches Beispiel aus dem täglichen Leben Auffällig unauffällig steht auf unserem Joghurt zu lesen: „Mit rechtsdrehende Milchsäure L(+)“. Dexter Laevus Chiralität und Molekülgestalt Dexter Laevus Dexter Laevus Was heißt (+) und (-)? Substanzen, welche die Schwingungsebene des linear polarisierten Lichtes drehen, nennt man optisch aktiv. Erfolgt die Drehung der Schwingungsebene und somit auch die Drehung des Analysators nach rechts, um wieder größtmögliche Lichtundurchlässigkeit zu erhalten, so nennt man die Verbindung rechtsdrehend (+), muß man den Analysator in Linksrichtung nachstellen, wird die Verbindung als linksdrehend (-) bezeichnet. © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 Historische Entwicklung Im Jahre 1874 gaben gleichzeitig und völlig unabhängig voneinander der holländische Physikochemiker J. H. van't Hoff und sein früherer Kommilitone J. A. LeBel die schlüssige Erklärung für die optische Aktivität mancher und die Inaktivität anderer Kohlenstoffverbindungen: Sie postulierten, dass chirale Verbindungen (L oder D) z. B. bestehend aus einem Kohlenstoffatom mit vier verschiedenen Gruppen a,b,c und d optisch aktiv sind. L. Pasteur hat als Erster einen Zusammenhang zwischen der optischen Aktivität und der Dissymmetrie auf molekularer Ebene nachgewiesen, aber er konnte nicht genau sagen, wie ein Molekül rechts- oder linksdrehend sein konnte. Dexter Laevus P. Cintas, Angew. Chem. 2007, 119,4090 – 4099 Louis Pasteur * 27. Dezember 1822 in Dole, Département Jura; † 28. September 1895 in Villeneuve-l’Étang bei Paris Aus spiegelbildlichen Kristallformen eines Salzes der Traubensäure sowie ihrer optischen Aktivität schloss er auf ihre zugrunde liegende molekulare Asymmetrie (1874). Damit wurde er zum Begründer der Stereochemie. Joseph-Achille Le Bel * 21. Januar 1847 in Pechelbronn, Elsass; † 6. August 1930 in Paris) war ein französischer Chemiker. Optische Aktivität organischer Verbindungen durch die Annahme von tetraedrischen, „asymmetrischen“ Kohlenstoffatomen (1874) Jacobus Henricus van ’t Hoff * 30. August 1852 in Rotterdam; † 1. März 1911 in Steglitz b. Berlin Vor Abschluss seiner Doktorarbeit überraschte van 't Hoff die Fachwelt mit einem kurzen Artikel zum optischen Drehvermögen und zur Stereochemie von Kohlenstoffbindungen. Beispiele für chirale Moleküle Verbindungen mit asymmetrisch substituiertem C-Atom (C1-Achse) Ein asymmetrisch substituiertes Atom (z.B. *C-Atom mit vier unterschiedlichen Gruppen) ist ein stereogenes Zentrum. * Weitere Beispiele für chirale Moleküle Man sieht also, dass es offenbar hinreichend, aber nicht notwendig ist, bei chiralen Molekülen von der Existenz eines Chiralitätszentrums auszugehen. Es gibt vielmehr auch chirale Moleküle ohne Chiralitätszentrum Einige Definitionen Enantiomere: Stereoisomere, die sich wie Bild und Spiegelbild zueinander verhalten Stereoisomere: Verbindungen gleicher Konstitution und verschiedener Konfiguration Diastereomere: Stereoisomere, die nicht enantiomer zueinander sind Chiralitätszentrum: stereogenes Zentrum = asymmetrisch substituiertes C-Atom; C-Atom mit vier verschiedenen Gruppen/Substituenten („asymmetrisches C-Atom“ ist eine übliche, aber unglückliche Bezeichnung). Was bedeutet D/L und R/S? D/L-Nomenklatur: Hauptsächlich bei Zuckern und Aminosäuren verwendet. Sie gehen auf Emil Fischer zurück, der dem rechtsdrehenden (+)Glycerinaldehyd willkürlich folgende Projektionsformel zuordnete. In ihr steht die OH-Gruppe rechts, diese Form des Glycerinaldehyds wird als DForm bezeichnet (D von dexter = rechts). R,S-Nomenklatur (Cahn-Ingold-Prelog-System): 1.Die direkt an das stereogene *C-Atom gebundenen Atome werden nach fallender Ordnungszahl angeordnet, d.h. das Atom mit der höheren Ordnungszahl hat die höhere Priorität. 2.Man betrachtet nun ein Molekül in der Weise, dass der Substituent niedrigster Priorität (meist H) nach hinten zeigt. (-)-(R)-Milchsäure ≅ D(-)-Milchsäure (Bio)chemie und Chiralität * * * Pfefferminz Kümmel * citrusartig terpentinartig * * bitter süss Die Contergan-Katastrophe Wirkstoff Thalidomid 1956 Markteinführung durch die Firma Grünenthal, Aachen (Forschungsleiter Dr. Heinrich Mückter) Einschätzung: sicher und harmlos, sogar für Kinder geeignet. Anwendung als mildes Beruhigungsmittel. Anwendung gegen Morgenübelkeit, vor allem in den ersten Wochen der Schwangerschaft Fälle von Robbengliedrigkeit bei Neugeborenen treten Anfang der 60iger Jahre auf 1961-1962 wird Contergan aus dem Handel genommen © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 http://einestages.spiegel.de/external/ShowTopicAlbumBackground/a730/l0/l0/F.html#featuredEntry Die Contergan-Katastrophe Contergan Teratogene Wirkung von (S)-Contergan resultierte in Mißbildungen in Form von verkümmerten Extremitäten bei mehr als 10000 Neugeborenen, in 40 Ländern der Welt, vor allem in Deutschland, Großbritannien, Australien * * Enzym und chirale Moleküle Schematisches Diagramm, das zeigt, warum nur ein Enantiomer von einem Enzym gebunden wird. Ein Enantiomer passt in die Bindungsstelle, das andere nicht. © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 Chiralität und optische Aktivität Chiralität ist die Erscheinung, dass eine geometrische Figur oder eine Anordung von Punkten mit ihrem Spiegelbild nicht übereinstimmen (nach Lord Kelvin, 1893) Chemische Verbindungen, deren Moleküle chiral sind, kommen als Enantiomere vor. Racemate sind Gemische, die von beiden Enantiomeren gleich viele Moleküle enthalten. Optische Aktivität ist die Erscheinung, dass die Schwingungsebene von linear polarisiertem Licht beim Durchgang durch ein Enantiomer um einen bestimmten Winkel α gedreht wird. Der spezifische Drehwinkel α (c = 1 g/ml; d = 1 dm) ist eine Stoffkonstante. Beide Enantiomere besitzen den gleichen spez. Drehwinkel, aber mit entgegengesetzter Drehrichtung (+)/(-) Chemische Evolution: Entstehung von Homochiralität A. G. Griesbeck, U. J. Meierhenrich, Angew. Chem. Int. Ed. 2002, 41, 3147-3154 U. J. Meierhenrich, Chem. Soc. Rev. 2012, 41, 5447–5458 U. J. Meierhenrich et al, Physics od Life Reviews, 2011, 8, 307 Autokatalytische Reaktion nach Soai Beispiel einer enantioselektiven Organoautokatalyse: Spontane enantioselektive Verstärkung lichtung manche meinen lechts und rinks kann man nicht velwechsern werch ein illtum (Ernst Jandl, 1925-2000)