Kap.20 Neuroendokrine Tumoren
Werbung
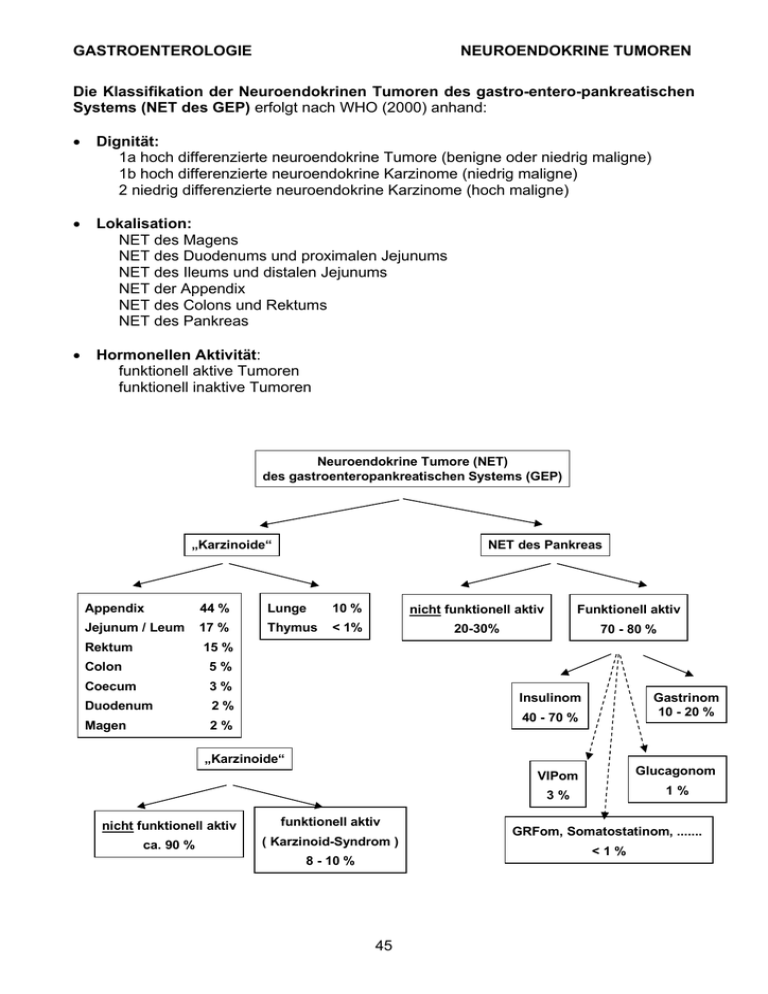
GASTROENTEROLOGIE NEUROENDOKRINE TUMOREN Die Klassifikation der Neuroendokrinen Tumoren des gastro-entero-pankreatischen Systems (NET des GEP) erfolgt nach WHO (2000) anhand: • Dignität: 1a hoch differenzierte neuroendokrine Tumore (benigne oder niedrig maligne) 1b hoch differenzierte neuroendokrine Karzinome (niedrig maligne) 2 niedrig differenzierte neuroendokrine Karzinome (hoch maligne) • Lokalisation: NET des Magens NET des Duodenums und proximalen Jejunums NET des Ileums und distalen Jejunums NET der Appendix NET des Colons und Rektums NET des Pankreas • Hormonellen Aktivität: funktionell aktive Tumoren funktionell inaktive Tumoren Neuroendokrine Tumore (NET) des gastroenteropankreatischen Systems (GEP) „Karzinoide“ NET des Pankreas Appendix 44 % Lunge 10 % nicht funktionell aktiv Funktionell aktiv Jejunum / Leum 17 % Thymus < 1% 20-30% 70 - 80 % Rektum 15 % Colon 5% Coecum 3% Duodenum 2% Magen 2% Insulinom 40 - 70 % Gastrinom 10 - 20 % VIPom Glucagonom 3% 1% „Karzinoide“ nicht funktionell aktiv funktionell aktiv ca. 90 % ( Karzinoid-Syndrom ) 8 - 10 % 45 GRFom, Somatostatinom, ....... <1% GASTROENTEROLOGIE NEUROENDOKRINE TUMOREN Grundlagen der Therapie von GEP-NET: Primär ist die kurative Resektion anzustreben. Ist diese nicht möglich sollte eine Tumorverkleinerung angestrebt werden (Debulking). Die weiteren Therapieoptionen zeigt das folgende Diagramm: Therapieoptionen bei nicht kurativ resezierbaren NET Chirurgisches Tumordebulking Kein Tumorwachstum Langsames Tumorwachstum Octreotid Symptomatische Therapie: • Karzinoid: Octreotid • Insulinom: Diazoxid • Gastrinom: Protonenpumpenhemmer ODER Rasches Tumorwachstum IFN α Progreß Kombination Progreß Chemoembolisation von Lebermetastasen Chemotherapie Progreß Somatostatinrezeptorgerichtete Radiopeptidtherapie Verbesserung/Erhaltung der Lebensqualität Literaturhinweis: - C. Spitzweg, B. Göke. Therapie endokriner gastrointestinaler Tumoren. Internist 43: 219-229, 2002. - U. Plöckinger et al. Guidelines for the diagnosis and treatment of of neuroendocrine gastrointestinal tumours. Neuroendocrinology 80: 394-424, 2004. 46 GASTROENTEROLOGIE NEUROENDOKRINE TUMOREN 1. EXTRAPANKREATISCHE NEUROENDOKRINE TUMOREN Klinische Symptome: • Hormonell aktiv - Karzinoidsyndrom: bei hepatischer Metastasierung oder Lokalisation in Lunge, Ovar und Retroperitoneum (d.h. außerhalb des Einzugsgebietes der Pfortader, kein first pass Effekt in der Leber), Durchfälle (70-85%), Flush (90%), Endokardfibrose (30%), Bronchokonstriktion/Atemnot (20%), kolikartige Bauchschmerzen (50%), selten: Pellagra-ähnliche Läsionen (5%) durch Niacinmangel. • Hormonell inaktiv: meist lange klinisch inapparent, symptomatisch durch Lokalkomplikationen (Bauchschmerzen, Gewichtsverlust, intestinale Obstruktion/Ileus, intestinale Ischämie, Ureterobstruktion, Hepatomegalie, Ikterus, gastrointestinale Blutungen). • Spezialproblem Karzinoidkrise: Akut lebensbedrohliche Situation! Ausgelöst durch massive Mediatorenfreisetzung aus Tumormassen (nach Embolisierung von Leberherden, Manipulation am Tumor bei OP, diagnostische Punktion): Kopfschmerz, Somnolenz, Koma, Blutdruckabfall, Tachykardie, Arrhythmie. Pathophysiologie: Entartete EC-Zellen sind pluripotent und synthetisieren zahlreiche Mediatoren (Serotonin, Substanz P/K/A, Bradykinin, Histamin, Prostaglandine, Gastrin u.a.). Charakteristische Eigenschaft ist die verstärkte Hydroxylierung und Decarboxylierung von Tryptophan und Serotonin (Folge: Niacinmangel). Lokalisation: Pathologisch-anatomisch wird der Befall in embryologisch definierten Vorder-, Mittel- und Hinterdarm lokalisiert (85% im Gastrointestinaltrakt, 10% im Bronchialsystem, 5% primär in Leber, Gallenblase, Pankreas, Thymus, Ovarien, Prostata, Larynx und Haut; in 30 % muliple Tumoren). Im Gastrointestinaltrakt verteilen sich die NET gehäuft auf Appendix, Ileum und Rektum. Diagnostik: Die klinische Symptomatik ist wegweisend! • Labor: quantitative Bestimmung von 5-HIES–Exkretion im 24 h Sammelurin (normal: <10 mg/24 h; cave: diätetische/medikamentöse Störfaktoren beachten!, zwei Tage vor und während der Urinsammlung störende Medikamente/Nahrungsmittel meiden), Gastrin- / Histaminmessung im Plasma; Chromogranin A (bei >80% der NET positiv, guter Verlaufsparameter, schlechtere Lebenserwartung bei CGA >75 nmol/l), neuronenspezifische Enolase, α- und β-HCG (bei metastasierten Karzinoiden erhöht), evtl. Serotonin im Serum • Somatostatin-SMS-Rezeptorszintigraphie (Octreotid-Scan) • Metajodbenzylguanidin-(MIBG)-Szinitigraphie: bei negativem Octreotid-Scan hilfreich • Evtl. CT, MRT, Ultraschall, Endosonographie • Histologie: Immunhistochemie mit Nachweis von Synaptophysin, Chromogranin, NES, Serotonin und von diversen Peptiden • Herzecho zum Ausschluß Endokardfibrose Therapie: • Chirurgische Exzision, Tumordebulking • Langwirksame Somatostatinanaloga (Octreotid 3x50 µg – 3x500 µg/Tag subkutan, Octreotid-LAR alle 28 Tage 20 mg i.m., Besserung der Symptomatik in 75-90% der Fälle; auch zur Prophylaxe/Therapie einer Karzinoidkrise) • α-Interferon (3x3 Mio. IE/Woche subkutan; alternativ: PEG-Intron 1x/Woche) 47 GASTROENTEROLOGIE • • • NEUROENDOKRINE TUMOREN evtl. Indium-111-oder Yttrium-90-markiertes Octreotid evtl. hepatische Chemoembolisation evtl. Chemotherapie Verlaufskontrolle: Bei vollständiger Resektion des hormonaktiven Tumors ½-jährliche Bestimmung der Hormonspiegel. Bei Anstieg bildgebende Untersuchungen (CT, MRT, Octreotid-Scan). Bei vollständiger Resektion nicht aktiver Tumoren Vorgehen wie bei der Karzinomnachsorge (initial ½- dann jährliche Kontrollen). Flush, Diarrhoe, Bronchospasmus, Rechtsherzinsuffizienz V.a. Karzinoid 5-HIES im 24 h-Sammelurin ? < 10 mg/24h > 10 mg/24h Kein Karzinoid Karzinoid Therapieoptionen bei Karzinoid: • Kurative, chirurgische Exzision/ Tumordebulking • Somatostatinanaloga • Alpha-Interferon • evtl. Indium-111-/Yttrium-90markiertes Octreotid • evtl. hepatische Chemoembolisation • evtl. Chemotherapie 48 GASTROENTEROLOGIE NEUROENDOKRINE TUMOREN 2. INSULINOM Sporadisch oder im Rahmen einer MEN I Erkrankung auftretendes, solitäres Adenom des Pankreas, das von den ß-Zellen der Langerhans-Inseln ausgeht. In ca. 10% der Fälle findet man multiple Adenome. Die multipel auftretenden Insulinome sind in der Regel gutartig, während ca. 10% der solitär auftretenden Insulinome maligne Tumoren darstellen. Klinische Symptome: Anzeichen der Hypoglykämie (Schwitzen, Zittern, Heißhunger), unklare neurologisch-psychiatrische Zustände (Verwirrtheit, Desorientiertheit, Krampfanfälle oder kurzfristige Synkopen). Diagnostik: • Klinische Symptome • Hungerversuch (über 72 h): Dissoziation zwischen abfallenden Blutzuckerwerten und gleichbleibenden oder ansteigenden Insulin- und C-Peptid-Spiegeln (Proben für Plasmaglukose-, Insulin- und C-Peptidspiegel werden alle 4-6 Stunden gewonnen, oder bei Auftreten von Symptomen) – Abgrenzung von Hypoglycaemia factitia (kein CPeptidanstieg bzw. -supression). Falls Insulin/Glucose-Quotient >0.3 (µU Insulin pro ml/mg% Glucose) beträgt, ist hochgradiger Verdacht auf ein Insulinom gegeben (DD: Glibenclamid-Einnahme) • Intraoperative Palpation und Sonographie, MRT, CT, Angiographie, Endosonographie, Octreotid-Scan Therapie: • Therapie der Wahl beim Insulinom (85-90% benigner, solitärer Pankreastumor) ist die lokoregionale kurative, chirurgische Exzision (Tumorenukleation, distale Pankreatektomie, Pankreatikoduodenektomie). Bei gesicherter Klinik und biochemischer Befundlage kann in den Händen eines erfahrenen Pankreaschirurgen mittels prä- und intraoperativem Ultraschall bei sorgfältiger intraoperativer Palpation unter Umständen auf eine aufwendige Lokalisationsdiagnostik verzichtet werden. Da maligne Insulinome eine sehr langsame Wachstumsrate aufweisen, sollte auch im Falle metastasierter Insulinome (5-10%) ein chirurgisches Tumordebulking in Erwägung gezogen werden (Linderung der klinischen Symptomatik, zum Teil langfristige Remissionen) • Regelmäßige Einnahme kohlenhydrathaltiger Nahrung besonders in den späten Abendstunden und vor körperlichen Anstrengungen • Diazoxid (200-600 mg oral/Tag ): ein antihypertensiv wirkendes Benzothiadiazinderivat mit hyperglykämischer Wirkung (Suppression der Insulinfreisetzung durch direkten Angriff an der ß-Zelle sowie durch extrapankreatische Stimulation der Glykogenolyse). Zufriedenstellende Kontrolle der Hypoglykämien bei etwa 50% der Insulinompatienten (erhebliches Nebenwirkungsspektrum: kardiale Arrhythmien, Kardiomyopathie, Knochenmarksdepression, Anorexie, Erbrechen, Natriumretention, Ödeme). • Langwirksame Somatostatinanaloga (150-1500 µg Octreotid subkutan/Tag): nur in etwa 50% der Fälle erfolgreich. Cave: Durch die gleichzeitige Somatostatin-induzierte Hemmung der Freisetzung des Insulin-gegenregulatorischen Hormons Glukagon aus den Alpha-Zellen der Langerhans-Inseln kann die Hypoglykämiesymptomatik verstärkt werden. • evtl. α-Interferon (3x3 Mio. IE/Woche subkutan) • evtl. hepatische Chemoembolisation • evtl. Chemotherapie 49 GASTROENTEROLOGIE NEUROENDOKRINE TUMOREN Hypoglykämie V.a. Insulinom 72 h-Hungerversuch Glucose < 40 mg/dl Glucose > 60 mg/dl Insulin < 6 µg/ml Kein Insulinom Insulin > 6 µg/ml Insulinom Therapie beim Insulinom: • Kurative, chirurgische Exzision/ Tumordebulking • Regelmäßige Einnahme kohlenhydratreicher Nahrung • Diazoxid • Somatostatinanaloga • Alpha-Interferon • evtl. hepatische Chemoembolisation • evtl. Chemotherapie 50 GASTROENTEROLOGIE NEUROENDOKRINE TUMOREN 3. GASTRINOM (Zollinger-Ellison-Syndrom) Hypersekretion von Magensäure mit fulminanter Ulkusentstehung, rezidivierendem Auftreten von Ulzera, Refluxkrankheit und Diarrhoe sowie einem Nicht-ß-Zell-Tumor des Pankreas. Lokalisation und Dignität: Etwa 66% der Gastrinome treten sporadisch auf (häufig solitär, 50–60% im Pankreas, 30–35% im Duodenum, Passaros „Gastrinom-Dreieck“: Begrenzung durch Pankreaskopf, Duodenum und Leberpforte). Etwa 50% der sporadischen Gastrinome sind nach Metastasierung in die Leber, in abdominelle Lymphknoten oder in den Knochen als maligne einzustufen. Gastrinome im Rahmen der multiplen endokrinen Adenomatose Typ I (30% der Gastrinome, 60% im Duodenum, 40% im Pankreas) treten häufig multipel auf. Maligne Gastrinome sind beim MEN I seltener, die Metastasen befinden sich in der Leber, häufig auch nur Lymphknotenmetastasen. Klinische Symptome: dyspeptische Beschwerden (z.B. Ulkusschmerz), Diarrhöen, gelegentlich Dysphagie, Übelkeit und Erbrechen. Diagnostik: • Nachweis eines erhöhten Gastrinspiegels im Serum • Zur weiteren Differenzierung der Hypergastrinämie dient der Sekretintest: Beim Zollinger-Ellison-Syndrom weiteres Ansteigen des Gastrinspiegels um mehr als 200 pg/ml nach Injektion von Sekretin (1 oder 2 klinische Einheiten/kg Körpergewicht). Bei Hypergastrinämien mit anderen Ursachen bleiben die Gastrinwerte nach Gabe von Sekretin unverändert oder fallen ab. Häufigste Ursache für erhöhte Gastrinspiegel ist die Therapie mit säurehemmenden Medikamenten (H2-Rezeptor-Antagonisten, Protonenpumpenhemmer – 1 Woche vor Diagnostik absetzen!). Der Sekretintest ist indiziert bei basalen Gastrinspiegeln im leicht erhöhten Bereich (100-1000 pg/ml). Bei sehr stark erhöhten basalen Gastrinspiegeln (mehr als 1000 pg/ml) ist bei entsprechender Klinik die Diagnose nahezu gesichert. Hohe Gastrinspiegel differentialdiagnostisch auch bei chronisch-atrophischer Gastritis Typ A (kein rezidivierendes Ulkusleiden). • Lokalisation: Die sensitivsten Verfahren zur insgesamt sehr schwierigen Tumorlokalisation sind endoskopischer Ultraschall und Octreotid-Scan. Therapie: • Protonenpumpenhemmer (Omeprazol, Lansoprazol, Pantoprazol). Die notwendige Dosis sollte dabei individuell ermittelt werden (basale Säuresekretion, gemessen am Morgen vor der nächsten Einnahme des Protonenpumpenhemmers, unter 5 mmol/Stunde). • Langwirksame Somatostatinanaloga nur in Ausnahmefällen (aufgrund sehr guter Wirksamkeit der Protonenpumpenhemmer). • Chirurgische Tumorentfernung: Wegen der häufigen malignen Entartung kurative Exzision bei sporadischen Gastrinomen in nur etwa 30% der Fälle möglich. Postoperatives Absetzen der Protonenpumpenhemmer erst, wenn die Serumgastrinspiegel abfallen und sich bei einem Auslaßversuch des Protonenpumpenblockers normalisieren. Beim Gastrinom im Rahmen eines MEN ISyndroms kurative Resektion aufgrund des multilokalen Auftretens selten möglich, in Anbetracht des sehr niedrigen malignen Potentials auch nicht zwingend erforderlich. Hier Therapie der Wahl lebenslange, säurehemmende Therapie mit Protonenpumpenhemmern. 51 GASTROENTEROLOGIE NEUROENDOKRINE TUMOREN Ulcera oberer GI-Trakt, Diarrhoe V.a. Gastrinom Gastrin im Serum < 100 pg/ml 100-1000 pg/ml > 1000 pg/ml Kein Gastrinom Sekretintest Gastrinom Kein Gastrinanstieg Gastrinanstieg >200 pg/ml Therapieoptionen bei Gastrinom: • Kurative, chirurgische Exzision/ Tumordebulking • Protonenpumpenhemmer • evtl. Somatostatinanaloga • evtl. hepatische Chemoembolisation • evtl. Chemotherapie 52











