PowerPointpräsentation hier klicken
Werbung

Slide 1
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
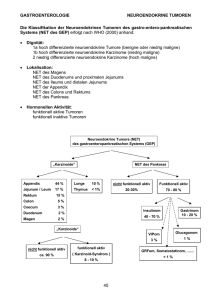
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 2
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 3
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 4
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 5
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 6
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 7
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 8
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 9
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 10
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 11
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 12
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 13
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 14
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 15
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 16
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 17
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 18
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 19
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 20
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 21
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 22
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 23
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 24
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 25
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 2
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 3
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 4
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 5
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 6
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 7
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 8
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 9
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 10
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 11
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 12
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 13
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 14
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 15
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 16
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 17
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 18
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 19
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 20
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 21
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 22
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 23
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 24
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko
Slide 25
Neuroendokrine Tumoren des
gastropankreatischen Systems (GEP-NET)
Behandlung und Prognose
M. Kraft
Medizinische Klinik B der
Westfälischen Wilhelms-Universität Münster
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
Chromogranin A
NSE, Synaptophysin
Ki67
Einteilung der GEP - NET
• Einteilung nach Histologie
• spezifische Färbemethoden
• Einteilung nach Funktionalität
Neuroendokrine Tumoren des
gastropankreatischen Systems
neuroendrokrine Tumoren
nicht funktionell
~ 30 - 55 %
Problem: Diagnose spät
funktionell
Pankreas
•
•
•
•
•
•
Insulinom
Gastrinom
Glukagonom
VIPom
Somatostatinom
GRFom
Darm
• Karzinoid
Lunge
Nebenniere
Thymus
Charakteristika GEP-NET
Tumor
Inzidenz/
Mio. / a
Symptom
Karzinoid
0,5 - 2
Durchfälle, plötzliche Rötung im Gesicht und
Oberkörper mit Schweißausbruch,
Insulinom
1-2
erniedrigter Blutzucker, Schwindel,
Konzentrationsstörungen, Bewusstlosigkeit,
Gastrinom
0,5-1,5
Schmerzen, Durchfälle, Magen-Darm
Geschwüre
Glukagonom
0,01-0,1
Hautausschlag, Gewichtsverlust, leichte
Blutzuckererhöhung
Somatostatinom
0,01-0,2
Blutzuckererhöhung, Gallensteine,
Durchfälle,
VIPom
0,05-0,2
Durchfälle, Kaliumverluste,
Flüssigkeitsverlust
Einteilung der GEP - NET
• Einteilung nach Histologie
• Einteilung nach Funktionalität
• Einteilung nach molekulargenetischen
Kriterien
Multiple Endokrine Neoplasie
(MEN) Typ I
Erstbeschreibung durch Wermer 1954
– autosomal-dominant vererbtes Tumorsyndrom
sehr variable Kombination aus
– Nebenschilddrüsenvergrößerung (pHPT) +
– Hypophysenvorderlappentumore +
– Inselzelltumore des Pankreas
Ursache entdeckt 1988 durch Larsson et al.:
Mutation auf Chromosom 11q13 (Menin Gen)
neuroendokrine Tumore bei
MEN I
Inselzelltumor
MEN – I (%)
Gastrinom
20 – 61
Insulinom
12 – 21
Glukagonom
VIPom
Somatostatinom
3
1
1
Grundprinzipien der Therapie
bei GEP-NET
chirurgische
Therapie
solitärer Tumore
medikamentöse,
symptomatische
Therapie
antiproliferative
Heilung
Erhaltung der
Lebensqualität
Kontrolle des
Tumorwachstums
Therapie
kurative Therapie bei
GEP-NET des Pankreas
• chirurgische Resektion derzeit einziger
kurativer Therapieansatz
• nur bei lokalisierten Tumoren
deshalb Frühdiagnose entscheidend
• in Einzelfällen auch gleichzeitige oder
zeitversetzte Entfernung einer Metastase
möglich
• immer auch Tumorart und
molekulargentischen Hintergrund
berücksichtigen
Therapie metastasierter
neuroendokriner Tumoren
• individuelles spontanes
Wachstumsverhalten abschätzen
• aggressive Therapien nur bei schnell
wachsenden Tumoren
• Ziel
– Erhaltung der Lebensqualität
– antiproliferative Wirkung nicht immer
gesichert
Therapie von
Lebermetastasen
Lokale Therapie
• chirurgische Entfernung
–Indikation falls > 90 % entfernbar
Perkutane Ethanol Injektion (PEI)
–falls < 5 cm
–TransArteriell (Chemo)Embolisation (TAE, TACE)
Lebertransplantation
in Einzellfällen möglich
TAE / TACE
Medikamentöse Therapie
- symptomatisch
Somatostatin und Somatostatinanaloga
– Hormon / körpereigener Botenstoff
– bindet an spezifische Rezeptoren (Somatostatinrezeptoren 1-5)
– hemmt Freisetzung von
• Magensaft
• Bauchspeicheldrüsensaft
• vielen anderen Hormonen
Interferon – a (alpha)
– Botenstoff des Immunsystems, hemmt Virusvermehrung in Zellen
Säureblocker bei Gastrinom
Diazoxid (Proglizem) bei Insulinomen
– hemmt Insulinausschüttung aus ß-Zellen des Pankreas
– stimuliert die Blutzuckerfreisetzung aus der Leber
Therapie metastasierter
neuroendokriner Tumoren
Langwirksame Somatostatinanaloga
– Unterschiede in der Wirkdauer
• Octreotid (Sandostatin) 8 h
• Lanreotid (Somatuline LP) 10-14 Tage,
• LAR-Octreotid (Sandostatin – LAR) 28 Tage
– Expression der Rezeptoren für Somatostatinanaloga
ist gewebespezifisch (SSTR 1-5)
– Mehrzahl der GEP-NET exprimieren SSTR 2
– 35-55%-ige Hemmung des Wachstums
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen von Somatostatinanaloga:
• Blähungen
• Durchfälle
• Fettstühle
• Blutzuckerwerterhöhung
• Gallensteinleiden
(bei OP ggf. Cholezystektomie)
Nebenwirkungen selten und fast nie
Indikation für Therapie-Abbruch
Therapie metastasierter
neuroendokriner Tumoren
IFN-a
– wirkt symptomatisch und hemmt das Tumorwachstum
• hemmt die Gefäßneubildung
• fördert die Tumorzellzerstörung durch spezialisierte
Immunzellen
• führt zum Zelltod von Tumorzellen (Apoptose)
• hemmt das Zellwachstum
–
–
–
–
biochemischer Effekt in 40-50 % der Fälle
20-40 % der Fälle Wachstumsstillstand
12-20 % der Fälle teilweises Ansprechen
3x3 – 3x5 Mio. IE / Woche
• höhere Dosen ohne zusätzliche Effekt
(Öberg, Digestion, 2000; Arnold, Baillieres Clin Gastroenterol, 1996)
Therapie metastasierter
neuroendokriner Tumoren
Nebenwirkungen einer Therapie mit IFN-a
frühe Nebenwirkungen
• Grippe – Symptome
• Durchfall
• Appetitmangel
• Übelkeit
• Kopfschmerzen
• Leibschmerzen
Blutbildveränderungen
späte Nebenwirkungen
• chronische Müdigkeit
• Depression
• Infektanfälligkeit
• Durchfall
• Leberwerterhöhung
• Gewichtsverlust
• Haarausfall
• Autoimmune Erkrankungen
• Hypertriglyzeridämie
• Dermatitis
Therapie metastasierter
neuroendokriner Tumoren
Kombination IFN-a und Somatostatinanaloga
– Kombinationtherapie einer Monotherapie
wahrscheinlich überlegen
– Ansprechraten bis 67 % (Frank, 1999, Am J Gastroenterology)
– Dosis
• 3 x 200 µg Octreotid
• 3 x 5 Mio. IE IFN-a
– Empfehlung:
• Einsatz bei allen Patienten die nicht auf eine
Monotherapie ansprechen
Therapie metastasierter
neuroendokriner Tumoren
systemische Chemotherapie
• gut differenzierte
neuroendokrine Tumore
des Pankreas
Streptozotocin +
5 FU o. Doxorubicin
Ansprechraten 60-70 %
• schnell wachsende
schlecht differenzierte
neuroendokrine Tumore
Etoposid + Cisplatin
Ansprechraten 67 %
NW: Nieren- und Leberschaden, Hemmung der Blutbildung,
Nervenschaden (Etoposid + Cisplatin)
Doxorubicin Schaden des Herzens, kumulativ !
systemische Chemotherapie nicht indiziert bei
GEP-NET des Magens, Dünndarm und Dickdarm
Therapie metastasierter
neuroendokriner Tumoren
Somatostatingerichtete Radiopeptidtherapie
•
111 In
DTPA- Octreotid (Pentatreotid)
– deutliches biochemisches Ansprechverhalten und geringe
Toxizität bei progredienten GEP-NET
•
90 Yttrium
DOTA-Octreotid
– ß-Strahler (höhere biologischer Aktivität)
– erste Studien zeigen signifikante Abnahme der
Tumorgröße
– ! Ausscheidung über Nieren Bestrahlungsdosen der
Nieren relativ hoch (nicht mit AS)
Somatostatinrezeptorgerichtete
Radiopeptidtherapie
90
Y- DOTA Octreotid
Somatostatinrezeptor
innere
Bestrahlung
111
In - DTPAOctreotid
Somatostatinrezeptor
tragende Tumorzelle
antiproliferativer
Effekt
innere
Bestrahlung
Therapie
- Zusammenfassung Erstdiagnose
GEP-NET
kurativer Ansatz
möglich
OP
palliativer Ansatz
keine klinischen
Beschwerden
Restaging nach
3-6 Monaten
Symptomatik
Octreotid
symptomatische
Therapie
Tumorprogress
??
a-Interferon
OP
TAE/TACE
PEI
Chemotherapie
90Y-Octreotid
Prognose
• individuell verschieden und schwer
abschätzbar
• auf Grund symptomatischer Therapie
Verschiebung des Komplikationsspektrums
• Insulinom sehr gute Prognose
• Gastrinom und Karzinoid häufiger bereits mit
Metastasen
• insgesamt langsames Wachstumsverhalten
der meisten GEP-NET
Prognoseabschätzung
GEP-NET des Pankreas
lokal fortgeschritten oder Tochtergeschwülste
ja
nein
Differenzierung ?
Ki-67 > 2 % ?
Nerven / Gefäßbeteiligung ?
gut
schlecht
ja
höheres Risiko
nein
niedriges Risiko