rundum chemie 2
Werbung

Rundum Chemie
2
Lösungen zu den Aufgaben
im LehrerInnenmaterial
Oberstufe
8. Klasse
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
2
Inhalt
Chemie der Kohlenwasserstoffe
Vorsicht
bei gesundheitsgefährdenden
Stoffen
Methan und
Ethan – die einfachsten Alkane
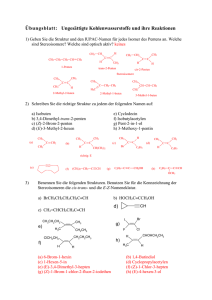
1. Die einfachsten organischen Verbindungen sind nur aus den Ele­
menten Kohlenstoff und Wasserstoff aufgebaut. Man bezeichnet sie als
Kohlenwasserstoffe. Die einfachste Kohlenwasserstoff-Verbindung ist
Me­than – der Hauptbestandteil des Erdgases. Durch Strukturuntersu­
chungen weiß man, dass im Me­than-Molekül ein Kohlenstoff-Atom mit
vier Wasserstoff-Atomen verbunden ist.
a) Geben Sie die LEWIS-Formel (Strukturformel) für ein Kohlenstoff-Atom
und für Methan an.
Stellen Sie die Summenformel auf. Illustrieren Sie die Molekülmodelle
farbig (Kohlenstoff-Atom schwarz; Wasserstoff-Atome grau).
Lösungen
Kalottenmodell
H
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
C
H C H
C H4
H
Kugel/Stab-Modell
b) Geben Sie Vorkommen, Eigenschaften und Verwendung von Methan an.
Hauptbestandteil des Erdgases, Sumpfgas, Biogas;
farbloses, geruchloses Gas, brennbar, im Gemisch mit Luft explosiv,
leichter als Luft; Heizgas, Rohstoff für die chemische Industrie
2. Eine weitere Kohlenwasserstoff-Verbindung ist Ethan. In diesem Molekül sind zwei Kohlenstoff-Atome
direkt miteinander verbunden. Weitere Bindungen gehen diese Kohlenstoff-Atome mit WasserstoffAtomen ein.
a) Zeichnen Sie in nebenstehendes Kästchen die Strukturformel des
Ethan-Moleküls und beurteilen Sie die C – H-Bindung und die C – C­Bindung.
H H
© 2007 Verlag E. DORNER GmbH, Wienrvorlage C–H: leicht polare Atombindung
H C C H
H H
C–C: reine Atombindung
b) Vervollständigen Sie die folgenden Merksätze:
Die Bindung zwischen den beiden Kohlenstoff-Atomen im Ethan-Molekül bezeichnet man als
Einfachbindung
Einfachbindung
dungen
bindung
Atomen beträgt
heißen
. Kettenförmige Kohlenwasserstoffe mit solchen C – C-
Alkane
Alkane
EinfachbinEinfach-
. Der Bindungswinkel zwischen den Kohlenstoff- und Wasserstoff-
109,5°
(Tetraederwinkel) .
109° (Tetraederwinkel)
3. Welche Aussagen können Sie den Strukturformeln entnehmen?
Aussagen zum Molekülbau und zur chemischen Bindung
Chemie der Kohlenwasserstoffe
3
Lösungen
Molekülbau
homologe Reihe der Alkane
Vorsicht bei und
gesundheitsgefährdenden
Stoffen
1. Vervollständigen Sie die verschiedenen Modelldarstellungen des Alkans Propan.
a) und b) Malen Sie die Atome farbig aus (Kohlenstoff schwarz und Wasserstoff grau) und geben Sie
zusätzlich im Feld b) den Bindungswinkel zwischen den Atomen an.
c) Zeichnen Sie die bindenden Elektronenpaare ein.
d) Formulieren Sie die vereinfachte Strukturformel und die Summenformel von Ethan.
a) Kalottenmodell
b) Kugel/Stab-Modell
:
109,5°
H – H – H
d) vereinfachte Struktur- und Summenformel
H3C–CH3
H –C – C – C – H
C2H6
H – H – H
2. Vervollständigen Sie die Tabelle der ersten vier homologen Alkane. Kennzeichnen Sie die Veränderung
der Siedetemperatur innerhalb der homologen Reihe. Nutzen Sie die vorgezeichneten Keile und zeichnen
Sie diese farbig nach.
Alkane
Strukturformel
Methan
H C H
H
H
H H
Ethan
H C C H
Summenformel
Siedetemperatur
Siedetemperatur
Aggregatzustand
bei 20 °C
CH4
-161 °C
(g)
C2H6
-89 °C
(g)
C3H8
-42 °C
(g)
C4H10
-0,5 °C
(g)
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
c) vollständige Strukturformel
H H H
Propan
H C C C H
H H H
H H H H
Butan
H C C C C H
H H H H
3. Wie lautet die allgemeine Summenformel der Alkane?
CnH2n+2
4. Nennen Sie in Ihrer Mitschrift die Ursache für die Veränderung der Siedetemperatur innerhalb der
homologen Reihe der Alkane.
Zunahme der Van-der-Waals-Bindungskräfte mit steigender Kohlenstoffkette
4
Chemie der Kohlenwasserstoffe
© 2007 Verlag E. DORNER GmbH, Wienrvorlage H H
Vorsicht
Verzweigte
beiAlkane
gesundheitsgefährdenden
und ihre BenennungStoffen
Lösungen
1.
Verbindungen mit gleicher Summenformel und unterschiedlicher Strukturformel bezeichnet man als Isomere. Sie haben unterschiedliche Eigenschaften.
2. Um organische Stoffe eindeutig zu benennen, wurden die „Genfer Nomenklaturregeln“ festgelegt.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
a) Vervollständigen Sie die Tabelle.
Name
des Alkans
vereinfachte Strukturformel
des Alkans
Name des
Alkyl-Restes
vereinfachte Strukturformel
des Alkyl-Restes
Methan
CH4
Methyl-
– CH3
Ethan
CH3 – CH3
Ethyl-
–CH2–CH3
Propan
CH3–CH2–CH3
Propyl-
–CH2–CH2–CH3
Butan
CH3–CH2–CH2–CH3
Butyl-
–CH2–CH2–CH2–CH3
b) Die folgenden Regeln sind bei der Benennung zu beachten. Vervollständigen Sie die Tabelle.
Regel
Beispiel
Strukturformel
Die längste Kette bestimmt den Stammnamen
des Alkans.
-pentan
CH3 CH CH2 CH2 CH3
Die Namen der Alkyl-Reste werden dem
Stammnamen vorangestellt.
Methylpentan
Dem Namen der Alkyl-Reste werden möglichst
kleine Zahlen vorangestellt, die die Num­
mer des Kohlenstoff-Atoms der Hauptkette
an­geben, an dem der Alkyl-Rest hängt.
CH3
1
2-Menthylpentan
Unterschiedliche Seitenketten werden alpha­
betisch nach den Namen der Alkyl-Reste
geordnet.
3-Ethyl-2,4-dimethylpentan
c) Kreuzen Sie die richtigen Antworten an.
2,2,4-Trimethylpentan …
hat drei gleiche Seitenketten.
3
4
5
CH3
1
2
3
4
CH3
5
CH3
CH3 CH CH CH CH3
1
2
3
CH3
4
5
CH3
CH2 CH3
iso-Butan …
trägt die Bezeichnung Methylpropan.
ist ein Isomer zu Pentan.
CH3–CH2–CH2–CH2–CH2–CH3
2-Methylpentan
2
CH3 CH CH2 CH CH3
2,4-Dimenthylpentan
Hexan
CH3
CH3 CH CH2 CH2 CH3
Treten gleiche Alkyl-Reste mehrfach auf, wird
das entsprechende griechische Zahlwort
(di-, tri-, tetra-, penta-) als Vorsilbe verwendet.
d)
CH3 CH CH2 CH2 CH3
CH3–CH–CH2–CH2–CH3
2,3-Dimethylbutan
CH3–CH–CH–CH3
CH3–CH3
CH
CH3
2,2-Dimethylbutan
CH3–C–CH2–CH3
3-Methylpentan
CH3–CH2–CH–CH2–CH3
CH
3
CH3
3
Chemie der Kohlenwasserstoffe
5
Substitutionsreaktion
Vorsicht bei gesundheitsgefährdenden
von Alkanen mit Halogenen
Stoffen
Lösungen
1. Der Lehrer oder die Lehrerin führt Ihnen auf dem Tageslichtprojektor das folgende Experiment vor.
a) Notieren Sie Ihre Beobachtungen.
Brom wird entfärbt.b
Uhrglas 1: Hexan mit Brom
1
2
3
gelbliche Trübung
Uhrglas 2: Silbernitrat-Lösung
Uhrglas 3: Universalindikator-Lösung
Indikator färbt sich gelbrot.
b) Stellen Sie die Reaktionsgleichung für die Reaktion im Uhrglas 1 auf. Welches Produkt wurde durch
die Reaktion in den Uhrgläsern 2 und 3 nachgewiesen? Benennen Sie auch das zweite Produkt.
→CH
6
13
Br + HBr
Monobromhexan; Nachweis von Hydrobromid
2. Beschreiben Sie mithilfe der Abbildung die bei der Reaktion ablaufenden Schritte.
Startreaktion:
Licht und Wärme spalten
1.
die Elektronenpaarbindung im Brommolekül.
→ Brom-Radikale
Zusammenstoß zwischenoß
Brom-Radikal und Hexan-Molekül;
Kettenreaktion:
2.
Brom-Radikal entreißt ein Wasserstoff-Atom.
→
Licht
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
C6H14 + Br2
Hydrobromid
reagiert weiter.
Abbruchreaktion (nicht dargestellt):
Zwei Radikale reagieren miteinander.
3. Definieren Sie den Begriff „Substitution“.
chemische Reaktion, bei der
zwischen den Molekülen Atome oder
Atomgruppen ausgetauscht werden
(Austauschreaktion).
6
Chemie der Kohlenwasserstoffe
3.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage und Hexyl-Radikal; das Hexyl-Radikal
Halogenalkane
Vorsicht bei gesundheitsgefährdenden
und Ozon
Stoffen
Lösungen
Halogenalkane sind Derivate der Alkane, die durch Substitutionsreaktionen entstehen.
1. Definieren Sie den Begriff „Derivat“.
Derivate sind Abkömmlinge einer organischen Verbindung, die durch eine
chemische Reaktion aus dieser entstehen.
2. Geben Sie die Reaktionsgleichungen für die schrittweise Fluorierung von Methan bis zum Tetrafluor­
methan an. Benennen Sie die Produkte und die Reaktionsart.
→ CH F + HF; Monofluormethan
CH F + F → CH F + HF; Difluormethan
CH F + F → CF + HF; Trifluormethan
CHF + F → CF + HF; Tetrafluormethan; Substitutionsreaktionen
CH4 + F2
3
3
2
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
2 2
2 2
3
2
3
2
4
3. Nennen Sie die Bindungsart in Halogenalkanen. polare
Atombindung
4. Geben Sie Verwendungsmöglichkeiten der Halogenalkane an.
Herstellung von Farbstoffen, Klebstoffen, Kühlmittel, Waschmittel,
Lösungsmittel für Fette, Treibgas
5. Halogenkohlenwasserstoffe zerstören die Ozon­
schicht der Stratosphäre. Wie in der Abbildung
dargestellt, werden die reaktionsträgen Halogen­
alkane durch die UV-Bestrahlung in aggressive
Radikale umgewandelt.
UVStrahlen
Ozonschicht
C
C
© 2007 Verlag E. DORNER GmbH, Wienrvorlage CCl3F
a) Geben Sie die Reaktionsgleichung für die Spal­
tung eines Halogenwasserstoff-Moleküls an.
CCl3F
ClO
→ CCl F + Cl
2
b) Formulieren Sie die Ozon-Spaltreaktion.
O3
O3
C
O2
O3
2 O2
UVStrahlen
O3
O2
→O
+O
c) Chlor-Atome wirken beim Zerfall von OzonMolekülen wie ein Katalysator. Begründen Sie dies
durch die Angabe der Reaktionsgleichungen.
→ ClO + O
ClO + O → Cl + 2 O
Cl + O3
2
3
Erdoberfläche
2
2
Chlor liegt wieder vor.
Chemie der Kohlenwasserstoffe
7
Vom
Vorsicht
Halogenalkan
bei gesundheitsgefährdenden
zum Alken – Eliminierung
Stoffen
Lösungen
1. Durch das folgende Experiment kann man aus einem Halogenalkan einen Kohlenwasserstoff herstel­
len, der zur Gruppe der Alkene gehört.
farbloses Gas
Sand mit
Bromethan
Glaswolle
Bei der Durchführung des nebenstehenden Expe­
riments konnten die folgenden Beobachtungen
gemacht werden:
(1) Es entsteht in der Silbernitrat-Lösung ein gelb­
licher Niederschlag.
Indikatorpapier
(2) Ein am Rand des Reagenzglases befestigtes
Universalindikatorpapier färbt sich rot.
Silbernitrat-Lösung
Wasser
Hydrobromid wurde nachgewiesen.
H3C–CH2
I
→ H C=CH
2
2
+ HBr; es entsteht Ethen.
Br
b) Geben Sie die Reaktionsbedingungen und die Energiebilanz an.
Wärme, Katalysator; stark endotherme Reaktion
2. Beschreiben Sie mithilfe der Abbildung die während der Reaktion ablaufenden Vorgänge.
Durch die äußeren Bedingungen wird
ein Brom-Atom und ein Wasserstoff-
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
a) Welcher Stoff wurde durch (1) und (2) nachgewiesen? Stellen Sie eine Reaktionsgleichung für die
ablaufende Reaktion auf und benennen Sie das zweite Produkt.
Atom abgespalten; es entsteht Hydrozwischen den Kohlenstoff-Atomen
eine C=C-Zweifachbindung aus;
es entsteht Ethen.
3. Definieren Sie den Begriff „Eliminierungsreaktion“.
Aus einem Molekül eines Ausgangsstoffes wird unter Ausbildung einer Mehrfachbindung ein anderes Molekül abgespalten (Eliminierungsreaktion,
Abspaltungsreaktion).
8
Chemie der Kohlenwasserstoffe
© 2007 Verlag E. DORNER GmbH, Wienrvorlage bromid . Gleichzeitig bildet sich
C2H4
HC≡CH
C2H2
Atombindung; C=C-Zweifachbindung
Ethin: Atombindung;
C=C-Dreifachbindung
180°
H
C C H
H H H
C C C C H
H
H H
H H H H
H
C C C C C H
H
H H H
H
H
H
C5H10
C3H6 -47 °C
C2H4 -104 °C
(l)
(g)
(g)
C4H6
C2H2 -84 °C
C3H4 -23 °C
Alkene:
CnH2n
Alkine:
(l)
(g)
(g)
(g)
CnH2n-2 sich
4. Formulieren Sie jeweils die allgemeine Summenformel.
H H H
H C C C C C H
H H H
H C C H
3. Vervollständigen Sie die Tabellen der ersten vier homologen Alkene bzw. Alkine. Kennzeichnen Sie die Veränderung der Siedetemperatur inner­
halb der jeweiligen homologen Reihe. Nutzen Sie die vorgezeichneten Keile und zeichnen Sie diese farbig nach.
Ethen: 2. Geben Sie jeweils die Bindungsart zwischen den Kohlenstoff-Atomen im Ethen-Molekül und im Ethin-Molekül an.
H2C=CH2
120°
c) Zeichnen Sie die bindenden Elektronenpaare ein.
d) Formulieren Sie die vereinfachte Strukturformel und die Summen­
formel von Ethen bzw. Ethin.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. a) Malen Sie die Atome der verschiedenen Modelldarstellungen des
Alkens Ethen und des Alkins Ethin farbig aus (Kohlenstoff schwarz und
Wasserstoff grau).
b) Geben Sie jeweils den Bindungswinkel zwischen den Atomen an.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Molekülbau
Vorsicht bei und
gesundheitsgefährdenden
homologe Reihe der Alkene
Stoffenund Alkine
Lösungen
Chemie der Kohlenwasserstoffe
9
Lösungen
Vergleich
dergesundheitsgefährdenden
kettenförmigen Kohlenwasserstoffe
Vorsicht bei
Stoffen
A
B
Hex-2-in, C6H10
C
Propen, C3H6
Methan, CH4
1. Benennen Sie die in den Abbildungen dargestellten Moleküle und stellen Sie die Summenformeln auf.
Ordnen Sie diese der jeweiligen Stoffgruppe zu. Illustrieren Sie diese farbig.
2. Geben Sie Gemeinsamkeiten dieser drei Stoffgruppen an.
Sind aus Kohlenstoff- und Wasserstoff-Atomen aufgebaut, bilden homologe
Reihen, Aggregatzustand ändert sich von gasförmig über flüssig zu fest
mit steigender Kettenlänge, brennbar, bilden bei vollständiger Verbrennung
Wasser und Kohlenstoffdioxid, nicht gut in Wasser löslich, reagieren mit
Halogenen, bilden Isomere
3. Vervollständigen Sie die folgende Tabelle.
Endung der
Namen
-an
-en
-in
allgemeine
Summenformel
CnH2n+2
CnH2n
CnH2n-2
nur C–C-Einfachbindungen
Substitution
Eliminierung
keine
eine C=C-Zweifach- eine C≡C-Dreifach-
bindung
bindung
Addition
Addition
typische
Reaktionsarten
Nachweisreaktion
10
Chemie der Kohlenwasserstoffe
Entfärbung von Brom- Entfärbung von Bromwasser durch Addition wasser durch Addition
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Alkane AlkeneAlkine
Strukturmerkmal
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Die Ihnen bekannten kettenförmigen Kohlenwasserstoffe sind Alkane, Alkene und Alkine.
Ringförmige
Vorsicht bei gesundheitsgefährdenden
Kohlenwasserstoffe I
Stoffen
Lösungen
Außer den kettenförmigen Kohlenwasserstoffen gibt es eine weitere Gruppe organischer Stoffe, die ring­
förmigen (cyclischen) Kohlenwasserstoffe.
1. a) Geben Sie die ausführliche und die verkürz­
te Strukturformel sowie die Summenformel von
Cyclohexan an.
C6H12
b) Vergleichen Sie deren Bindungen und
Struktur­
formeln mit denen der kettenförmigen
Kohlenwasser­stoffe.
H H
H
H
C
C H
H C
H C
C H
C
H
H
H H
H2C
H2C
CH2
CH2
CH2
CH2
Alle C–C-Bindungen sind Einfachbindungen; die Summenformel stimmt nicht
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
mit der allgemeinen Formel der Alkane, aber mit der der Alkene überein.
c) Begründen Sie, warum Cyclohexan wie ein Alkan reagiert.
Chemische Reaktionen werden durch die vorliegenden Bindungen bestimmt.
Im Cyclohexan gibt es nur Einfachbindungen (wie bei Alkanen).
2. Eine besondere Ringform tritt in den aromati­
schen Kohlenwasserstoffen auf.
a) Geben Sie die ausführliche und verkürzte
Strukturformel sowie die Summenformel von
Benzen an. Beschreiben Sie die Strukturbeson­
derheit des Benzens.
H C
H C
H
C
C
H
C H
C H
© 2007 Verlag E. DORNER GmbH, Wienrvorlage C6H6; im Benzen ist jedes Kohlenstoff-Atom mit je einer Einfachbindung mit
einem benachbarten Kohlenstoff-Atom und einem Wasserstoff-Atom verbunden. Die sechs verbleibenden Elektronen bilden einen stabilen, ebenen
Ring.
b) Begründen Sie, warum Benzen nicht wie die Alkene eine Additionsreaktion mit Brom eingeht. Geben
Sie die Reaktionsgleichung und die Reaktionsart für die Reaktion mit Brom an.
Der Benzen-Ring ist so stabil, dass er nicht wie eine C=C-Zweifachbindung
durch Brom aufgebrochen werden kann. Benzen reagiert wie ein Alkan.
C6H6 + Br2 → C6H5Br + HBr; Substitutionsreaktion
Chemie der Kohlenwasserstoffe
11
12
Chemie der Kohlenwasserstoffe
H
H
Substitution
Substitution
Reaktionstyp
H
H
H
H
H
H
H
H
C
C
C
H
H
C
C
C
H
H
C6H6
Benzen
Aromaten:
H
H
H
Addition
(spontane
Reaktion)
C
C Br
H C
H C
C Br
C
H
H
H H
H
1,2-Dibromcyclohexan
C6H10 Br2
C
C
C
H
C
C
Substitution
Katalysator
H
H
H
C
H
Br
Brombenzen
Hydrogenbromid
C6H11 Br + HBr
C–C-Einfach- und ringförmiges
Zweifachbindungen Elektronensystem
H
H
H
H
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Belichtung
Belichtung
Reaktionsbedingungen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage H
C
C Br
H C
H C
C H
C
H
H
H H
H
Bromhexan und
Hydrogenbromid
C6H11 Br + HBr
H H H H H H
H C C C C C C Br
H H H H H H
Bromhexan und
Hydrogenbromid
C6H12 Br + HBr
C–C-Einfachbindungen
Reaktionsgleichung mit
Strukturformel
Reaktionsprodukt(e)
Reaktion mit Brom (Br2):
C–C-Einfachbindungen
Art der C/C-Bindungen
C H
H C
H C
C H
C
H
H
H H
H
Strukturformel
H
H
C
H
H H H H H H
H C C C C C C H
H H H H H H
H
C6H10
C6H12
C6H14
Molekülformel
Cyclohexen
Cyclohexan
Cycloalkene:
Cycloalkane:
Alkane:
n-Hexan
Lösungen
Ringförmige
Vorsicht bei gesundheitsgefährdenden
Kohlenwasserstoffe II
Stoffen
Neben kettenförmigen Molekülen können die Kohlenwasserstoffe auch ringförmige Molelüle bilden.
Ergänzen Sie die Tabelle.
Vorsicht
Übersicht:
beiReaktionsarten
gesundheitsgefährdenden
der organischen
Stoffen
Chemie
Lösungen
Für Reaktionen in der organischen Chemie sind drei Reaktionsarten typisch: Substitution, Addition und
Eliminierung.
1. Ergänzen Sie die folgende Tabelle und ziehen Sie Schlussfolgerungen daraus.
Additionsreaktion
A+B
allgemeine Gleichung mit den
Stoffen A, B, C
2
Anzahl der Ausgangsstoffe
Anzahl der Produkte
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Mehrfachbindung liegt vor in
einem …
Strukturmerkmal der/des
Ausgangsstoffe/-s
Energiebilanz
Name der Reaktion mit
Wasserstoff
→C
→1
C
→A+B
1
→2
Ausgangsstoff
Produkt
mindestens eine
Mehrfachbindung
exotherm
keine Mehrfachbindung
Hydrierung
Dehydrierung
C4H6 + H2
Reaktionsgleichung für ein
selbst gewähltes Beispiel
Eliminierungsreaktion
endotherm
→CH
4
8
C4H8 → C4H6 + H2
Schlussfolgerung:
Additions- und Eliminierungsreaktion sind umkehrbare Reaktionen
2. a) Geben Sie die Unterschiede zwischen Additionsreaktion, Eliminierungsreaktion und Substitutions­
reaktion an.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Bei der Substitution reagieren zwei Ausgangsstoffe zu zwei Produkten,
es ist keine Mehrfachbindung in den Ausgangsstoffen oder Produkten
vorhanden, Reaktionsbedingungen sind Wärme und Licht, die umgekehrte
Reaktion ist wieder eine Substitutionsreaktion.
b) Stellen Sie für ein selbst gewähltes Beispiel die Gleichung für eine Substitutionsreaktion auf und
begründen Sie, dass es sich um eine Substitutionsreaktion handelt. Benennen Sie die Produkte.
→ C H Cl + HCl; ein Wasserstoff-Atom im Butan-Molekül
wird gegen ein Chlor-Atom ausgetauscht → Hydrogenchlorid, Chlorbutan
z. B. C4H10 + Cl2
4
9
Chemie der Kohlenwasserstoffe
13
–
2
1ORGAN
I S3 CH4 E–
CH EM I E
EYI
6
7
AC
S
U
E
D
5
A
L
K
E
N
ELR
8
TO
W
O
E
H
LE
R
9
IBI
10
OE
FL
U
O
R
11
13
B
A
N
A
N
E
NNA
W
14
12
USZC
HPA
15
TTI
H
E
X
A
D
E
C
AN
16
17
ARB
E
N
ZE
NXBN
22
NÄTA
HE
18
19
20
21
KG
H
EI
Z
G
A
S
N
O
N
A
N
23
A
R
S
E
NIWR
24
26
27
28
SESSE L 25NOMENKLATUR
N
29
O
XIDZIRA
30
31
32
TO
F
C
K
W
A
D
DI
TIO
N
33
35
36
S
UBSTIT
UTI
ONANIO
37
ERU
CISSKL
38
EP
ERHAU
39
IA
Ö
LE
40
BC
A
M
PIN
G
GA
SN
34METHAN
A
U
S
Waagrecht:
1. Gegensatz von anorganischer Chemie
5. Kohlenwasserstoffe mit Zweifachbindung
6. Himmelsrichtung
8. deutscher Chemiker, dem die erste organische Synthe­
se gelang
10. Element in FCKWs
11. Früchte, die unter Ethen schneller reifen
15. Name von C16H34
16. einfachster aromatischer Kohlenwasserstoff
19. Verwendungszweck von Methan
21. Name von C9H20
23. giftiges Element, aus Krimis bekannt
24. Konformation des Cyclohexans
25. Benennung chemischer Verbindungen
29. Reaktionsprodukt einer Verbrennung
30. früher Kühlmittel in Kühlgeräten (Abkürzung)
31. Reaktionstyp bei Alkenen
33. Reaktionstyp bei Alkanen
34. Gas aus organischen Abfällen
37. Vorsilbe bei einer bestimmten Art von Isomerie
38. Tetrachlorethen (Abkürzung)
39. Schmiermittel
40. Verwendungszweck für Butan
14
Chemie der Kohlenwasserstoffe
Senkrecht:
2. Stoff zeigt kaum eine Reaktionsbereitschaft (Adjektiv)
3. Vorsilbe für ringförmige Alkane
4. Wasser im festen Aggregatzustand
7. Bindungen in Alkinen
9. Allgemeiner Name für den Kraftstoff von Ottomotoren
11. Campinggas
12. Abkürzung für halogeniertes, giftiges Holzschutzmittel
13. Konformation des Cyclohexans
14. Name von C6H14
17. Schweißgas
18. Molekülmodell, das die Raumerfüllung wiedergibt
20. In der C=C-Bindung sind die Kohlenstoff-Atome
... gebunden.
22. menschliche und tierische Ausscheidung
26. Stoff, der vor zu intensiver UV-Strahlung schützt
27. Vorsilbe bei einer bestimmten Art von Isomerie
28. einzelnes Halogen-Atom, nachdem es mit UV-Strah­
lung aus einem Molekül abgespalten wurde
32. Lösungsmittel, Derivat von Benzen
35. wärmespeicherndes Gebäude in Gartenbaubetrieben
36. internationale Organisation, die Nomenklaturfragen
klärt
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Vorsicht
Kohlenwasserstoffe
bei gesundheitsgefährdenden Stoffen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Lösungen
Vorsicht
Molekülbau
bei und
gesundheitsgefährdenden
homologe Reihe der Alkanole
Stoffen
Lösungen
1. Vervollständigen Sie die verschiedenen Modelldarstellungen des Alkohols Ethanol.
a) und b) Malen Sie die Atome farbig aus: Kohlenstoff schwarz, Sauerstoff rot und Wasserstoff grau.
c) Zeichnen Sie die bindenden und nichtbindenden Elektronenpaare ein.
d) Formulieren Sie die vereinfachte Strukturformel und die Summenformel von Ethanol.
a) Kalottenmodell
b) Kugel/Stab-Modell
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
c) vollständige Strukturformel
d) vereinfachte Struktur- und Summenformel
H3C–CH2OH
C2H5OH
2. Geben Sie den Namen und die Formel der funktionellen Gruppe der Alkanole an.
Hydroxyl-Gruppe [–OH]
3. Vervollständigen Sie die Tabelle der ersten vier homologen Alkanole.
Summenformel
Schmelztemperatur
Siedetemperatur
Aggregatzustand
bei 20 °C
CH3OH
–98 °C
65 °C
(l)
Ethanol
C2H5OH
-114 °C
78 °C
(l)
Propanol
C3H7OH
-126 °C
97 °C
(l)
C4H9OH
–90 °C
117 °C
(l)
Alkanole
Strukturformel
Methanol
H C O H
H
© 2007 Verlag E. DORNER GmbH, Wienrvorlage H
H H H H
Butanol
H C C C C O H
H H H H
4. Formulieren Sie die allgemeine Summenformel der Alkanole.
CnH2n+1OH
Chemie der Kohlenwasserstoffe
15
Vorsicht bei gesundheitsgefährdenden
Stoffen
Zusammenhang
von Struktur und Löslichkeit
von Alkohol
Lösungen
1. Ethanol ist sowohl in Wasser als auch in organischen Lösungsmitteln wie Hexan sehr gut löslich. Um
dieses Phänomen erklären zu können, vergleichen Sie die Struktur und die Eigenschaften der Lösungs­
mittel und von Ethanol miteinander. Ergänzen Sie die Tabelle.
H H H H H H
H
H C C C C C C H
H H H H H H
Name des Moleküls:
H
O
Name des Moleküls:
Wasser
Elektronegativitätsdifferenzen zwischen
C/H: C/C: Elektronegativitätsdifferenzen zwischen
O/H: räumliche Struktur: symmetrisch/unsymmetrisch
räumliche Struktur: symmetrisch/unsymmetrisch
Polarität im Molekül:
Polarität im Molekül:
Bindungskräfte zwischen den Molekülen:
Bindungskräfte zwischen den Molekülen:
hydrophil/hydrophob, lipophil/lipophob:
hydrophil/hydrophob, lipophil/lipophob:
0
symmetrisch
unpolar
1,3
unsymmetrisch
polar
Van-der-Waals-Kräfte
hydrophob, lipophil
Wasserstoffbrückenbindungen
lipophob, hydrophil
Name des Moleküls: Ethanol
Name des Kohlenwasserstoff-Restes:
Name der funktionellen Gruppe:
Ethyl-Gruppe
Hydroxyl-Gruppe
Polarität im Kohlenwasserstoff-Rest:
Polarität der funktionellen Gruppe:
unpolar
polar
Bindungskräfte zwischen den KohlenwasserstoffResten:
Bindungskräfte zwischen den funktionellen Grup­
pen:
Van-Der-Waals-Kräfte
Wasserstoffbrückenbindungen
hydrophil, lipophob/hydrophob, lipophil:
hydrophil, lipophob/hydrophob, lipophil:
hydrophob, lipophil
hydrophil, lipophob
2. Erklären Sie, warum Hexan-1-ol in Wasser nahezu unlöslich, in Heptan dagegen sehr gut löslich ist.
Heptan ist hydrophob, ebenso der Kohlenwasserstoff-Rest von Hexanol.
Der hydrophobe Charakter des längeren Kohlenwasserstoff-Restes erschwert
das Lösen im Wasser.
16
Chemie der Kohlenwasserstoffe
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
0,4
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Hexan
Mehrwertige
Alkohole und ihre Eigenschaften
Vorsicht bei gesundheitsgefährdenden
Stoffen
Lösungen
1. Der einfachste zweiwertige Alkohol ist Ethan-1,2-diol (Glycol). Er wird als Frostschutzmittel verwendet.
Geben Sie die Summen- und Strukturformel des Moleküls an und gestalten Sie das Kalottenmodell farbig:
Kohlenstoff schwarz, Sauerstoff rot und Wasserstoff grau.
H H
HO C C OH
C2H4(OH)2
H H
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
2. Der wichtigste dreiwertige Alkohol ist Propan-1,2,3-triol (Glycerol). Er kommt als Grundbaustein in
Fetten vor. Geben Sie die Summen- und Strukturformel des Moleküls an und gestalten Sie das Kalottenmodell farbig: Kohlenstoff schwarz, Sauerstoff rot und Wasserstoff grau.
OH OH OH
H C C C H
C3H5(OH)3
H H H
3. Hexanhexol (Sorbitol) wird als Süßstoff verwendet. Er ist ein fester Stoff und schmeckt noch süßer als
Glycerol. Stellen Sie die Strukturformel auf und geben Sie eine Erklärung für diese Wirkung.
OH OH OH OH OH OH
OH OH OH OH OH OH
H HCC CCC C
C CC
C HC C H
H H H
HH HHH H
H H H
Durch die hohe Anzahl von
OH-Gruppen im Molekül verstärkt
sich die Süßkraft des Alkohols.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage 4. Geben Sie die Strukturformeln für die folgenden Stoffe an: Propan-1-ol, Propan-1,3-diol und Propan1,2,3-triol. Versuchen Sie mithilfe des Molekülbaus Veränderungen der folgenden Eigenschaften innerhalb dieser Reihe zu bestimmen. Nutzen Sie die vorgezeichneten Keile, um die Zu- oder Abnahme zu
kennzeichnen.
Propan-1-ol
Strukturformel
Eigenschaften
OHH H
Propan-1,3-diol
OH H OH
Propan-1,2,3-triol
OH OHOH
H C C C H
H C C C H
H C C C H
H H H
H H H
H H H
Siedetemperatur
Viskosität
Löslichkeit in Benzin
Ursachen für diese
Veränderungen
Mit jeder OH-Gruppe mehr im Molekül stiegt die Polarität.
Es werden mehr Wasserstoffbrückenbindungen gebildet.
Alkohole
17
Vorsicht bei gesundheitsgefährdenden
Stoffen
Alkoholische
Gärung
Lösungen
1. Ausgangsstoffe für die Herstellung von Weinen sind zuckerhaltige Lösungen. Durch die alkoholische
Gärung wird in Gegenwart von Hefepilzen Ethanol hergestellt. Als Nebenprodukt entsteht ein farbloses,
geruchloses und ungiftiges Gas. Stellen Sie für diese Reaktion die Gleichung auf. Gehen Sie dabei von
der Summenformel der Glucose aus.
→
(Hefepilze)
C6H12O6
2 C2H5OH + 2 CO2
2. Stellen Sie die Reaktionsgleichung für den Nachweis des Gases mit Calciumhydroxid-Lösung auf.
CO2 + Ca + 2 OH2+
→ CaCO3 + H2O
Oechslegrad: 75 °Oe
b) Ein Traubensaft hat 82 °Oe. Geben Sie die Dichte an und berechnen Sie die Masse von einem Liter
dieses Fruchtsaftes.
Dichte
= 1,082 g/ml, m =
· V = 1,082 g/ml · 1000 ml = 1082 g
c) Vervollständigen Sie die Aussage:
Je zuckerhaltiger ein Saft ist, desto
weniger sinkt die Oechslewaage in die Flüssigkeit ein.
4. Interpretieren Sie den Verlauf der im Gärdiagramm dargestellten Gärkurve.
Weinansatz: 125 °Oe, d. h., ein Liter enthält 250 g Zucker; nach 1­–2 Tagen
beginnt die Gärung; etwa 2 Wochen sehr heftige Gärung (Hauptgärung),
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
3. Man bestimmt die Dichte einer Lösung, indem man ein Aräometer (Spindel, Senkwaage) in einen mit
der Flüssigkeit gefüllten Messzylinder eintaucht. Mit einer von dem Pforzheimer Goldschmied F. OECHSLE
erfundenen Mostwaage lässt sich das spezifische Gewicht des Mostes, die Dichtezahl, direkt ablesen,
wobei der über 1000 mg/mL hinausgehende Wert als Oechslegrad (°Oe) bezeichnet wird.
a) Ein Most hat eine Dichte von ñ = 1,075 g/mL. Geben Sie den Oechslegrad an.
weitere 10 Wochen langsame Gärung; bei etwa 20 °Oe beträgt der Zucker-
5. Durch „Brennen“ wird aus Wein Weinbrand hergestellt. Weinbrand hat einen Alkoholgehalt von 38–
42 Vol.%. Erklären Sie in Ihrer Mitschrift den Vorgang des „Brennens“ von Wein und entwickeln Sie eine
­Skizze für die experimentelle Durchführung.
Das „Brennen“ von Wein ist eine Destillation. Alkohol siedet bei 78 °C,
Wasser erst bei 100 °C, dadurch ist beim Erwärmen auf etwa 80 °C die
Abtrennung von Alkohol möglich.
18
Alkohole
© 2007 Verlag E. DORNER GmbH, Wienrvorlage gehalt noch 40 g/l und bei einem Alkoholgehalt von 14 % endet die Gärung.
Vorsicht
Molekülbau
bei und
gesundheitsgefährdenden
homologe Reihe der Alkanale
Stoffen
Lösungen
1. Vervollständigen Sie die verschiedenen Modelldarstellungen des Alkanals Ethanal.
a) und b) Malen Sie die Atome farbig aus: Kohlenstoff schwarz, Sauerstoff rot und Wasserstoff grau.
c) Zeichnen Sie die bindenden und nichtbindenden Elektronenpaare ein.
d) Formulieren Sie die vereinfachte Strukturformel und die Summenformel von Ethanal.
a) Kalottenmodell
b) Kugel/Stab-Modell
c) vollständige Strukturformel
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
H
d) vereinfachte Struktur- und Summenformel
H3C – CHO
H C C
CH3CHO
H
H
2. Geben Sie den Namen und die Formel der funktionellen Gruppe der Alkanale an.
Aldehyd-Gruppe [–CHO]
3. Vervollständigen Sie in der Tabelle die Daten der ersten vier homologen Alkanale.
Alkohole
Methanal
(Formaldehyd)
Strukturformel
O
H C
Ethanal
(Acetaldehyd)
Propanal
Schmelztemperatur
Siedetemperatur
Aggregatzustand
bei 20 °C
HCHO
-117 °C
-19 °C
(g)
CH3CHO
-121 °C
21 °C
(l)
C2H5CHO
–81 °C
49 °C
(l)
C3H7CHO
–99 °C
76 °C
(l)
O
H C C
H
H
H H
O
H C C C
H H
H
H H H
Butanal
Summenformel
H
H
© 2007 Verlag E. DORNER GmbH, Wienrvorlage O
O
H C C C C
H H H
H
4. Formulieren Sie die allgemeine Summenformel der Alkanale.
CnH2n+1CHO
Alkohole
19
Lösungen
Molekülbau
Vorsicht bei und
gesundheitsgefährdenden
homologe Reihe der Alkansäuren
Stoffen
1. Vervollständigen Sie die verschiedenen Modelldarstellungen der Alkansäure Ethansäure.
a) und b) Malen Sie die Atome farbig aus: Kohlenstoff schwarz, Sauerstoff rot und Wasserstoff grau.
c) Zeichnen Sie die bindenden und nichtbindenden Elektronenpaare ein.
d) Formulieren Sie die vereinfachte Strukturformel und die Summenformel von Ethansäure.
a) Kalottenmodell
b) Kugel/Stab-Modell
H
d) vereinfachte Struktur- und Summenformel
O
H C C
H3C – COOH
CH3COOH
O H
H
2. Geben Sie den Namen und die Formel der funktionellen Gruppe der Alkansäuren an.
Carboxyl-Gruppe [–COOH]
3. Vervollständigen Sie die Tabelle der ersten vier homologen Alkansäuren.
Alkansäure
Methansäure
(Ameisensäure)
Strukturformel
H C
Summenformel
Schmelztemperatur
Siedetemperatur
Aggregatzustand
bei 20 °C
HCOOH
8 °C
101 °C
(l)
CH3COOH
17 °C
118 °C
(l)
C2H5COOH
–21 °C
141 °C
(l)
-4 °C
164 °C
(l)
O
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
c) vollständige Strukturformel
Ethansäure
(Essigsäure)
H
H C C
O
O H
H
Propansäure
(Propionsäure)
Butansäure
(Buttersäure)
H H
O
H C C C
H H
O H
H H H
H C C C C
O
O H
H
CH3HH 7COOH
4. Formulieren Sie die allgemeine Summenformel der Alkansäuren.
20
Oxidationsprodukte der Alkohole
CnH2n + 1COOH
© 2007 Verlag E. DORNER GmbH, Wienrvorlage O H
Vorsicht
Struktur bei
undgesundheitsgefährdenden
Eigenschaften der Alkansäuren
Stoffen
Lösungen
1. Formulieren Sie die Dissoziationsgleichung der Ethansäure in Ionenschreibweise und geben Sie die
Namen der Teilchen an.
O
O
H3C C OH
Wasser
-
+
H 3C C O + H
Ethansäure + Wasser → Ethansäurerest-Ion (Acetat-Ion) + Wasserstoff-Ion
2. Zeichnen Sie die Strukturformel der Decansäure ein und charakterisieren Sie die Eigenschaften der
Carbonsäuregruppe bzw. des Kohlenwasserstoff-Restes in Bezug auf die Löslichkeit.
H H H H H H H H H
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
H C C C C C C C C C C
H H H H H H H H H
Kohlenwasserstoff-Rest
O H
O
Carboxylgruppe
Polarität:
unpolar
Polarität:
polar
hydrophil/hydrophob:
hydrophob
hydrophil/hydrophob:
hydrophil
lipophil/lipophob:
lipophil
lipophil/lipophob:
lipophob
3. Die ersten vier Alkansäuren sind in Wasser sehr gut löslich. Bei den darauf folgenden Säuren der
homologen Reihe nimmt die Wasserlöslichkeit ab. Geben Sie die Ursachen dieser Erscheinung an.
Die unpolare, hydrophobe Kohlenwasserstoff-Kette der Moleküle gewinnt
zunehmend an Einfluss. Langkettige Alkansäuren sind in Wasser unlöslich.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage 4. Welche Bindungskräfte wirken zwischen den Alkansäure-Molekülen?
Wasserstoffbrückenbindungen und Van-der-Waals-Kräfte
5. Wird die Alkansäure Stearinsäure (C17H33COOH) geschmolzen und in ein Becherglas mit Wasser
gegossen, so erstarrt sie auf der Wasseroberfläche. Dabei richten sich die Stearinsäure-Moleküle aus.
Zeichnen Sie die ausgerichteten Moleküle in die Abbildung ein.
Oxidationsprodukte der Alkohole
21
Übersicht:
Vorsicht beiCarbonsäuren
gesundheitsgefährdenden Stoffen
Lösungen
1. Vervollständigen Sie die folgende Übersicht der Carbonsäuren. Geben Sie das charakteristische Merkmal an und benennen Sie das angegebene Beispiel.
funktionelle Gruppe:
Carboxyl-Gruppe
O
*R– C
allgemeine Strukturformel:
* [R – Alkyl-Rest]
gesättigte,
verzweigte
Carbonsäuren
ungesättigte
Carbonsäuren
mehrwertige
Carbonsäuren
Hydroxy carbonsäuren
aromatische
Carbonsäuren
Merkmal:
Beispiel:
nur Einfachbindungen im Alkyl-Rest
CH3 – CH2 – COOH
Propansäure
zusätzliches Merkmal:
Beispiel:
Verzweigung in der Alkylkette
CH3 CH CH2 COOH
CH3
3-Methylbutansäure
zusätzliches Merkmal:
Beispiel:
Mehrfachbindung
CH3 – CH2 – CH = CH – COOH
Pent-2-ensäure
mehrere Carboxyl-Gruppen
zusätzliches
Merkmal:
Beispiel:
HOOC – CH2 – CH2 – COOH
zusätzliches Merkmal:
Beispiel:
CH3 CH CH2 COOH
zusätzliches
Merkmal:
Beispiel:
COOH
Butan-1,4-disäure
eine Hydroxyl-Gruppe
OH
3-Hydroxybutansäure
mit aromatischem System
Benzencarbonsäure
2. Ergänzen Sie die fehlenden Namen bzw. Strukturformeln und ordnen Sie die Carbonsäuren den oben
genannten Gruppen zu. Geben Sie ein Beispiel für das Vorkommen an.
Strukturformel
COOH
COOH
CH 3 CH COOH
OH
HOOC CH CH COOH
OH OH
22
Oxidationsprodukte der Alkohole
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
gesättigte,
unverzweigte
Carbonsäuren
O H
Name
Vorkommen
Ethandisäure (Oxalsäure)
in Rhabarber,
in Sauerklee
mehrwertige Carbonsäure
2-Hydroxypropansäure
(Milchsäure)
Hydroxycarbonsäure
bakterieller Abbau von
Milchzucker
2,3-Dihydroxybutandisäure in reifen Weintrauben
mehrwertige Hydroxyund Früchten
carbonsäuren
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Stoffklasse:
Carbonsäuren
Aromatische
Verbindungen mit Sauerstoff
Vorsicht bei gesundheitsgefährdenden
Stoffen
Lösungen
1. Ergänzen Sie für die angegebenen aromatischen Sauerstoff-Verbindungen: a) Name des Stoffes,
b) Summenformel, c) funktionelle Gruppe, d) Zuordnung zu einer Stoffklasse der organischen Chemie
und e) zu erwartende typische Reaktionen aufgrund des Einflusses der funktionellen Gruppe.
CH2OH
a)
Benzylalkohol
a)
Benzencarbaldehyd
a)
Benzencarbonsäure
b)
C6H5–CH2OH
b)
C6H5–CHO
b)
C6H5–COOH
c)
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
d)
© 2007 Verlag E. DORNER GmbH, Wienrvorlage COOH
CHO
e)
Hydroxyl-Gruppe
aromatischer Ring
Alkohole
c)
d)
Alkoholatbildung,
Esterbildung mit Säuren, Oxidation
e)
Aldehyd-Gruppe
aromatischer Ring
Aldehyde
reduzierende Wirkung, Oxidation,
Hydrierung
Carboxyl-Gruppe
aromatischer Ring
d)
Carbonsäuren
c)
e)
saure Reaktion,
Salzbildung, Esterbildung mit Alkoholen
2. Phenol (Hydroxybenzen) besteht aus einem Benzen-Molekül, in dem ein Wasserstoff-Atom durch eine
Hydroxyl-Gruppe ersetzt ist. Stellen Sie die Summen- und Strukturformel für Phenol auf und nennen Sie
Beispiele für die Verwendung.
SummenformelStrukturformel
OH
C6H5–OH
Verwendung
Ausgangsstoff für die Herstellung von:
- Farbstoffen
- Arzneimitteln
- Holzschutzmitteln
- Kunststoffen
3. Ist Phenol ein Alkohol oder eine Säure? Entscheiden Sie dies nach den typischen Eigenschaften der
Verbindung: Phenol ist in Wasser nur schwer löslich, die Lösung wirkt desinfizierend, die wässrige Lösung
zeigt einen pH-Wert von etwa 5 an, mit Natrium-Ionen reagiert Phenol zu Natriumphenolat.
Die Verbindung Phenol (Carbolsäure) ist eine sehr schwache Säure..
4. Zeichnen Sie die Strukturformel folgender Verbindungen:
1,2-Dihydroxybenzen
(Brenzcatechin)
OH
OH
2-Hydroxybenzencarbonsäure
(Salicylsäure)
COOH
OH
1,3-Dihydroxybenzen
(Resorcin)
OH
OH
Oxidationsprodukte der Alkohole
23
Lösungen
Sauerstoffderivate
Vorsicht bei gesundheitsgefährdenden
der Kohlenwasserstoffe
Stoffen
I
1. R – CH2OH
R – CHO
Oxidation am Kupferreduzierende Wirkung,
kontakt,
Hydrierung,
Esterbildung mit Säuren, neutrale Reaktion
Alkoholatbildung,
neutrale Reaktion
R – COOH
Esterbildung mit Alkanolen, saure Reaktion,
Salzbildung mit
Metallen, Neutralisation
mit Basen
Alkanole
Alkanale
Alkansäuren
CH3 – CH2 – CH2OH
CH3–CH2–CHO
CH3–CH2–COOH
Propan-1-ol
Propanal
Propansäure
CH3–(CH2)16–CH2OH
CH3–(CH2)16–CHO
CH3 – (CH2)16 – COOH
Octadecanol
Octadecanal
Octadecansäure
3. Vergleichen Sie chemische Eigenschaften der Verbindungen mit drei und achtzehn Kohlenstoff-­Atomen
und stellen Sie die Änderungen der Eigenschaften innerhalb der homologen Reihe grafisch dar. Nutzen
Sie die vorgezeichneten Keile, um die Zu- oder Abnahme zu kennzeichnen.
Propan-1-ol, Propanal und Propansäure besitzen durch den starken Einfluss der
funktionellen Gruppen deutlich unterschiedliche chemische Eigenschaften.
Bei den Stoffen mit 18 C-Atomen hat die funktionelle Gruppe kaum noch
einen Einfluss auf die chemischen Eigenschaften der Stoffe.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
Einfluss des
Kohlenwasserstoff-Restes
Einfluss der
funktionellen Gruppe
4. Vergleichen Sie in Ihrer Mitschrift die chemischen Eigenschaften von Propan und Propansäure sowie
Octadecan und Octadecansäure. Begründen Sie Ihre Antwort.
Propan besitzt andere chemische Eigenschaften als Propansäure.
Die funktionelle Gruppe hat einen starken Einfluss auf das Molekül.
Die chemischen Eigenschaften von Octadecan und Octadecansäure sind
nahezu gleich. Der Einfluss der funktionellen Gruppe ist kaum vorhanden.
24
Oxidationsprodukte der Alkohole
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Anzahl der Kohlenstoff-Atome
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
2. Ergänzen Sie die folgende Tabelle der Verbindungen mit drei und achtzehn Kohlenstoff-Atomen.
Vorsicht bei gesundheitsgefährdenden
Sauerstoffderivate
der Kohlenwasserstoffe
Stoffen
II
Lösungen
Die Sauerstoffderivate der Kohlenwasserstoffe lassen sich leicht ineinander umwandeln.
1. a) Tragen Sie die Strukturformel der drei Stoffe in die Kästchen ein und geben Sie die Oxidationszahlen der Kohlenstoff-Atome an.
b) Nennen Sie die Reaktionsart für die Umwandlung einer Stoffgruppe in die andere.
Alkohol
H H H
-3
-2
-1
H – C– C– C– OH
Alkanal
H H
Oxidation
-3
→
←
-1
H – C– C– C
Reduktion
H H H
H H
Propanol
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
-2
Alkansäure
H
H H
Oxidation
-3
→
-2
-3
H – C– C– C
O
H H
Propanal
OH
O
Propansäure
2. Stellen Sie für folgende Reaktionen die Reaktionsgleichungen auf.
a) Propanol wird mittels Kupfer(II)-oxid zu Propanal umgesetzt.
CH3–CH2–CH2OH + CuO
Kat.
→
CH3–CH2–CHO + Cu + H2O
b) Propanol wird mittels Luftsauerstoff katalytisch zu Propansäure umgesetzt.
Kat.
CH3–CH2–CH2OH + O2
CH3–CH2–COOH + H2O
→
c) Propanol wird vollständig verbrannt.
2 CH3–CH2–CH2OH + 9 O2
→
6 CO2 + 8 H2O
d) Propan-2-ol wird mittels Kupfer(II)-oxid zur Reaktion gebracht. Bezeichnen Sie das Reaktionsprodukt.
Zu welcher Stoffklasse gehört es?
CH3–CH(OH)–CH3 + CuO
→
CH3–CO–CH3 + Cu + H2O; Propanon (Aceton),
Alkanon (Keton)
e) Kann Propan-2-ol oder Propanon zu Propansäure oxidiert werden? Begründen Sie Ihre Antwort.
Nein, innerhalb der Ketone kann ein Kohlenstoff-Atom nur zwei Bindungen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage für den Sauerstoff zur Verfügung stellen. Oxidiert man kräftiger, dann kommt
es zur Zersetzung.
f) Stellen Sie die Reaktionsgleichung für die vollständige Oxidation von Propan-2-ol auf.
CH3–CH(OH)–CH3 + 9 O2
Kat.
→
6 CO2 + 8 H2O
g) Formulieren Sie die Reaktionsgleichung für die Hydrierung von Propanal.
CH3–CH2–CHO + H2 Kat. CH3–CH2–CH2–OH
→
3. Zeigen Sie an einem Beispiel, dass auch Stoffe mit verschiedenen funktionellen Gruppen miteinander
reagieren können. Gehen Sie von Propanol und Propansäure aus. Stellen Sie die Reaktionsgleichung auf
und benennen Sie das Reaktionsprodukt sowie die Reaktionsart.
CH3–CH2–CH2–OH + HOOC–CH2–CH3
CH3–CH2–CH2O–CO–CH2–CH3 + H2O
Propansäurepropylester, Esterbildung (Substitution)
Oxidationsprodukte der Alkohole
25
Vorsicht bei gesundheitsgefährdenden
Ester-Bildung,
Molekülbau und Verwendung
Stoffen
Lösungen
Ethansäure
Name
Ethanol
Formel
CH3COOH
Formel
CH2H5OH
Stoffklasse
Alkansäuren
Stoffklasse
Alkanol
funktionelle Gruppe
Carboxyl-Gruppe
funktionelle Gruppe
Hydroxyl-Gruppe
2. Alkohole und Alkansäuren reagieren katalytisch unter Abspaltung von Wasser zu einem Ester. Vervollständigen Sie die Reaktionsgleichung der vereinfachten Strukturformeln und kennzeichnen Sie die für
Ester typische Estergruppe der Reaktionsprodukte.
O
+ H O CH2 CH3
H3C C
O H
H3C C
O
O CH2 CH3
+ H2O
3. Geben Sie Namen, vereinfachte Strukturformel, Stoffklasse und die Bindungsart des Esters aus Aufgabe 2 an. Zeichnen Sie das Kalottenmodell des gebildeten Esters und gestalten Sie es farbig (Kohlenstoff schwarz, Sauerstoff rot und Wasserstoff grau ).
Name
Ethansäureethylester
Formel
CH3COOC2H5
Stoffklasse
Ester
Bindungsart
Esterbindung (Atombindung)
4. Geben Sie für die verschiedenen Aroma-Ester die Namen bzw. Formeln an.
Aroma
Name des Esters
Formel des Esters
Banane
Pentylethanoat
CH3COOC5H11
Apfel
Pentylpentanoat
C4H9COOC5H11
Rum
Propansäurebutylester
C2H5COOC4H9
5. Geben Sie die Reaktionsart der Veresterung an.
26
Oxidationsprodukte der Alkohole
Substitution, Kondensationsreaktion
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Name
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. Geben Sie die Namen, Formeln, Stoffklassen und funktionellen Gruppen der abgebildeten Moleküle
an und gestalten Sie diese farbig (Kohlenstoff schwarz, Sauerstoff rot und Wasserstoff grau).
Vorsicht
Übersicht:
beiOrganische
gesundheitsgefährdenden
Stoffe
Stoffen
Erdgas
Erdöl
Lösungen
a) ringförmige Alkane
b) z. B.: Cyclopentan
c) C5H10
a) Aromaten
b) z.
Erdölfraktionen
1
a) Alkane
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
b) z.
2
B. Ethan
3
c) CH3 – CH3
4
8
a) Alkine
b) z.
b) z. B.: Ethin
B. Ethen
c) HC
c) CH2=CH2
6
a) Alkanole
b) z. B.: Ethanol
c) Cl–CH3
c) CH3–CH2OH
9
11
10
b) z.
12
B. Ethanal
c) CH3 – CHO
Metallhydroxid
14
c) CH3 – CO – O – CH2 – CH3
9
10
a) Salz der Alkansäure
b) z. B.: Natriumethanat
c) CH3 – COOH
c) NaCH3COO
6
Addition (Hydrierung)
2
7
Eliminierung
(Dehydrierung)
Substitution
4
Addition
(Hydrierung)
Eliminierung
(Dehydrierung)
Substitution
5
Addition
10
9
15
b) z. B.: Ethansäure
Cracken
8
15
a) Alkansäuren
1
3
13
a) Alkanale
a) Ester
2. ≡ CH
7
b) z. B.: Monochlorethan
b) Ethylethanoat
© 2007 Verlag E. DORNER GmbH, Wienrvorlage c) C6H6
a) Alkene
5
a) Halogenderivate
B. Benzen
Veresterung
(Substitution)
Esterspaltung
11
Oxidation (Dehydrierung)
12
Reduktion (Hydrierung)
13
Addition (Hydratisierung)
14
Oxidation
15
Salzbildung
Oxidationsprodukte der Alkohole
27
Vorsicht bei gesundheitsgefährdenden Stoffen
Kreuzworträtsel
I
B
O
9
O E L E
11
D
A
O
15
16
R U M
19
20
S N
E S
C
T
23
E T H E
25
A
A
28
29
M A I N
32
I
N O N
36
N E
L
39
O
N
41
42
A L B
46
A L
E
48
K
N O
I
Z
50
A N
I
55
B
MN
57
Z U
E
60
U
E
62
G Ä R U N
1
2
3
X I
N
12
B
A
S I
E
N
26
A
D A
M
13
C E
I
G S
E
N
R S
A
33
E N
E
37
L
B U
I
R
43
M O D E
I
N A N
I
51
52
E T H A
R
T
58
U N P O
N
M
63
G
P E
4
5
T I O N
R
14
R
S I
A
A E U R
E
24
R O
E N
6
D E
I
40
S
L E
N
S C
H
O L
O
A R
I
64
D
34
G
L
A
49
N
L
R
35
C
E
H
A
M
G
10
S O D A
N
S
17
18
M O L
21
22
E
A C
T
O
H Ö L
27
A
E
30
31
N A S S
A N
T
38
L
B E
R
44
45
E L F
47
L
L A
E
U
M
O
53
54
E
R E
56
N A
I
59
T
A S
61
P
E
L T O N
7
8
Waagrecht:
3. Reaktionsart (so ent­stehen aus Alkanolen A
­ lkanale), 9. Bezeichnung für flüssige Fette, 10. handels­üblicher
Name für Natriumcarbonat, 11. Fluss in Sibirien, 13. Name des Elements 58, 14. Symbol für ein Element (u. a.
Bestandteil des Sandes), 15. alkoholisches Getränk, 17. Einheit der Stoffmenge, 19. Symbol eines Elements
(Be­standteil von Bronze), 20. niedrige Alkansäure (Handelsname, ä = ae), 21. Symbol von Actinium, 23. Alken
(Ausgangsstoff für viele Syn­thesen), 24. Bezeichnung für das Erdöl vor seiner Verarbeitung, 26. Element der 5.
Hauptgruppe, 28. Nebenfluss des Rheins, 30. Eigenschaft von Wasser, 32. Alken mit neun Kohlenstoff-Atomen, 34.
Alkan (molare Masse: 142 g/mol), 36. Symbol für das Edelgas Neon, 37. Spitze des Schiffes, 38. Symbol des Elements mit der Massenzahl 9, 39. Symbol des Elements Nickel, 40. Symbol für ein Element der 6. Haupt­gruppe,
41. Gebirgszug in Bayern, 43. Hilfsmittel zur Erklärung theoretischer Sachverhalte, 44. Ordnungszahl von Natrium
(als Wort), 46. Symbol eines Leichtmetalls, 47. Symbol von Lanthan, 48. Alkan mit neun Kohlenstoff-Atomen, 49.
Verbrennungsrückstand, 50. Verhältniswort, 51. Bestandteil alkoholischer Getränke, 53. Symbol des Elements 75,
55. Symbol von Mangan, 56. Symbol eines sehr reaktionsfreudigen Metalls, 57. Gegensatz von offen, 58. Eigenschaft von Stoffen, die sich nicht in Wasser lösen, 59. Symbol des Elements von 26. waagrecht, 62. Prozess der
Her­stellung von Ethanol aus Zucker, 63. Vorsilbe vor Oxiden mit erhöhtem Sauerstoffanteil, 64. Wissenschaftler,
der eines der ersten Atommodelle entwickelte
28
Oxidationsprodukte der Alkohole
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Senkrecht:
1. Element der 7. Hauptgruppe, 2. Farbe von Universalindikator-Lösung mit Basen, 4.
Verhältniswort,
5. Trivialname der einfachs­
ten Alkansäure (ä = ae),
6. Symbol für das Element
77, 7. Vorsilbe (eins bedeutend), 8. Zustandsform von
Propan bei 20 °C, 12. alkalisch reagierende Stoffe,
14. Reaktion von Säuren,
15. Symbol des Edelgases
Radon, 16. einfaches, sehr
giftiges Alkanol, 17. einfaches, sehr giftiges Alkanal,
18. wie 47 waagrecht,
19. Symbol für das Element
21, 22. Symbol für das Element Cobalt, 25. Vorsilbe
einer Gruppe von Säuren
(mit NH2-Gruppe), 27. Stoffgruppe (aus Alkohol und
Säuren entstanden), 29.
wie 4 senkrecht, 31. wie 50
waagrecht, 33. Reaktionsart
in der organischen Chemie,
35. Name eines Eisensalzes
(Halogenid), 41. Kohlenwasserstoff mit Dreifach­bindung,
42. Erdölprodukt (Mehrzahl),
44. chemischer Grundstoff,
45. Halogen, 50. Laboreinrichtung zum Experimentieren mit giftigen Stoffen,
52. kleinste Bausteine der
chemischen Elemente,
54. Metall, Hauptbestandteil
von Stahl, 60. Symbol des
Elements 68, 61. Symbol des
teuersten Edelmetalls
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Lösungen
Vorsicht
Aufgabensammlung
bei gesundheitsgefährdenden Stoffen
Lösungen
1.a)Ethanol: farblose, brennbare Flüssigkeit mit Siedepunkt 78 °C, Elektronenpaarbindung, funktionelle
Gruppe ist die OH-Gruppe (Hydroxyl-Gruppe). Neben den unpolaren C–C- und C–H-Bindungen treten im Molekül eine polare C–O-Bindung und eine polare O–H-Bindung, ähnlich wie im Wasser, auf.
Zwischen den O–H-Gruppen des Ethanol-Moleküls und den Wasser-Molekülen treten Wasserstoffbrückenbindungen auf. Deshalb ist Ethanol in Wasser auch gut löslich. Ethanol reagiert mit Alkalimetallen
wie Wasser unter Bildung von Wasserstoff und Alkaliethanolat (salzartig).
Kaliumhydroxid: weißer Feststoff, Ionenverbindung (Salz), K+OH–; hygroskopisch, leicht löslich in
Wasser. Beim Lösen entsteht aufgrund des frei beweglichen Hydroxid-Ions (OH–-Ion) Kalilauge.
b)• Mithilfe eines Indikators; bei Ethanol keine Reaktion, bei Kaliumhydroxid Verfärbung: alkalische
Lösung!
• Brennbarkeit des Ethanols: verbrennt mit blauer Flamme (Spiritusbrenner)
2. Ethan: gasförmig und unlöslich in Wasser; Molekül ist wegen der fehlenden Polarität hydrophob
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Ethanol: flüssig und leicht löslich in Wasser. Die Bindung in der O–H-Gruppe ist ähnlich polar wie
die Bindung im Wasser-Molekül. Zwischen den O–H-Gruppen des Ethanol-Moleküls und den WasserMolekülen treten Wasserstoffbrückenbindungen auf. Deshalb ist Ethanol in Wasser auch gut löslich.
3. Methanol + Natrium:
2 H3CO–H + 2 Na → 2 H3CO– + 2 Na+ + H2↑,
exotherm
Natrium-Methanolat
Methan ist völlig unpolar, während im Methanol die Polarität in der O–H-Gruppe ähnlich der im
Wasser-Molekül ist. Methanol reagiert deshalb ähnlich wie Wasser, Bildung von Wasserstoff und
Natriummethanolat. Die Reaktion ist aber weniger heftig.
4. Petroleum ist eine unpolare, hydrophobe Flüssigkeit, die das darin aufbewahrte Alkalimetall vor Luftund Wasserzutritt schützt. Wasser würde mit Alkalimetallen sehr heftig unter Wasserstoffentwicklung
und Bildung von stark alkalischen Lösungen reagieren.
5.a) 250 mL Weißwein, 10,5 Vol% Alkohol; 250 mL • 0,105 • 0,78 g/mL = 20,47 g Ethanol
b) 0,7 L Rotwein, 12,5 Vol% Alkohol; 700 mL • 0,125 • 0,78 g/mL = 68,25 g Ethanol
6.a)
Körpergewicht
Volumen Wein
Alkoholgehalt
Masse an Ethanol
Frau
65 kg
0,4 L
12 Vol%
37,44 g
Mann
75 kg
1L
12 Vol%
93,6 g
Blutalkohol in Promille =
m (Alkohol in g)---m (Körper in kg) • 0,7
37,44
––––––­– = 0,82 ‰
65 • 0,7
93,6
––––––­– = 1,78 ‰
75 • 0,7
Blutalkohol nach
8 Stunden
Abbau 0,1 ‰ pro Stunde,
daher werden in 8 Stunden
0,8 ‰ abgebaut – der Blutalkohol-Rest beträgt
0,02 ‰.
Abbau 0,15 ‰ pro Stunde, daher werden in 8
Stunden 1,2 ‰ abgebaut
– der Blutalkohol-Rest
beträgt 0,58 ‰.
b) Bei einem vom Gesetz zugelassenen Blutalkoholhöchstwert von 0,5 ‰ darf am nächsten Morgen
nur die Frau ein Fahrzeug lenken, beim Mann liegt der Blutalkoholgehalt mit 0,58 ‰ noch immer
über dem zulässigen Wert und er darf nicht mit dem Auto fahren.
Oxidationsprodukte der Alkohole
29
Lösungen
Vorsicht bei gesundheitsgefährdenden Stoffen
Aufgabensammlung
7. Das Ethanol wird zu Ethanal oxidiert, das Kaliumchromat wird von der
Atemluft reduziert, wobei die Farbe von gelb nach grün umschlägt.
H3C–CH2OH (g)
→
H3C–CHO (aq) + 2 H+ (aq) + 2 e–
2 CrO42– (aq) + 16 H+ + 6 e–
→
2 Cr3+ (aq) + 8 H2O (l)
H3C–CHO (aq) + 2 Cu2+ + 4 OH– → H3C–COOH + Cu2O (s) + 2 H2O
Das blaue Cu2+-Ion wird zu rotem Cu+-Oxid reduziert und das Ethanal zu Ethansäure oxidiert.
8. Speiseessig ist eine wässrige Lösung von Essig-(Ethan-)säure mit einem Massenanteil von etwa
5 % Ethansäure, die durch enzymatische Oxidation von Ethanol gebildet wurde (Gärungsessig).
9.
Strukturformel
H – C– C– O – H
Atommasse
46 u
Siedetemperatur 78 °C
Wasserstoffbrückenbindungen
zwischen den einzelnen
Ethanol-Molekülen aufgrund der
Polarität der Bindungen in der
O–H-Gruppe
H – C– C
H
–
O
OH
–
–
H H
H
–
H H
Methylmethanoat
C2H4O2
60 u
-23 °C
Keine Wasserstoffbrückenbindung möglich, da am O-Atom
des Methanols der SäureRest der Methansäure gebunden ist.
10. Propanol
Aceton
Leichtbenzin
Cyclohexan
Hexadecanol
30
Oxidationsprodukte der Alkohole
Alkohole
Die hydrophile OH-Gruppe bildet mit WasserMolekülen Wasserstoffbrückenbindungen aus.
Es besitzt zwei kurze unpolare Methyl-Reste
und eine polare Carbonyl-Gruppe. Diese bildet
mit Wasser-Molekülen Wasserstoffbrückenbinmischbar
dungen aus. Die Alkyl-Reste sind so klein, dass
ihre hydrophobe Eigenschaft die Löslichkeit im
Wasser nicht beeinträchtigt.
Gemisch von unpolaren Kohlenwasserstoffen,
nicht mischbar daher hydrophob; Van-der-Waals-Kräfte zwischen den Molekülen
vollkommen unpolar, daher hydrophob; Van-dernicht mischbar
Waals-Kräfte zwischen den Molekülen
Der hydrophobe unpolare Alkyl-Rest ist sehr
nicht mischbar lang, sodass er die Löslichkeit stärker beeinflusst als die polare OH-Gruppe.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Ethanol
C2H6O
mischbar
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Name
Summenformel
Vorsicht bei gesundheitsgefährdenden Stoffen
Lösungen
11.a)
Indikator
Geruch
Phenolphthalein
-
Wasser
NatriumhydroxidVerfärbung
Lösung
Methanol
Methanol-Lösung -
Brennbarkeit
-
SchiffReagenz
-
-
-
-
stechend
+
-
+
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
b)
Indikator
Phenolphthalein
Methanal-Lösung Methansäure
Rotfärbung
Ethansäure
Rotfärbung
Geruch
stechend
stechend
nach Essig
Reaktion mit
SchiffSiedeSchwefelsäure Reagenz temperatur
+
-19 °C
Bildung von CO
101 °C
118 °C
12. Die Ameisen verspritzen Methan-(Ameisen-)säure.
13.a) a) CaCO3 (s) + 2 CH3COOH (aq) → Ca2+ (aq) + 2 CH3COO– (aq) + H2CO3 (aq)
H2CO3 (aq) → H2O + CO2↑ (g)
Der Kalk löst sich unter Bildung von gelöstem Calciumacetat und unbeständiger Kohlensäure, die in
Wasser und Kohlenstoffdioxid zerfällt.
b) Kalk ist ein schlechter Wärmeleiter. Dadurch verringert sich die Wärmeübertragung, während
Stromverbrauch und Dauer für die Heißwasserbereitung steigen an.
14.
Methanol
Siedetemperatur 65 °C
Zwischen den
polaren HydroxylGruppen bilden
sich starke Wasserstoffbrückenbindungen aus.
Methanal
-19 °C
Zwischen den Molekülen können sich
keine Wasserstoffbrückenbindungen
ausbilden.
Methansäure
101 °C
Zwischen den Carboxyl-Gruppen zweier
Carbon-säure-Moleküle bilden sich
Wasserstoffbrückenbindungen aus, so
dass Doppelmoleküle entstehen.
15.a) Ethylethanoat ist ein Ester, der den Strom nicht leitet, da keine Ionen vorhanden sind.
Die Farbe einer Universalindikator-Lösung wird nur durch anwesende H3O+-Ionen oder OH–-Ionen
verändert. Keine von beiden sind vorhanden.
b) Durch Zusatz von Wasser und nach leichter Erwärmung wird der Ester in seine Bestandteile
Ethanol und Ethansäure gespalten. Durch Protolyse der Ethansäure entstehen H3O+-Ionen und
Acetat-(H3CCOO–-)Anionen, was die Leitfähigkeit erklärt. Durch die Anwesenheit von H3O+ Ionen wird die Univeralindikator-Lösung hellrot.
16. Ölsäure ist eine ungesättigte Carbon-(Fett-)säure; an der Doppelbindung erfolgt die Addition von
Brom. Stearinsäure ist eine gesättigte Carbonsäure, eine Additionsreaktion ist nicht möglich.
Oxidationsprodukte derAlkohole
Alkohole
31
Vorsicht
Verarbeitung
bei gesundheitsgefährdenden
des Erdöls – fraktionierte Stoffen
Destillation
Lösungen
Erdöl ist ein Rohstoff, der aus unterschiedlichen organischen Verbindungen zusammengesetzt ist. Das
geförderte Erdöl wird in Trennanlagen von Verunreinigungen befreit. Das Produkt ist Rohöl. In einer Erdölraffination erfolgt die fraktionierte Destillation des Rohöls.
1. Erklären Sie den Begriff „fraktionierte Destillation“.
Erdöl ist ein Gemisch, das aus unterschiedlichen Verbindungen zusammengesetzt ist. Die Trennung erfolgt nach unterschiedlichen Siedebereichen.
b) z.B.
Pentan, Hexan, Heptan, Octan
c) Nonan,
Decan, Dodecan
d) Eicosan
Siedetemperatur
in °C
Stoff
Methan
Ethan
Propan
Butan
Pentan
2-Methylbutan
Hexan
Heptan
2,3-Dimethylpentan
Octan
–162
–89
–42
–1
36
28
69
98
2-Methylheptan
2,2,4-Trimethylpentan
Nonan
Decan
Docedan
Eicosan
Cyclopentan
Cyclohexan
Cyclohexen
88
126
Siedetemperatur
in °C
118
99
151
174
216
343
49
81
83
e) –
3. Erläutern Sie die Bedeutung
der Glocken, die auf den einzelnen Böden des Destillations­turmes
angebracht sind.
Ausschnitt: Glockenböden
→ a) < 30 °C
→ b) 30 °C < < 150 °C
Die Glocken haben
→ c) 150 °C < < 1250 °C
Durchlässe, durch die
der Dampf nach oben
→ d) 250 °C < < 350 °C
steigt. Er perlt durch
das Kondensat, das sich
auf dem Boden ange-
→ e) > 350 °C
erhitztes Rohöl
vom Röhrenofen
zur
VakuumDestillation
Destillationsturm
sammelt hat.
Dabei destillieren alle Anteile des Kondensats nach oben, die bei der
Dampftemperatur verdampfen.
32
Energie und Umwelt
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
a) z.B. Methan, Ethan, Propan, Butan
Stoff
© 2007 Verlag E. DORNER GmbH, Wienrvorlage 2. Stellen Sie anhand der Tabelle fest, welche
Kohlenwasserstoffe in den Temperaturbereichen
sieden, die am Bild des Destillationssturmes
angegeben sind, und benennen Sie die einzelnen
Fraktionen, die bei der fraktionierten Destillation
gewonnen werden.
Vorsicht
Biogas im
beiKohlenstoffkreislauf
gesundheitsgefährdenden Stoffen
Lösungen
1. Stoffkreislauf im natürlichen System
Durch den Menschen verursachter
zusätzlicher Materialfluss
Pflanzen
(Fotosynthese)
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage als regenerativer
Energieträger
als fossiler
Energieträger
TREIBHAUSEFFEKT
Sonnenenergie
O2
Nutzung von Methan durch den
Menschen
Nutzpflanzen
(Fotosynthese)
wenig
CH4
CH4
CO2
O2
CO2
viel NH3
und CH4
CH4
Nutzung durch den
Menschen (Verbrennung)
CO2
Tiere
(Stoffwechsel)
Nutztiere
(Stoffwechsel)
tote Biomasse
zusätzliche
tote Biomasse,
Mist, Jauche
Gärschlamm
als
Dünger
Weg 1
CO2
CH4
Biogas-Anlage
CH4
ErdgasLagerstätte
Weg 2
Salze
Bakterien
(Zersetzung)
Deponien,
Gruben,
Wiesen, Felder
StickstoffVerbindungen,
Salze
Oberflächenwasser,
Grundwasser
2. a) Regenerative
(erneuerbare) Energieträger stehen im Gegensatz zu herkömmlichen Brennstoffen theoretisch unbegrenzt zur Verfügung und schädigen bei der Nutzung die Atmosphäre und das Klima nicht. Beispiele sind
Sonne, Wind, Wasser, Biomasse.
b) Schonung
fossiler Vorräte, Teil des Kohlenstoffkreislaufs, Verringerung
des Treibhauseffekts, Entsorgung von Biomüll.
Energie und Umwelt
33
Lösungen
Struktur
Makromolekülen
Vorsicht von
bei gesundheitsgefährdenden
Stoffen
Struktur von Plastomeren
Struktur von Duromeren
Struktur von Elastomeren
kettenförmige und
verzweigte Moleküle,
weitgehend parallele
Anordnung.
Moleküle können
aneinander entlanggleiten.
Duromere
Elastomere
räumlich eng vernetzte
Moleküle,
feste Atombindungen
zwischen den Ketten,
Moleküle unbeweglich.
weitmaschig vernetzte Moleküle (durch
Schwefel- oder Kohlenstoffbrücken), verknäult, Ketten können
verformt werden.
2. Ordnen Sie den drei Kunststoffklassen die folgenden Eigenschaften zu:
bei Erwärmung verformbar, bei Zimmertemperatur elastisch, bei Erwärmung nicht verformbar, federnd,
nicht schmelzbar, plastisch formbar, teilkristallin und amorph, sehr hart und spröde, dehnbar und zusammendrückbar, löslich in organischen Stoffen, unlöslich in organischen Stoffen, nicht schmelzbar.
Plastomere
bei Erwärmung verformbar, plastisch verformbar, teilkristallin
und amorph, löslich in
organischen Stoffen
Duromere
bei Erwärmung nicht
verformbar, nicht
schmelzbar, sehr hart
und spröde, unlöslich
in organischen Stoffen
Elastomere
bei Zimmertemperatur elastisch, federnd,
dehnbar und zusammendrückbar, nicht
schmelzbar
3. Ordnen Sie den drei Kunststoffklassen die aufgelisteten Produkte zu:
Schlauchboot, Zahnrad, Mülltonne, Tragetasche, Autoreifen, Trommelstöcke, Badekappe, Fahrrad­
rückleuchte, Strahltriebwerk, Gießharz, Sitzpolster.
Plastomere
Mülltonnen
Tragtaschen
Fahrradrückleuchten
Lichtschalter
34
Organische Werkstoffe
Duromere
Zahnrad
Trommelstöcke
Strahltriebwerk
Gießharz
Elastomere
Schlauchboot
Autoreifen
Badekappen
Sitzpolster
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Plastomere
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. Beschreiben Sie die Strukturen der Plastomere, Duromere und Elastomere.
Vorsicht
Polymerisation
bei gesundheitsgefährdenden
und Polykondensation Stoffen
..
+
..
..
+
..
..
+ HO
H
OH
+
Lösungen
..
H
..
.. + 2 H
OH
Schematische Darstellung der
Polymerisation
Polykondensation
1. Vergleichen Sie mithilfe obiger Darstellung die Polymerisation und Polykondensation durch Ausfüllen
der Tabelle.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
entscheidendes Strukturmerkmal
der Monomeren
Polykondensation
Zweifachbindung
funktionelle Gruppe
Ketten
Ketten, teilweise Vernetzungen
Struktur des Polymerisats
bzw. Polykondensats
keine Nebenprodukte Nebenprodukte, meist Wasser
Abspaltung von Nebenprodukten
Verhältnis der Zusammensetzung
Monomer/Polymer
gleich
funktionelle Gruppe
Zuordnung zu einer Reaktionsart
Addition
Substitution
2. Welche Voraussetzungen müssen die Ausgangsstoffe bei der Polykondensation besitzen, damit es zur
Vernetzung der Ketten kommt?
Die Ausgangsstoffe müssen mehr als zwei funktionelle Gruppen besitzen.
3. Stellen Sie die Reaktionsgleichungen auf.
Q CH CH2
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Polymerisation
CH CH2
Q CH CH2
ĺ
CH3
Q
Styrol →Polystyrol
ĺ
CH CH2
CH3
Q
→Polypropen
Propen 4.
H H H H H H H H
O H H H H O
nN C C C C C C N + n C C C C C C
H H H H H H H H
1,6-Diaminohexan
OH H H H H OH
Adipinsäure
→
H H H H H H H H O H H H H O
N C C C C C C N C C C C C C
H H H H H H
Nylon
H H H H
+ 2n H2O
n
Wasser
Organische Werkstoffe
35
Makromolekulare
Vorsicht bei gesundheitsgefährdenden
Stoffe
Stoffen
Lösungen
1. Tragen Sie die folgenden Begriffe in die vorgegebene Übersicht ein, so dass die Einteilung makromolekularer Stoffe deutlich wird.
Duromere, Eiweiße, Elastomere, Kunststoffe, makromolekulare Stoffe, Naturstoffe, Phenoplaste, Polypeptide, Polysaccharide, Polyvinylchlorid, Stärke, synthetischer Kautschuk, Plastomer.
makromolekulare Stoffe
Plastomer
Polypeptide
Duroplast
Elastomer
Beispiel:
Beispiel:
Beispiel:
Beispiel:
Beispiel:
Stärke
Eiweiße
PVC
Phenomere
synthetischer
Kautschuk
2. Nennen Sie die Monomeren (Grundbausteine), aus denen die genannten makromolekularen Stoffe aufgebaut sind.
Makromolekulare Stoffe
Monomere
Polypeptide
2-Aminosäuren
Polysaccharide
Monosaccharide
Cellulose
Monosaccharide
Polyethylen
Ethen (Ethylen)
Polyvinylchlorid
Monochlorethen (Vinylchlorid)
Phenoplast
Phenol, Methanol (Formaldehyd)
synthetischer Kautschuk
Diene
Silicone
Silanole
3. Vergleichen Sie die Eigenschaften von makromolekularen Stoffen mit denen der entsprechenden
Monomeren.
Monomer
Makromolekularer Stoff
Größe der
Molekülmasse
unter 500
über 10 000
Einheitlichkeit der
Molekülmasse
einheitlich
nicht einheitlich
Schmelzen und Sieden bei Erweichen in bestimmten
Temperaturbereich, danach
bestimmter Temperatur
Zersetzung
Verhalten beim
Erwärmen
Schmelz- und
36
Organische Werkstoffe
janein
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Polysaccharide
Kunststoffe
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Naturstoffe
Bezeichnung
Vorsicht bei gesundheitsgefährdenden
und Verwendung von Kunststoffen
Stoffen
Lösungen
1. Leiten Sie aus den Symbolen der Kunststoffe die noch fehlenden Namen ab.
2. Ergänzen Sie durch Ankreuzen, ob es sich um Plastomere, Duromere oder Elastomere handelt.
3. Ergänzen Sie weitere Verwendungsmöglichkeiten der genannten Kunststoffe.
Symbol
Plastomere
Kunststoff
Duromere Verwendung
PVC
Polyvinylchlorid
PE
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Polyethen
PS (Styropor)
Polystyrol
PA (Nylon)
Polyamid
PP
Polypropen
P DE
X
Kanister, Tonbänder, Schläuche,
Fußbodenbeläge, Dachrinnen
Plastiksackerl, Folien, Getränkekästen
Spielzeug, Kübel, Mülltonnen
P DE
X
P DE
X
P DE
X
X
Einwegverpackungen (aufgeschäumt),
Jogurtbecher, Zeichengeräte
Isoliermaterial, Strumpfhosen, Netze,
Seile, Textilien, Angelschnur
Rohre, Gehäuse von TV und Radio,
Autobatteriegehäuse, Verpackungen
P DE
X
PAN (Dralon)
P DE
Polyacrylnitril
x
PTFE (Teflon)
P
Polytetrafluorethen
BR/NBR/SBR
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Elastomere
X
Textilfasern, Taue
D
Beschichtung von Pfannen und Töpfen,
Auskleidung von Lagern
Reifen, Schläuche, Gummimatratzen,
X Rohrleitungen, Bälle
P DE
Synthetischer Kautschuk
PF
E
elektrisches Isoliermaterial,
Formteile, Schichtpressstoffe
P DE
X
Phenoplast
PU/PUR
P
D
E
Kunststoffski, Skischuhe, Badeschwämme,
Polyurethan
x
x
x
Schaumdichtungsmittel
–
P
D
Schläuche, Schutzanstriche,
X Bremsflüssigkeit
Silicone
X X
E
PMMA (Acrylglas)
P DE
Polymethansäuremethylester
x
bruchsichere Verglasung,
Leuchten- und Fahrzeugbau
Organische Werkstoffe
37
Lösungen
Vorsicht bei gesundheitsgefährdenden Stoffen
1. Die Rohstoffe Erdöl und Erdgas sind Stoffgemische. Beschreiben Sie die Aufbereitung dieser Stoffgemische zu Produkten, die zur Herstellung von Kunststoffen verwendet werden können.
Synthetische Kunststoffe werden aus petrochemischen Produkten hergestellt.
Durch fraktionierte Destillation und anschließendes Cracken (u. U. nochmalige
Destillation) lassen sich reine Monomere für die Kunststoff-Herstellung gewinnen
Kunststoffe
Abkürzung Reaktionstyp
Polymerisate
Polyethen
PE
Polypropen
Polyvinylchlorid
PVC
Polymethacrylsäuremethylester
PMMA
Polytetrafluorethen
Polykondensate
Polyaddukte
Polyacrylnitril
PAN
Styren-Butadien-Kautschuk
BUNA
Phenolharze
–
Polyester
–
Polyamid
PA
Polycarbonate
PC
Polyurethane
PU
Epoxid
-harze
Silicone
–
–
–
Polymerisation
Polykondensation
Polyaddition
3. a) Entwickeln Sie die Reaktionsgleichung zur Bildung von Polyethen.
n CH2=CH2
→ –[CH2–CH2]–n
b) Begründen Sie, warum es sich um eine Polymerisationsreaktion handelt.
Es werden n Moleküle mit einer Zweifachbindung gespalten und zu einer
Kette mit Einfachbindungen vereinigt.
38
Organische Werkstoffe
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Produkte
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
2. Ergänzen Sie die folgende Tabelle.
Vorsicht
Struktur bei
des gesundheitsgefährdenden
Glucose-Moleküls
Stoffen
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
a) FISCHER-Struktur
Nach einem Strukturvorschlag von FISCHER aus
dem Jahre 1888 liegt das Glucose-Molekül als
offene Kettenform vor. In Lösungen liegen Glucose-Moleküle jedoch nicht in der offenen Kettenform
vor, sondern vorwiegend in der Ringform.
b) HAWORTH-Struktur
Um die räumliche Struktur des Glucose-Moleküls
besser zu veranschaulichen, hat HAWORTH für die
Ringform die nebenstehende Darstellung vorgeschlagen.
Lösungen
H
1
H
2
HO
3
H
4
H
5
H
6
H
C O
1
C OH
H
2
HO
3
H
4
H
5
H
6
C H
C OH
C OH
C OH
C OH
C OH
C H
C OH
C
O
C OH
H
H
Kettenform
Ringform
H
6
H C OH
H
C4
HO
C5
O
H
OH
H
3
C
H
2
O
H
1
C
OH
C
OH
Kurzschreibweise
1. a) Geben Sie die funktionellen Gruppen des Glucose-Moleküls in der offenen Kettenform mit den zu
erwartenden typischen chemischen Reaktionen an.
C-1-Atom: Aldehyd-Gruppe; reduzierende Wirkung;
übrige C-Atome: Hydroxyl-Gruppen; Alkoholatbildung, Esterbildung
b) Beschreiben Sie den Übergang von der offenen Kettenform zur Ringform der FISCHER-Struktur.
Die Ringbildung entsteht formal, indem die Aldehyd-Gruppe am C-1-Atom
unter der Aufspaltung der Zweifachbindung mit der OH-Gruppe am C-5-Atom
© 2007 Verlag E. DORNER GmbH, Wienrvorlage intramolekular reagiert.
2. Wie kann man durch Nachweisreaktionen die CHO-Gruppe in der Glucose von der in Aldehyden
(Alkanalen) unterscheiden?
Aldehyde zeigen mit Schiffs-Reagenz eine Rotfärbung; bei Glucose erfolgt
mit Schiffs-Reagenz keine Reaktion.
3. Erläutern Sie, wie man von der Darstellung nach FISCHER zu der nach HAWORTH kommt.
Nach der Ringbildung in der Fischer-Struktur werden die C-Atome 1 bis 5
und das O-Atom in eine Sechseckebene gebracht. Die H-Atome und die OHGruppe dieser C-Atome sind oberhalb und unterhalb dieser Sechseckebene
angeordnet. Die CH2OH-Endgruppe steht senkrecht zur Ebene nach oben.
Chemie und Ernährung
39
Vorsicht
Vom Monosaccharid
bei gesundheitsgefährdenden
zum Disaccharid Stoffen
Lösungen
Monosaccharide
6
CH2OH
C5
H
H
OH
C4
HO
O
3
H
2
C
chreiben Sie die
S
Summenformel
auf:
H
1
C
C
O
6CH2
5C
H
C6H12O6
OH
OH
2
OH C1
C CH2OH
H
4C
3
H
HO
Glucose
OH
H
HO
chreiben Sie die
S
Summenformel
auf:
C6H12O6
Fructose
1. Erklären Sie den Begriff Isomerie am Beispiel von Glucose und Fructose.
Beide Stoffe haben die gleiche Summenformel und Molekülmasse,
2. Vergleichen Sie Glucose und Fructose in folgender Tabelle:
GlucoseFructose
Vorkommen
in Früchten, im Honig in Früchten, im Honig
molare Masse
180 g/mol
180 g/mol
Schmelztemperatur
146 °C
105 °C
ja
ja
Traubenzucker
ja
ja
Fruchtzucker
Reaktion mit:
– FEHLING-Lösung
– ammoniakalischer Silbernitrat-Lösung
handelsübliche Bezeichnung
Disaccharide
6
H
6
CH2OH
C5
H
C
OH
HO 3
C
4
H
O
H
H
H
1
C
H
C
OH
2
3
C
C
OH
Monosaccharid
Glucose
C5
4
O
H
Verknüpfung
1,4
6
CH2OH
O
H
2
H
H
1
C
CH2OH
C5
H
C
OH
HO 3
C
O
4
C
OH
H
1
HO
C
O
reduzierend
Monosaccharid
Glucose
ja
Glucose
CH2
C
H
3C
C
HO
OH
Monosaccharid
1
2
2
H
OH
H
O
OH
5
OH C6
C CH2OH
4
H
Verknüpfung Monosaccharid
1,2
Maltose
Fructose
reduzierend
nein
Saccharose
3. Ergänzen Sie die Übersicht der oberhalb dargestellten Disaccharide.
4. Stellen Sie unter Verwendung der Summenformeln die Reaktionsgleichungen für die Bildung beider
Disaccharide auf. Begründen Sie die vorliegende Reaktionsart.
Maltose und Saccharose: C6H12O6
→ C12H22O11 + H2O
Substitution (Kondensation), Abspaltung von Wasser
40
Chemie und Ernährung
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
unterscheiden sich aber in der Struktur und ihren Eigenschaften.
Vorsicht bei gesundheitsgefährdenden
Kohlenhydrate
im Überblick
Stoffen
Lösungen
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. Ergänzen Sie die folgende Tabelle.
wissenschaftlicher Name
handelsüblicher Name
Summenformel
MonosaccharidBausteine
Vorkommen
Glucose
Traubenzucker
C6H12O6
—
Früchte, Honig
Fructose
Fruchtzucker
C6H12O6
—
Früchte, Honig
Saccharose
Haushaltszucker
C12H22O11
Glucose und Fructose
Zuckerrübe
Maltose
Malzzucker
C12H22O11
Glucose
in keimender Gerste
Stärke
—
(C6H10O5)n
Glucose
Mais, Reis
Cellulose
—
(C6H10O5)n
Glucose
Holz, Schilf
2. Ordnen Sie die folgenden Begriffe in die Übersicht ein: Cellulose, Disaccharide, Fructose, Glucose,
Kohlenhydrate, Maltose, Monosaccharide, Polysaccharide, Saccharose, Stärke.
Kohlenhydrate
Monosaccharide
Disaccharide
Beispiele:
Beispiele:
Glucose
Fructose
Beispiele:
Saccharose
Maltose
Cellulose
Stärke
3. Der Abbau der Stärke kann durch folgende schematische Darstellung vereinfacht erklärt werden.
O
n
+
HO
2 2
O
...
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Polysaccharide
n
2
n
2
O
O
O
n ...
O
O
O
n
+
HO
2 2
O
n
a) Stellen Sie die Wortgleichung auf.
→ Maltose
Maltose + Wasser → Glucose
Stärke + Wasser
b) Nennen Sie die Reaktionsarten für den Abbau der Stärke zu Glucose sowie die Umkehrung der
­Reaktion.
Abbau der Stärke: Hydrolyse
Umkehrung: Kondensation (Polykondensation)
Chemie und Ernährung
41
Vorsicht
Verdauung
beider
gesundheitsgefährdenden
Kohlenhydrate beim Menschen
Stoffen
Lösungen
Ergänzen Sie den Lückentext mit folgenden Begriffen:
Enzym, Stärke, Saccharose, Cellulose, Abbau, zerkleinert, neutralisiert, Amylase, spaltet, Glucose, Monosaccharide, Abbau.
Wir verzehren mit unserer Nahrung Kohlenhydrate vor allem in Form
von Stärke, Saccharose, Cellulose, aber auch Glucose und Fructose.
Im Gegensatz zu pflanzenfressenden Tieren kann der Mensch keine
Cellulose ver­dauen.
Der
Abbau
der Kohlenhydrate beginnt bereits im Mund. Durch
das Kauen wird die Nahrung
zerkleinert
und eingespeichelt. Im
Enzym
α-Amylase. Die α-Amylase
spaltet
Stärke in
kleinere Bruchstücke. Durch die Speiseröhre ge­langt der zerkleinerte
und stark eingespeichelte Nahrungsbrei in den Magen. Solange er
vom stark sauren Magensaft noch nicht durchtränkt ist, läuft die im
Mund begonnene Spaltung der Kohlen­hydrate weiter.
Im Zwölffingerdarm
neutralisiert
der Bauchspeicheldrüsensaft
den sauren Nahrungsbrei. Die ebenfalls in der Bauchspeicheldrüse
gebildete
Amylase
spaltet die Kohlenhydrat-Ketten weiter auf
zu Maltose- und dann zu
Glucose
einheiten.
Im Dünndarm wird nur noch der Milchzucker (= Lactose) gespalten
und die Kohlenhydrat-Grundbausteine, die
Monosaccharide
,
resorbiert. Diese werden dann über das Pfortadersystem zur Leber
transportiert. Von dort aus gelangen sie in die verschiedenen Körperzellen. Hier findet ihr
Abbau
statt. Dabei entstehen Kohlenstoff-
dioxid, Wasser und Energie.
Schrittweise Verdauung
der Kohlenhydrate
42
Chemie und Ernährung
© 2007 Verlag E. DORNER GmbH, Wienrvorlage tige
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Mundspeichel befindet sich das für die Kohlenhydratverdauung wich-
Vorsicht
Fette als bei
natürliche
gesundheitsgefährdenden
Ester
Stoffen
Lösungen
Die in Fetten gebundenen Fettsäuren sind oft langkettig und enthalten stets eine gerade Anzahl von
­Kohlenstoff-Atomen.
1. Ordnen Sie die folgenden Fettsäuren den gesättigten und ungesättigten Fettsäuren zu:
Linolensäure (C17H29COOH), Buttersäure (C3H7COOH), Palmitinsäure (C15H31COOH),
Ölsäure (C17H33COOH), Stearinsäure (C17H35COOH), Linolsäure (C17H31COOH).
Vorkommen
z. B.: in Butter,
Kokosfett und
Schmalz
gesättigte Fettsäuren
Palmitinsäure
Buttersäure
Vorkommen
ungesättigte Fettsäuren
Linolsäure
z. B.: in Leinöl,
Margarine und
Maiskeimlingen
Stearinsäure
Ölsäure
Linolensäure
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
2. Wie lassen sich ungesättigte Fettsäuren einfach nachweisen?
durch Addition von Brom unter Aufspaltung der Mehrfachbindung
3. Zur Bildung eines Fettes werden drei Fettsäuren mit dem dreiwertigen Alkohol Glycerol verestert.
Vervollständigen Sie die schematische Reakti­
onsgleichung
der Fettsäureveresterung.
H 2C OOC
R1
Glycerol
H2C
OH
HC
OH
H2C
OH
+
Fettsäuren
HOOC R1
+
HOOC R2
HOOC R3
ĺ
ĺ
ĺ
HCFettOOC R 2++
3 HWasser
2O
OOC RR
22C
HH
H2C
C OOC
OOC
R1 31
HC
OOC RR2 2++ 33HH2O
HC OOC
2O
HH2C
OOC RR3 3
2C OOC
4. Geben Sie den Reaktionstyp der Fettsäureveresterung an.
Substitution, Kondensationsreaktion
© 2007 Verlag E. DORNER GmbH, Wienrvorlage 5. 6.
Stearinsäure (gesättigte Fettsäure)
Glycerol
Buttersäure (gesättigte Fettsäure)
Ölsäure (ungesättigte Fettsäure)
Chemie und Ernährung
43
Vorsicht
Verdauung
beider
gesundheitsgefährdenden
Fette beim Menschen Stoffen
Lösungen
G
al
le
lle
Ga
Fetttröpfchen
Ergänzen Sie den Lückentext mit folgenden Begriffen:
Magen, Lipasen, Glycerol und Fettsäuren, Pfortader, Triglyceriden,
Zwölffingerdarm, fettspaltenden, emulgieren, Leber.
Fette sind Ester aus
Glycerol
und
Fettsäuren
.
Fettmicelle
Durch die Verdauung werden die mit der Nahrung aufgenommenen
Lipa
se
Fette mithilfe von Enzymen in Glycerol und Fettsäuren gespalten.
Die Fettverdauung beginnt im
Magen
einen geringen Anteil der aufgenommenen Nahrungsfette aufspaltet.
Der Hauptanteil der Fette wird erst im
Zwölffingerdarm
abgebaut. Die in der Leber gebildeten Gallensäuren
die
emul
e
Lip
as
e
Lipase
Fettmoleküle
die großen Fetttröpfchen zu kleinen Fetttröpfchen, sodass
fettspaltenden
Lipasen
Enzyme der Bauchspeicheldrüse, die
, diese besser angreifen und spalten können. G
­ rößere
Fettbruchstücke werden nach der Aufnahme durch die Darmwand
sofort wieder zu
Triglyceriden
zusammengesetzt und über
die Lymphgefäße abtransportiert. Kleinere Bruchstücke werden auf
dem direkten Weg über die
transportiert.
44
Chemie und Ernährung
Pfortader
in die
Leber
Glycerol + Fettsäuren
Emulgierung und Abbau
von Fettmolekülen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage gieren
Lipas
, wo die Magenlipase
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Fettverdauung beim Menschen
Verderb
Vorsicht von
bei gesundheitsgefährdenden
Fetten
Stoffen
Lösungen
Fette und fettreiche Lebensmittel können schnell
verderben; sie werden ranzig. Die dabei ablaufenden chemischen Vorgänge werden durch Wärme,
Licht, Sauerstoff, Enzyme und Mikroorganismen
ermöglicht bzw. beschleunigt. Der Verderb von Fetten findet in zwei Schritten statt:
1) Sauerwerden der Fette durch hydrolytische
Spaltung:
Mikroorganismen spalten Fette mithilfe des Enzyms Lipase in Glycerol und freie Fettsäuren.
Der Vorgang entspricht dem enzymatischen Abbau
der Fette in unserem Verdauungstrakt.
Ranzige Butter enthält Buttersäure.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Formel der
Fettsäure
Anteil der verschiedenen Fettsäuren in den Butter­
mg
proben (in
)
kg
Probe A
Probe B
Probe C
Probe D
Probe E
C3H7COOH
0
5
38
78
119
C5H11COOH
0
4
28
25
46
C7H13COOH
8
22
51
51
86
C9H19COOH
38
58
104
136
229
C11H23COOH
78
59
142
137
231
C13H27COOH
193
152
283
170
477
Bewertung
2,3
2,8
3,0
4,6
5,4
Frei vorliegende Fettsäuren in Butterproben.
Bewertung: 1 bis 2 = nicht ranzig; 3 = leicht ranzig;
4 = ranzig; 5 = stark ranzig; 6 = extrem ranzig
2) Ranzigwerden der Fettsäuren durch Autoxidation:
Bei der Autoxidation handelt es sich um eine radikalische Kettenreaktion, bei der die freien Fettsäuren durch Luftsauerstoff angegriffen werden. Der
Kettenstart wird durch Licht, Wärme und Schwermetall-Ionen angeregt. Bei der Kettenreaktion entstehen Hydroperoxide (R–O–O–H). Diese werden
weiter zu Aldehyden und Ketonen oxidiert. Derart
verdorbenes Nahrungsfett ist ranzig; es riecht und
schmeckt unangenehm und sollte aus gesundheitlichen Gründen nicht verzehrt werden.
Die Autoxidation kann durch den Zusatz von Antioxidantien wie Vitamin E verhindert oder verzögert
werden. Solche Stoffe fangen die Radikale ab.
1. Formulieren Sie die Hydrolysereaktion für das dargestellte Fett-Molekül.
O
H O C C15 H 31
H 2C O H
O
© 2007 Verlag E. DORNER GmbH, Wienrvorlage H C O H
H 2C O H
2. Bei
+
H O C C17 H 35
O
H O C C15 H 31
der Hydrolyse von Fetten entstehen freie Fettsäuren. Die Qualität der
Butterprobe nimmt mit dem steigenden Anteil an freien Fettsäuren ab. Für
den ranzigen Geruch sind kurzkettige Fettsäuren (im Besonderen Buttersäure)
verantwortlich.
3. Vitamin
E verzögert bzw. verhindert die Autoxidation von Fettsäuren. Auf-
grund des geringen Gehaltes an diesem Vitamin unterliegt Olivenöl relativ
schnell der Autoxidation. Eine kühle lichtgeschützte Lagerung unter Sauerstoffabschluss verhindert die Reaktion.
Chemie und Ernährung
45
Lösungen
1. Vorsicht
Struktur bei
der gesundheitsgefährdenden
Aminosäuren
Stoffen
+
{
NH3
R C H
COO
Neutrale Aminosäuren mit unpolarer Seitenkette: Glycin, Alanin, Valin,
Leucin, Isoleucin, Prolin, Methionin, Phenylalanin, Tryptophan
Neutrale Aminosäuren mit polarer Seitenkette: Serin, Threonin, Cystein,
Tyrosin, Asparagin, Glutamin
Aminosäuren mit saurer Seitenkette: Asparaginsäure, Glutaminsäure
Aminosäuren mit basischer Seitenkette: Lysin, Agrinin, Histidin
Begründungen:
© 2007 Verlag E. DORNER GmbH, Wienrvorlage grün: Es treten nur Kohlenwasserstoffbindungen auf, sie sind unpolar.
gelb: Es treten funktionelle Gruppen in den Seitenketten auf, z. B. OH-Gruppen.
rot: Zwei Carboxyl-Gruppen, die sauer reagieren, stehen einer basisch reagierenden Amino-Gruppe gegenüber.
blau:Zwei basisch reagierende Amino-Gruppen stehen einer sauer reagierenden Carboxyl-Gruppe gegenüber.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
2. 46
Chemie und Ernährung
Die Peptidbindung
Vorsicht
bei gesundheitsgefährdenden Stoffen
Lösungen
Glycin (Gly) ist Aminoethansäure. Alanin (Ala) ist 2-Aminopropansäure.
1. Stellen Sie die Strukturformeln beider Aminosäuren auf und entwickeln Sie daraus die Reaktions­
gleichung für die Bildung eines Dipeptids aus diesen Aminosäuren.
H 2 N CH2 COOH + H 2 N CH2 COOH ĺ H 2 N CH2 CO NH CH2 COOH + H 2 O
CH3
CH3
2. Beschreiben Sie die ablaufende Reaktion.
Eine Peptidbindung entsteht durch Kondensation der Carboxyl-Gruppe eines
Aminosäure-Moleküls mit einer Amino-Gruppe einer zweiten Aminosäure.
wird Wasser gebildet.
3. a) Erstellen Sie die Reaktionsgleichung für die Bildung der beiden Tripeptide Alanylserylglycin
(Ala · Ser · Gly) und Glycylserylalanin (Gly · Ser · Ala).
b) Markieren Sie die Peptidbindungen.
H
H
H
H 2 N C COOH + H 2 N C COOH
H
H
H 2 N C COOH
H 2 N C COOH
CH3
CH3
CH2
H
→ 2H O
→
→ 2H O
2
H
H
H
H2N C
C
C COOH
CH2 CH
2
H
H
H
H2N C
C
C COOH
CH3 CH2 H
3
OH
© 2007 Verlag E. DORNER GmbH, Wienrvorlage H 2 N C COOH
OH
OH
H
H
H 2 N C COOH
CH2
H
→
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Aus dem OH-Rest der Carboxyl-Gruppe und einem H-Atom der Amino-Gruppe
OH
4. Formulieren Sie die Anzahl der Kombinationsmöglichkeiten für die Bildung eines Tripeptids aus den
zwei Aminosäuren Alanin und Glycin. Die Verknüpfung gleicher Aminosäuren ist hierbei möglich.
Es ergeben sich 23 = 8 Kombinationsmöglichkeiten: Ala · Ala · Ala,
Ala · Ala · Gly, Ala · Gly · Ala, Ala · Gly · Gly, Gly · Ala · Ala, Gly · Ala · Gly,
Gly · Gly · Ala, Gly · Gly · Gly
5. Stellen Sie die Reaktionsgleichung für die Hydrolyse eines Tripeptids, das aus drei Alanin­-Molekülen
entstanden ist, auf.
H O
H O
H
H 2 N C C N C C N C COOH + 2 H 2 O
CH3
H CH3
H CH3
→
H
3 H 2 N C COOH
CH3
Chemie und Ernährung
47
Lösungen
Verdauung
Vorsicht beider
gesundheitsgefährdenden
Eiweißstoffe beim Menschen
Stoffen
Ergänzen Sie den Lückentext mit folgenden Begriffen:
Salzsäure, Denaturierung, Enzym, körpereigene, Aminosäuren, Erepsin, Trypsin, Zellen, kurzkettige, eiweißspaltenden, neutralisiert.
Eiweißstoffe müssen vollständig bis in die kleinsten Bausteine gespalten werden, da größere Bruchstücke im Blut zu Abwehrreaktionen
führen. Aus diesen Grundbausteinen, den
der Körper wieder
körpereigene
Aminosäuren
, baut
Eiweißverbindungen auf. Die
Eiweiß
Verdauung der Eiweißstoffe beginnt im Magen.
Salzsäure
werden die Eiweißmoleküle entknäuelt und dadurch für das eiweißspaltende
Enzym
Pepsin leichter angreifbar. Die Pepsine spal-
ten die langkettigen Eiweißmoleküle in
kurzkettige
BruchPolypeptidkette
stücke mit mehreren Aminosäuren, in Pep­tide.
Durch
den
Bauchspeicheldrüsensaft
neutralisiert
eiweißspaltenden
wird
der
Nahrungsbrei
. So können im Dünndarm die
Erepsin
Enzyme aktiv werden, die einen leicht
alkalischen pH-Wert benötigen, um die Bruchstücke in die einzel-
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Denaturierung
Pepsin
und denaturiert die Eiweißverbindungen. Bei der
wirkt keim­tötend
Pe
ps
in
Die im Magensaft enthaltene
Erepsin
nen Aminosäuren aufzuspalten. Im Zwölffingerdarm spalten die
und
Erepsin
Trypsin
Eiweißmolekül
, die Peptidketten stufenweise bis zu den Ami-
nosäuren. Diese werden über die Darmwand aufgenommen und über
Aminosäure 1
die Pfortader zur Leber transportiert. Von dort gelangen die Aminosäuren über die Blutbahn in die
körpereigenen
Zellen
Eiweißstoffen aufgebaut werden.
Aminosäure 2
, wo sie zu
Aminosäure 3
Aminosäuren
Einige Schritte bei der Eiweißverdauung
48
Chemie und Ernährung
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Enzyme der Bauchspeicheldrüse, vor allen Dingen
Vorsicht
Proteine bei
– eine
gesundheitsgefährdenden
haarige Sache
Stoffen
Lösungen
Der Grundbaustein des Proteins im Haar ist eine Proteinkette, die zu einer rechts gängigen Schraube
aufgedreht ist. Sie wird als α-Helix bezeichnet. Aus dieser Helix werden zunehmend komplexere Strukturen bis hin zum vollständigen Haar aufgebaut.
1. Die räumliche Struktur der α-Helix wird durch Wasserstoff­
brücken­
bindungen stabilisiert. Zeichnen Sie Wasserstoffbrücken­
bindungen in die Abbildung ein und erklären Sie deren Entstehung.
Die -Helix wird durch intramolekulare Wasserstoffbrückenbindungen zwischen den Peptid-Gruppen stabilisiert. Dabei tritt das Sauerstoff-Atom
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
der CO-Gruppe mit dem Wasserstoff-Atom der
NH2-Gruppe in Wechselwirkung.
2. Erklären Sie die relative Dehnbarkeit und Elastizität von Haaren.
Bei starker Dehnung werden die Wasserstoffbrückenbindungen zwischen den Bindungen
der Helix gebrochen und eine gestreckte Struktur
entsteht. Über Disulfidbrücken bleiben die Polypeptidketten aber weiterhin
miteinander verknüpft. Entfällt die Zugbelastung, so nimmt die -Helix und
somit das Haar wieder die ursprüngliche Form an.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage 3. Erläutern Sie den grundsätzlichen Unterschied zwischen den Disulfidbrücken und den Wasserstoffbrückenbindungen.
Disulfidbrücken: Elektronenpaarbindungen zwischen Schwefel-Atomen;
Wasserstoffbrückenbindungen: elektrostatische Kräfte wirken zwischen
Sauerstoff- und Wasserstoff-Atomen.
4. Wie können Sie nachweisen, dass in den Haaren die Elemente Stickstoff und Schwefel enthalten sind?
Haar durch Erhitzen zersetzen; in den Dämpfen entsteht Schwefelwasserstoff (Nachweis mit Bleiacetatpapier) und Ammoniak (Nachweis mit Unitestpapier)
Chemie und Ernährung
49
Vorsicht
Tertiärstruktur
bei gesundheitsgefährdenden
von Proteinen
Stoffen
Lösungen
Die räumliche Struktur eines Proteins wird durch verschiedene Wechselwirkungen zwischen den Seitenketten der Polypeptid-Kette stabilisiert. In der Abbildung und in der Tabelle sind die verschiedenen Bindungstypen zusammengestellt.
O
H
O
O
H
OH
H
C
O
–
H
H
H
N
H
O
H
H
C
N
Valin
O
H
H
arag
in
+
H
2
2
CH
NH
3
O
C
O
CH
2
CH
CH
2
C
C
N
2
C
O
H
N
H
H
2
C
CH
CH 2
O
H
S
S
C
H
H
N
C
C
CH 2
C
O
N
H
H
H
H
Glycin
C
Asp
N
C
C
H
H
C
CH
2
C
O
H
C
O
Hülle aus
Wasser-Molekülen
50
C
O
H
N
2
Asparagin
H
N
H
O
H
H
H
Cystein
O
über Wasserstoffbrücken
gebundene Wasser-Moleküle
Bindungstyp
Charakterisierung
Beispiel
Elektronenpaarbindung
Atome werden über gemeinsame Elektronenpaare miteinander verbunden;
die Bindungselektronen eines Paares
gehören zu beiden Atomen.
Die SH-Gruppen der Seitenketten von zwei
Cystein-Einheiten bilden unter Abspaltung
von Wasserstoff ein gemeinsames Elektronenpaar („Disulfid-Brücke“)
Ionenbindung
Zwischen Kationen und Anionen wirken
elektrostatische Anziehungskräfte.
lonenbindung zwischen dem positiv geladenen N-Atom eines Lysin-Restes und dem
negativ geladenen O-Atom eines Glutaminsäure-Restes
Wasserstoffbrückenbindung
Zwischen einem partiell positiv geladenen H-Atom und einem partiell negativ geladenen O-Atom wirken elektrostatische Anziehungskräfte.
Wasserstoffbrückenbindung zwischen dem
Carbonyl-Sauerstoff-Atom einer Peptidbindung und dem Wasserstoff-Atom der NHGruppe einer anderen Peptidbindung
VAN-DER-WAALS-Bindung
Wechselwirkungen zwischen unpolaren
Molekülen oder Molekül-Teilen
VAN-DER-WAALS-Bindung zwischen einem
Valin-Rest und einem Leucin-Rest
Chemie und Ernährung
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
C
C
O
CH
3
H
CH 3 C 3
CH
O
© 2007 Verlag E. DORNER GmbH, Wienrvorlage in
yc
Gl
H
CH2
C
O
C
CH
Valin
C
O
H
N
C
O
N
H
Serin
H
p
sä ara
ur gin
e -
O
CH
3
N
C
H
H
2
CH
C
N
CH
Prolin
As
H
C
C
O
Cy
O
H
N
in
e
st
H
C
H
C
in
H
C
CH
Leuc
H
H
CH2
CH2
N
C
CH3 CH3
C
O
H
C
H
C
H2C
H
H
H
NH
3
CH
CH 2
+
cin
Gly
N
O
Hülle aus
Wasser-Molekülen
H
H
O
Lys
in
C
–
O
CH 2
O
H
H
H
O
CH 2
CH 2
C
N
H
C
C
H
CH 2
O
C
H
O
H
C
C
N
O
N
Se
O
H
H
re
H
rin
Se
u
nsä
i
tam
Glu
O
H
H
H
rin
N
H
H
Überblick:
Vorsicht
bei
Kohlenhydrate
gesundheitsgefährdenden
– Fette – Eiweißstoffe
Stoffen
Vorsicht bei
Überblick:
Kohlenhydrate
gesundheitsgefährdenden
– Fette – Eiweißstoffe
Stoffen
Lösungen
Arbeitsblatt
Ergänzen Sie die Übersicht:
Ergänzen Sie die Übersicht:
Rundum
– Lösungen
RundumChemie Chemie2 2LehrerInnenmaterial
Lehrerband
OH
Glycerol
HO OH
H
H
Fettsäure
H2N
Fettsäure
AminoGruppe
Rest
durch Peptidbindungen
Palmitinsäure
Stearinsäure
Glucose
Caprylsäure
durch Wasserstoffbrückenbindungen
Saccharose
Ölsäure
Linolsäure
Linolensäure
© 2007
Verlag E. DORNER
GmbH, Wienrvorlage © 2007
Schulbuchverlag
E. DORNERrvorlage
R
→
H
COOH
→
Fettsäure
CH2OH
Stärke
Begründung:
Einfach- und Zweifachzucker besitzen zahlreiche
Hydroxyl-Gruppen, die
Wasserstoffbrücken ausbilden können.
Begründung:
Ungesättigte Fettsäuren
besitzen einen Knick in
der KohlenwasserstoffKette. Sie sind daher
schwerer in eine geordnete Struktur zu bringen.
durch Disulfidbrücken,
Wasserstoffbrückenbindungen, Van-derWaals-Kräfte und Ionenbindungen
Begründung:
Säuren, Salze und hohe
Temperaturen zerstören
die Wechselwirkung
zwischen den Seitenketten eines Proteins.
Chemie und Ernährung
Chemie und Ernährung
51
49
Vorsicht bei gesundheitsgefährdenden Stoffen
Kreuzworträtsel
G
L
Y
17
C
I
18
N
20
I
21
O
5
N
22
C
23
4
R
a
O
H
H
7
G
R
8
E
R
Z
O
M
U
9
C
K O
K
26
25
C
E
H
L
R
O
L Y
C
E
31
30
O
H
L
N
S
T
S
L
E
S
R
24
6
F
R
O
L
12
A
S
M
I
O
E
Ä
D
E
Ä
R S
K
15
E
N
E
H
Y
F
F
D
T
E
R
R
I
G
11
S
E
O S
M
Ä
U
J
A
30
29
V
I
U
R
R
E
N
13
T
O
S
Ä
T
I
T
A T E
O
Ö
A
U K
N
G
R
27
26
28
N
S
C
L
B
N
M
I
O
D
T
I
O
I
32
31
C
R
R
P
E N
P
H
P
E
A T
C
F
L
Ü
25
24
T
14
G
H
U
R
S
O
L
3
I S
P
L
L
E
10
I
E
L
E
U
U
28
27
2
M
S
I
19
D
T
E
A
Z
Y
R
M
E
I
N
E
16
H
A
L
O
G
E
N
Waagrecht:
1. einfachste Aminosäure; 2. Wasser im festen Aggregatzustand; 3. Formel einer Säure; 4. stabilisiert
Gemische aus Wasser und Öl; 5. Formel einer Lauge; 6. Aggregatzustand; 7. dreiwertiger Alkohol; 8. Mineralien mit besonders hohem Metallgehalt; 9. Nährstoffe; 10. chemisches Element; 11. nachwachsender
Rohstoff; 12. Baustein von Proteinen; 13. Biokatalysatoren; 14. Aminosäuresequenz; 15. wird selbst beim
Schlafen „verbraucht“; 16. Element der 7. Hauptgruppe (allgemeine Bezeichnung)
Senkrecht:
17. Konformation von Zweifachbindungen in natürlichen ungesättigten Fettsäuren; 18. Molekül mit Teilladungen; 19. Aggregatzustand; 20. Einheit der Stoffmenge; 21. geladenes Teilchen; 22. Ballaststoff;
23. andere Bezeichnung für Saccharose; 24. ein Einfachzucker; 25. Verknüpfung zweier Aminosäuren;
26. ein Halogen; 27. einfach ungesättigte Fettsäure; 28. Atome mit gleicher Ordnungszahl, aber unterschiedlicher Massenzahl; 29. kleinstes Teilchen; 30. Wirkstoffe, die mit der Nahrung aufgenommen werden;
31. Naturwissenschaft; 32. Vielfachzucker
52
Chemie und Ernährung
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Lösungen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
Chemie
Vorsichtder
beiKohlenwasserstoffe
gesundheitsgefährdenden Stoffen
Schnelltest
1. Zu den organischen Verbindungen gehören
AHolz,
X
BGlas,
CSalz,
DHarnstoff,
X
EBienenwachs.
X
9. Die Verbindung
3-Ethyl-2,3,4-trimethylhex-1-en
Aist ein Alkan mit einem verzweigten Molekül,
Bbesitzt die Molekülformel C10H22,
Cist ein gesättigter Kohlenwasserstoff,
Dgeht
bevorzugt Additionsreaktionen ein.
X
2. Die Moleküle aller organischen Verbindungen enthalten
AWasserstoff-Atome,
BKohlenstoff-Atome,
X
CSauerstoff-Atome.
10. Bei der Reaktion von Alkanen mit Halogenen
Ahandelt
es sich um eine Substitutionsreaktion,
X
Berfolgt eine Additionsreaktion,
Cbildet
sich ein Hydrogenhalogenid,
X
Dentstehen
Halogenalkane.
X
3.
Die Moleküle des einfachsten Kohlenwasser­
stoffes Methan sind
Awürfelförmig,
Bquadratisch,
Ctetraederförmig,
X
Doktaederförmig.
11. Organische Halogen-Verbindungen lassen
sich nachweisen durch die
AGlimmspanprobe,
BReaktion mit Silbernitrat-Lösung,
C
X BEILSTEIN-Probe,
DFEHLING-Probe.
4.
12. Das Strukturmerkmal der Alkene ist die
AC–H-Bindung,
BC–C-Bindung,
CC=C-Bindung.
X
Propan und Butan werden als Flüssiggase
bezeichnet, weil
Asie bei Raumtemperatur flüssig sind,
Bsie
X sich leicht unter Druck verflüssigen lassen,
Csie sich leicht in flüssigem Wasser lösen.
5. Isomere Verbindungen haben
Adie
X gleiche Molekülformel,
Bdie gleiche Strukturformel,
Cverschiedene
Siedetemperaturen.
X
6. In den Alkan-Molekülen liegen
AC–C-Einfachbindungen
vor,
X
BC-Atome, H-Atome und O-Atome vor,
CC/C-Mehrfachbindungen vor,
DC–H-Bindungen
vor.
X
7.
Mit zunehmender Kettenlänge in der
homologen Reihe der Alkane
Asteigen
Schmelztemperaturen und
X
Siedetemperaturen,
Bnimmt die Löslichkeit in Wasser zu,
Cwerden
die VAN-DER-WAALS-Kräfte stärker,
X
Dnimmt
die Molekülmasse zu,
X
Enimmt die Zahl der Isomeren ab.
13. Alkine bilden eine homologe Reihe mit der
allgemeinen Formel
ACnH2n+2,
BCnH2n,
CC2n+2Hn,
DC
X nH2n–2.
14. Die Zunahme der Siedetemperatur in der
homologen Reihe der Alkine beruht auf der
zunehmenden
AAnzahl der Wasserstoffbrückenbindungen,
BMolekülmasse,
X
CPolarität der Moleküle,
DStärke
der VAN-DER-WAALS-Kräfte.
X
15. Der einfachste aromatische Kohlenwasserstoff
hat die Molekülformel C6H6 und heißt
AHexan,
BCyclohexen,
CBenzen.
X
8. Bei der Verbrennung von Alkenen entstehen
AKohlenstoffdioxid,
X
BWasser,
X
CSauerstoff,
DAlkane.
Schnelltest
53
Vorsicht bei gesundheitsgefährdenden Stoffen
Alkohole
2. Als alkoholische Gärung bezeichnet man
Aden Prozess, bei dem Zucker mithilfe von
Hefepilzen zu Alkohol und Sauerstoff
abgebaut wird,
Bden
X Prozess, bei dem Zucker mithilfe von
Hefepilzen zu den Produkten Alkohol und
Kohlenstoffdioxid abgebaut wird,
Cden Prozess, bei dem Eiweißstoffe und Fette
mithilfe von Hefepilzen in Alkohol umge­
wandelt werden,
Dden Prozess, bei dem Zucker mithilfe von
Bakterien den Abbau bis hin zum Alkohol
steuert.
3. Bier, das nach dem österreichischen Reinheitsgebot hergestellt wurde, enthält
AZucker, Wasser, Malz und Schrot,
BWasser, Schrott und Korn,
CMehl, Wasser, Malz und Gerste,
DWasser,
Gerste und Malz.
X
4. Der Bierbrauprozess läuft nach folgendem
Verfahren ab
AMaischen,
Läutern, Würzen, Gären, Lagern,
X
Abfüllen,
BWürzen, Läutern, Maischen, Gären, Abfüllen,
Lagern,
CMaischen, Würzen, Läutern, Gären, Abfüllen,
Lagern,
DMaischen, Würzen, Läutern, Lagern, Gären,
Abfüllen.
5. Damit im Bioreaktor während des Gärprozesses die Bedingungen optimal sind, muss
über Messfühler
Ader Alkoholspiegel ständig gemessen
werden, damit sich die Mikroorganismen
optimal entwickeln können,
Bder
X pH-Wert, die Konzentration der Stoffe
und die Temperatur ständig überprüft
werden,
Cder Gehalt an Kohlenstoffdioxid gemessen
werden,
Dder Sauerstoff- und Kohlendioxid- und der
Alkoholgehalt gemessen werden.
54
Schnelltest
6. Die homologe Reihe der Alkanole beginnt
mit dem Molekül Methanol und wird so
fortgeführt
AEthanol, Propanol, Pentanol, Butanol,
BEthanol, Butanol, Pentanol, Propanol,
CEthanol,
Propanol, Butanol, Pentanol,
X
DEthanol, Pentanol, Propanol, Butanol.
7. Je größer die Moleküle und die Molekül­
masse
Adesto höher die Zwischenmolekularen Kräfte
und desto niedriger die Siedetemperatur,
Bdesto niedriger die zwischenmolekularen
Kräfte und die Siedetemperatur,
Cdesto höher die Siedetemperatur, da geringe
zwischenmolekulare Kräfte wirken,
Ddesto
höher die Siedetemperatur, das große
X
zwischenmolekulare Kräfte wirken.
8. Propanol mischt sich in Heptan
Aschlecht,
da zwischen dem unpolaren
X
Heptan und dem polaren Propanol keine
Wechselwirkungen ausgebildet werden.
Bgut, da das unpolare Propanol sich gut im
unpolaren Heptan mischt,
Cschlecht, da das unpolare Propanol keine
Wechselwirkung mit dem polaren Heptan
eingeht,
Dgut, da sich polare Stoffe wie Propanol und
Heptan gut miteinander mischen.
9. Glycerol unterscheidet sich von den anderen
Alkoholen dadurch, dass
Aes die längste bekannte Kohlenstoff-Kette
hat,
Bes sehr zähflüssig ist, da es unpolare Eigenschaften aufweist,
Ces
X an jedem seiner drei C-Atome eine Alkoholgruppe aufweist und somit sehr polare
Eigenschaften hat,
Des zwei Alkohol-Gruppen aufweist und
deshalb sehr zähflüssig ist.
10. Methanol und Ethanol unterscheiden sich
Anur in ihrer Kettenlänge, alle anderen
Eigenschaften sind hingegen gleich,
Bnur in ihrer Giftigkeit,
Cin
X ihrer Kettenlänge und somit in allen ihren
Eigenschaften,
Dnur in der unterschiedlichen Brennbarkeit.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. Ethanol besteht aus folgenden Elementen
AWasserstoff und Sauerstoff,
BWasserstoff, Sauerstoff und Silicium,
CWasserstoff,
Kohlenstoff und Sauerstoff,
X
DWasserstoff und Kohlenstoff.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Schnelltest
Oxidationsprodukte
der Alkohole
Vorsicht bei gesundheitsgefährdenden
Stoffen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. Eine Oxidation
Aführt
zur Bildung von Aldehyden aus
X
primären Alkoholen,
Bführt
zur Bildung von Aldehyden aus sekunX
dären Alkoholen,
Cläuft nur bei der Reaktion von anorganischen
Stoffen ab,
Dmuss durch ständige Wärmezufuhr unterstützt werden.
2. Formaldehyd
Aist in vielen Lebensmitteln enthalten,
Bist
X stark giftig,
Csteht
unter Verdacht, Krebs auszulösen,
X
Dist
X auch in Holzklebern enthalten,
Edient
dem Haltbarmachen anatomischer
X
Präparate,
Fist eine bläuliche Flüssigkeit.
3.Aldehyde
Akönnen nicht weiter oxidiert werden,
Bsind chemisch wenig reaktiv,
Cwerden
zur Herstellung von Kunststoffen
X
auch heute noch verwendet,
Dsind
gute Desinfektionsmittel.
X
4.Aceton
Aentsteht
durch Oxidation von Propan-2-ol,
X
Bhat
X einen würzigen Geruch,
Cist
X im Nagellackentferner enthalten,
Dist hoch giftig und unbrennbar,
Eist
X ein gutes Lösemittel und wird deshalb im
Labor häufig eingesetzt.
5.Carbonsäuren
Awirken im Gegensatz zu anorganischen
Säuren nicht ätzend,
Bkommen
in vielen Früchten vor,
X
Csind alle flüssig,
Dbilden
auch feste Vertreter,
X
Efärben Universalindikator blau und reagieren
nicht mit Blaukrautsaft,
Fkönnen
unedle Metalle auflösen.
X
6. Ameisensäure
Awurde
früher durch Destillation von Ameisen
X
gewonnen,
Bist
X in den Brennhaaren der Brennnessel zu
finden,
Cist
X eine wasserklare, stechend riechende
Flüssigkeit mit einer höheren Dichte als
Wasser,
Dwird
auch als Methansäure bezeichnet.
X
Schnelltest
7. Essigsäure
Aentsteht,
wenn Wein sauer wird,
X
Bentsteht
durch
Essigsäuregärung unter LuftX
abschluss,
Cwird
als verdünnte Lösung als Haushalts­
X
essig verwendet,
Dwird
durch großtechnische Syntheseverfahren
X
hergestellt.
8. Buttersäure
Ariecht angenehm nach frischer Butter,
Bist
X in den Früchten des Ginkgobaumes enthalten,
Cist
X eine wasserklare Flüssigkeit,
Dreagiert heftig mit Essigsäure.
9. Oxalsäure
Abildet
weiße, gut wasserlösliche Kristalle,
X
Bist
in
höheren
Dosen auch für den Menschen
X
giftig,
Cist
X im Waldsauerklee enthalten und wird deshalb auch als Kleesäure bezeichnet,
Dist eine Tricarbonsäure mit zwei Carboxylgruppen im Molekül.
10.Biodiesel
Awird
aus Pflanzenöl (Rapsöl) gewonnen,
X
Bist
ein
Fettsäuremethylester,
X
Cist
gut
umweltverträglich, aber teurer als
X
anderer Treibstoff,
Dschont
den Motor, da er gute SchmiereigenX
schaften hat,
Ezerfrisst
herkömmliche Dichtungen und RohrX
leitungen.
11.Oxidationszahlen
Awerden
als formale Ladungen für die einzelX
nen Atome notiert, um Elektronenübergänge
leichter sichtbar zu machen,
Bvon Elementen errechnen sich aus:
Ordnungszahl minus 1,
Cvon
X Metallen sind stets positiv,
Din organischen Verbindungen sind nicht
bestimmbar.
12. Oxidationsprodukte der Alkohole
Asind
Aldehyde, Ketone und Carbonsäuren,
X
Bsind Ester und Ether,
Creagieren alle mit TOLLENS-Lösung und
FEHLING-Lösung,
Denthalten
im Molekül mehr Sauerstoff-Atome
X
als der Alkohol aus dem sie hergestellt
werden können.
Schnelltest
55
Energie
Vorsicht und
bei gesundheitsgefährdenden
Umwelt
Stoffen
2. Gründe, warum Schulen häufig zu den großen Stromverschwendern zählen:
AIm Sommer wird immer geheizt und die
Türen sind immer geöffnet.
BDas Licht muss aus Sicherheitsgründen auch
nachts brennen.
Cveraltete
Heizungsanlagen, ständig Licht in
X
den Klassen und Fluren sowie offene Fenster
DDie SchülerInnen nutzen in den Pausen den
schuleigenen Strom für das Aufladen ihrer
Handys.
3. Folgende Sparmaßnahmen wären sinnvoll:
AEnergiesparlampen,
Stoßlüften, Temperatur
X
absenken, Fugen abdichten,
BLicht ausschalten, Fenster immer geschlossen halten, Jacken anbehalten,
Cmoderne Heizanlagen einbauen, Energie­
überwacher einstellen, jede dritte Lampe entfernen,
DAbhärtungstraining für alle SchülerInnen und
LehrerInnen, Heizöl billig einkaufen, Energie­
sparlampen verwenden.
4. Folgende Crackprodukte entstehen bei der
fraktionierten Destillation:
AHexanol, Hexan, Ethan, Ethanol und Propan,
BEthen, Ethin, Pentan und Butan,
Ckurzkettige
Alkane und Alkene, wie beispielsX
weise Ethen und Butan,
Dlangkettige Alkane, wie beispielsweise Decan
oder Hexadecan.
5. Unter dem Reforming-Prozess versteht man
Aden Prozess, bei dem Otto- von Dieselkraftstoff getrennt wird,
Bden Vorgang, bei dem dem Dieselkraftstoff
Zusatzstoffe für den Winter beigemischt
werden,
Cein chemisches Verfahren, um das Destillieren des Rohstoffs zu beschleunigen,
56
Schnelltest
Dchemische
Reaktionen, um das Benzin durch
X
die Erhöhung des Anteils an cyclischen Verbindungen zu veredeln.
6. Bei der fraktionierten Destillation
Agelangen
die verschiedenen Produkte in
X
einem Destillationsturm und werden je nach
Siedepunkt auf den verschiedenen Glockenböden abgetrennt,
Bnutzt man die unterschiedliche Dichte zur
Trennung der verschiedenen Produkte,
Csteigen die schweren Kohlenwasserstoffe
weiter nach oben und werden so von den
leichten getrennt,
Dwerden mithilfe der Schmelztemperatur die
einzelnen Produkte voneinander getrennt.
7. Unter einer Lambda-Sonde versteht man
Aeinen Messfühler, der die Form des
griechischen Buchstabens lambda hat,
Beinen Messfühler, der die Menge des Kraftstoffverbrauchs misst,
Cein
X Steuergerät zur Regulation der Einspritzmenge von Kraftstoff in den Motor,
Deinen Messfühler, der den Sauerstoffgehalt
an ein Steuergerät meldet.
8. Für die Zunahme des Treibhauseffekts
werden folgende Gründe verantwortlich
gemacht:
Ader in der Luft vorhandene Wasserdampf und
das Kohlenstoffdioxid,
Bdie Edelgase,
Cdie
X Zunahme des Gehalts an Kohlenstoff­
dioxid, Methan und FCKW,
Ddie Vergrößerung des Ozonlochs.
9. Die Brennstoffzelle macht sich folgenden
chemischen Prozess zunutze:
Adie
X Knallgasreaktion, bei der Sauerstoffgas
und Wasserstoff unter Energieumwandlung
zu Wasser reagieren,
Bdie Fotosynthesereaktion, bei der Licht­
energie in chemische Energie umgewandelt,
die anschließend verbrannt wird,
Cdie Reaktion zweier energiearmer Stoffe zu
einem energiereicheren Produkt,
Ddie Protolyse von Wasser, bei der Energie
umgewandelt wird.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. In der Stromrechnung sind Abgaben ent­
halten für
AStromsteuer, Ökosteuer, KKW-Abgabe und
Konzessionsabgabe,
BStromsteuer,
Miete für den Zähler, ÖlverX
brauchssteuer und KWKG-Abgabe,
CStromsteuer, KWKG-, erneuerbare Energienund Konzessionsabgabe,
DFestpreis, Verbrauchspreis und Ökosteuer.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Schnelltest
Vorsicht
Organische
bei Werkstoffe
gesundheitsgefährdenden Stoffen
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. Kunststoffe werden folgenden drei Kategorien
zugeordnet
AThermoplaste, Plaste und Elaste,
Belastische Plaste, Thermoelaste und Duro­
elaste,
CPlastomere,
Duromere und Elastomere,
X
DElastoplaste, elastische Duroplaste und
Thermomere.
2. Es sind drei verschiedene Reaktionstypen
zur Bildung von Makromolekülen bekannt
APolymerisation, Polycopolysation und Poly­
addition,
BPolymerisation, Polykondensation und Comerisation,
CPolymerikation, Polykondensation und Polyaddition,
DPolymerisation,
Polykondensation und PolyX
addition.
3. Von einer Polykondensation spricht man,
wenn
AMonomere
unter Abspaltung eines kleinen
X
Moleküls zum Produkt reagieren,
BMonomere nur unter Abspaltung von Wasser
zu einem neuen Stoff reagieren,
CMonomere mit Wasser zu einem neuen
Molekül reagieren,
DMonomere unter Abspaltung eines Dimers zu
einem Makromolekül reagieren.
4. Bei einer Copolymerisation reagieren
AMonomere zu einem Coprodukt,
Bzwei unterschiedliche Monomere unter Ausbildung einer Doppelbindung miteinander,
Czwei
verschiedene Monomere, die auf unterX
schiedliche Weise angeordnet sein können,
DMonomere zu einem bestimmten Polymerisationsprodukt.
5. Die Ausgangsstoffe der Polyvinylchlorid­
synthese sind
AElastomere,
elastische Duromere, PlastoX
mere
BNatriumchlorid, Ethen
CSalz, Chlorsäure, Kohlenstoff
DKohlenstoffdioxid, Ethen, Chlor.
Schnelltest
Bdas Veredeln von Baumwollfasern zu hochwertigen Baumwolltextilien,
Cdas
X Aufbringen von Sulfonamiden auf Woll­
fasern als Fraßgifte gegen Motten,
Ddas Färben mit künstlichen Farbstoffen.
7. Ein Autoreifen ist wie folgt aufgebaut
AFelge, Laufrad, Gummischicht, Kautschukschicht,
BFelge,
innere Gummischicht (Seele), gumX
miertes Gewebe, Stahlgürtel, Lauffläche,
CFelge, Gummischicht, Laufgürtel,
DFelge, Stahlband, Gummilaufrad, Abriebschicht.
8. Unter Synthesekautschuk versteht man
ANaturkautschuk. Der in der Fabrik für die
Autoreifenindustrie bearbeitet wird,
BNaturkautschuk, der mit technischem Kautschuk gestreckt wird,
Csynthetische
Kautschuke, die künstlich aus
X
den Monomeren Butadien und Isopren hergestellt werden.
Dsynthetischer Gummi zur Kunststoff­
herstellung.
9. Der Begriff PET bedeutet
APolyethylentechnik,
BPolyesterterephthalat,
CPolyethylenterephtalat,
X
DKleintierstreu aus recyceltem Kunststoff.
10. Wie viel Prozent eines Autos bestehen aus
Kunststoffbauteilen?
Arund 25 %,
Brund 40 %,
Cfast 50 %,
Drund
30 %.
X
11. Möglichkeiten der Kunststoffverwertung sind
ARecycling, Mehrweggebrauch und Kompostierung,
BVerwerten, Vermeiden, Wiederverwenden,
Crohstoffliche,
energetische und thermische
X
Verwertung,
DVerbrennen
und Gewinnen von Fernwärme
X
in Heizkraftwerken.
6. Unter Eulanisierung versteht man
Adas Aufbringen von antibakteriellen Mitteln
auf Baumwollfasern,
Schnelltest
57
Chemie
Vorsichtund
bei Ernährung
gesundheitsgefährdenden Stoffen
2. Der Grundumsatz
Aist
X die Energie, die ein Mensch bei völliger
Ruhe im Liegen benötigt,
Bergibt zusammen mit dem
Gesamtenergiebedarf den Leistungsumsatz,
Cist
X bei Männern höher als bei Frauen,
Dist bei Kindern höher als bei Erwachsenen,
da bei Kindern die Stoffwechselvorgänge
schneller ablaufen.
3. Die Strukturformel zeigt
Aeine
einfach ungesättigte Fettsäure,
X
Beine einfach ungesättigte Aminosäure,
Cein ungesättigtes Fett,
Ddie
X im Olivenöl vorkommende Ölsäure.
4. Fette
Asind hydrophob und polar,
Bsind
GIyceridester, die bei der Reaktion von
X
Glycerol, mit Fettsäuren entstehen,
Centhalten stets drei gleiche Fettsäure-Reste,
Dbesitzen im Gegensatz zu Ölen einen
höheren Anteil an ungesättigten Fettsäuren,
Elassen
sich durch Kochen mit Natronlauge
X
verseifen.
5.Nahrungsfette
Asind negativ zu beurteilen, da sie zu Übergewicht führen können,
Bsollten 50 % unseres Gesamtenergiebedarfs
decken,
Cfinden
sich versteckt auch in Schokolade,
X
Wurst und Käse,
Dsollten
bevorzugt ungesättigte Fettsäuren aus
X
Pflanzenölen enthalten.
Elassen sich durch Wasserstoff-Anlagerung an
die C=C-Zweifachbindung härten.
58
Schnelltest
6.Kohlenhydrate
Awerden von Pflanzen mithilfe des Sonnenlichts aus Kohlenstoffmonoxid und Wasser
aufgebaut,
Bbesitzen die allgemeine Molekülformel
Cn(H2O)m, da sie aus Kohlenstoff-Atomen und
Wasser-Molekülen bestehen,
Cwerden
in Mono-, Di- und Polysaccharide einX
geteilt,
Dbesitzen aufgrund der zahlreichen OH-Gruppen alkalische Eigenschaften,
Esind aufgrund der zahlreichen OH-Gruppen
lipophil.
7. Die nebenstehende Formel
Azeigt die Struktur von Fructose,
Bzeigt
den Aufbau eines TrauX
ben-zucker-Moleküls,
Centspricht der Summenformel
CH12O6,
Dgehört
zu einem Zucker, bei dem
X
die TOLLENS-Probe positiv verläuft,
Egehört zu einem Zucker, bei dem die
FEHLING-Probe negativ verläuft.
8. Eiweißstoffe
Awerden als Proteine bezeichnet, sofern sie
nicht als Nährstoffe dienen,
Bfinden
sich in unseren Haaren, der Haut und
X
der Muskulatur,
Cbestehen
aus Aminosäuren, die sich nur in
X
der Struktur ihrer Seitenkette unterscheiden,
Dentstehen, wenn die Reste verschiedener
Aminosäuren durch Peptidbindungen miteinander verknüpft werden,
Ebesitzen eine charakteristische Reihenfolge
der Aminosäure-Bausteine, die als Tertiärstruktur bezeichnet wird.
9. Unsere Nahrung sollte
Areich an tierischen Eiweißstoffen, aber arm
an pflanzlichen Fetten sein,
Btäglich Fleisch enthalten, da Fleisch ein Stück
Lebenskraft ist,
Ckeinesfalls Süßigkeiten enthalten, da diese
nur zu Übergewicht führen,
Dgut
X schmecken und nicht nur Nährstoffe enthalten,
Edem Körper über den Gesamtenergiebedarf
hinaus Energie zuführen, um Reserven für
schlechtere Zeiten zu bilden.
Rundum Chemie 2 LehrerInnenmaterial – Lösungen
1. Lebensmittel enthalten
AFette
und Kohlenhydrate als wichtigste
X
Energie­lieferanten,
BEiweißstoffe in Form von Stärke und
Cellulose,
Cunverdauliche Ballaststoffe, auf die folglich
verzichtet werden kann,
DMineralien und Hormone, die im Gegensatz
zu Nährstoffen keine Energie liefern.
© 2007 Verlag E. DORNER GmbH, Wienrvorlage Schnelltest

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)