Zellen des zentralen Nervensystems
Werbung
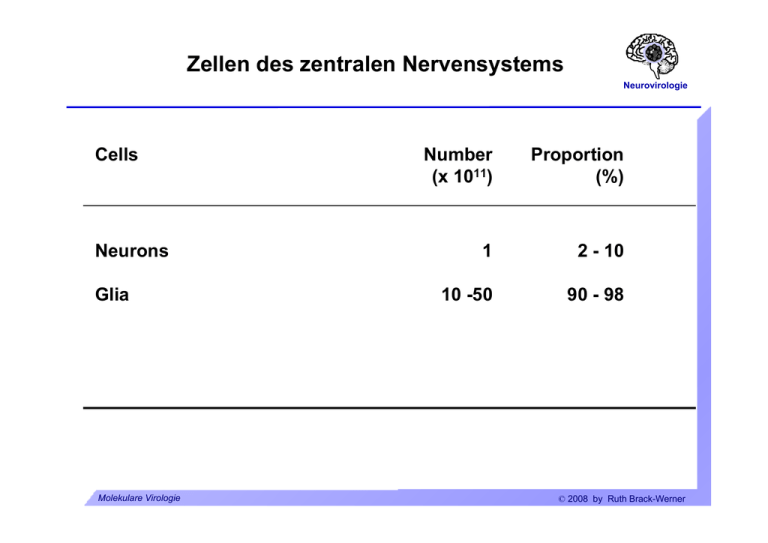
Zellen des zentralen Nervensystems Neurovirologie Cells Neurons Glia Molekulare Virologie Number (x 1011) Proportion (%) 1 2 - 10 10 -50 90 - 98 © 2008 by Ruth Brack-Werner ZNS-Zellen: Neuronen Neurovirologie Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen:Gliazellen Neurovirologie Oligodendrozyten: Isolieren Axone durch Myelinscheiden. Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen: Gliazellen Neurovirologie Mikrogliazellen Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen: Gliazellen Neurovirologie Mikrogliazellen Funktionen: Gehirnständig Makrophagen; Antigen Präsentation und Immunüberwachung. Aktivierte Mikrogliazellen: Beweglich; Phagozytierend; Produzieren neurotoxische und proinflammatorische Substanzen. Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen: Gliazellen Neurovirologie Astrozyten Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen: Gliazellen Neurovirologie Astrozyten: Funktionen Unterstützung neuronaler Funktionen: Nährstofflieferant; Aufrechterhaltung einer idealen „Umgebung“ für die neuronale Funktion: - [K+] - Entfernung toxischer Stoffen; - Aufnahme von Neurotransmitter (Glutamat). Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen: Gliazellen Neurovirologie Astrozyten: Funktionen Entwicklung: Richtungsgeber für axonales Wachstum. Immunolog. Funktionen: Expression immunmodulatorischer Substanzen (Zytokine/Chemokine) nach Aktivierung. Abschirmung des Gehirns: Erhaltung der Blut-Hirn und Blut-CSF Schranken; Narbenbildung bei Verletzungen. Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen: Gliazellen Neurovirologie Neural Stem Cells Definition: self-renewing, multipotent cells that can differentiate into neurons, astrocytes and oligodendrocytes Molekulare Virologie © 2008 by Ruth Brack-Werner ZNS-Zellen: Übersicht Neurovirologie 1. Neuron/Zellkörper 3. Kapillare 2. Oligodendrozyt 5. Astrozyt 6. Ependymale Zelle 4. Neuron/Axon 7. Microgliazelle Molekulare Virologie © 2008 by Ruth Brack-Werner Abschirmung des Gehirns Neurovirologie Blut-CSF Schranke CSF = Cerebrospinalfluessigkeit. Blut-Hirn Schranke: Endothelzellen bilden eine enge Schicht, mit sog. „tight junctions“ zwischen den Zellen, die für viele Substanzen undurchlässig ist. Molekulare Virologie © 2008 by Ruth Brack-Werner Abschirmung des Gehirns Neurovirologie Zerebrospinalflüssigkeit Umspült das Gehirn Bildung durch die Choroid plexi der Ventrikel aus Blut. Ca. 300 - 500 ml/24 h; Austausch mit Neuropil. Molekulare Virologie © 2008 by Ruth Brack-Werner Abschirmung des Gehirns: Gehirn-CSF Schranke Neurovirologie Ventrikel Choroid plexi: In 3. und 4. Ventrikel; gefäßreich; Bildung und Aufnahme von CSF; Molekulare Virologie © 2008 by Ruth Brack-Werner Abschirmung des Gehirns Blut-Hirn Schranke Blood/brain barrier pericyte Neurovirologie astrocyte foot process lumen tight junction ventricle / CSF ependymal cells basement membrane ependymo-glial membrane lumen / blood microglia astrocytes neuron brain parenchyma glial-pial membrane pia mater Molekulare Virologie subarachnoid space / CSF © 2008 by Ruth Brack-Werner Neurovirologie Neurovirologie Infektion des ZNS durch Viren Molekulare Virologie © 2008 by Ruth Brack-Werner Mechanismen der virus-assoziierten Pathogenese im ZNS Neurovirologie Neuronen-Schäden - bzw. Tod. Direkt Zytotoxische Infektion von Neuronen (Tollwut) Indirekt Infektion von Gliazellen: Oligodendrozyten: Demyelinisierung (JC-Virus); Mikrogliazellen: Aktivierung zur Synthese von neurotoxischen Substanzen Astrozyten: Aktivierung; Verlust von Eigenschaften, die essentiell für die Funktionen von Neuronen sind. Molekulare Virologie © 2008 by Ruth Brack-Werner Wie kommen Viren in das ZNS? Neurovirologie Retrograder axonaler Transport Tollwut, Herpesviren Über das Blut Überwindung bzw. Zerstörung der Blut-Hirn- bzw. der BlutCSF Schranken durch: Infektion von Endothelzellen Eindringen von infizierten Zellen Eindringen von infektiösen Viruspartikeln. Molekulare Virologie © 2008 by Ruth Brack-Werner Retrograder und Anterograder Transport über Axone Neurovirologie Aus “Principles of Virology”, Flint SJ, Enquist LW, Racaniello VR, Skalka AM (Eds), 2004, ASM Press. Molekulare Virologie © 2008 by Ruth Brack-Werner Virusinfektion von Neuronen Neurovirologie Tollwutvirus Rhabdoviridae: neg.Strang RNA Viren Übertragung durch Tierbisse Inkubationszeit 20 Tage bis drei Monate Infektion führt zur Lähmung und Tod in fast allen Fällen. Impfung mit inaktivertem Virus. z. B. Viruspräparationen aus infizierten menschlichen Fibroblasten, inaktiviert durch Behandlung mit β− Propiolakton; Verwendung hauptsächlich in Europa und USA. Molekulare Virologie © 2008 by Ruth Brack-Werner Tollwutvirus Neurovirologie Lewis Body im Neuron: Replikationsstätte des Virus Molekulare Virologie © 2008 by Ruth Brack-Werner Tollwutvirus Neurovirologie Pathogenese Voraussetzungen für die Pathogenese: Virus muss ZNS erreichen; Wanderungsgeschwindigkeit 50-100 mm/Tag; Glykoprotein des Virus. Neuron muss überleben: Geringeres Apoptosepotential des Virus ist mit höherer Pathogenität verbunden; Herunterregulation der Virusreplikation und Transkription. Molekulare Virologie © 2008 by Ruth Brack-Werner Virusinfektion von Neuronen Neurovirologie Poliovirus Fam./Genus: Picornaviridae/Enterovirus Einzelstrang-RNA (+) Übertragung von Mensch zu Mensch über Nasen/Rachen Sekrete Faekale orale Uebertragung (z.B. kontaminierte Lebensmittel) Verbreitung im Menschen: Oropharynx und Darm; Blut ZNS (Neurone)] Molekulare Virologie © 2008 by Ruth Brack-Werner Poliovirus (Fortsetzung) Neurovirologie Inkubationszeit 7-14 Tage Eindringen in das ZNS vermutlich über retrograder axonaler Transport. Virus vermehrt sich in erster Linie im gastrointestinal Trakt. Infektion führt zu Lähmungserscheinungen bei ca. 0.1 bis 1% d. infizierten Personen (abhängig vom Virusstamm). Zerstörung von motorischen neuronen. Impfstoffe: 1. Formalin-inaktivertes Virus (Salk). 2. Lebend-Impfstoff: Mischung von attenuierten Stämmen (Sabin). Molekulare Virologie © 2008 by Ruth Brack-Werner Infektion von Gliazellen durch Viren Neurovirologie Virusgenom Familie/Genus Verteter Neurale Zielzellen Neg. ssRNA, unsegment. Paramyxoviridae Morbillivirus Masernvirus Neuronen, Astrozyten Oligodendrozyten. Bornaviridae Borna disease virus Astrozyten dsDNA Papovaviridae Polyomavirus JC-Virus Oligodendrozyten, Astrozyten. RNA/DNA Retroviridae „BLV-HTLV Retroviren“ HTLV-I Makrophagen, Microglia, Astrozyten HIV Makrophagen, Microglia, Astrozyten Lentivirus Molekulare Virologie © 2008 by Ruth Brack-Werner Masernvirus Neurovirologie ZNS-Komplikationen Auftreten Inzidenz nach Infektion (%) Akute post-Infektions2-4 weeks Masernenzephalitis (APME) 0,1* Measles inclusion body encephalitis (MIBE) Monate Immunsuppr. Personen Subacute sclerosing panencephalits (SSPE) 2-10 Jahre 1/105* Pathogen. Autoimmun? Persist. Inf. Zell zu Zell Verbreit. von defekten NukleoKapsiden. -“- *Inzidenz signifikant niedriger nach Masernimpfung nach Schneider-Schaulies, J. et al., J Neurovirol. 1999, 613-622 Molekulare Virologie © 2008 by Ruth Brack-Werner Masernvirus Neurovirologie Veränderte Genexpression während der persistenten Infektion: Verminderte Synthese von viralen Hüllproteinen in Astrozyten. Zell-zu-Zell Transmission im ZNS. Molekulare Virologie © 2008 by Ruth Brack-Werner HTLV-I Neurovirologie Krankheit: HAM/TSP. HTLV-assoziierte Myelopathie/Tropische spastische Paraparese. Funktionelle Störungen des Rückenmarks führt zu partiellen Lähmungen der unteren Extremitäten und krampfartige Erscheinungen. Demylinisierung. Inkubationszeit: 18 Wochen bis mehrere Jahre Endemisch in Japan, Karibik, äquatorial Afrika, Südamerika. Infiltration von immunaktiven Zellen: Monozyten, Makrophagen, CD8+ T-Zellen. Pathogenesemodell: Zerstörung von Virus-Antigen präsentierenden Gehirnzellen durch CTLs. Molekulare Virologie © 2008 by Ruth Brack-Werner JC-Virus Neurovirologie Krankheit: PML. Progressive multifokale Leukoencephalopathie. Mehrere Demylinisierungsherde, häufig mit Makrophagen-Infiltrate. Symptome: Demenz, halbseitige Lähmung, halbseitige Blindheit. Krankheit i.d. Regel bei immunsupprimierten Personen. Über 80% aller Personen sind mit JC-Virus infiziert. Diagnose: PET bzw. CT-Scan. Tod: 4 - 12 Monate nach Diagnose. Molekulare Virologie © 2008 by Ruth Brack-Werner Neurovirologie The human immunodeficiency virus (HIV) and the central nervous system Molekulare Virologie © 2008 by Ruth Brack-Werner Nachweis von HIV infizierten Zellen im ZNS Neurovirologie aus Kramer-Hämmerle, S. et al., VirusRes. 2005 Molekulare Virologie © 2008 by Ruth Brack-Werner Possible entry routes of HIV into the brain Neurovirologie aus Kramer-Hämmerle, S. et al., VirusRes. 2005 Molekulare Virologie © 2008 by Ruth Brack-Werner HIV-Neuropathology Neurovirologie Manifestation Prevalence at autopsie* HIV-positive microglia nodules 20 - 50% Multinucleated giant cells 25 - 60% Loss of neurons; dendrite alterations > Demyelinisation of white matter 70 - 90% Astrocytosis 30 - 60% 90% * Kolson & Pomerantz, 1996, J Biomed Sci 3: 389. Molekulare Virologie © 2008 by Ruth Brack-Werner HIV-Neuropathology: Multinucleated giant cell Neurovirologie Cytoplasm Nuclei Courtesy of Prof. Jeanne Bell, Dept. of Pathology, The University of Edinburgh Molekulare Virologie © 2008 by Ruth Brack-Werner HIV-Neuropathology: Astrocytosis. Neurovirologie αGFAP HIV encephalitis negative HIV encephalitis positive Courtesy of Prof. Jeanne Bell, Dept. of Pathology, The University of Edinburgh Molekulare Virologie © 2008 by Ruth Brack-Werner Productive infection: Microglia / Brain macrophages Neurovirologie Immunohistochemistry for HIV structural protein (p24gag) Courtesy of Prof. Jeanne Bell, Dept. of Pathology, The University of Edinburgh Molekulare Virologie © 2008 by Ruth Brack-Werner Restricted infection: Astrocytes Neurovirologie Anti-Nef IHC HIV-Encephalitis HIV negative Data used w/ kind permission from Jeanne Bell, Univ. of Edinburgh Molekulare Virologie © 2008 by Ruth Brack-Werner HIV host-cell interactions in the brain: Potential envelope attachment molecules Neurovirologie Table 4. Potential envelope attachment molecules and HIV-1 receptors on the surface of brain cells Molecules Expressed on CD4 and CCR5 chemokine receptor Macrophages/microglial cells 260 kDa protein Astrocytes 65 kDa protein Astrocytes Human mannose receptor Astrocytes Galactosyl ceramide Astrocytes, oligodendrocytes DC-SIGN BMVECs L-SIGN BMVECs Cell surface proteoglycans BMVECs CXCR4 Neurons Kramer-Hämmerle et al., 2005, VirusRes 111, 194-213 Molekulare Virologie © 2008 by Ruth Brack-Werner Modell f. HIV-induzierte Neuropathogenese Neurovirologie Slide 37 aus Kramer-Hämmerle, S. et al., VirusRes. 2005 Molekulare Virologie © 2008 by Ruth Brack-Werner CNS-modulatory cellular factors in HIV-infected brains Neurovirologie Potentially harmful Neurotoxic Arachidonic acids Glutamate, quinolinic acid, L-cystein Nitric oxide, superoxide anions SDF-1 and cleavage product gen. by MP-2 Molekulare Virologie Chemoattractive MCP-1, IL-8 Pro-inflammatory TNF-α, IL-1β, IFN-γ © 2008 by Ruth Brack-Werner CNS-modulatory cellular factors in HIV-infected brains Neurovirologie Potentially beneficial Molekulare Virologie Chemokines MIP-1ß, RANTES, fractalkine Glutamate transporters EAAT-1 by macrophages Cytokines TGF-β © 2008 by Ruth Brack-Werner Selected effects of HIV factors on brain cells Env gp120 Tat Nef Neurons Apoptosis Depolarization; Apoptosis; Cell death; Alters electrophysiologic al properties; Astrocytes Impaired glutamate uptake; Promotes survival; NO up; Activation of cellsignalling pathways; Altered growth properties TNF-α up; Promotes monocyte infiltration (directly and via MCP-1) Release of proinflammatory factors Macrophages/ Release of microglial cells TNF-α, ß-chemokines Aktuelle Fragen der Neurovirologie Neurovirologie Was sind die Konsequenzen von chronischen Infektionen des Gehirns? Wie kontrollieren Gehirnzellen die Virusreplikation? Wie kann man den Eintritt von Viren in das Gehirn verhindern? Mechanismen der Pathogenese von Viren im Gehirn. Wie kann man persistierende Viren „ruhigstellen“ ? Molekulare Virologie © 2008 by Ruth Brack-Werner