8-Stoffwechsel Ib
Werbung
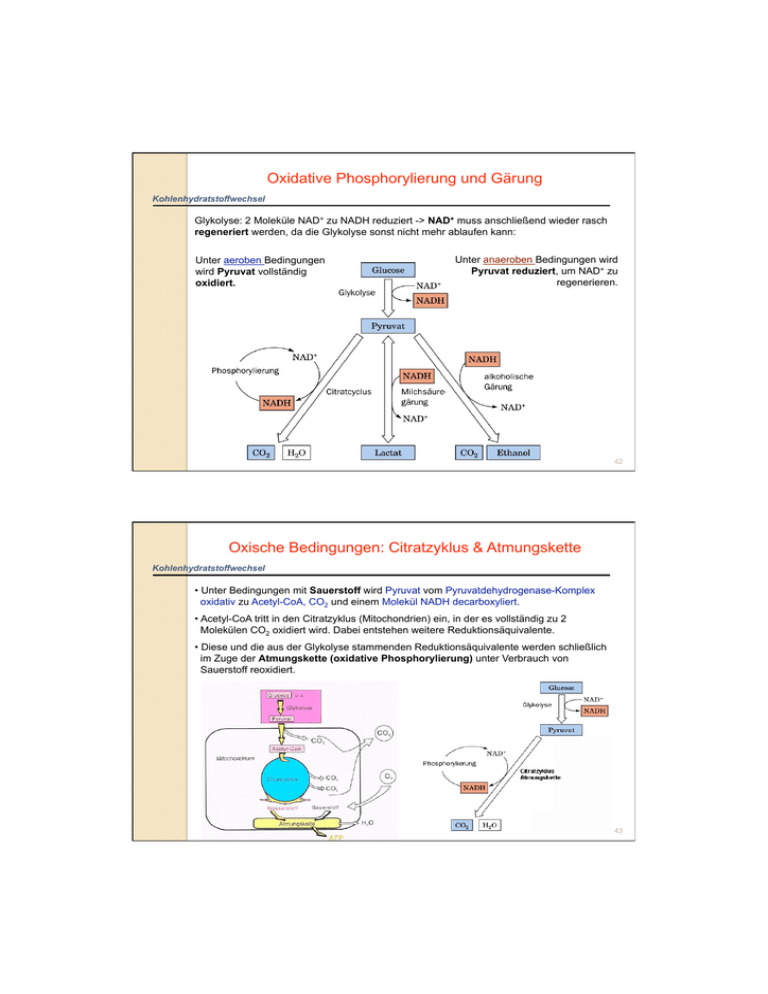
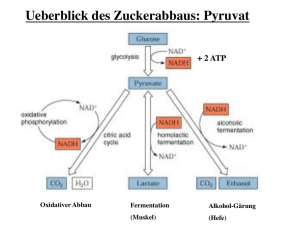
Oxidative Phosphorylierung und Gärung Kohlenhydratstoffwechsel Glykolyse: 2 Moleküle NAD+ zu NADH reduziert -> NAD+ muss anschließend wieder rasch regeneriert werden, da die Glykolyse sonst nicht mehr ablaufen kann: Unter aeroben Bedingungen wird Pyruvat vollständig oxidiert. Unter anaeroben Bedingungen wird Pyruvat reduziert, um NAD+ zu regenerieren. 42 Oxische Bedingungen: Citratzyklus & Atmungskette Kohlenhydratstoffwechsel • Unter Bedingungen mit Sauerstoff wird Pyruvat vom Pyruvatdehydrogenase-Komplex oxidativ zu Acetyl-CoA, CO2 und einem Molekül NADH decarboxyliert. • Acetyl-CoA tritt in den Citratzyklus (Mitochondrien) ein, in der es vollständig zu 2 Molekülen CO2 oxidiert wird. Dabei entstehen weitere Reduktionsäquivalente. • Diese und die aus der Glykolyse stammenden Reduktionsäquivalente werden schließlich im Zuge der Atmungskette (oxidative Phosphorylierung) unter Verbrauch von Sauerstoff reoxidiert. 43 Oxische Bedingungen: Citratzyklus & Atmungskette Kohlenhydratstoffwechsel • Unter Bedingungen mit Sauerstoff wird Pyruvat vom Pyruvatdehydrogenase-Komplex oxidativ zu Acetyl-CoA, CO2 und einem Molekül NADH decarboxyliert. • Acetyl-CoA tritt in den Citratzyklus (Mitochondrien) ein, in der es vollständig zu 2 Molekülen CO2 oxidiert wird. Dabei entstehen weitere Reduktionsäquivalente. • Diese und die aus der Glykolyse stammenden Reduktionsäquivalente werden schließlich im Zuge der Atmungskette (oxidative Phosphorylierung) unter Verbrauch von Sauerstoff reoxidiert. 44 Anoxische Bedingungen: Gärung Kohlenhydratstoffwechsel In den Gärungsschritten wird im Gegensatz zum aeroben Abbauweg kein ATP gebildet. In der ALKOHOLISCHEN GÄRUNG (Hefen) wird aus Pyruvat in 2 Reaktionen durch die Pyruvatdecarboxylase und die Alkoholdehydrogenase Ethanol gebildet. Dabei wird das NADH aus der Glykolyse zu NAD+ reoxidiert. Milchsäurebakterien und auch die Muskelzellen im Menschen betreiben die MILCHSÄUREGÄRUNG. Hierbei wird Pyruvat durch eine Lactatdehydrogenase mittels NADH zu L-Lactat und NAD+ reduziert. 45 Milchsäuregärung Kohlenhydratstoffwechsel Homofermentative Milchsäuregärung: • homofermentativen Milchsäurebakterien • bei Sauerstoffmangel von einigen Pilzen, Pflanzen, Tieren und Menschen Dabei werden Zucker zunächst in der Glykolyse zu Pyruvat abgebaut. Dieses wird von der Laktatdehydrogenase mit NADH zu Lactat (Anion der Milchsäure) reduziert. Das NADH wird dabei zu NAD+ oxidiert. Im Verlauf der Glykolyse werden je Molekül Glucose je 2 Moleküle Lactat, NADH und ATP gebildet, so dass die Nettoenergieausbeute 2 Moleküle ATP je Molekül Glucose beträgt. Glucose + 2 ADP + 2 Pi 2 Lactat + 2 ATP + 2 H2O + 2 H+ 46 Milchsäuregärung beim Menschen Kohlenhydratstoffwechsel Im Vergleich zur aeroben Atmung wird bei Gärungen nur eine geringe Menge Energie (dafür rasch) gewonnen, da dabei nur die Substratkettenphosphorylierung genutzt wird. Auf Milchsäuregärung spezialisierte Zellen beim Menschen: • Erythrozyten: keine Mitochondrien -> können Glu nur unter anaeroben Bedingungen verstoffwechseln • Muskelzellen: wenn nicht genügend O2 für aerobe Atmung (bei anstrengender Muskeltätigkeit) -> Körper zerlegt im Muskel gespeichertes Glykogen ohne ATPVerbrauch in Glu-6-P-> anaerob zu Lactat abgebaut -> Lactat sammelt sich in Muskeln -> Übersäuerung -> Muskelerschöpfung und Müdigkeit -> Lactat in Ruhephasen durch Blut in Leber transportiert und zu Pyruvat oxidiert (Glucose-Synthese) ATP Produktion in der Glycolyse ist ca. 100-mal schneller als durch oxidative Phosphorylierung. Daher verbraucht der Muskel überwiegend „glykolytisches“ ATP. 47 Reaktion der Lactatdehydrogenase Kohlenhydratstoffwechsel NADH überträgt ein Hydridion (H-) auf die Ketogruppe des Pyruvat. -> Säure-katalysiert (His 195) Die Lactatdehydrogenase findet man im Cytosol der Zellen des gesamten menschlichen Organismus -> 5 Isoenzyme: LDH-1 LDH-2 LDH-3 LDH-4 LDH-5 – – – – – Herz Lymphsystem Lunge Nieren Leber, Quergestreifte Muskulatur 48 Alkoholische Gärung Kohlenhydratstoffwechsel Glucose + 2 ADP + 2 Pi 2 Ethanol + CO2 + 2 ATP + 2 H2O + 2 H+ Hefen haben in der alkoholischen Gärung eine alternative Möglichkeit zur EGewinnung, wenn kein O2 zur Verfügung steht. Im Vergleich zur Zellatmung entsteht dabei aber weniger Energie: bei vollständiger Oxidation werden aus 1 Molekül Glucose 38 ATP gewonnen, bei der alkoholischen Gärung nur 2 ATP (aus der Glykolyse). Die zwei weiteren Reaktionsschritte der Gärung (Ethanolproduktion) dienen nur mehr der Regeneration von NAD+. Hefe regeneriert NAD+ dabei durch einen zweistufigen Prozess, bei der Pyruvat zunächst in Acetaldehyd umgewandelt wird und dieser dann unter Verwendung von NADH zu Ethanol reduziert wird: Pyruvatdecarboxylase: TPP (B1) – abhängig 49 Reaktion der Alkoholdehydrogenase Kohlenhydratstoffwechsel NADH überträgt ein Hydridion (H-) auf die Ketogruppe des Acetaldehyds! -> Metallionen-katalysiert (Zn2+) Acetaldehyd ist sehr giftig und wird deshalb schnell durch die ADH umgesetzt: ADH enthält ein Zink-Ion (Zn2+), welches die Carbonylgruppe am Acetaldehyd polarisiert. Dadurch können 2 e- und 1 H+ vom NADH auf Acetaldehyd übertragen werden, wodurch es zu EtOH reduziert und NAD+ regeneriert wird. 50 Abbau anderer Hexosen Kohlenhydratstoffwechsel Andere Hexosen werden während der Investmentphase in die Glykolyse eingeschleust: Galactosämie: Galactose kann nicht in G6P umgewandelt werden Angeborene Fructose-Intoleranz: Fructose kann in der Leber nicht abgebaut werden (selten) 51 Abbau anderer Hexosen: Beispiel Kohlenhydratstoffwechsel GALAKTOSE-Eintritt in Glykolyse: • Spaltung von Lactose (Milchzucker) in D-Glucose und D-Galactose • D-Galactose durch Galactokinase unter ATP-Verbrauch in Galactose-1-P umgewandelt • Austausch von UDP-gebundener Glucose mit Galactose (durch GALT: Galactose-1phosphat-Uridyltransferase) -> es entsteht Glucose-1-P und UDP-Galactose -> bei Galactosämie fehlt GALT • Glucose-1-P zu Glucose-6-P isomerisiert • UDP-Galactose zu UDP-Glucose epimerisiert 52 ER Gluconeogenese Kohlenhydratstoffwechsel Wenn keine Kohlenhydrate in der Nahrung zur Verfügung stehen und die Glycogenspeicher verbraucht sind, werden Zucker aus „NichtKohlenhydraten“ in der Leber synthetisiert: Gluconeogenese = Neusynthese von Glucose aus organischen Nicht-Kohlenhydrat-Bausteinen wie Pyruvat, Lactat und Abbauprodukte von Aminosäuren. Täglicher Glucose-Bedarf: ca. 160 g. Cytosol Fettsäuren können NICHT für die Gluconeogenese verwendet werden, da diese direkt zu Acetyl-CoA abgebaut werden, und es keinen Nettoumsatz zu Oxalacetat (dem zentralen Metaboliten der Gluconeogenese) gibt! Mitochondrium 53 Oxalacetat, zentraler Metabolit der Gluconeogenese Kohlenhydratstoffwechsel Bis auf drei enzymatische Schritte (Kinase-katalysiert) ist die Gluconeogenese die Umkehrung der Glykolyse: Glu -> Glu-6-P Fru-6-P -> Fru-1,6-BP PEP -> Pyruvat (Hexokinase) (Phosphofructokinase) (Pyruvatkinase) 54 Oxalacetat, zentraler Metabolit der Gluconeogenese Kohlenhydratstoffwechsel Zwei dieser Umkehr-Reaktion dienen der Umwandlung von Pyruvat in PEP : 55 Pyruvatcarboxylase Kohlenhydratstoffwechsel Pyruvatcarboxylase ist ein Biotin-abhängiges Enzym und carboxyliert Pyruvat zu Oxalacetat: Biotin als prostthetische Gruppe fungiert dabei als mobiler Carrier von aktiviertem CO2. Das Biotin ist über seine Carboxygruppe an einem Lysinrest gebunden. Dadurch entsteht ein flexibler Arm, wodurch die Biotingruppe von einem aktiven Zentrum zum zweiten „schwingen“ kann. Die Reaktion von Pyruvat zu Oxalacetat besteht aus zwei Phasen -> 56 Mechanismus der Pyruvatcarboxylase: Schritt 1 Kohlenhydratstoffwechsel Die Reaktion der Pyruvatcarboxylase vollzieht sich in zwei Phasen: 57 Phosphoenolpyruvat (PEP)-Carboxykinase: Schritt 2 Kohlenhydratstoffwechsel Im 2. Schritt reagiert das „aktivierte“ Pyruvat mit GTP (ähnlich dem ATP eine energiereiche Verbindung) zu Phosphoenolpyruvat: Von Pyruvat zu Glucose müssen insgesamt 6 Moleküle ATP (4 ATP + 2 GTP) aufgewendet werden. Der Abbau von Glucose zu Pyruvat und Resynthese von Glucose verbraucht daher netto 4 Moleküle ATP! 58 Pentosephosphatweg Kohlenhydratstoffwechsel Neben ATP benötigt der Organismus auch Reduktionskraft (=Äquivalente), die für anabolische Reaktionen (Biosynthesen) benötigt werden: -> der Pentosephosphatweg (Hexosemonophosphat-Shunt) im Cytosol stellt eine Möglichkeit der Verwertung von Kohlenhydraten dar, bei dem Reduktionsäquvialente in Form von NADPH generiert werden. -> Weiters dient er der Interkonversion von verschiedenen Kohlenhydraten. -> Dieser Seitenweg der Glycolyse ist vor allem in der Leber aktiv, wo ca. 30% der Glucose über diesen Stoffwechselweg oxidiert werden. Die Reaktionen lassen sich wie folgt zusammenfassen: 3 G6P + 6 NADP+ + 3 H2O 6 NADPH + 6 H+ + 3 CO2 + 2 F6P + GAP 59 Die 3 Phasen bzw. 2 Äste des Pentosephosphatweges Kohlenhydratstoffwechsel Phase 1 (Oxidativer, irreversibler Ast): Oxidation von Glu-6-P erzeugt NADPH und Ribulose-5-phosphat (Ru-5-P): 3 Glu-6-P + 6 NADP+ + 3 H2 OX. 6 NADPH + 6 H+ + 3 CO2 + 3 Ru-5-P Phase 2 (Nicht-Oxidativer, reversibler Ast): Isomerisierung und Epimerisierung von Ru-5-P zu Ribose-5-Phosphat bzw. Xylulose-5-Phosphat: 3 Ru-5-P Nicht-OX. R-5-P + 2 Xu-5-P Phase 3 (Nicht-Oxidativer, reversibler Ast): Umwandlung der Zucker 60 NADPH Produktion im Pentosephosphatweg (oxidativ. Ast) Kohlenhydratstoffwechsel 1. Phase: Zwei Reaktionen stellen NADPH bereit Intramolekularer Ester 61 Phase 3: Reorganisation der Zucker (nicht-oxidativ. Ast) Kohlenhydratstoffwechsel In der 3. Phase werden verschiedene Monosaccharide ineinander umgewandelt. Dabei entstehen Monosaccharide, die für die Biosynthese von anderen Verbindungen essentiell sind, wie z. B. Ribose-5-Phosphat und Erythrose-4-Phosphat: Transketolase Transaldolase Transketolase (Reaktionen siehe nächste Folie!) 62 63 Verwendung der Zucker aus dem Pentosephosphatweg Kohlenhydratstoffwechsel Nukleinsäurebiosynthese Biosynthese von Aromaten, Lignin & Polyphenolen 64 Glycolyse und Pentosephospatweg Kohlenhydratstoffwechsel Bereitstellung von NADPH für: • Synthese von FS • Synthese von Steroiden • Entgiftungsreaktionen Bereitstellung von R5P für: • RNA Biosynthese • DNA Biosynthese 65 NADPH in Entgiftungsreaktionen Kohlenhydratstoffwechsel NADPH wird auch für Entgiftungsreaktionen benötigt! -> besondere Rolle bei der Entgiftung von toxischen Hydroperoxiden: Erythrozyten z.B. sind durch den Transport von Sauerstoff besonders gefährdet vor oxidativen Schäden durch reaktive Sauerstoffspezies (ROS), wie z.B. Wasserstoffperoxid (H2O2). Glutathion-Peroxidase verwendet GSH = reduziertes Glutathion (γ-L-Glutamyl-L-CysteinylGlycin), um Hydroperoxide zu Alkohol und Wasser zu reduzieren. Dabei entsteht GSSG, oxidiertes Glutathion. Medikamente Nahrungsmittel Glutathion-Peroxidase Glutathion-Reduktase Die Glutathion-Reduktase verwendet NADPH, um das oxidierte GSSG wieder zu GSH zu reduzieren. Dieser Reaktionszyklus ist essentiell für Erythrocyten, d.h. sie sind völlig auf den Pentose-P-Weg angewiesen. Ein Mangel an NADPH führt zu vorzeitigem Zelltod. G6PDH 66 Mangel an Glucose-6-Phosphatdehydrogenase Kohlenhydratstoffwechsel Menschen mit G6P-Dehydrogenase Mangel können an einer schweren hämolytischen Anämie erkranken: DURCH EINEN DEFEKT IN DER G6PDH SIND DIE ERYTHROZYTEN ERHÖHTEM OXIDATIVEN STRESS AUSGESETZT -> ZU WENIG NADPH GENERIERT, SO DASS Z.B. OXIDATIVEN SCHÄDEN IN DER BLUTKÖRPERCHEN-MEMBRAN ENTSTEHEN -> DARUM HÄMOLYTISCHE ANÄMIE! Auslöser Symptome der hämolytischen Anämie: • hohe Dosen von Medikamenten, wie z.B. Antimalariamittel Primaquin • bestimmte Nahrungsmittel enthalten Substanzen, die ebenfalls Symptome verursachen können (Fava-Bohnen, Vicia faba: Favismus) Vicia faba 67 G6PDH Mangel & Malaria Kohlenhydratstoffwechsel G6PDH Mangel ist eine der am weitesten verbreitete genetische Erkrankung (ca. 400 Mio. Menschen sind Träger). G6PDH-Mangel ist erblich und weist einen Xchromosomalen Erbgang auf -> d.h. heterozygote Träger (Frauen) haben ein geringeres Erkrankungsrisiko. G6PDH-Defizienz ist weit verbreitet in Gebieten, in denen die Malaria heimisch ist (ca. 50% der Menschen sind Träger). Warum? VERBREITUNGSKARTE VON MALARIA Menschen mit einem G6PDH-Defekt haben einen erhöhten Schutz gegen Malaria, da sich der Erreger Plasmodium falciparum in den Erythrozyten vermehrt, aber sehr empfindlich gegenüber oxidativen Stress ist -> Selektionsvorteil: Ein G6PDH-Mangel ist in den Gegenden verbreitet, bei denen Malaria häufig auftritt. 68