Ringvorlesung "Chemisch Biologische Synthese"
Werbung

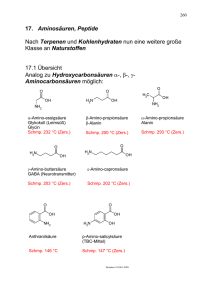
Ringvorlesung "Chemisch Biologische Synthese" 3. Aminosäuren und Peptide (3h) 3.1. Aminosäuren und deren Synthese 3.2. Peptidsynthesen 3.3. Globale Strukturen (T. Schrader) (T. Schrader) (T. Schrader) 3.1. Aminosäuren und deren Synthese a) Allgemeines zu Aminosäuren: evtl. aus Voet-Voet. Wichtig: Bausteine aller Peptide, Seitenketten machen nach der Faltung die Funktion der meisten Peptide als Biokatalysatoren und Rezeptoren aus. 20 proteinogene, 8 essentielle Aminosäuren. Zwitterionische Struktur auch im Kristall, dadurch gute Löslichkeit in Wasser, schlechte in org. Lösungsmitteln sowie hohe Schmelzpunkte (~300°C). Klassifizierung in unpolare, polare und geladene Seitenketten. Nomenklatur in 3-Buchstaben- (Ala, Ser) bzw. EinBuchstaben-Codes (K,L,F). Meistens L-, bei Bakterienzellwänden meist D-; meist α−, aber auch β− wichtig (z. B. in Medikamenten). Herausforderungen bei der Synthese: Amphiphiler Charakter (N-/C-Schützung) und Racemisierungstendenz (auch bei Peptidsynthesen ein Problem, z.B. über Oxazolinonbildung). Abb. Alle Aminosäuren mit Seitenketten und Buchstabencodes. Unpolar: H2N CO2H H2N CO2H H2N CO2H H2N CO2H H2N CO2H Gly Ala Val Leu Ile G A V L I Polar: S-Me NH Ph H2N CO2H CO2H H2N HN CO2H H2N CO2H OH H2N CO2H Phe Pro Met Trp Thr F P M W T O O OH H2N CO2H SH H2N OH NH2 NH2 CO2H H2N CO2H CO2H H2N H2N CO2H Ser Cys Asn Gln Tyr S C N Q Y Geladen: NH2 NH2 CO2H HN NH N NH CO2H H2N CO2H H2N CO2H CO2H H2N H2N CO2H H2N CO2H Asp Glu Lys Arg His D E K R H 1 Klassische Aminosäuresynthesen werden vorausgesetzt: Strecker, Gabriel, Erlenmeyer, Schöllkopf. Literaturverzeichnis für neuere Reviews über asymmetrische Synthesen, z. B.: R. M. Williams, Synthesis of optically active α-Amino Acids, Pergamon, Oxford, 1989; R. O. Duthaler, Tetrahedron 1994, 50, 1539-1650; H. Heimgartner, Angew. Chem. 1991, 103, 271297. Es gibt auch bei dem einfachen Grundgerüst der Aminosäuren mehrere prinzipielle Wege, um das N-C-C-System aufzubauen. Zu jedem Weg findet man Hunderte von Synthesen in der Literatur. Die besten neueren wollen wir kennenlernen. EX Ac N C PG O Nu N R1 R1 Ac Ac OR2 C O N H OR2 C O OR2 "N"δ+ C O OR2 NC Ac N R1 a) α-Aminosäuren: katalytische Hydrierung (Monsanto-Prozeß für L-DOPA gegen Parkinson, Nobelpreis für Knowles), Ausblick Dehydrogenasen und andere enzymatische Verfahren. OR OH OR OMe OH Rh-I P DIPAMP Ac-NH CO2H H2N Dehydro-Aminosäure P CO2H Ph Ph OMe L-DOPA ee = 93% DIPAMP b) evtl. Claisen-Umlagerung chelatisierter Enolate (Kazmeier); aus T. Wirth-Highlight: Angew. Chem. 1997, 109, 235-237 über α-alkylierte α-Aminosäuren: R1 O F 3C N H R3 O O R2 1. LHMDS 2. MXn R1 Claisenuml. R3 TFA N M O O R2 H3O+ R2 R3 R1 H2N O OH 2 c) Chirale Imidazolinone und Oxazolidinone aus Glycin (Seebach) H2N O CHO + H2N 1. LDA N 2. R--X N Boc 1. H+ H N 2. Camphersulfonsäure N H OMe O 1. Boc2O 2. Me3OBF4 N Boc OMe N 1. BuLi in situ OMe N 4N TFA/H2O H2N 2. R'-CH=CH-CO2R" R N Boc R R' CO2R" CO2Me R2 R1 d.r.>97:3 d.r.>97:3 d) evtl. Einbau in Peptide über 3-Amino-2H-Azirine (Heimgartner) ; aus T. Wirth-Highlight: Angew. Chem. 1997, 109, 235-237 über α-alkylierte α-Aminosäuren e) Asymmetrische Strecker-Varianten (aus: T. Lindel, Nachrichten 2000, 48, 790-792; und: L. Yet, Angew. Chem. Highlight 2001, 113, 900-901): NH R-CHO + NH 3 + HCN R NH2 H R NH2 H3O+ R CN CO2H Klassische Strecker-Variante der Synthese von α-Aminosäuren 1. 5 Mol% cat., -70°C, 1d N + HCN R H O MeOH/HCl F3C 2. TFAA N R NH2 CN Pd(PPh3)4 R CO2Me N < 95% ee cat. tBu O 10 Mol% cat., 10 Mol% Ti(OiPr)4, CN Ph N R N Ph 2 Äquiv. TMSCN, i-PrOH, RT, 1d R N H Ph < 99% ee Cl tBu Jacobsen-Katalysatoren (Al und metallfrei) Ph N Al X OH tBu H N O O tBu tBu O N H OtBu OMe O cat. Benzhydrylamine (Snapper, Hoveyda) 3 1. 9 Mol% cat, 2 Äquiv. TMSCN, 20 Mol% PhOH 1. HCl (g) 2. DDQ H N R 2. 2N HCl H N H R NH2 H R 3. 1N HCl 4. Amberlyst A-21 CN CONH2 Ph Ph P O O Cl Al O O P Ph Ph < 96% ee cat. Shibasaki-Binole mit Al (Lewissäure/base) Br Br OH OH OH OH + Br HO 1. 2 Äquiv. HCN 2. 1 Äquiv. R-CHO 4 Stufen NH3+Cl- HN 3. 1 Äquiv. HO -40°C, 1 d H2N R R CN CO2Me Br 0.1 Äquiv. 0.1 Äquiv. + + Zr(OtBu)4 0.3 Äquiv. O cat. N Me Br Br OtBu O Zr Br N NMI O Zr O O NMI 0.1 Äquiv. Br Br O OtBu Br Kobayashi-Binole mit Zr f) β-Aminosäuren: Amino Acids 1996, 11 (3-4), 397-405; N. Sewald: Darstellung von chiralen β-Aminosäuren über as. kat. Michael-Addition mit dem Feringa-System; dazu neuere (Highlight von Magriotis, Angew. Chem. 2001, 113, 4507-4509): Noyori: NHAc H2 (1 atm), BINAP NHAc PPh 2 PPh 2 H Ru(OAc)2, 0.5 Mol% MeO2C MeO2C 96% ee Sibi: O N N MgBr2, H2N-OBn O N NH-OBn N R cat., 30 Mol% O O N R < 95% ee N cat. g) Chem. Soc. Rev.: 1996, 25, 117-128: As. Synthese von β-Aminosäuren. 4 h) in Arbeit: Review von D. Seebach über seine β-Peptide (Angew. Chem. 2003). Hier nur die Synthesen, die Strukturen später im dritten Teil bei den globalen Strukturen; Eur. J. Org. Chem. 1999, 335-360; 2000, 1-15 (beides Synthesen); Angew. Chem. 1999, 1223 (βsheets). i) Mit β-Aminosäuren macht man die wichtigen β-Lactamantibiotika. Die beste katalytische asymmetrische β-Lactamsynthese (Highlight von Magriotis, Angew. Chem. 2001, 113, 4507-4509): O Me 2N Cl NMe2 O Me2N + Ph NMe2 Cl + H Ph Ts Nu H O Nu H Ph OMe N Ts CO 2Et StaudingerReaktion 10 Mol% H - Protonenschwamm H O N H EtO2C + Nu Nu = N H Ph Bz-O H 3.2. Peptidsynthesen: a) Problematik der Verknüpfung von freien Aminosäuren: Schutzgruppen und racemisierungsfreie quantitative Amidknüpfung. Die Fmoc, Boc und Z-Schutzgruppe sowie der t-Butylester und Benzylester (an und ab). Alle Seitenketten müssen ebenfalls geschützt werden, am besten so, daß sie alle in einem Schritt milde wieder entfernt werden können (heute vor allem Trifluoressigsäurespaltung bevorzugt). R1 O R1 X PG1-NH + H2N O-PG2 Z-NH O-PG2 PG2 = tBu, Bn O O N H O R2 O PG1 = Z, Boc, Fmoc O PG1-NH R2 O H N O O H N H Boc-NH O N H Fmoc-NH Aufbringen von PG1 und PG2 mit Z-Cl, Boc2O, Fmoc-Cl, Isobuten, Benzylchlorid; Abspalten mit H2/Pd-C / TFA und Piperidin (Fmoc, E1cb). b) Lösungssynthese mit Kupplungsreagenzien. Aktivierung der Säure über: gemischte Anhydride, Aktivester, DCC/EDC-HOBt-Methode, HATU/HBTU, PyBop, PyClop, T3P. Probleme bei der Peptidsynthese: Man braucht eine racemisierungsfreie, quantitative und schnelle Kupplung ohne Nebenprodukte. Oft tritt aber gerade durch Protonierung oder Deprotonierung der aktivierten Peptide eine teilweise Racemisierung ein. Folgende Nebenreaktionen muß ein gutes Kupplungsreagenz daher vermeiden: 5 1. Azlacton-Bildung: H HN H O R O H R X OH N X O O R B O N ...... O N + BH R' R' R' R' O R 2. Unerwünschte Cyclisierungen: R R Dipeptid-Ester bilden spontan Diketopiperazine. O H N H2N OR'' NH O R' O O HN R O R R' Z-geschützte Peptide können Hydantoine bilden. O NH HN R'' O O Spezielles Problem von Boc-Aminosäuren. HN N CHR' R O C C H OR'' CO R'' O O R' O C NH OR'' + R'NH R C H O HN O O H O R' O HN O R'NH O O R' 3. Racemisierung: R OH R'NH R C OR'' OH OR'' 4. Überaktivierung: R'''HN R' R'''HN O C OH DCC R' R' R'''HN O C OX R' O R'''HN O O symmetrisches Anhydrid N-Acylharnstoff Oxazolon Literatur: J. Pept. Protein. Res. 1987, 29, 574; Angew. Chem. 1963, 75, 282; THL 1992,33, 2815. 6 Übersicht über die gebräuchlichsten Kupplungsreagenzien: N C N C N N N DCC N X Mukayiama, BEP, .... PF6- Me2N N N O N X Alkyl EDC NMe2 NMe2 N N N N NMe2 PF6 O P NMe2 Me2N N NMe2 N OH X X = C : O-HBTU X = N : O-HATU X = C : N-HBTU X = N : N-HATU BOP N N N N O P PF6- O O N O P N N O O O P Prop Prop P O O P O Prop Cl 2 BOP-Cl PyBOP N P Cl 3 PyClop T3P R1 R1 gemischte Anhydride: PF6- OH + Cl Boc-NH R3N O O O O O Boc-NH O O O H2N O-tBu R1 R2 H N Boc-NH O O-tBu R2 O R1 R1 Aktivester: O Boc-NH F O Boc-NH O O NO2 F F F F DCC/HOBt: Zweiter Schritt: O R O N N N O N C O N H R O N N R'-NHR'' N R O R''N R 7 Hydroxybenztriazol vermeidet eine Überaktivierung der Carbonsäure auf der IminoesterZwischenstufe, die zu unerwünschten Nebenreaktionen führt wie Zyklisierungen, Harnstoffbildung, Oxazolonbildung und - Racemisierung! Literatur zu unerwünschten Nebenreaktionen: Pept. Protein. Res. 1987, 29, 574; Angew. Chem. 1963, 75, 282; THL 1992,33, 2815. Literatur zu DCC: JOC 1989, 54, 1922; JACS 1966, 88, 1013; JACS 1966, 88, 1020. Literatur zu wasserlöslichen Varianten (EDC): JOC 1961, 61, 2525. T3P: Ganz neu ist dieses preiswerte Kupplungsreagenz (Clariant), das ebenfalls racemisierungsfrei arbeitet und wasserlösliche Phosphonat-Nebenprodukte liefert, die sehr bequem durch Ausschütteln abtrennbar sind: O O O Prop P P Prop O O P O Prop T3P O O O Prop P P Prop O O P O Prop O R-CO2H R O P Prop O O P O P O Prop Prop O O NMP R-NH2 Produkt Literatur: Chem Commun. 1999, 1842. HATU / HBTU: Dies ist der Merzedes Benz unter den Kupplungsreagenzien! PF6- Me2N NMe2 NMe2 N N N N N N N N O H NR 2 N N OH N N OH R O N N N O PF6- Me2N NMe2 NMe2 N-HBTU und O-HBTU N N N O NMe2 NMe2 N-HATU und O-HATU (NGE) Lange Zeit wurde O-HBTU als vorliegende Struktur postuliert; die Kristallstruktur lieferte jedoch N-HBTU; leider ist die reaktivere Spezies jedoch O-HBTU; dafür gibt es seit neuestem auch eine effiziente Synthese. TBTU = HBTU mit Tetrafluoroborat als Gegenion. Der Vorteil von HATU ist ein Nachbargruppeneffekt (NGE) des Pyridin-Stickstoffs mit der freien Aminogruppe, der deren Nucleophilie erhöht: JOC 1998, 63, 9678; Angew. 2002, 114, 457. Der Mechanismus der Kupplung verläuft wie folgt: 8 N RCOO N N O - - NMe2 N NMe2 NMe2 PF6 Me2N PF6 N N O - ON N N N N N O NMe2 O O Me2N R NMe2 O R Me2N O O R NMe2 - HOBt NMe2 O N NMe2 N Amin + O N O Produkt NMe2 R O Bop und PyBop: Allgemein sind phosphorhaltige gute Abgangsgruppen sehr beliebt. Hier ist der Mechanismus ganz ähnlich, aber es entsteht das besser lösliche Phosphorsäuretriamid (Vorteil: Trispyrrolidinophosphinoxid ist nicht giftig wie HMPT). N N N N N N O P N NMe2 PF 6 O P NMe2 Me2N PF6N N Bop PyBop PyClop: geht auch gut bei sterisch anspruchsvollen Carbonsäuren. PF6 N P Cl 3 - PF6 N - P X PF6 Base O R N HO 3 - P O R 3 O PyClop X = OBt (PyBOP) X = Cl RNH2 RNH2 O P O + N 3 O R R N H R O + Oxazolinon 2 9 c) Festphasensynthese (Merrifield, Nobelpreis): Harze (Wang), Ankuppeln der ersten Aminosäure, Repetitive Kupplung der Bausteine und Entschützung am Harz, Kaisertest et al. auf vollständige Kupplung, Abspaltung vom Harz. HPLC-Analytik und Aufreinigung (evtl. Beispiel). Erreichbare Größe heute: 30 Aminosäuren-max. 50 Aminosäuren. R1 O + Fmoc-NH O 2 R1 1. DMAP O HO O H2N 2. Piperidin O Wang-Harz O Fmoc-HN OH R2 R1 O Fmoc-NH DIC/HOBt R2 TFA O N H freies Peptid O Zum Test auf vollständige Kupplung verwendete man früher Ninhydrin, dessen Färbung durch Zusätze nach blau verstärkt wurde (Kaisertest). Viel empfindlicher (Nachweis von <1% freier Aminogruppen) ist aber der rote Azofarbstoff NF31, der kovalent an die freien Aminogruppen des unvollständig gekuppelten Pepids auf einem selektierten Harzkügelchen gebunden wird. Die rote Farbe zeigt unvollständige Kupplung an. R1 O O2N N N O N O NO2 + O H2N O NF31 Nach Abspaltung des Peptids vom Harz unter gleichzeitiger Entfernung sämtlicher Seitenketten-Schutzgruppen (meistens mit TFA) erfolgt die Reinigung über präparative HPLC und anschließend die Reinheitskontrolle über analytische HPLC. Beispielchromatogramme eines rohen und eines gereinigten Oligopeptids: roh: 10 gereinigt: d) Sequenzanalyse: Edman-Abbau (vollautomatisch, Identifikation über HPLC mit UVDetektion). Val-Tyr-His-Ala + Ph-N=C=S Ph H N H N Ph-OH H O N O N H S N H O H+ N NH H3O+ Ph-OH H O N N H N O S + H2N Ph O N H N N H N 1. OHO S Ph Ph 2. H3O+ H N O N NH H O S O H N OH S Ph N H+ O Lenkung der Cyclisierung wahrscheinlich über HSAB (Thiazolinon: weiches protoniertes Amid - Angriff vom Schwefel; Thiohydantoin: hartes Carboxylkation: Angriff vm harten Stickstoff). e) Größere Peptide: Peptidligation: klassische Verfahren über Thioester und Cysteine. Neuere Varianten (Kießling etc.) über die Staudinger-Reaktion an beliebiger Stelle. Native Ligation an Cysteinen (gut bis ~100 Aminosäuren): H2N-Peptid N H H2N-Peptid X + NaSPh O H2N-Peptid N H S O N H S-Ph + O Peptid-OH H2N HS R1 H2N-Peptid Peptid-OH H2N O intramolekular! R1 Umesterung - PhS- HS R1 R1 N H Peptid-OH HN O O O 11 P. E. Dawson et al., Science 1994, 266, 776. Neuere Varianten (gut bis ~300 Aminosäuren): Repetitive Kupplung von Peptidfragmenten mit N-terminalem geschützten Cystein und Cterminalem Thioester am Harz. Entschützung des neuen N-terminalen Cysteins bereitet die nächste Runde vor: pH 7 PG-Cys-Peptid-COSR + Cys-Peptid Sepharose H2O PG-Cys-Peptid-CO-NH-Cys-PeptidSepharose - PG H3N+-Peptid-COSR H3N+-Peptid-CO-NH-Cys-Peptid-CO-NH-Peptid Sepharose Staudinger-Ligation (Kießling et al., beliebige Stelle): O Peptid O X + HS PPh 2 N Peptid PPh 2 -N2 Peptid H2O PPh 2 S Peptid PPh 2 O N-Peptid O N3-Peptid S Peptid S Iminophosphoran O Peptid f) N H Peptid via: N N N Peptid R PPh 2 Biochemische Peptidligation: Proteinsplicing und Konformations-assistierte Ligation. 3.3. Globale Strukturen: a) Einführung über Peptidfaltung: Nach der Biosynthese in den Ribosomen falten sich die entstandenen Proteinstränge zur nativen, bioaktiven Koformation von alleine? Hier handelt es sich um einen immer noch unzureichend verstandenen Ordnungsprozeß mit faszinierender Perfektion und Schnelligkeit: binnen weniger Sekunden werden Trillionen potentieller Konformationen in die thermodynamisch stabilste umgewandelt, bei der sich das gesamte Protein ansammelt; nur diese ist biologisch aktiv. Bei Fehlfaltungen assistieren "Helferlein": Chaperone sind große molekulare Proteinkästen mit definierten Bereichen für die ungestörte Faltung von gestreckten Polypeptidketten, die aus dem Ribosom kommen. Mehr dazu unten. Übersicht Peptidfaltung: M. Karplus, C. M. Dobson, A. Sali, Angewandte Chemie 1998, 110, 908-935. Karplus führt Energiehyperflächen mit komplexen Fortschrittsvariablen ein, die 12 ähnlich wie die bei den Reaktionen kleiner Moleküle (H + H2) nur wenige günstige Trakejtorien erkennen lassen, auf denen die Faltungsreaktion wahrscheinlich wie ein Golfball ins thermodynamische Loch rollt, ohne viel Zeit zum Abtasten aller möglichen Wege zu verbrauchen. Abb. 8-5 (Voet-Voet: S. 193: Hypothetische Faltung eines dimeren Proteins: Zuerst entsehen lokale Sekundärstrukturen, die sich nach und nach übereinander lagern und schließlich die enge kompakte Faltung ergeben, die im letzten Schritt zum Dimer aggregiert. Heute diskutiert man hydrophobe Cluster von unpolaren Aminosäureresten als nucleation sites solcher Sekundärstrukturen. Die wichtigsten attraktiven Wechselwirkungen scheinen also solvophobe und dispersive WWen zu sein. 13 Chaperone: Die Chaperone binden ATP, welches über ihre ATP-Synthase-Aktivität hydrolysiert wird und so die Konformation der Chaperone verändert. Dadurch wird die Affinität für das nichtnative Protein ganz stark verändert. Nach Zusammensetzung der molekularen Kapsel (Gro-El und Gr-ES) erfolgt die Faltung des Proteins. Nach ATP-Hydrolyse geht der Gro-El und Gro-ESKomplex auseinander, und das gefaltete Protein wird wieder heraus gelassen. Übersicht Chaperone: S. Walter, J. Buchner, Angewandte Chemie 2002, 114, 1142-1158. b) Nur zwei Bindungen in α-Aminosäuren sind drehbar; damit verbinden sich die charakteristischen Diederwinkel θ und φ. Diese kann man per NMR-Experiment über die Karplus-Gleichung ermitteln (Bystrov-Modifikation für den zusätzlichen Stickstoff: Faktor 1.09 für die höhere Elektronegativität). In letzter Zeit ist es auch gelungen, Peptide mit externen Liganden konformationell zu fixieren. Der Nachweis erfolgte z.B. über die Karplus-Analyse der 3JH,H-Kopplungskonstanten (s. unten: Aminopyrazole als β-FaltblattLiganden). Die konformationelle Freiheit unterschiedlicher Aminosäuren im Peptidverband wird durch zweidimenionale sogenannte Ramachandran-Plots dargestellt und zeigt auch direkt die unterschiedliche Tendenz von Aminosäuren, bestimmte Konformationen zu bevölkern. Lit: (a) Delepierre, M.; Dobson, C. M.; Poulsen, F. M. Biochemistry 1982, 21, 4756. (b) Bystrov, V. F. Prog. Nucl. Magn. Reson. Spectrosc. 1976, 10, 41. Abbildung Diederwinkel + Karplus-Gleichung: 3J = [Acos2θ - Bcosθ + Csin2θ ] / 1.09 14 H θ H N C C' O J (NH-α-CH) Ac-L-Val-L-Val-OMe NH(1) NH(2) 3 complexation [%] free 8.2 8.5 0 Pyrazol 8.2 9.0 50 APCE 8.6 9.6 65 MAMP 9.8 10.0 85 PivAStyP 9.0 9.7 86 AcAStyP 9.6 9.8 93 TriFlAStyP 10.0 9.8 94 θ θ Abbildung: Aminopyrazol + Ac-Gly-Val-OMe. Kopplungskonstanten um die 10 Hz zeigen perfekte β-sheet-Konformation an (Diederwinkel θ um die 180°). Ramachandran-Plot: Voet-Voet, 144, 7-7 und 7-8. Ein Ramachandran-Plot stellt die erlaubten Bereiche für Diederwinkel verschiedener Aminosäuren in Proteinen dar. Man sieht, daß ein großer Teil des Konformationsraumes gar nicht zugänglich ist. c) α-Helix und β-Sheet sind extrem wichtige Peptid-Sekundärstrukturen von fundamentaler Bedeutung. Sie sollte genau verstanden werden (parallel, antiparallel, biologische Funktion, Voet-Voet, auch β-Schleifen, 7-22). Pathologische Faltungsprobleme führen zu schwersten Krankheiten, die unter dem Namen protein-folding deseases in die Literatur eingegangen sind (BSE, Creutzfeld-Jakob, Alzheimer). 15 Abb. α-Helix, β-Sheet (auch antiparallel). Betonung des H-Brückenmusters (vgl. Voet-Voet). Abb. β-Schleife: Hier befinden sich Aminosäuren wie Prolin, die gerne einen Knick in der Hauptkette induzieren. Abb.: Prionenstäbchen (links) O N N N H O N H N N H O H O H NR H OMe O H NR N RO H H N R O H H H NN H H N N N H N O O H + Alzheimer Amyloid-Plaque (rechts). • ...Fast Screening Method: PrP alone PrP with AmpOx S P Abb.: Verkappen der β-sheets im Prionprotein: neue Therapie von BSE? d) Kristallstrukturen von Proteinen werden durch die unterschiedliche Darstellung von αHelices und β-Sheets im Rückgrat übersichtlich; man erkennt im Vergleich sofort den dramatisch unterschiedlichem Gehalt an Sekundärstrukturen in Proteinen unterschiedlicher Funktion (von reinen β-Sheet zu reinen α-Helix-Proteinen). Die Berechnung von Proteinstrukturen ist auch heute noch nur mit Homologie-Modeling und ähnlichen Vereinfachungen möglich (SYBYL von Tripos und Insight von Accelrys, früher MSI). Die Bestimmung von dreidimensionalen Strukturen erfolgt heute entweder über Xray (klassisch) oder in den letzten Jahren immer stärker auch durch NMR-Experimente (Nobelpreis 2002 für K. Wüthrich, TROSY-Experiment, evtl. Abbildung). Man geht dabei wie folgt vor: 15N-Markierung aller Aminosäuren und Peptidsynthese klassisch oder molekularbiologisch durch Überexpression in Mikroorganismen; nach zweidimensionalen COSY-Experimenten zur Zuordnung aller Aminosäureesignale Aufnahme von dreidimensionalen NOESY-Spektren; Zuordnung aller NOESY-Kreuzpeaks und quantitative dreidimensionale Reproduktion der Proteinstruktur über ComputerAlgorithmen; in vielen Fällen hervorragende Übereinstimmung mit Kristallstrukturen; manchmal aber starke Abweichungen. Gute Ergänzung: X-ray zeigt meist hohe Auflösung 16 aller gut strukturierten Bereiche; NMR zeigt wahre Struktur in wäßriger Lösung und kann auch Dynamik abbilden (wichtig für die molekulare Erkennung und Katalyse). Kristallstruktur von: α-Helix-reich: Calmodulin: Voet 18-21, S. 496. Cytochrom c: Voet 20-18, S. 543. Myoglobin: 7-41, S. 167. Das Cytochrom b in der Atmungskette vermittelt Elektronentransferreaktionen durch die zwischen den Helices eingelagerten Hämgruppen, welche jeweils an Histidinen aufgehängt sind. Dazu Schemabild des Adrenalinrezeptors, der eine Bindungsmulde von 7 membrandurchspannenden Helices bildet, die das Adrenalinmolekül binden und das Signal über die Membran weiterleiten: Adrenalin Nach Andocken des Adrenalinmoleküls wird das Signal über eine Konformationsänderung im Inneren des Rezeptors über die Membran ins Zellinnere geleitet und dort weiter verstärkt. P P P P P P P Signal 17 Myoglobin (links) ist ein globuläres (kompaktes) Protein, welches durch die α-Helices äußerst steif gebaut ist. Zwei Histidine tragen auch hier wieder die Hämgruppe, die für den Transport von Sauerstoff verantwortlich ist. Calmodulin (rechts) bindet Ca2+-Ionen und reguliert damit deren Spiegel. Die α-Helix in der Mitte trennt als Abstandhalter zwei globuläre Domänenn, die über ihre Carbonylsauerstoffe im Rückgrat jeweils zwei Ca2+-Ionen binden können. β-Sheet-reich: Concanavalin A: Voet 7-43, S. 169; Carboanhydrase: Voet 7-44, S. 169. (In der Nähe befinden sich auch auch viele schöne Abbildungen von β-Schleifen etc.! Dazu werden Elektronendichteverteilungen und Röntgenbeugungsmuster gezeigt - Empfehlung). Concanavalin A (links) besteht praktisch nur aus zwei β-Faltblättern, bildet also zwei steife Wände. Es gehört zur wichtigen Familie der Lectine, die spezifisch Zucker binden, hier besonders α-D-Glucose. Carboanhydrase (rechts) hat die Funktion, CO2 in Hydrogencarbonat HCO3- zu überführen. Dazu benutzt es ein über drei Histidine gebundes Zink2+-Kation, 18 welches ein gebundenes Wasser deprotoniert und als nucleophiles OH--Teilchen an CO2 angreifen läßt Für diese katalytische Funktion sind die drei Histidine in β-Faltblätter eingelagert und bilden dadurch die optimale steife Anordnung zur gleichzeitigen Bindung des Zn2+-Kations. Dazu Kofaktoren in Enzymen gebunden: Beispiel der Alkoholdehydrogenase mit NAD+ in der Rossman-Spalte: TROSY-Experiment und NMR-Strukturen. Aus der Homepage von Kurt Wüthrich: Rinder-Prionprotein Menschliches Prionprotein Erkennen Sie die beunruhigende Ähnlichkeit!? 19 Wie funktioniert eine dreidimensionale Strukturbestimmung mit NMR? H Nach 13C- und 15N- Markierung erfolgt zunächst die vollständige Zuordnung aller 1H-, 13C- und 15N-Kerne über COSY-Experimente (blau). Anschließend werden alle NOE-Kontakte zwischen Protonen vermessen und quantitativ ausgewertet (rot). Die Summe aller NOE's liefert schließlich die dreidimensionale Anordnung. O H3C 15 13 O COSY H 15 O N C N 13 C H H CH2 NOE H 20