Zusammensetzung und Struktur der Proteine
Werbung

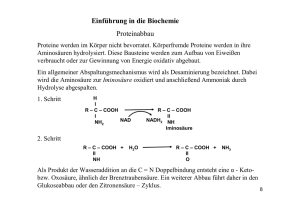
Zusammensetzung und Struktur der Proteine Stryer (6. Auflage) Kapitel 2 Vielfalt der Proteine Wie kommt diese Vielfalt an Proteinen zustande? 1. 2. 3. 4. 5. 6. Peptide und Polypeptide sind Ketten aus 20 verschiedenen L-Aminosäuren (Primärstruktur). Sekundärstrukturen von Polypeptiden Tertiärstrukturen von Polypeptiden (Proteine) Quartärstruktur von Proteinen Aufbau grosser Polypeptide Proteinmodifikationen Proteine bestehen aus 20 verschiedenen -Aminosäuren Die Sequenz, die Reihenfolge der Aminosäuren entspricht der Primärstruktur. Diese bestimmt im wesentlichen die Sekundär-, Tertiär- und (wenn vorhanden) die Quartärstruktur eines Proteins. -Aminosäuren sind untereinander über Peptidbindungen verknüpft und bilden Peptide, bzw. Polypeptide. Polypeptide können Sekundärstrukturen ausbilden: z. B. Helix, -Faltblatt und andere. Tertiärstruktur: die Sekundärstrukturen eines wasserlöslichen Polypeptids falten zu kompakten, dreidimensionalen Strukturen, wobei im Innern apolare Aminosäurereste bevorzugt auftreten. Die L- und D-Isomere von Aminosäuren Die L- und D-Isomere von Aminosäuren als Fischerprojektionen O O OH H2N H OH H2N H CH3 CH3 L-Alanin O OH H NH2 CH3 O OH H NH2 CH3 D-Alanin In Proteinen finden sich ausschliesslich L-Aminosäuren Nahezu alle L-Aminosäuren besitzen den (S)-Chiralitätssinn nach dem System von Cahn, Ingold und Prelog (RSSystem). Die Anordnung der Substituenten nach absteigender Priorität gegen den Uhrzeigersinn steht für die S-Konfiguration des Chiralitätszentrums. Ionisierungsgrad in Abhängigkeit des pH-Wertes pK1 = 2.3 pK2 = 9.7 Alanin c = 0.1 M pKw pH Glycin und Alanin AS mit aliphatischen Seitenketten COOH H2N H CH2 H3C CH CH3 COOH H2N H H3C H CH2 CH3 COOH H2N H CH2 H2C S CH3 Cyclische Struktur von Prolin COOH HN H Auch Prolin besitzt eine aliphatische Seitenkette, unterscheidet sich jedoch von den anderen 19 Aminosäuren dadurch, dass seine Seitenkette sowohl mit dem -Kohlenstoffatom als auch mit dem Stickstoffatom verbunden ist. Prolin beeinflusst die Architektur eines Proteins in hohem Masse, da es durch seine Ringstruktur in seiner Konformation stärker eingeschränkt wird als die anderen Aminosäuren. AS mit aromatischen Seitenketten COOH H2N H COOH H2N CH2 CH2 N H OH H AS mit aliphatischen Hydroxylgruppen COOH H2N H CH2 OH COOH H2N H H OH CH3 Cystein enthält eine Sulfhydryl- oder Thiolgruppe Basische AS Basische AS Lysin und Arginin besitzen vergleichsweise lange Seitenketten, deren Endgruppen bei pH = 7 positiv geladen sind. Lysin wird von einer primären Aminogruppe, Arginin von einer Guanidiniumgruppe abgeschlossen. Histidin enthält eine Imidazolgruppe, einen aromatischen Ring, der ebenfalls positiv geladen sein kann. pKa = 12.5 pKa = 6 AS mit Carboxylaten und Carboxamiden in der Seitenkette COOH H2N H COOH H2N H COOH H2N H CH2 CH2 CH2 COOH CONH2 CH2 CONH2 Ionisierbare Gruppen In Polypeptidketten ist der pKa-Wert der Aminosäureseitenketten relevant. Am N- bzw. am CTerminus sind natürlich auch die basische Aminogruppe und die saure Carboxylgruppe relevant. Die Kurzschreibweise der AS Primärstruktur: Peptidbindungen verknüpfen die AS zu Polypeptidketten Die Amidgruppe entsteht durch Kondensation der Aminogruppe einer -Aminosäure mit der Carboxylgruppe einer andern. Umsetzung von Aminen mit Carbonsäuren zu Carbonsäureamiden Diese Reaktion ist der Bildung von Carbonsäureestern aus Carbonsäuren und Alkoholen sehr ähnlich. Wegen der Säure-Base Reaktion der Aminogruppe, die natürlich spontan stattfindet, läuft die Bildung der Amide nur sehr langsam ab; zudem muss noch das Wasser aus dem Gleichgewicht entfernt werden (wie bei der Bildung von Estern). In der Biochemie ist die Bildung von Amiden ein absolut essentieller Vorgang bei der Proteinsynthese. Da diese sehr schnell ablaufen muss, wird die Carboxygruppe in eine viel reaktivere Form überführt (AminoacylAMP), die dann in einer exothermen Reaktion zu Amiden umgesetzt wird. Biochemische Umsetzung von zwei Aminosäuren zu einem Dipeptid R + ATP H OAMP H3N C + PPi O R H + H3N H O N C C O + AMP OH H R' Biochemische Umsetzung von zwei Aminosäuren zu einem Dipeptid ATP ein Aminoacyl-AMP Aminosäuresequenzen haben eine Richtung: Beispiel Pentapeptid Doppelbindungscharakter der Peptidbindung daher liegen alle Atome zwischen den beiden -C-Atome in einer Ebene Übung Aminosäuren 1. Zeichnen und beschriften Sie die stereochemische Struktur von LThreonin. Geben Sie an, ob R- oder S-Konfiguration vorliegt. 2. Das Tripeptid Glutathion (-Glu-Cys-Gly) übernimmt in vielen Organismen eine Schutzfunktion, indem es toxische Peroxide abbaut, die während des oxidativen Stoffwechsels erzeugt werden. Zeichnen Sie die chemische Strukturformel von Glutathion. Beachten Sie dabei: das Symbol weist darauf hin, dass die Peptidbindung zwischen Glu und Cys zwischen der Carboxylgruppe von Glu und der Aminogruppe von Cys besteht. 3. Alle L-Aminosäuren verfügen über eine absolute S-Konfiguration. Die einzige Ausnahme macht L-Cystein, das in R-Konfiguration vorliegt. Erklärung! Sekundärstrukuren Polypetidketten können sich zu regelmässigen Strukturen wie -Helix, -Faltblatt, Kehren und Schleifen falten -Helix In einer -Helix (Linus Pauling, 1951) windet sich die Polypeptidkette in einer rechts drehenden Spirale auf der Ebene eines virtuellen Zylinders. Dabei hat eine Windung die Länge von 0.54 nm und pro Windung sind 3.6 Aminosäuren untergebracht. Diese Strukturen werden durch H-Brücken zwischen den NHund den CO-Gruppen der Polypeptidkette zusammengehalten, wobei die H-Brücken auf der Ebene des virtuellen Zylinders liegen und ungefähr parallel zur Längsachse der Helix ausgerichtet sind. Durch die Torsion der Polypeptidkette entlang der Helix kommen die Aminosäureseitenketten nach aussen zu liegen. Im Innern der Helix kommen sich die Atome der Polypeptidkette auf van der Waals-Radien nahe. Die mittlere Länge einer -Helix beträgt 3-4 Windungen. Struktur der -Helix Wasserstoffbrücken der -Helix Übereinanderliegende Atome in einer -Helix, die über H-Brücken zusammengehalten werden Eine -Helix bestehend aus 3-4 Windungen wird durch ungefähr 10 H Brücken zusammengehalten (entspricht in etwa der Stärke einer C-C Bindung) Schematische Darstellung der -Helix Myoglobin aus -Helices und random coil aufgebautes Polypetid (Tertiärstruktur = räumliche Auffaltung der Sekundärstrukturen Struktur eines -Stranges Die Seitenketten (grün) liegen abwechselnd ober- und unterhalb des Stranges Antiparalleles -Faltblatt Wie in -Helix auch hier H-Brücken nur zwischen Atomen, die an Peptidbindung beteiligt sind Paralleles -Faltblatt Schematische Darstellung von Strängen In schematischen Darstellungen werden -Stränge in der Regel als breite Pfeile gezeichnet, die in Richtung des carboxyterminalen Ende weisen, um den Typ des gebildeten Faltblatts - parallel oder antiparallel - deutlich zu machen Ein Protein, das mehrheitlich aus einem -Faltblatt besteht Kehren und Schleifen Die meisten Proteine haben eine kompakte globuläre Gestalt, was häufige Richtungsänderungen im Verlauf ihrer Polypeptidketten voraussetzt. Viele dieser Richtungswechsel kommen durch ein allgemeines Strukturprinzip zustande: eine so genannte (-)Kehre oder Haarnadelkehre (reverse, bzw. -turn oder hairpin bend). Bei vielen dieser Kehren ist die CO-Gruppe eines Restes i innerhalb des Polypeptids über eine Wasserstoffbrücke mit der NH-Gruppe des Restes i + 3 verknüpft Struktur einer Kehre Tertiärstruktur eines Polypetids Anordnung der Sekundärstrukturen im Raum zu einem komplexen Gebilde Welche Kräfte spielen dabei eine Rolle? • • • • Hydrophober Effekt Schwefelbrücken Salzbrücken Wasserstoffbrücken Verteilung der AS in Myoglobin Oberfläche Gelb: Hydrophobe Aminosäuren Blau: Hydrophile Aminosäuren Querschnitt “Umgestülpte” AS Verteilung im Porin Quervernetzung durch Schwefelbrücken Die Bildung einer Disulfidbrücke zwischen zwei Cysteinresten ist eine Oxidationsreaktion Stabilisierung der Tertiär- und Quartärstruktur in Rinderinsulin Quartärstruktur Anordnung getrennter Polypetidketten (Untereinheiten eines Proteins) zu einem funktionellen Protein Das Cro-Protein (DNA-bindend) des Bakteriophagen ist ein Dimer Das 22-Tetramer des menschlichen Hämoglobins Komplexe Quartärstruktur Die Hülle des Rhinovirus besteht aus je 60 Kopien von vier verschiedenen Untereinheiten. Nebenan eine schematische Darstellung, in der die drei Untereinheiten (rot, blau, grün) wiedergegeben sind, die an der Aussenseite des Virus sichtbar sind. Die Aminosäuresequenz eines Proteins legt dessen dreidimesionale Struktur fest Experimente mit Rinder-Ribonuklease Ein einzelner Polypetidstrang mit vier Disulfidbrücken Reduktion der Disulfidbrücken mit Mercaptoethanol ...und Denaturierung mit Harnstoff Harnstoff vermag nicht-kovalente Verbindungen äusserst wirksam zu zerstören Sequenz bestimmt Struktur Die denaturierte und mittels Dialyse von Harnstoff und Mercaptoethanol befreite Ribonuklease hat ihre enzymatische Aktivität allmählich wiedergewonnen. Sequenz bestimmt Struktur Anderes Resultat, wenn man reoxidiert ohne den Harnstoff zu entfernen: Die Disulfidbrücken werden falsch gebildet (105 Möglichkeiten vier Disulfidbrücken zu bilden aus 8 Cysteinen)