Chemie für Biologen - an der Universität Duisburg
Werbung

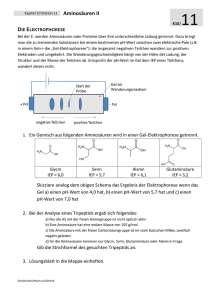
Chemie für Biologen SS 2013 Prof. G. Haberhauer Institut für Organische Chemie der Universität Duisburg-Essen (Teil 13: Aminosäuren, Peptide) Carbonsäureamide Synthesen O R C OH T O + NH 3 R C HNH3 O R C - H 2O O Ammoniumcarboxylat Carbonsäure NH 2 P2O5 - H 2O Carbonsäurenitril R C N O R C Cl O + NHR'2 + HCl R C NR'2 Carbonsäurechlorid Nomenklatur O H C NH 2 Formamid H3C C O O H C NH 2 N CH 3 CH 3 N,N-Dimethylformamid Acetamid Cyclische Amide: Lactame S CH 3 N CH 3 COOH NH O -Lactam (gespannter Vierring, hydrolyseempfindlich) O Penicilline .. O R C :NR2 O N H -Lactam O NH -Lactam -Caprolactam (-) :O: R C NR2 (+) H RNH Mesomerie: Die Amidbindung besitzt partiellen Doppelbindungscharakter. Kohlensäure-Derivate O + 2 HCl H2N NH 2 Harnstoff (Diamid der Kohlensäure) Cl + 2 NH3 Cl Phosgen (Säurechlorid) HO OH H 2CO3 Kohlensäure NH H2N O O CO 2H NH NH 2 Arginin -Aminosäure O + H 2O H2N NH 2 + H2N Harnstoff CO 2H NH 2 Ornithin -Aminosäure Harnstoff ist das Endprodukt des Eiweißabbaus bei Menschen und Säugetieren. Ein erwachsener Mensch produziert ca. 20 g/Tag. Die Hydrolyse von Arginin ist der letzte Schritt im Harnstoff-Zyklus. Aminosäuren O -Aminosäuren R CH C Bausteine von Peptiden und Proteinen NH2 OH 3-Aminopropansäure, O CH 2 CH 2 C -Alanin, eine -Aminosäure OH Baustein von Coenzym A NH 2 -Aminobuttersäure (GABA) O CH 2 CH 2 CH2 C Neurotransmitter, Mangel führt zu OH epileptischen Anfällen NH 2 Aminosäuren sind difunktionelle Verbindungen. Sie besitzen eine basische und eine saure funktionelle Gruppe. O O R CH C R CH C NH3 O NH2 OH zwitterionische (normale) Form: unpolare Form: in polarem Lösungsmittel Gasphase -Aminosäuren, Beispiele Viele Aminosäuren besitzen weitere funktionelle Gruppen. L- und D-Form von Aminosäuren im Tetraedermodell und in der Fischer-Projektion Die natürlich vorkommenden -Aminosäuren besitzen zumeist die L-Konfiguration. Titrationskurve von Glycin Isoelektrischer Punkt: pH-Wert, bei dem die Aminosäure im elektrischen Feld nicht wandert. pI = ½ (pK1 + pK2) Schema der Peptide-Synthese Amid- bzw. Peptid-Bindung O CH 2 C OH NH 2 Glycin CH 3 O + H2N CH C OH O CH 3 O CH 2 C NH CH C OH NH 2 H-Gly-Ala-OH - H 2O Alanin O O H3C CH C NH CH 2 C OH NH 2 Isomere Dipeptide H-Ala-Gly-OH SäureO H2N AminKomponente OH + H R1 O H N R2 O OH R2 H2N - H2O R1 N H OH O (4) Schützen (1) Aktivieren (2) Schützen (3) Schützen = Desaktivieren Die Synthese kann so gesteuert werden, dass nur eines der beiden Isomere entsteht. Bradykinin, ein Nonapeptid Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg N-terminale Aminosäure C-terminale Gewebshormon, wird bei Entzündungen und Immunreaktionen freigesetzt, beeinflusst den Blutdruck. Peptide sind wie andere Carbonsäureamide in stark sauren und alkalischen Lösungen hydrolyseempfindlich. Die Totalhydrolyse liefert Art und Anzahl der Aminosäuren, nicht aber die Sequenz. Sequenzanalyse durch schrittweisen Abbau. Aminosäure-Sequenz = Primärstruktur von Proteinen (in DNA codiert) Peptide können im Labor synthetisiert werden. Beispiel: Synthese des Enzyms Ribonuclease (124 Aminosäuren), R. B. Merrifield 1969, Nobelpreis 1983. Besser: Biotechnologische Synthese, z. B. Humaninsulin (Escherichia coli). Humaninsulin: Aminosäuresequenz (Primärstruktur) A-Kette: 21, B-Kette: 30 Aminosäuren, verknüpft durch Disulfidbrücken Hormon der Bauspeicheldrüse (Pankreas), wirkt blutzuckersenkend Name: Langerhanssche "Inseln" des Pankreas Struktur von Proteinen Faltblattstruktur zweier Polypeptidketten Wasserstoffbrücken-Bindungen sind als .... markiert. -Helix einer Polypeptidkette WasserstoffbrückenBindungen sind als ....... markiert. Rechtsgängige -Helix mit den Atomen, die das Rückrat der Peptidkette bilden Triosephosphat-Isomerase Ein ubiquitäres Enzym, ist in der Glykolyse von Bedeutung. 6 Bänder = -Helix, Pfeile = Faltblatt