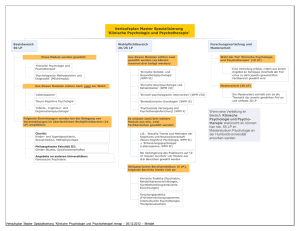
Klinische Studien in Horizont 2020
Werbung

Klinische Studien in Horizont 2020 Webinar, 19. Januar 2016 Dr. Uta Baddack-Werncke & Dr. Doris Bell Agenda • • • • • Klinische Studien Beschreibung im Antrag Einbindung von Studienzentren und Unteraufträge Berechnung der Unit Costs Ethik Tipps und Links Webinar „Klinische Studien“, 19. Januar 2016 2 Klinische Studien in Verbundforschungsprojekten = Any clinical research involving a substantial amount of work related to the observation of, data collection from, or diagnostic or therapeutic intervention on multiple or individual patients/subjects. It includes but is not limited to clinical trials in the sense of the EU Clinical Trials Directive (2001/20/EC). Webinar „Klinische Studien“, 19. Januar 2016 3 Klinische Studien in Verbundforschungsprojekten …bereiten erfahrungsgemäß Probleme (bei Antragstellung, Administration…) • H2020 Finanzierungsregeln für klinische Studien schwierig anzuwenden Kliniken keine typischen Zuwendungsempfänger: oft nicht ausgerüstet die tatsächlichen Kosten nachzuweisen (z.B. Zeitaufschrieb) Kosten: Vielzahl kleiner Elemente, sehr schwer als tatsächliche Kosten nachzuvollziehen • Schwierig zu planen: Rekrutierung von Patienten kann sich verzögern, unvorhergesehener drop out Einbindung von Studienzentren, z.T. viele Zentren, unterschiedlich eingebunden • Besondere ethische und regulatorische Aspekte zu berücksichtigen Webinar „Klinische Studien“, 19. Januar 2016 4 Klinische Studien in Verbundforschungsprojekten • Können der Hauptteil eines Projekts sein, oder ein Teilprojekt • Können direkt im Topictext gefordert sein, oder zusätzlich im Projektplan vorgesehen werden, obwohl sie nicht gefordert sind. • Es gelten die allgemeinen rechtlichen und finanziellen Regeln von Horizont 2020 (Ausnahme: Möglichkeit Unit Costs abzurechnen) • Prinzipiell sind alle Phasen klinischer Studien förderfähig, aber: Topics geben inhaltlichen Rahmen, Phasen und evtl. Methoden vor • Translationale Forschung im Fokus: Ergebnisse sollen in die Klinik überführt werden • Teilweise Anwendung des Clinical Trial Templates gefordert Webinar „Klinische Studien“, 19. Januar 2016 5 Beschreibung klinischer Studien im Antrag wichtig: Grundlegende Informationen der geplanten klinischen Studie liefern • Studienhypothese, Ablauf, Umfang, Populationen, Ein-/ Ausschlusskriterien, Anzahl Untersuchungszentren und Sicherheitsaspekte • Dokumente auf dem Teilnehmerportal Webinar „Klinische Studien“, 19. Januar 2016 6 Beschreibung klinischer Studien im Antrag Für manche Topics zwingend anzuwenden: Clinical Trial Template • Für jede klinische Studie ein einzelnes Template ausfüllen • In jedem Abschnitt kurze präzise Angaben – wenn manche Unterpunkte nicht zutreffen, kurze Erklärung hierzu abgeben. • Falls Informationen (noch) nicht verfügbar sind: Quelle der benötigten Daten angeben und die Auswahl der anzuwendenden Methoden klar beschreiben • Für alle anderen Topics kann das Template als Orientierung zur Beschreibung der klinischen Studie in Part B des Antrags dienen (aber NICHT ausfüllen & anhängen!) • Webinar „Klinische Studien“, 19. Januar 2016 7 Clinical Trial Template zwingend für folgende Topics 2016: • • • • PM-01: Multi omics for personalised therapies addressing diseases of the immune system PM-06: Vaccine development for malaria and/or neglected infectious diseases PM-09: New therapies for chronic diseases PM-11: Clinical research on regenerative medicine 2017: • PM-02: New concepts in patient stratification • PM-07: Promoting mental health and well-being in the young • PM-08: New therapies for rare diseases • PM-10: Comparing the effectiveness of existing healthcare interventions in the adult population • HCO-07: Global Alliance for Chronic Diseases (GACD) Webinar „Klinische Studien“, 19. Januar 2016 8 Aufbau Clinical Trial Template 1. Identifier 2. Study design and endpoints, relevant guidance documents 3. Scientific advice/ communication with regulatory authorities / ethics committees 4. Subjects/population(s) 5. Statistic analysis planning and power calculation 6. Cumulative safety information 7. Conduct - schedule with key study milestones, recruitment strategy, assignment of intervention - study management, monitoring, data and sample management, sponsor, committees - study medication, clinical centres 8. Orphan designation 9. ’Unit costs per patient’ for clinical trials Webinar „Klinische Studien“, 19. Januar 2016 9 Aufbau Clinical Trial Template 2. Study design and endpoints 2.1 Study design: Beschreibung und Begründung für die Wahl der Studienart & Designs kontrolliert, doppelblind, randomisiert, open-label… 2.2 Primary and secondary endpoints: Beschreibung der primären und sekundären “outcomes” und wie diese als Endpunkte gemessen werden, Stichwort: outcome measures 2.3 Relevant guidance documents Bezug zu Leitlinien oder Vorgaben, die für die Studie relevant sind, z.B. • wissenschaftlichen Gesellschaften (beispielsweise zu Standardbehandlung), • regulatorischen Gremien (z.B. EMA) und • Health Technology Assessment Agenturen (z.B. DAHTA) Webinar „Klinische Studien“, 19. Januar 2016 10 Aufbau Clinical Trial Template 3. Scientific advice / protocol assistance / communication with regulatory / competent authorities / ethics committees Angaben zum Genehmigungsverfahren und Ethikvotum entsprechend der EU- und nationalen Gesetze Falls mit Behörden für Nachfragen oder Beratungen bereits Kontakt aufgenommen wurde : - Was wurde wann besprochen: Korrespondenz, Gesprächsprotokolle etc. - Wie ist der Status? - Wurden schon positive Voten oder Erlaubnisse erteilt? Auch andere Unterstützung nennen (Uniklinik, CRO,…) Webinar „Klinische Studien“, 19. Januar 2016 11 Tipp: wo finde ich Hinweise zur (europäischen) Gesetzgebung und zu regulatorischen Vorgaben? http://ecrin.org/en/tools/campus http://www.ema.europa.eu/ Übersichtsgrafik des BMG über nationale und europäische Gesetze und Behörden zu Arzneimitteln und Medizinprodukten: www.bmg.bund.de/fileadmin/dateien/Downloads/M/Medi zinprodukte/Poster_Medizinprodukte_111124.pdf Webinar „Klinische Studien“, 19. Januar 2016 12 Aufbau Clinical Trial Template 4. Subjects/populations Beschreibung der Studienpopulation durch Ein- und Ausschlusskriterien: - möglicher Einschluss von besonderen Populationen wie Kindern und älteren Menschen - Erklärung, warum bestimmte Gruppen ausgeschlossen sind - Falls Untergruppen gebildet werden sollen – Erklärung dieser Gruppen Tipp: Patientenverbände / -vertreter ins Konsortium oder Advisory Board aufnehmen Webinar „Klinische Studien“, 19. Januar 2016 13 Aufbau Clinical Trial Template 5. Statistic analysis planning and power calculation Beschreibung und Begründung der Berechnung der Fallzahl/Gruppengröße: - Power calculation - Angaben zur statistischen Methodik und geplanten Analyse Tipp: Biometriker rechtzeitig einbinden; Konsortium sollte ein oder mehrere Einrichtungen mit Biometrie-Experten aufweisen, insbesondere bei großen Studien Webinar „Klinische Studien“, 19. Januar 2016 14 Aufbau Clinical Trial Template 6. Cumulative safety information Angaben zur Sicherheit und Verträglichkeit der geplanten Intervention, z.B.: - Präklinische Daten (in-vitro und in-vivo) - Vorangegangene Klinische Studien - Pharmakovigilanzsystem Webinar „Klinische Studien“, 19. Januar 2016 15 Aufbau Clinical Trial Template 7. Conduct 7.1 Schedule for study conduct including timelines for key study milestones - First patient / subject, First visit FPFV - Last patient / subject, First visit LPFV - Last patient / subject, Last visit LPLV - End of study – mit follow-up und Datenauswertung 7.2 Description of recruitment strategy Schätzung der Rekrutierungszahlen pro Monat pro Zentrum: basierend auf vorhanden (oder voraussichtlichen) Daten Webinar „Klinische Studien“, 19. Januar 2016 16 Aufbau Clinical Trial Template 7. Conduct 7.3 Assignment of intervention for controlled trial: Beschreibung der Methodik, wie Patienten / Teilnehmer den Gruppen zugeordnet werden und wie die Verblindung umgesetzt wird 7.4 Study management, monitoring, data and sample management - Strategie des Studienmanagements - Monitoringplan (Visiten, Quelldatenverifizierung etc) - Berichterstattung von Nebenwirkungen - Datensammlung und –management - Probenmanagement Webinar „Klinische Studien“, 19. Januar 2016 17 Aufbau Clinical Trial Template 7. Conduct 7.5 Sponsor, coordinating centre(s) and committees: - Angaben zum Sponsor - Rolle der einzelnen teilnehmenden Zentren - Ausschüsse: z.B. Data safety monitoring board, Ethics board 7.6 Study medication (investigational and non investigational medicinal products) Ggf. Angaben zu Herstellung und Kennzeichnung der Studienmedikation 7.7 Clinical Centres Liste der teilnehmenden Untersuchungszentren (Details folgen) Webinar „Klinische Studien“, 19. Januar 2016 18 Aufbau Clinical Trial Template 8. Orphan status Ggf. Nachweis, dass orphan designation beantragt ist oder vorliegt 9. Unit costs per patient Nur auszufüllen, falls unit costs (Fallpauschalen pro Patient) als Abrechungsmethode gewählt werden Tipp: Unit costs ausschließlich über die Methode der EU Kommission berechnen; diese Methode wird detailliert in “Annex 1: Method to determine the unit costs“ dargelegt (Seite 6-10 des Templates) Webinar „Klinische Studien“, 19. Januar 2016 19 Annex 2: Mandatory deliverables 1. 'First study subject approvals package' - vor Untersuchung des 1. Probanden: Final version of study protocol as approved by first regulator / ethics committee(s) Registration number of clinical study Approvals of ethics committees and (national) competent authority 2. 'All approvals package' = alle weiteren Genehmigungen an allen anderen Studienzentren 3. 'Midterm recruitment report' = wenn Hälfte der Studienpopulation rekrutiert wurde An overview of recruited subjects by study site, potential recruiting problems and, if applicable, a detailed description of implemented and planned measures to compensate delays in the study subject recruitment. 4. 'Report on status of posting results' Webinar „Klinische Studien“, 19. Januar 2016 20 Agenda • • • • • Klinische Studien Beschreibung im Antrag Einbindung von Studienzentren und Unteraufträge Berechnung der Unit Costs Ethik Tipps und Links Webinar „Klinische Studien“, 19. Januar 2016 21 Einbindung der Studienzentren 1. Partner (beneficiary) 2. Unterauftragnehmer 3. in-kind contributions provided by third parties against payment 4. Linked third parties Webinar „Klinische Studien“, 19. Januar 2016 22 Einbindung der Studienzentren Zentrum integriert als Vorteil Nachteil 1. Partner (beneficiary) Bevorzugte Option Klare Regeln Großes Konsortium: unflexibel Ggf. unerfahrene Partner 2. Unterauftragnehmer z.B. CRO Art. 13 GA Kleines Konsortium Einfach abzurechnen Profit möglich Keine Kernaufgaben Vergaberegeln beachten Task in DoA anzugeben 3. in-kind contributions provided by third parties against payment Art. 11 GA Kleines Konsortium Flexibel Unit costs oder actual costs Reporting wie Partner Angabe der 3rd party in DoA Vorab Regelung mit Partner nötig Profit nicht möglich 4. Implementation of action tasks by linked third parties – Art. 14 GA Kleines Konsortium Ganze action tasks durchführbar „linked“-Status muss nachgewiesen werden Profit nicht möglich Webinar „Klinische Studien“, 19. Januar 2016 23 Umgang mit Unteraufträgen (1) Wenn klinische Studie Hauptaktivität des Projekts ist: nicht in ihrer Gesamtheit als Unterauftrag, • Auslagerung gewisser Teile (GMP Produktion, Audit, Monitoring etc.) • Design, Planung, Überblick und intellektueller Input liegen klar bei den Projektpartnern • Budgetanteil ist nicht das ausschlaggebende Kriterium! Wenn klinische Studie nur kleiner Teil des Projekts: komplette klinische Studie könnte als Unterauftrag vergeben werden 'Akademische CROs' existieren (z.B. ECRIN Netzwerk, KKS) – diese könnten bereit sein, Partner im Konsortium zu werden Webinar „Klinische Studien“, 19. Januar 2016 24 Umgang mit Unteraufträgen (2) • Expertise für die klinische Studie sollte im Konsortium vertreten sein • Die Aufgabe (!) muss im Annex I definiert sein • Vereinbarter 'price per patient', Profit möglich • Kein overhead • bestes Preis/Qualität Verhältnis, Transparenz, Gleichbehandlung • Öffentliche Einrichtungen: interne Vorgaben und anzuwendendes Gesetz im Zusammenhang mit öffentlicher Beschaffung beachten Webinar „Klinische Studien“, 19. Januar 2016 25 Abrechnung von Unit Costs / Patient Webinar „Klinische Studien“, 19. Januar 2016 26 Quelle: EU Kommission Webinar „Klinische Studien“, 19. Januar 2016 27 Quelle: EU Kommission Webinar „Klinische Studien“, 19. Januar 2016 28 Was ist bei Unit Costs per Patient zu beachten? • gesetzliche Bestimmungen und Leitfäden von H2020 • Die Art der Abrechnung ist irrelevant für Begutachtung des Antrags! • unit costs und/oder actual costs Kombination möglich • jeder Partner/Studienzentrum entscheidet individuell • detaillierte vollständige Auflistung der Kosten pro Patient pro Arbeitsschritt basierend auf dem Protokoll der klinischen Studie nach Methode der EU Kommission Wenn angewendet: • Alle beteiligten Partner (die unit costs abrechnen) exakt die gleiche Auflistung, • für alle Patienten eines Zuwendungsempfängers! Ressourcen pro Patient gleich, Kosten können zwischen Partnern variieren • Grundlage für Berechnung: Kosten des letzten Rechnungsabschluss Ansprechpartner: EU-Referent / Verwaltung Webinar „Klinische Studien“, 19. Januar 2016 29 Kostenkategorien der unit costs Direkte Kosten a. Personal Ärzte Anderes medizinisches Personal Technisches Personal b. Verbrauchsmaterial c. Medizinische Ausstattung (Abnutzung und Instandhaltung) d. Andere für die Studie notwendige Service-Verträge und e. indirekte Kosten (25% der direkten Kosten) Ausgeschlossen: Anreise und Verpflegung von Probanden / Patienten Erstattung möglich unter “other direct costs” Webinar „Klinische Studien“, 19. Januar 2016 30 Berechnung der unit costs per patient Methode: Commission Decision C(2014) 1393 http://ec.europa.eu/research/participants/data/ref/h2020/other/legal/unit_costs/unit%20costs_clinical_studies.pdf Webinar „Klinische Studien“, 19. Januar 2016 31 Beispiel: Berechnung der Kosten für Personal Gesamte Personalkosten: = tatsächliche Gehälter aller Ärzte des Krankenhauses (oder medizin. / techn. Personal) + Sozialversicherungsbeiträge + andere Kosten, die im Gehalt enthalten sind und normalerweise Arbeitnehmern gezahlt werden oder sich aus nationalen Gesetzen ergeben (z.B. Weihnachtsgeld) • Ausgehend von 1720 Arbeitsstunden pro Jahr und basierend auf letztem Rechnungsabschluss (Jahr N-1) • Durchschnittliche Stundenkosten = • Bedingungen: Art. 6.1.A.1 H2020 model grant agreement Webinar „Klinische Studien“, 19. Januar 2016 Gesamte Personalkosten 1720 Std x Vollzeitäquivalente 32 Beispiel: Kosten einer HDL-Analyse von Blut 1. ist ein Task, dessen Teile exakt aufgelistet werden müssen (für alle Partner gilt die gleiche Liste) 2. Unit Costs müssen anhand der verschiedenen Kostenkategorien ermittelt werden - Personal (Ärzte, anderes medizinische / technisches Personal) - Verbrauchsmaterial - medizinische Ausstattung Webinar „Klinische Studien“, 19. Januar 2016 33 Agenda • • • • • Klinische Studien Beschreibung im Antrag Einbindung von Studienzentren und Unteraufträge Berechnung der Unit Costs Ethik Tipps und Links Webinar „Klinische Studien“, 19. Januar 2016 34 Ethische Aspekte Ethik gehört nicht ins Clinical study Template, sondern in den Antrag Quelle: EU Kommission Webinar „Klinische Studien“, 19. Januar 2016 35 Ethische Aspekte betreffen • Interventionen an Menschen • Probandenaufklärung (Informed consent) • Privatsphäre und Datenschutz • Verwendung menschlicher Proben und Daten • Tierversuche • Forschung in Entwicklungsländern (double standards) • Dual use (militärische Anwendbarkeit) Bei der Antragseinreichung wird der Ethics Issues Table ausgefüllt kritische ethische Punkte werden vom Antragsteller aufgelistet und der Umgang damit dargestellt (Ethics self assessment) – Anleitung hierfür im Teilnehmerportal Webinar „Klinische Studien“, 19. Januar 2016 36 Ethics Issues Table online AND Proposal section 5.1: In section 5.1 In sub-sections of section 5.1 (one for each issue ticked… see EC guide) In Annex „supporting docs“ Webinar „Klinische Studien“, 19. Januar 2016 37 Ethics Guide For each item in checklist: Info to be provided in section 5.1 Documentation to be provided in Annex “supporting documents” Webinar „Klinische Studien“, 19. Januar 2016 38 Ethics Review Verfahren Ethische Beurteilung in zwei Stufen 1. Ethics Screening (durch Evaluatoren, beurteilen ob Ethics Review erforderlich ist) 2. Ethics Review (durch Ethikkommission) – – – – Verwendung menschlicher embryonaler Stammzellen Interventionen an Kindern Forschung in Entwicklungs-/Drittländern Verwendung nicht-menschlicher Primaten • Ergebnis: Screening- oder Review-Report evt. nachträgliche Änderungen! • Erfordernisse werden in die Zuwendungsvereinbarung (GA) eingebaut • Ethik Audit möglich Webinar „Klinische Studien“, 19. Januar 2016 39 Informed Consent – Tipps zur Vorgehensweise • Demonstrieren Sie Verständnis für die Bedeutung der Probandenaufklärung • Beschreiben Sie das Prozedere der Probandenaufklärung • Klären Sie auch auf, wie die Privatsphäre & Datenschutz gewahrt werden • Erläutern Sie verständlich die Ziele und Verfahrensschritte der klinischen Studie • Nennen Sie absehbare Risiken und beschreiben den zu erwartenden Nutzen, bzw. wenn kein klinischer Nutzen für die involvierte Person zu erwarten ist. • Verfügbare Behandlungen / Kompensationen, falls Proband Schaden nimmt • Erläutern Sie mögliche Kosten für den Probanden im Rahmen der Studienteilnahme • Zeigen Sie auf, dass die Teilnahme an der Studie freiwillig ist. • Nennen Sie die Anzahl der Probanden, die an der Studie teilnehmen. • Wenn schriftliche Probandenaufklärung nicht üblich ist: erläutern Sie alternative Verfahren der Aufklärung: landesübliche Verfahren, mit Zeugen, Videos, etc. Webinar „Klinische Studien“, 19. Januar 2016 40 Datenschutz – Tipps zur Vorgehensweise • Dokumentieren Sie, dass Aufzeichnungen, die den Probanden eindeutig identifizieren, nach Vorschrift vertraulich behandelt werden und nicht öffentlich zugängig gemacht werden. • Befolgen Sie Datenschutz nach den EU-Regularien • Sofern Sie für Ihre Studie biologische Proben sammeln oder weiterverarbeiten, nennen Sie Name und Ort der Einrichtung, die diese Proben verwahrt. • Beschreiben Sie, wie lange die Proben verwahrt werden sollen und wer Zugang zu den Proben und den Ergebnissen hat. • Erläutern Sie, wie mit verwahrten, identifizierbaren Proben verfahren werden soll und welche Pläne zur Anonymisierung oder Zerstörung der Proben nach der Analyse bestehen Webinar „Klinische Studien“, 19. Januar 2016 41 Ethikvotum -ethics approval- für Klinische Studien Grundlage: Art. 34.2 Zuwendungsvereinbarung (GA) • • • Koordinator muss alle ethisch bedenklichen Aktivitäten melden, die nach nationalem Recht einer Prüfung / Genehmigung bedürfen Koordinator muss Ethikvotum vorlegen, das nach nationalem Recht nötig wäre ggf. eine Zusammenfassung in Englischer Sprache vorzulegen Webinar „Klinische Studien“, 19. Januar 2016 42 Tierversuchsvorhaben - erlaubte Zwecke: a) Grundlagenforschung; b) translationale oder angewandte Forschung mit einem der folgenden Ziele: i) Verhütung, Vorbeugung, Diagnose oder Behandlung von Krankheiten oder anderen Anomalien oder deren Folgen bei Menschen, Tieren oder Pflanzen; ii) Beurteilung, Erkennung, Regulierung oder Veränderung physiologischer Zustände bei Menschen, Tieren oder Pflanzen oder iii) das Wohlergehen der Tiere und die Verbesserung der Produktionsbedingungen für die zu landwirtschaftlichen Zwecken aufgezogenen Tiere; c) Entwicklung, Herstellung, Qualitäts-, Wirksamkeits- und Unbedenklichkeitsprüfung von Arzneimitteln, Lebensmitteln und Futtermitteln und anderen Stoffen oder Produkten; d) Schutz der natürlichen Umwelt zur Gesundheit/des Wohlergehens von Mensch oder Tier; e) Forschung im Hinblick auf die Erhaltung der Arten; f) Aus- und Fortbildung und g) forensische Untersuchungen Richtlinie: 2010/63/EU vom 22.09.2010 „zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere“ http://www.bfr.bund.de/cm/343/5_Beratung_Anlage%203_2010-63-EU.pdf Webinar „Klinische Studien“, 19. Januar 2016 43 Tierversuchsvorhaben – ethische Aspekte • Berechnung der Tierzahlen: wieviel Tiere sind nötig um fundierte Aussage zu erhalten • Wie wird das Wohlbefinden der Tiere gesichert? Endpunkte angegeben • Wie werden Leiden und Schmerz minimiert • Alternativen zum Tierversuch darlegen – bzw. warum keine in Frage kommen • Stichhaltige Leiden-Nutzen-Abwägung • Begründung für die Wahl der Tierart bzw. des Modells • Prinzip der 3 Rs: Reduce, Refine, Replace erläutern und implementieren Tierversuchsgenehmigung, Nachweis der Qualifizierung des Personals Ethik-Votum oder Einbeziehung eines Ethikexperten Einhaltung nationaler und EU-Gesetze (z.B. TierSchG, 2010/63/EU) Webinar „Klinische Studien“, 19. Januar 2016 44 Fehler bezüglich ethischer Aspekte bei der Antragstellung • Unterschätzung der Bedeutung ethischer Aspekte für das Forschungsvorhaben • Unzureichende, zu allgemeine Beschreibung von Interventionen an Mensch / Tier oder anderen sensiblen Bereichen • Datenschutz: keine klare Darstellung, wie Daten und Proben anonymisiert, geschützt und gespeichert / gelagert werden; wer kann später welche Daten nutzen? • Informed consent – sind Studienteilnehmer wirklich umfassend informiert?! • Wenn Kinder / nicht Einwilligungsfähige involviert sind: Nutzen-Risiko-Abwägung Webinar „Klinische Studien“, 19. Januar 2016 45 … und wie man sie vermeidet • Verständnis für ethische Belange des Vorhabens geht klar aus Antrag hervor • Alle Interventionen und ethische Implikationen werden detailliert dargestellt • Nationale und EU-Richtlinien werden im Antrag nicht nur erwähnt, sondern speziell mit dem Vorhaben in Verbindung gebracht • Ggf. Einbeziehung eines ethischen Beirats • Bei größeren ethischen Herausforderungen: separates Work Package • umfassend darlegen, wie die Probandenaufklärung erfolgt, wie mit Datenschutz und Privatsphäre umgegangen wird Webinar „Klinische Studien“, 19. Januar 2016 46 Weitere Tipps und Erfahrungen Webinar „Klinische Studien“, 19. Januar 2016 47 Experten begutachten klinische Studien sehr streng Je umfangreicher die Studie im Rahmen des Gesamtprojektes sein soll, desto mehr Informationen sollten Sie bereits zur Antragstellung liefern (können) • Begründung für die Studie: Hypothese und Ziel der Studie, Vorstudien • Angemessenheit Design & Methoden (Statistik, Endpunkte…) • notwendige Expertise & Erfahrung im Konsortium • Realistische Planung des Projekts: Nutzen Sie das CT Template zur Orientierung Fallzahlen und Zahl der Studienzentren / Rekrutierung / drop out Rückfallplan & Puffer für Verzögerungen Laufzeitverlängerung nicht möglich! • • • Nutzen Sie Unit Costs zur nationale & EU Vorgaben (2001/20/EG, 536/2014) & ICH Richtlinien sicheren Budgetrahmen entsprechend wählen – oft höhere Kosten als erwartet Kostenplanung Projekt auf das Wesentliche konzentrieren, nicht zu viele „Nebenschauplätze“ Webinar „Klinische Studien“, 19. Januar 2016 48 Kommentare von Gutachtern (1) • patient recruitment is weighted towards one major country • The applicants have chosen to focus on specific patient populations to develop a stratification tool. However, since [this disease] is a heterogenic disease, without further description it is unclear how the data generated in those conditions could be extended to the general [disease] population. • […] study will be conducted in a single country: the proponents fail to explain sufficiently how the results of this study will be used to infer conclusions to be valid for other European countries • The statistical representativeness of cohorts is not adequately worked out in the proposal. Results may be somehow biased. It will not be possible to make crossnational comparisons and to explore differences between regions in the EU. • proposal may not adequately take into account the variety of health care systems and organization of emergency services within the EU. The integration of the proposed model into existing health care systems is not well addressed. Webinar „Klinische Studien“, 19. Januar 2016 49 Kommentare von Gutachtern (2) • The effect sizes assumed to power the proposed studies were also deemed too optimistic given the heterogeneity of patients with multimorbidity. • Sample size seems to be too low for efficacy assessment • The clinical trial design does not seem to represent the best approach, i.e., including a placebo control group and an active comparator group […] would be more convincing. • There is insufficient explanation for the dosing selected […] for the proposed phase IIa study. The safety results at different doses of the phase I study should have been more explicitly stated, and the risky approach of using only a single dosing regimen as part of a phase IIa study should have been better justified • the efficacy criteria related to these exploratory analyses are not well defined • The definition of outcome measures and objectives […] are ambiguous, mainly because they will only be defined based on a literature search in WP2-WP4 […] Webinar „Klinische Studien“, 19. Januar 2016 50 Nutzen Sie Unterstützungsangebote bei Planung & Durchführung multinationaler Studien Beispiele • Netzwerke zur Durchführung klinischer Studien vor Ort und bei Partnern erfragen • In Deutschland z.B. Koordinierungszentren für Klinische Studien (KKS Netzwerk) • multinationale Studien: European Clinical Research Infrastructure Network (ECRIN) Webinar „Klinische Studien“, 19. Januar 2016 51 ECRIN: „akademisches“ CRO für klinische Studien Quelle: Health NCP Net 2.0, Webinar „Clinical Studies in H2020 proposals“, Vortrag: ECRIN http://www.healthncp.net/news-events/new-presentations-available-webinar-clinical-studies-horizon2020-proposals Webinar „Klinische Studien“, 19. Januar 2016 52 Leitfäden und Vorgaben der EU Kommission • Horizont 2020 Grants Manual: http://ec.europa.eu/research/participants/data/ref/h2020/grants_manual/pse/h2020-guidepse_en.pdf • Horizont 2020 Online Manual: http://ec.europa.eu/research/participants/docs/h2020-funding-guide/cross-cuttingissues/ethics_en.htm • Aktuelle Präsentation der EU Kommission zu Klinischen Studien https://ec.europa.eu/research/health/pdf/infoday_2015/clinical_studies_in_h2020.pdf • Clinical Trial template https://ec.europa.eu/research/participants/portal/doc/call/h2020/sc1-pm-01-2016/1677602essential_information_for_clinical_studies_en.pdf • Aktueller FAQ zu Topics der SC1 der DG Research & Innovation https://ec.europa.eu/research/participants/portal/doc/call/h2020/sc1-pm-01-2016/1697601faqs_v4_en.pdf Webinar „Klinische Studien“, 19. Januar 2016 53 Zuständige Behörden • Übersicht über nationale und europäische Gesetze und Behörden zu Arzneimitteln und Medizinprodukten: http://www.bmg.bund.de/fileadmin/dateien/Downloads/M/Medizinprodukte/Poster_Medizinprodukte_111124.pdf • Europäische Arzneimittelagentur (EMA): http://www.ema.europa.eu/ema/ • BfArM - Klinische Prüfung von Arzneimitteln: http://www.bfarm.de/DE/Arzneimittel/zul/klinPr/_node.html • Beratungsverfahren des BfArM http://www.bfarm.de/DE/Service/Beratungsverfahren/_node.html • Übersicht zuständiger Behörden und Stellen für Prüfungen von Medizinprodukten: http://www.dimdi.de/static/de/mpg/adress/index.htm • Informationen zu Verfahrensabläufen bei Anträgen auf klinische Prüfung am PaulEhrlich-Institut: http://www.pei.de/DE/infos/pu/genehmigung-klinische-pruefung/verfahrensablaeufe/klinische-pruefungen-verfahrensablaeufenode.html Webinar „Klinische Studien“, 19. Januar 2016 54 Rechtsgrundlagen • Deklaration von Helsinki: http://www.wma.net/en/30publications/10policies/b3/ • GCP-Verordnung: http://www.gesetze-im-internet.de/gcp-v/index.html • Leitlinie zur Guten klinischen Praxis (ICH-GCP): http://ichgcp.net/de • Europäische Richtlinie zu klinischen Studien 2001/20/EC bzw. Verordnung 536/2014: http://ec.europa.eu/health/human-use/clinical-trials/index_en.htm • Arzneimittelgesetz (AMG) http://www.gesetze-im-internet.de/amg_1976/ Webinar „Klinische Studien“, 19. Januar 2016 55 Ethik und Datenschutz • Hinweise und Anleitung zum Ethics Self Assessment in Horizont 2020 Projekten: http://ec.europa.eu/research/participants/docs/h2020-funding-guide/cross-cutting-issues/ethics_en.htm • Broschüre der EU KOM „Ethics for Researchers“: ftp://ftp.cordis.europa.eu/pub/fp7/docs/ethics-for-researchers.pdf • Präsentation DG Research & Innovation „Integrating Ethics in EU Research“ ftp://ftp.cordis.europa.eu/pub/fp7/docs/integrating-ethics.pdf • Internetseite zur Ethik in EU-Projekten: http://cordis.europa.eu/fp7/ethics_en.html • Empfehlungen zu klinischen Studien mit Kindern: ftp://ftp.cordis.europa.eu/pub/fp7/docs/ethicalconsiderations-paediatrics_en.pdf • Anleitung zum Informed Consent: http://ec.europa.eu/research/participants/data/ref/fp7/89807/informedconsent_en.pdf • Vorgaben zum Datenschutz: http://ec.europa.eu/research/participants/data/ref/fp7/89827/privacy_en.pdf • Arbeitskreis medizinischer Ethikkommissionen für u.a. Mustertexte, Checklisten, Probandeninformation / -einwilligung, Formulare für Anträge…: http://www.ak-med-ethik-komm.de/index.php/de/ Webinar „Klinische Studien“, 19. Januar 2016 56 Ansprechpartner/innen der NKS Gesundheit in der NKS Lebenswissenschaften Telefon 0228-3821-xxxx Heinrich-Konen-Str. 1 (Postadresse) Heinrich-Konen-Str. 5 (Besucheradresse) 53227 Bonn E-Mail: Internet: [email protected] www.nks-lebenswissenschaften.de Dr. Uta Baddack-Werncke -1692 Dr. Doris Bell -1708 Dr. Rebecca Breuer -1705 Dr. Lydia Kammler -1702 Jan Skriwanek -1677 Dr. Sabine Steiner-Lange -1690 Dr. Caroline Töx -2043 Anuscheh Vahabzadeh -1660 E-Mail: [email protected] Webinar „Klinische Studien“, 19. Januar 2016 57