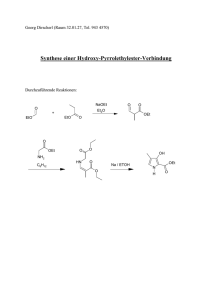
Synthese von Ni (salen) Herstellung des Liganden
Werbung

Nickelsalen-Komplex Versuche vom 11. 17 & 18. Mai 2005 Durchgeführt von Sebastian Ahles, Jörg Duschmalé & Stephan Steinmann Synthese von Ni (salen) Herstellung des Liganden Einleitung Der vierzähnige Chelat-Ligand N,N’-Bis-salicyliden-ethylendiamin bildet sehr stabile quadratisch planare Komplexe mit zweiwertigen Metallkationen. Er wird durch eine Reaktion von Salicylaldehyd mit Ethylendiamin hergestellt. Der Stickstoff greift nukleophil den Kohlenstoff der Aldehydgruppe an, worauf sich Wasser abspaltet. O OH 2 H H CH + H2N NH2 N OH N + 2 H 2O HO Material und Methoden - Ethanol, leicht entzündlich - Salicylaldehyd, gesundheitsschädlich, reizend - Ethylendiamin, ätzend Versuchsdurchführung Es wurden 1.7 ml Salicylaldehyd in 15 ml siedendem Ethanol in einem kleinen Erlenmeyerkolben gelöst. Zu der Lösung wurden 1.7 ml Ethylendiamin gegeben. Die Lösung wurde auf Raumtemperatur abgekühlt, wobei sich ein gelber Niederschlag bildete. Der Niederschlag wurde abfiltriert und im Exsikkator getrocknet. Resultate und Diskussion Das intensiv gelbe Salen zeigt einen einzigen, sehr starken Peak bei 406 nm. Das Spektrum wurde von einer Lösung in Ethanol aufgenommen und hat nur qualitativen Wert, da wir die Konzentration der Lösung nicht kennen. Sie war jedoch sehr gering, da wir sie mehrfach verdünnen mussten, bis der Peak in einen vernünftigen Bereich zu liegen kam. Dies deutet auf einen sehr hohen Extinktionskoeffizienten hin. 1 Version 1.0 Nickelsalen-Komplex Versuche vom 11. 17 & 18. Mai 2005 Durchgeführt von Sebastian Ahles, Jörg Duschmalé & Stephan Steinmann Absorption Spektrum von Salen 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0 340 390 440 490 540 590 640 690 740 nm Abbildung 1 UV-VIS Spektrum von 1,2 Bis-salicliden-ethylendiamin Die Ausbeute betrug 1.6482 g, was 76.1% entspricht. Dass wir uns bei der Berechung für die benötigte Menge Ethylendiamin verrechnet haben, sollte keinen grossen Einfluss auf die Reaktion gehabt haben, da wir zu viel, nämlich 1.7 ml statt 0.55 ml, verwendeten. Synthese des Ni(II)-Komplexes Einleitung Nickel bildet mit dem Salen-Liganden einen planaren Komplex. Es wird Nickelacetat verwendet um den Liganden zu deprotonieren. N H H H H N N N + 2+ 2+ Ni (OAc)2 OH HO + Ni O 2 HOAc O Material und Methoden - Nickelacetattetrahydrat, gesundheitsschädlich, kanzerogen - 1,2-Bis-salicyliden-ethylendiamin - Methanol, giftig, leicht entzündlich - Methylenchlorid, gesundheitsschädlich - Dieethylether, hochentzündlich 2 Version 1.0 Nickelsalen-Komplex Versuche vom 11. 17 & 18. Mai 2005 Durchgeführt von Sebastian Ahles, Jörg Duschmalé & Stephan Steinmann Versuchsdurchführung Es wurden 1.3311 g Salen in 40 ml Methanol suspendiert, die Suspension wurde erhitzt, ohne dass sich das Salen gelöst hätte. In 10 ml Methanol wurden 1.3901 g Nickelacetattetrahydrat gelöst und ebenfalls erhitzt. Die Lösung war grün. Beim Zusammengiessen der heissen Lösung und der heissen Suspension entstand sofort ein roter, relativ feiner Niederschlag. Die im Eisbad gekühlte Lösung wurde durch einen Papierfilter abfiltriert und trockengesaugt. Um das Produkt zu reinigen, wurden die Rohkristalle in circa 100 ml kochendem Methylenchlorid gelöst. Die Lösung wurde heiss filtriert, da sich der Komplex im Methylenchlorid löste, die Verunreinigungen, wie überschüssiges Salen, sich jedoch nicht lösten. Die Mutterlauge, die das Produkt enthielt wurde mit Ether versetzt, was die Ausfällung des Komplexes zur Wirkung hatte. Es wurde so viel Ether hinzugegeben, bis praktisch keine sichtbare Ausfällung mehr erfolgte. Der Komplex wurde jeweils durch einen Papierfilter abfiltriert und mit wenig Ether nachgewaschen. Das feinfasrige, rot-orange Produkt wurde an der Luft getrocknet. Es wurden 0.0082 g des Produktes eingewogen und in einem 100 ml Messkolben in Ethanol gelöst, was nicht sehr gut ging. So wurde eine 2.51·10-4 M Lösung erhalten. Resultate und Diskussion Die Ausbeute betrug 1.4617 g, was einer Ausbeute von 77.8 % entspricht, was innerhalb der von der Literatur angegebenen Werte von zwischen 60 und 90 % liegt. Die Schmelzpunktbestimmung ergab 342 °C (Literaturwert 345 °C), wobei beginnende Zersetzung zu beobachten war. Das Spektrum, das von einer Lösung in Ethanol aufgenommen wurde, zeigt einen Peak, mit einer erkennbaren Schulter sowie einer zweiten, die erahnt werden kann, wenn man sie, da sie in der Literatur beschrieben ist, sucht. Die Bestimmung des Extinktionskoeffizienten ergab folgende Werte: Wellenlänge [nm] Absorption Gemessener Wert: log ε 540 0.05946 2.37 440 0.66333 3.42 408 1.33627 3.73 Literaturwert logε 2.04 3.46 3.82 3 Version 1.0 Nickelsalen-Komplex Versuche vom 11. 17 & 18. Mai 2005 Durchgeführt von Sebastian Ahles, Jörg Duschmalé & Stephan Steinmann 1.6 1.4 Absorption 1.2 1 0.8 0.6 0.4 0.2 0 340 440 540 640 740 Wellenlänge [nm] Abbildung 2 UV-VIS Absorptionsspektrum des Nickel-Salen-Komplexes Sowohl die Schmelzpunktbestimmung als auch die erhaltenen Werte für die Extinktionskoeffizienten zeigen, dass das Produkt nicht ganz rein erhalten wurde. Die Werte der Extinktionskoeffizienten können auch etwas abweichen: Bei uns liegt der Peak eigentlich bei 403 nm, ob die anderen Koeffizienten eigentlich auch zu anderen Wellenlängen gehörten ist schwierig zu beurteilen, da die Umgebung in dieser Bereiche für uns keine Rückschlüsse dazu liefert. Ausserdem scheinen die Messwerte um 540 nm fehlerbehaftet zu sein, da es nicht anzunehmen ist, dass ein so unruhiges Spektrum normal ist. Wollte man diesen Wert genau bestimmen, so müsste man ein Spektrum einer wesentlich weniger verdünnten Lösung aufnehmen, was wir jedoch unterliessen. 1.45 Absorption 1.4 1.35 1.3 1.25 1.2 1.15 390 395 400 405 410 415 Wellenlänge [nm ] Abbildung 3 Peak um 403 nm 4 Version 1.0 Nickelsalen-Komplex 0.85 0.8 0.75 0.7 0.65 0.6 0.55 0.5 0.45 0.4 420 0.06 0.0595 Absorption Absorption Versuche vom 11. 17 & 18. Mai 2005 Durchgeführt von Sebastian Ahles, Jörg Duschmalé & Stephan Steinmann 0.059 0.0585 0.058 0.0575 430 440 450 460 0.057 530 535 Wellenlänge [nm ] Abbildung 4 Schulter um 440 nm 540 545 550 555 Wellenlänge [nm ] Abbildung 5 Schulter um 540 nm Rückgewinnung des Nickels Einleitung Der Nickel-Salen Komplex wird durch die Einwirkung einer starken Säure zerstört, da erstens der Ligand protoniert wird und zweitens auch zersetzt wird. Wie das Zersetzungsprodukt genau aussieht, ist uns unbekannt. Material und Methoden - Salzsäure, 37%, ätzend Versuchsdurchführung Zu 1.2624 g des Komplexes wurde so viel HCl hinzugegeben, bis der sich bildende, zuerst noch grünliche Niederschlag weiss war, da erst dann davon ausgegangen werden kann, dass der Nickel aus dem Niederschlag entfernt wurde. Die Lösung selbst war grünlich. Durch Abnutschen wurde der Niederschlag von der Lösung getrennt. Da sich der Niederschlag nicht in organischen Lösungsmitteln löste, wurde er in Wasser gelöst und entsorgt. Die grüne Lösung wurde in der Kapelle auf circa einen Drittel eingeengt, dabei wurde viel HCl Gas frei gesetzt. Die so entstandene konzentriertere Lösung von Nickelchlorid wurde zum Eindunsten in der Kapelle stehen gelassen. 5 Version 1.0 Nickelsalen-Komplex Versuche vom 11. 17 & 18. Mai 2005 Durchgeführt von Sebastian Ahles, Jörg Duschmalé & Stephan Steinmann Resultate und Diskussion Da sich der Niederschlag nicht in organischen Lösungsmitteln löste, ist anzunehmen, dass der Stickstoff protoniert wurde und ein Chloridsalz bildete. Die Ausbeute an Nickelchlorid betrug 0.8202 g oder 93.7 %. Zurückgerechnet auf die ursprüngliche Menge eingesetztem Nickelacetat ergibt sich eine prozentuale Rückgewinnung von 60.5 %. Der grösste Teil der Ausbeute ging bei der Umkristallisation, bzw. dem Fällen mit Ether verloren: Die Mutterlauge blieb sehr farbig, obwohl Zugabe von mehr Ether keine sichtbare Veränderung mehr bewirkte. 6 Version 1.0