Synthese einer Hydroxy-Pyrrolethylester-Verbindung
Werbung
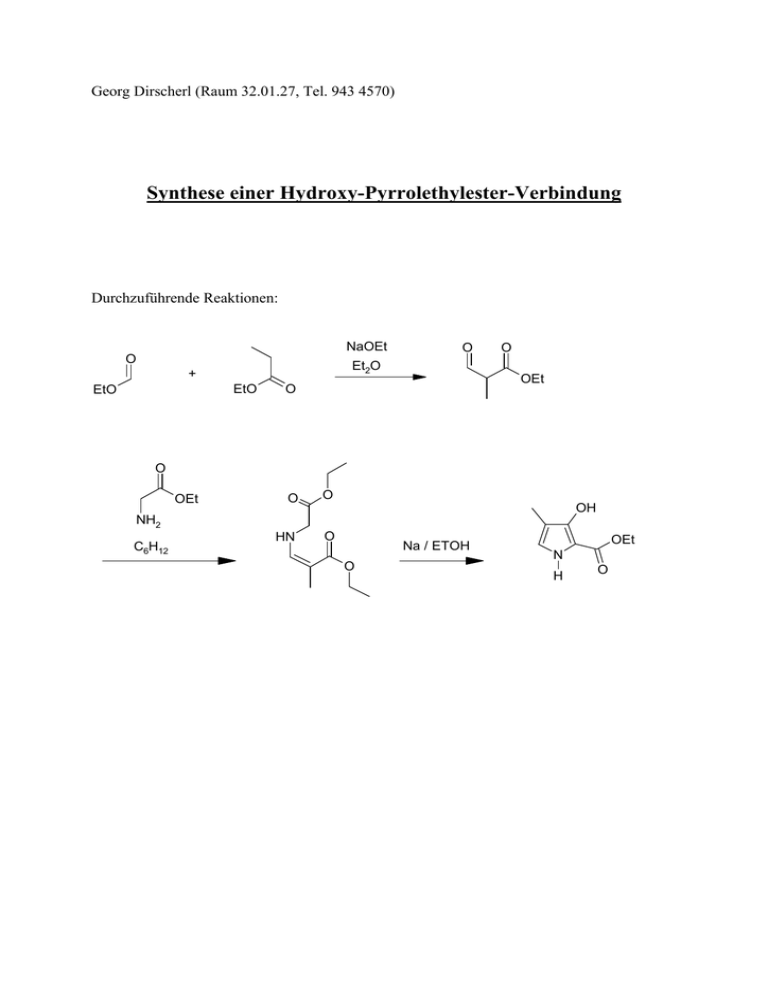
Georg Dirscherl (Raum 32.01.27, Tel. 943 4570) Synthese einer Hydroxy-Pyrrolethylester-Verbindung Durchzuführende Reaktionen: NaOEt O Et2O + EtO EtO O O OEt O O OEt O O HN O OH NH2 C6H12 Na / ETOH O OEt N H O 1. Synthese von 2-Methyl-3-oxo-propionsäureethylester: O O + EtO NaOEt EtO OEt Et2O O 130.14 C6H10O3 102.13 74.08 C5H10O2 C3H6O2 O Literatur: Chong, R.; Clezy, P. S. Aust. J. Chem. 1967, 20, 935-950. Ansatz: I) Name M [gmol-1] Ethylformiat 74,08 59264,0 800,00 102,13 81704,0 800,00 68,05 54440,0 800,00 II) Propionsäureetylester III) NaOEt d [gcm-3] m [mg] V [ml] n [mmol] Durchführung: Ein Gemisch aus Ameisensäureetylester (I) und Propionsäureetylester (II) wird zu einer Suspension von NaOEt (III) in 300 mL wasserfreien Ether getropft und 2 h bei RT gerührt (KPG-Rührer). Unter Eiskühlung werden 200 mL Wasser zugegeben und von der etherschen Schicht abgetrennt. Die wässrige Lösung wird – unter Eiskühlung und langsam (Tropftrichter, da ca. 100 mL HCl) – mit halbkonzentrierter HCl angesäuert. Anschließend wird 3 x mit je 200 mL Ether extrahiert und die gesammelten organischen Phasen mit je 200 mL 10 %iger Na2CO3-Lsg und anschließend mit Wasser gewaschen. Anschließend wird das Lösungsmittel im Vakuum entfernt und das so erhaltene gelbliche unter Vakuum fraktioniert destilliert. (Sdp. 61°C bei 16 mbar, Ausbeute ca. 20%) Analytik: 1H-NMR (CDCl3) Bemerkungen: • • Der eingesetzte Diethylether muss wasserfrei sein. Eventuell muss zuvor über NaH (Natriumhydriddispersion 4g/L frisch destilliert werden). Die Reaktion erfolgt unter N2-Schutzgas, d.h. es müssen vor Beginn der Reaktion die Glasgefäße ausgeheizt werden. 2. Synthese von 3-Ethoxycarbonylmethylimino-2-methyl-propionsäureethylester: O O O O Et + 1 3 0 .1 4 C 6H 10O 3 H2N C 6H 12 O O HN O O Et 103.1 2 C 4H 9N O 2 O 215.2 5 C 10H 17N O 4 Literatur: Chong, R.; Clezy, P. S. Aust. J. Chem. 1967, 20, 935-950. Durchführung: Eine Lösung aus dem in Stufe eins dargestellten 2-Methyl-3-oxo-propionsäureethylester und eine äquivalente Menge an Glycinethylester, das frisch aus dem Hydrochlorid freigesetzt wird, in 250 ml Cyclohexan, werden 6 h am Wasserabscheider refluxiert. Das Lösungsmittel wird abrotiert und das Rohprodukt unter Vakuum fraktioniert destilliert, man erhält die gewünschte Verbindung in 81% Ausbeute als gelbliches Öl (Sdp. 154°C bei 0.5 mbar). Freisetzung des Glycinethylesters aus dem Hydrochlorid: • • • • • • Glycin-ethylester-hydrochlorid in Ether suspendieren (ca. 20 g für 100 mL Ether) Ammoniak aus Druckgasflasche einleiten NH4Cl abfiltrieren Organische Phase über MgSO4 trocknen Fraktionierte Destillation (Sdp. ca. 44°C bei 10 mbar) Aufbewahrung: mit Schlifffett im Eisfach, ansonsten Lactonisierung Analytik: 1H-NMR (CDCl3) 3. Synthese von 3-Hydroxy-4-methyl-1H-pyrrol-2-carbonsäureethylester: O O OH Na / ETOH HN OEt O N H O O 169.18 215.25 C8H11NO3 C10H17NO4 Literatur: Chong, R.; Clezy, P. S. Aust. J. Chem. 1967, 20, 935-950. Durchführung: Zu einer Lösung aus 1.2 eq Natrium in 125 ml EtOH wird die in der zweiten Stufe dargestellte Schiffsche Base gegeben (1 eq) und 2.5 h refluxiert. Das Lösungsmittel wird im Vakuum entfernt, der verbleibende Rest in 150 ml H2O aufgenommen, 20 min gerührt, die Lösung abfiltriert und unter Eiskühlung mit 3 N HCl f pH 1-2 angesäuert. Der Niederschlag wird abfiltriert und im Hochvakuum getrocknet. Anschließend wird das Rohprodukt in 100 ml MeOH umkristallisiert, wobei von einem unlöslichen Niederschlag abfiltriert wird. Durch Einengen der Mutterlauge kann weiteres Produkt zu insgesamt 41% gewonnen werden. Analytik: 1H-NMR (CDCl3) Bemerkungen: • Die Reaktion erfolgt unter N2-Schutzgas, d.h. es müssen vor Beginn der Reaktion auch die Glasgefäße ausgeheizt werden.