Organische Chemie IV: Heterocyclen
Werbung

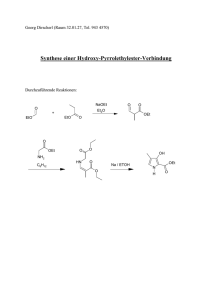
Organische Chemie IV: Heterocyclen Wintersemester 2002 / 2003 – Technische Universität München Klausur am 06.02.2003 1315 –1445 h ___________________________________________________________________________ Name; Vorname .......................................................................... Matrikel-Nr. .......................... (Druckbuchstaben) geboren am ............................. in ................................................................. ............................................................ (Eigenhändige Unterschrift) ___________________________________________________________________________ Hinweise zur Klausur: 1. Die Klausur besteht aus insgesamt 13 Blättern (Deckblatt plus Aufgabenblätter). Bitte kontrollieren Sie sofort, ob die Klausurunterlagen vollständig sind. 2. Bitte nur die vorgedruckten Bögen (einschließlich Rückseite) benutzen. Antworten sind zu kennzeichnen, sonst werden sie nicht bewertet. Bitte kurze Antworten! 3. Es sind keine Hilfsmittel erlaubt. Täuschungen und Täuschungsversuche führen zum Nichtbestehen der Klausur. 4. Bitte schreiben Sie mit einem Kugelschreiber oder Füller. Verwenden Sie keinen Bleistift und keine rote Tinte! 5. Jede richtig und vollständig beantwortete Aufgabe wird mit der jeweils angegebenen Anzahl von Punkten bewertet. Es können Teilpunkte gegeben werden. Die Klausur ist bestanden, wenn mindestens 50 Punkte erreicht worden sind. 1 2 3 4 5 6 7 8 9 10 Σ 14 8 24 8 8 8 6 6 6 12 100 NOTE: Seite 1 Aufgabe 1: (14P) S oder O S O B O O C A 1.Ph3P=CH2 2. MCPBA o.ä. (2+3P) Das cyclische Keton Α soll zu den beiden diastereomeren Epoxiden B und C umgesezt werden. Geben Sie mögliche Reaktionsbedingungen an! Produkt B soll anschließend mit folgenden Reagenzien weiter umgesetzt werden. Geben Sie hierfür jeweils die Reaktionsprodukte an! Achten Sie dabei auch auf die Regioselektivität und begründen Sie diese kurz. ( je 2+3P) O Al N OH nur ein syn-H für Deprotonierung O Me 2CuLi OH sekundäres C leichter zugänglich O LDBB OH Bildung des primären Carbanions günstiger Seite 2 Aufgabe 2: (8P) Durch Verwendung von 8-Phenylmenthol als chiralem Auxiliar wird in der photochemischen Reaktion von 1 mit dem Alken 2 faciale Diastereoselektivität induziert. Welches Produkt wird hierbei bevorzugt gebildet? Begründen Sie kurz Ihre Antwort, indem Sie die Regioselektivität und faciale Diastereoselektivität der Reaktion erklären! Wie lautet der Name der Reaktion? Ph O O Ph O 1 OEt + hν, λ = 300 nm R*OOC OEt Ph OEt OEt O 2 (3P) (1P) Name der Reaktion: Paterno Büchi Reaktion Regioselektivität: Bildung des stabilsten Biradikals: Ph O O Ph OEt O OEt Faciale Diastereoselektivität: Phenylrest schirmt Rückseite ab, Angriff des Alkens von vorne (4P) Seite 3 Aufgabe 3: (24P) Ergänzen Sie die in den Kästchen fehlenden Edukte, Produkte bzw. Reagentien! (je 3P) 3.1 O O COOMe ∆T S COOMe S 3.2 O Cl Cl Ph + N Ph Cl Cl Cl NEt3 Ph H (C6H6) N O Ph 3.3 OH · t O Ag BF4 Me (CHCl3) Bu 3.4 1. Hg(OAc)2, (THF) 2. NaBH4 NH Ac N Ac 3.5 CO 2Me O O 1. PPTS (Aceton/W) OHC MeO2 C 2. ( NH4)2CO 3 (DMF/H2 O), 120 °C N H PPTS = Pyridiniumpara-Toluolsulfonat 3.6 P4S10 v MeO O Br O Br MeO Lawesson-Reagenz S O O Seite 4 3.7 Mes N PhO N Mes Ru Ph N Cl SO 2Ph N Cl PCy3 SO2Ph 3.8 SnBu3 Ph 200 °C N O SnBu3 SnBu 3 Bu 3Sn O Seite 5 Aufgabe 4: (8P) Die Heck Reaktion kann asymmetrisch durchgeführt werden: [M(dba)2](3 mol %) [L](6 mol%) OTf + (i Pr) 2NH, 30°C (Benzol) ee > 90% O O 1 O 2 4.1 Markieren sie das verwendete Metall (M)! (2P) Ru Mn Rh Pd X 4.2 Wählen Sie einen sinnvollen Liganden (L)! (2P) OR O Ph2P O N O N R N N N OH HO t-Bu t-Bu Ph2P N R R t-Bu t-Bu X 4.3 In dieser Reaktion entsteht als Nebenprodukt 2. Erklären Sie kurz warum, und skizzieren Sie den Mechanismus der Reaktion. (4P) II Mechanismus : R-OTf + Pd(0) -> R-Pd -OTf Oxidative Addition H Pd-R Pd H R H O O O H Syn-Addition Pd und Ar 2 R Syn-Eliminierung PdH H PdH O O Pd H R H O O R R Seite 6 Aufgabe 5: (8P) 5.1 Das tetrasubstituierte Thiophen A kann gut über eine Hinsberg-Synthese hergestellt werden. Geben Sie hierfür die Edukte an! Ph Ph O EtO 2C S CO2Et + Ph Ph HO2C S O CO 2Et A (3 + 3P) 5.2 Die Hinsberg Reaktion ist besonders gut geeignet, um 3,4 disubstituierte Thiophene herzustellen. Wie würde sich das primär gebildete Thiophen A in ein entsprechendes Produkt überführt lassen? Durch eine... .(2 P) Oxymercurierung und anschließende Hydroborierung x Verseifung und anschließende Decarboxylierung Hydroformylierung und anschließendes Steamcracken Keto-Enol Tautomerie mit anchließender Walden-Umkehr Bildung des gemischten Anhydrids und anschließende Hydrierung Seite 7 Aufgabe 6: (8P) In der van Leusen-Synthese wird zum Aufbau von Fünfring-Heterorcyclen ein Reagenz mit der Abkürzung „TosMIC“ eingesetzt. 6.1 Kennzeichnen Sie, bei welcher der folgenden Strukturen A-D es sich um TosMIC handelt! N S O O NC S O O A NC S O O B NC S O O C D X 6.2 Die abgebildeten Heterocyclen 1-3 können durch die van Leusen-Synthese dargestellt werden. Markieren Sie, welche der Atome in 1-3 aus dem Edukt „TosMIC“ stammen. COOEt N N N H O N H 1 2 3 Seite 8 N3 Aufgabe 7: (6P) Abgebildet ist die Synthesesequenz zur Darstellung eines C2-symmetrischen Bisoxazolins, das in der enantioselektiven Katalyse als Ligand eingesetzt wird. Ergänzen Sie die in den Kästchen fehlenden Produkte! Ph N N N N SOCl 2 O HO O O O Cl HN NH Ph Ph O OH OH NEt 3, CH 2Cl 2 O Cl N N 1. MsCl, NEt3 2. NaOH, EtOH/H2 O O O HO H2N O OH N N 2 eq. O O N Ph N O Ph Seite 9 Aufgabe 8: (6P) Nifedipin A wird in der Behandlung von Hypertonie und Angina pectoris eingesetzt. Als Dihydropyridin ist es Zwischenprodukt einer Hantzsch´schen Synthese. Ergänzen Sie! NO 2 H2O/H2SO4 NO2 H CHCl2 O H N O O 2 OMe MeOOC COOMe O2 N NH3 A Seite 10 Aufgabe 9: (6P) In der folgenden Reaktion wird ein Pyridinring in einem Schritt aufgebaut. Geben sie den Reaktionspartner an und skizzieren Sie den Mechanismus durch Angabe des durchlaufenen Bicyclus! EtO2C N CO2Et EtOOC N COOEt N Br EtO2C N COOEt Br N ∆, (CHCl3) via: N COOEt N COOEt N N EtOOC Br Seite 11 Aufgabe 10: (12P) Pyrrole lassen sich wie fast alle Heterocyclen über eine Fülle von Kondensationsreaktionen darstellen, die sich nur in der jeweiligen Bindungsknüpfung und darin unterscheiden, dass Wasser aus verschiedenen Positionen heraus eliminiert wird. Zeigen Sie anhand von drei Beispielreaktionen, aus welchem Vorläufer Pyrrole zugänglich sein sollten, wenn man retrosynthetisch Wasser addiert. Zeigen Sie, welche Bindungen neu geknüpft wurden, indem Sie die retrosynthetische Analyse fortsetzen. Nennen Sie ein konkretes Beispiel für die von Ihnen retrosynthetisch beschriebene Reaktion, wobei Sie auch die Reagentien angeben. Zum besseren Verständnis sei hier eine Beispiellösung für Oxazole angegeben: N HO H N O H2N OH O H O O Br O Cl HCOOH N NH4+ HCOO - O Seite 12