Organische Chemie
Werbung
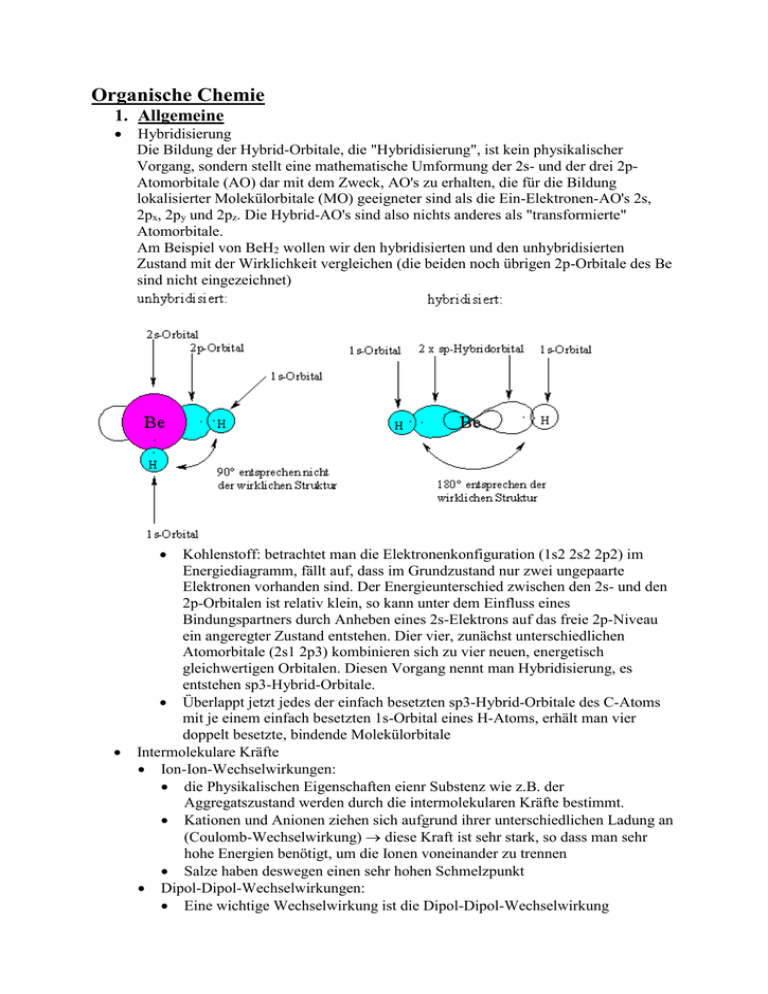
Organische Chemie 1. Allgemeine Hybridisierung Die Bildung der Hybrid-Orbitale, die "Hybridisierung", ist kein physikalischer Vorgang, sondern stellt eine mathematische Umformung der 2s- und der drei 2pAtomorbitale (AO) dar mit dem Zweck, AO's zu erhalten, die für die Bildung lokalisierter Molekülorbitale (MO) geeigneter sind als die Ein-Elektronen-AO's 2s, 2px, 2py und 2pz. Die Hybrid-AO's sind also nichts anderes als "transformierte" Atomorbitale. Am Beispiel von BeH2 wollen wir den hybridisierten und den unhybridisierten Zustand mit der Wirklichkeit vergleichen (die beiden noch übrigen 2p-Orbitale des Be sind nicht eingezeichnet) Kohlenstoff: betrachtet man die Elektronenkonfiguration (1s2 2s2 2p2) im Energiediagramm, fällt auf, dass im Grundzustand nur zwei ungepaarte Elektronen vorhanden sind. Der Energieunterschied zwischen den 2s- und den 2p-Orbitalen ist relativ klein, so kann unter dem Einfluss eines Bindungspartners durch Anheben eines 2s-Elektrons auf das freie 2p-Niveau ein angeregter Zustand entstehen. Dier vier, zunächst unterschiedlichen Atomorbitale (2s1 2p3) kombinieren sich zu vier neuen, energetisch gleichwertigen Orbitalen. Diesen Vorgang nennt man Hybridisierung, es entstehen sp3-Hybrid-Orbitale. Überlappt jetzt jedes der einfach besetzten sp3-Hybrid-Orbitale des C-Atoms mit je einem einfach besetzten 1s-Orbital eines H-Atoms, erhält man vier doppelt besetzte, bindende Molekülorbitale Intermolekulare Kräfte Ion-Ion-Wechselwirkungen: die Physikalischen Eigenschaften eienr Substenz wie z.B. der Aggregatszustand werden durch die intermolekularen Kräfte bestimmt. Kationen und Anionen ziehen sich aufgrund ihrer unterschiedlichen Ladung an (Coulomb-Wechselwirkung) diese Kraft ist sehr stark, so dass man sehr hohe Energien benötigt, um die Ionen voneinander zu trennen Salze haben deswegen einen sehr hohen Schmelzpunkt Dipol-Dipol-Wechselwirkungen: Eine wichtige Wechselwirkung ist die Dipol-Dipol-Wechselwirkung Aceton (2-Propanon) bildet aufgrund des Elektronegativitätunterschiedes zwischen dem Sauerstoffatom und dem Kohlenstoffatom in der C=ODoppelbindung einen Dipol aus in Lösung orientieren sich die Acetonmoleküle aufgrund der Dipol-DipolWechselwirkungen Als Ergebnis erhält man ein polar aprotisches Lösungsmittel mit hohem Löungsvermögen für polare Verbindungen Wasserstoffbrücken-Bindung: Wasserstoff-Brückenbindungen können zwischen Molekülen auftreten, die an einem elektronegativen Atom (O oder N) einen oder mehrere Wasserstoffatome tragen. Die Bindung zwischen elektronegativen Atom und Wasserstoffatom ist stark in Richtung des elektronegativen Atoms verschoben Wasserstoff partiell positiv und kann mit partiell negativen Atomen von anderen Molekülen in Wechselwirkung treten Wasserstoffbrücken-Bindungen führen ähnlich wie bei der ionischen Bindung zu einer Siedepunkt- und Schmelzpunkterhöhung Van der Waals’sche Kräfte: in allen Atomen und Molekülen entstehen durch Schwankungen in der Ladungsdichte der Elektronenhülee fluktuierende Dipole im Nachbaratom werden durch diese momentan vorhandenen Dipole gleichgerichtete Dipole induziert, so dass eine Anziehung entsteht mit zunehmender Größe der Moleküle bzw. Atome lassen sich die Elektronen leichter verschieben und lassen sich so leichter Dipole induzieren und die Van der Waals-Anziehung nimmt zu Acidität und Basizität (Brönsted und Lewis) o Brönsted-Säuren sind Substanzen, die H+-Ionen abgeben können o Brönsted-Basen sind Substanzen, die H+-Ionen aufnehmen können o Lewis-Säuren sind Elektronenpaarakzeptoren o Lewis-Basen sind Elektronenpaardonoren Lösungsmittel (polar, nichtpolar, protisch, apotisch) o die Löslichkeit eines Moleküls in einem Lösungsmittel wird durch die Wechselwirkung des Moleküls mit dem Lösungsmittel bestimmt o Polare Stoffe können sich besonders gut in polaren Lösungsmitteln lösen o wichtigste Eigenschaft eines Lösungsmittels ist Polarität wichtig dafür ist die Ladungsverteilung im Molekül; diese tritt auf, wenn Element verschiedener Elektronegativität miteinander verbunden sind; je höher die Differenz, desto größer die Polarität der Bindung o unpolar: wenn Ladungsverteilung symmetrisch um das Molekülzentrum angeordnet ist 2. Alkane und cyclische Alkane Isomerie o Isomere sind alle Verbindungen mit gleicher Summenformel, aber verschiedenen physikalischen und chemischen Eigenschaften unterschiedlicher Komplex!!! o man unterschiedet die folgenden Isomeriearten: Konstitutionsisomere = Strukturisomere(gleiche Summenformel, unterschiedliche Atomabfolge) Stereoisomere (gleiche Summenformel, gleiche Atomabfolge) Konfigurationsisomere (nicht durch Drehung von Bindungen ineinander überführbar) o Enantiomere (Bild und Spiegelbild, lassen sich nicht zur Deckung bringen) o Diastereomere (verhalten sich nicht wie Bild und Spiegelbild) Tosionsisomere (durch Drehungen von Bindungen ineinander überführbar) o Konformere (durch Drehung von Einfachbindungen ineinander überführbar) o cis-trans-Isomere = geometrische Isomere (durch Drehung einer Doppelbindung ineinander überführbar Konformationen von Ethan und Butan o Alkane besitzen sp3-hybridisierte C-Atome, d.h. sie besitzen nur Einfachbindungen. Um diese ist eine Rotation relativ einfach möglich. Durch diese Drehung entstehen Isomere (gleiche Summenformel, aber unterscheidbare Moleküle). Die Drehung um Einfachbindungen ist ein Spezialfall der Isomerie, man nennt sie Konformationsisomerie. o Die Rotationbarriere beträgt 12,5 kj/mol, d.h. bei Raumtemperatur drehen sich die Methylgruppen schnell aneinander vorbei. Die Drehung wird am besten in der Newman-Projektion erkennbar. Hierbei schaut man entlang der zu drehenden Bindung. Das vordere C-Atom wird als Punkt und das hintere CAtom als Kreis dargestellt. o Konformationsisomere, die sich in einem Energieminimum befinden, nennt man Konformere. Das Ethan besitzt ein Konformer, nämlich die gestaffelte Konformation. Die ekliptische Konformation ist ein Übergangszustand und besitzt keine Lebensdauer. o Betrachtet man die Konformationsisomere des Butans, wenn man entlang der C2-C3-Bindung schaut, so erkennt man, daß jetzt zwei energetisch unterschiedliche Konformere existieren. Nomenklatur o vom einfachsten möglichen Kohlenwasserstoff, dem Methan CH4, lassen sich durch hinzufügen von –CH2-Gruppen die längerkettigen, gesättigten Alkane ableiten o Summenformel der Moleküle: CnH2n+2 o mit Ausnahme der ersten vier Glieder werden die Namen von der griechischen (bzw. lateinischen) Bezeichnung für die Zahl der C-Aomte abgeleitet o Mathen, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan... o Zur systematischen Nomenklatur von komplexen Molekülen werden die IUPAC-Regeln verwendet: Alle Alkane enden mit der Silbe –an. Die Namen der Alkylgruppen ergeben sich aus den enstprechenden Alkanen, indem die Endung –an durch –yl ersetzt wird o verzweigte Alkane können mit folgenden Regeln benannt werden: 1. Suchen sie die längst zusammenhängende Kette von C-Aomten im Molekül und benennen sie diese 2. bestimmen sie den Namen der an die längste Kette gebundenen Alkylgruppen 3. Nummerieren sie die C-Atome der längsten Kette von dem Ende her, das einem Substituenten am nächsten ist 4. schreiben sie den Namen des Alkans, indem sie die Namen der Seitenketten in alphabetischer Reihenfolge ordnen, und fügen sie den Namen des Stammalkans an. Den Alkylgruppen wird dabei noch die Nummer des C-Atoms, an das es gebunden ist, vorausgestellt. Wenn eine Alkylgruppe mehrfach auftritt, wird durch die Vorsilbe Di-, Tri-, Tetra...angezeigt, wie oft das aber nicht bei alphabetischer Reihenfolge berücksichtigen Ringspannung und die Struktur von Cyclohexanen Cyclohexan besitzt eine spannungsfreie Sesselkonformation. Es ist daher die in der Natur am weitesten verbreitete Ringstruktur (z.B. Zuckermoleküle (Pyranosen) und Steroidringsysteme). Aufgrund der Sesselstruktur können optimale Bindungswinkel für sp3-C-Atome (109º) eingehalten werden. Die H-Atome stehen ekliptisch zueinander, d.h. die Ringspannung und die Pitzerspannung sind minimal. Dies kann man besonders gut in der Newman-Projektion sehen. Neben der Sesselform des Cyclohexanrings existieren weitere Konformationsisomere: Halbsessel-, Twist- und Wannenform. Dabei bilden die beiden Sessel- und die Twistform Energieminima. Betrachtet man die Bindungen am Cyclohexan, erkannt man zwei verschiedene Richtungen der Bindungen, nämlich axial und equatorial. Axiale Bindungen stehen (mehr oder weniger) senkrecht zur Ringebene. Die equatorialen Bindungen sind in der Ringebene. Beim Überführen der Sesselkonformationen ineinander wandeln sich alle axialen Bindungen in equatoriale Bindungen um und umgekehrt. Polycyclische Alkane, Steroide o den Steroiden liegt ein tetracylischer Kohlenstoff, das Steran zugrunde o Steran setzt sich aus drei Cyclohexanringen und einem Cyclopentanring zusammen, die anelliert sind, was bedeutet, dass benachbarte Ringe jeweils zwei C-Atome gemeinsam haben o Vom Steran kommt man zum Steroid durch Anfügen von Substituenten, wie z.B. zwei Methylgruppen Pyrolyse, Verbrennung der Alkane die wahrscheinlich wichtigste Reaktion der Alkane aus Erdöl und Erdgas ist ihre Verbrennung mit einem Überschuss an Sauerstoff zu Kohlendioxid und Wasser. Auch diese Reaktion läuft radikalisch ab. es werden erhebliche Mengen an Energie als Wärme frei, die man direkt verwendet (Heizung) oder mit Verlusten in andere Energieformen umwandelt mit einer allgemeinen Formal kann man bei einem beliebigen Kohlenwasserstoff die stöchiometrischen Faktoren der Oxidation rasch ermitteln 2 CnH2n+2 + (3n+1)O2 2n CO2 + (2n+2)H2O -ΔH (Verbrennungswärme) Ein im Verbrennungsmotor auftretendes Problem ist die Fehlzündung. Sie tritt hauptsächlich bei Gemischen mit geradkettigen Alkanen auf. Je höher die Octanzahl eines Gemisches, umso weniger Fehlzündungen gibt es. Radialische Chlorierung von Methan o Alkane und Chlor sind nebeneinander beständig; beim Erhitzen oder Belichten (UV-Licht) findet hingegen eine explosionsartige Umsetzung statt als Ergebnis werden einfach und mehrfach chlorierte Kohlenwasserstoffe gefunden o so entsteht z.B. aus Methan zunächst Methylchlorid und daraus über zwei weitere Zwischenschritte schließlich Tetrachlorkohlenstoff o Allgemein ausgedrückt wird ein H-Atom im Kohlenwasserstoff durch ein Chloratom ersetzt, es entsteht ein Alkylchlorid Substitution o im UV-Licht dissoziieren einige Chlormoleküle in Chloratome, die Radikale sind greifen Kohlenwasserstoffmolekül an, entreißt ihm ein H-Atom und bildet das stabile HCl sowie ein Alkylradikal dieses kann nun mit ChlorMolekül (Cl2) reagieren ein Chloratom binden und das zweite als ChlorRadikal freisetzen Ketteneffekt mögliche Kettenabbrüche sind die Reaktionen von zwei Radikalen miteinander (Rekombination) 3. Stereoisomerie Stereoisomere (gleiche Atomabfolge) Konfigurationsisomere (nicht durch Drehung von Bindungen ineinander überführbar) o Enantiomere Bild und Spiegelbild, lassen sich nicht zur Deckung bringen Verbindungen mit dieser Eigenschaft werden auch als chirale Verbindungen bezeichnet sie haben die gleichen physikalischen Eigenschften, aber unterschiedliche Vorzeichen für den betragsmäßig gleichen Drehwert die überwiegende Zahl der Reaktionen verläuft zwischen chiralen Reaktionspartnern, z.B. enzymatische Reaktionen Diastereomere (Konfigurationsisomere (nicht durch Drehung von Bindungen ineinander überführbar) o Enantiomere (Bild und Spiegelbild, lassen sich nicht zur Deckung bringen) o Diastereomere (verhalten sich nicht wie Bild und Spiegelbild) Tosionsisomere (durch Drehungen von Bindungen ineinander überführbar) o Konformere (durch Drehung von Einfachbindungen ineinander überführbar) o cis-trans-Isomere = geometrische Isomere (durch Drehung einer Doppelbindung ineinander überführbar) Chirale und achirale Verbindungen o chiral: zwei Verbindungen, die sich wie Bild und Spiegelbild verhalten o achiral: verhalten sich nicht wie Bild und Spiegelbild, lassen sich zur Deckung bringen Absolute Konfiguration R/S-Nomenklatur o R = rechtsdrehend o S = linksdrehend o Substituenten eines asymmetrischen C-Atoms werden wie folgt mit einer Rangfolge von 1 bis 4 versehen: 1. die höhere Ordnungszahl hat Vorrang 2. die höhere Massenzahl hat Vorrang (bei Isotopen) 3. Doppelbindungen werden wie zwei Einfachbindungen zum entsprechenden Atom gewertet 4. die Bewertung erfolgt in Sphären. In erster Sphäre befinden sich alle gebundenen Atome. In zweiter Sphäre alle an diese gebundenen Atome und so weiter. Kann man in der ersten Sphäre keinen Unterschied erkennen, untersucht man die zweite hat man die Reihenfolge festgelegt wird der rangniedrigste Substituent vom Betrachter aus nach hinten gelegt, und die übrigen ergeben eine eihenfolge entweder gegen den Uhrzeigersinn (S) oder im Ohrzeigersinn (R) zur zeichnerischen Darstellung benutzt man die Keilchstrichformel Fischer-Projektion o in der Fischer-Projektion wird die längste C-Kette im Molekül durch einen vertikalen Strich dargstellt, wobei das Ende mit der am höchsten oxidieren funktionellen Gruppe nach oben gezeichnet wird o alle asymmetrischen C werden nun mit ihren Substituenten durch horizontale Striche gekennzeichnet o stellt nichts anderes dar als die Übersetzung der quasi „dreidimensionalen“ Keilchstrichformel in die zwei Dimensionen der Papierebene. Konventionsgemäß sollen dabei vertikale Striche hinter die Projektionsebene zeigen und horizontale Striche davor o Befindet sich der Substituent (z.B. –OH) rechts, so handelt es sich um eine DVerbindung o bei den Kohlenhydraten wird das am weitesten von der am höchsten oxidierten funktionellen Gruppe entfernte asymmetrische C-Atom zur Kennzeichnung herangezogen Diastereomere o nicht durch Drehung von Bindungen ineinander überführbar o verhalten sich nicht wie Bild und Spiegelbild o verfügen mindestens über 2 asymmetrische C-Atome und besitzen unterschiedliche physikalische und chemische Eigenschaften o maximale Anzahl der Stereoisomere N hängt von der Anzahl der chiralen Zentren n ab und errechnet sich durch N = 2^n dabei sind jeweils zwei Stereoisomere enantiomer zueinander; zum Rest verhalten sie sich diastereomer Meso-Verbindungen: o Sonderfall bei Verbindungen mit mehreren chiralen Zentren (asymmetrischen C-Atomen) o besitzen innere Spiegelebene im Molekül und sind infolgedessen nicht chiral (achiral), d.h. Bild und Spiegelbild lassen sich zur Deckung bringen Die Stereoisomere der Weinsäure o 2^2 = 4 4. Eigenschaften und Reaktionen der Halogenalkane Nomenklatur der Halogenalkane und Polarität der Bindung o die Halogenalkane bestehen aus einem Alkylrest als Kohlenwasserstoffgerüst und einem Halogen als funktionelle Gruppe o Halogenalkane können durch elektrophile Addition eines Alkens mit Halogenen oder Halogenwasserstoff oder durch radikalische Substitution aus dem entsprechenden Alkan und Halogen hergestellt werden o nach den IUPAC-Regeln wird ein Halogen als Substituent wie eine Alkylgruppe behandelt Nucleophile Substitution Ein Nucleophil ist ein Reagenz, das ein Elektronenpaar für die Bildung einer kovalenten Bindung zur Verfügung stellen kann und einen Substituenten verdrängt Das Nucleophil muß nicht negativ geladen sein SN1-Reaktionen: o läuft z.B. an tertiären Halogenalkanen in Gegenwart eine Base ab o Beispiel: 3-Brom-3-methylhexan mit Hydroxid-Ionen im ersten Schritt dissoziiert das Edukt in ein Bromid-Ion und ein tertiäres, planares Carbenium-Ion Zwischenprodukt Energieminimum im zweiten Schritt reagiert ein Hydroxium-Ion mit dem Carbenium-Ion, wobei dem Hydroxium-Ion in Bezug auf die Orientierung zwei Möglichkeiten für den Angriff zur Verfügung stehen es entsteht äquimolares Gemisch aus (S)-3-Methyl-3-hexanol und (R)-3-Methyl-3hexanol ein solches Enantiomerengemisch im Verhältnis 1:1 nennt man Racemat Geschwindigkeit der Reaktion: -d[A]/dt = k * [A] SN2-Reaktionen: läuft z.B. an sekundären und primären Halogenalkanen ab besteht im Unterschied zu SN1 nur aus einem Schritt bei der Reaktion nähert sich das Hydroxid-Ion von der Rückseite der Kohlenstoff-Iod-Bindung, während sich das Iod-Atom entfernt; Übergangszustand kann weder isoliert noch experimentell nachgewiesen werden rückwärtiger Angriff führt zu einer Konfigurationsumkehr (aus S wird R und umgekehrt) A+B C+D (A Konzentration des Eduktes, B die des Nucleophils, C des Produktes) Reaktionsgeschwindigkeit: -d[A]/dt = d[C] = k * [A]*[B] Unterscheidung der beiden Reaktionen: SN1 nur, wenn stabiles Carbeniumion entstehen kann tertiäre Halogenalkane, tertiäre Alkohole, Alkylhalogenide oder Benzylhalogenide SN2, wenn kein stabiles Carbeniumion entstehen kann primäre Halogenalkane, meist auch sekundäre 5. Alkene Nomenklatur der Alkene o alle Alkene haben die Endung –en o es gelten folgende Regeln: 1. finden sie die längste Kette, welche die Doppelbindung enthält 2. Nummerieren sie die Kette so durch, dass die Doppelbindung eine möglichst niedrige Nummer erhält. Die Nummer der Doppelbindung entspricht dem C-Atom in der Doppelbindung mit der kleineren Nummer 3. Die Substituenten und ihre Positionen werden dem Namen des Alkens als Präfixe vorangestellt 4. bei einem Alken können die Substituenten auf derselben oder gegenüberliegenden Seiten liegen cis oder trans Struktur und Bindung in Ethen o Alkene sind einfachste, ungesättigte Kohlenwasserstoffverbindungen mit der empirischen Formel CnH2n o Funktionelle Gruppen mit einer C-C-Doppelbindung sind z.B. die Vinyl- und die Allyl-Gruppe o Da die -Bindung am stärksten ist, wenn beide p-Orbitallappen verdeckt zueinander stehen, ist die C-C-Bindung nicht mehr frei drehbar. Dieser Energieverlust beim Drehen der Bindung ist die Ursache für Cis-TransIsomerie bei Alkanen. Um die Trans- in die Cis-Form umzuwandeln, muß die -Bindung gebrochen werden o sp2-Hybridisiert Katalytische Hydrierung o Alken und Wasserstoff werden mit Hilfe eines Katalysators zu einem Alkan hydriert o Additionsreaktion Elektrophile Additionsreaktion an Alkene o Für die Reaktivität der Alkene ist die л-Bindung der C=C Doppelbindung verantwortlich o bevorzugte Reaktion ist Addition, d.h. ein symmetrisches oder unsymmetrisches Reagenz lagert sich unter Aufhebung der л-Bindung an die C-Atome der Doppelbindung an und überführt die ungesättigte in eines gesättigte Verbindung o Teilchen, die Elektronen suchen, sind elektrophil, häufig fehlen ihnen 2 Elektronen für eine stabile Verbindung, z.B. H+, Br+, BF3, AlCl3, Ag+... HX-Addition o Hydrohalogenierung o Additionsreaktion o Alken und Halogenwasserstoff werden zu Alkylhalogenid Regel von Markovnikov o man beobachtet, dass Alkylreste an einem positiv geladenen C-Atom die Ladung besser stabilisieren als H-Atome Kationen bilden sich an teriären CAtomen leichter als an sekundären oder primären Nucleophil geht an höher substituierendes C-Atom Elektrophile Addition von Brom an Alkene o unter Einwirkung der л-Elektronen des Alkens wird das Brom-Molekül polarisiert (л-Komlex) und heterolytisch gespalten Br+ bildet mit CAtomen einen Dreiring, der als Bromonium-Ion bezeichnet wird Br- greift diesen Dreiring von der Rückseite her an einem der C-Atome nucleophil an und verdrängt das Br+ mit seinem Elektronenpaar von diesem C_Atom farbloses Dibromid entsteht Stereochemie der Bromierung Hydratisierung o Additionsreaktion o aus Alken und Wasser unter Vorhandensein von H+-Ionen wird Alkohol 6. Alkine Nomenklatur und Gestalt der Alkine o Summenformel CnH2n-2 o besitzt als funktionelle Gruppe eine Kohlenstoff-Kohlenstoff-Dreifachbindung o besitzen Endung –in o für die genauere Benennung kann man analog zu den Alkenen die Regeln 1-3 anwenden o Doppelbindung erhält Vorzug vor Dreifachbindung, d.h. die kleinere Position (Alkenine) Eigenschaften und Bindung der Alkine Die beiden Kohlenstoffe der Dreifachbindung sind sp-hybridisiert Durch den zunehmenden p-Anteil vom sp3- zum sp-Hybrid steigt die Acidität der Kohlenwasserstoffe o Darstellung aus Kohle und H2 oder Koks und Kalk 7. Alkohole Nomenklatur der Alkohole o primäres Alkohol: C-Atom, an dem die Hydroxylgruppe sitzt, hat Bindung zu nur einem weiteren C-Atom o sekundärer Alkohol: Bindung zu zwei weiteren C-Atomen o tertiärer Alkohol: Bindung zu drei weiteren C-Atomen o Endung –ol o längste Kette suchen, die die –OH-Gruppe trägt durchnummerieren, so dass OH kleinste Nummer erhält Alkohole haben Priorität vor Doppel- oder Dreifachbindungen (dann Alkenole oder Alkinole) o besitzt eine Verbindung mehrere OH-Gruppen, wird sie als mehrwertiger Alkohol bezeichnet Anzahl wird im Namen durch Präfix angegeben (z.B. 1,2-Ethandiol) Darstellung von Ethanol o Endprodukt der Alkoholischen Gärung o Durch Fermentation erhält man nur eine Konzentration bis 15% Destillation für höhere Konzentrationen o in der Industrie wird Ethanol durch Addition von Wasser an Ethen in Gegenwart konz. Schwefelsäure hergestellt o sehr billig, findet als Lösungsmittel Verwendung Alkoholische Gärung o C6H12O6 2 CH3CH2OH + 2 CO2 o Ethanol entsteht als Endprodukt bei der Vergärung von Kohlehydraten durch Mikroorganismen (Hefe) Struktur und physikalische Eigenschaften der Alkohole o Alkohol enthalten eine oder mehrere –OH-Gruppen (Hydroxylgruppen) o Alkohole können z.B. aus Halogenalkanen durch nucleophile Substitution hergestellt werden o mit Oxidationsmitteln lassen sich Alkohole zu den entsprechenden Carbonylverbindungen oxidieren aus primären Alkoholen entstehen dabei Aldehyde, die meist weiter zu Carbonsäuren oxidiert werden. Sekundäre o Alkohole werden durch Oxidationsmittel in Ketone überführt o die niederen Alkohole (bis zu 10C-Atome) sind bei Raumtemperatur Flüssigkeiten, die eine geringere Dichte als Wasser aufweisen o vergleicht man die Siedepunkte von Methanol bzw. Ethanol mit dem eines Kohlenwasserstoffs vergleichbarer Molmasse, dann ergeben sich erhebliche Abweichungen die der Alkohole sind deutlich höher Dipol-Dipol-Kräfte o Elektrostatische Anziehungskräfte zwischen Molekülen o Dipol-Dipol-Wechselwirkungen wirken zwischen polaren Molekülen, die ein Dipolmoment besitzen und die sich in einem elektrischen Feld ausrichten. Moleküle mit verschobener, nach außen unkompensierter Ladungsverteilung aufgrund verschiedener Elektronegativität der Bindungspartner besitzen ein Dipolmoment. Es treten im Molekül Partialladungen auf (symbolisiert durch + und -) H-Brücken und Hydrophilie o vergleicht man die Siedepunkte von Methanol bzw. Ethanol mit dem eines Kohlenwasserstoffs vergleichbarer Molmasse, dann ergeben sich erhebliche Abweichungen die der Alkohole sind deutlich höher liegt daran, dass Alkohol-Moleküle untereinander Wasserstoffbrücken ausbilden und sich dadurch zu höhermolekularen Assoziaten zusammenlagern, so ie es vom Wasser selbst bekannt ist o Will man einen Alkohol verdampfen, so ist mehr Energie erforderlich als bei einem Kohlenwasserstoff vergleichbarer Molmasse, dessen Moleküle lediglich durch schwache Van der Waals-Kräfte zusammengehalten werden o Wasserstoffbrückenbindungen sind nicht nur zwischen Alkohol-Molekülen möglich, sondern auch von diesen zu Wassermolekülen sind mit Wasser verwandt o Beim Methanol, Ethanol und den Propanolen bestimmt die hydrophile OHGruppe das Lösungsverhalten der Moleküle, man findet vollständige Mischbarkeit mit Wasser o bei längerer C-Kette gewinnt der lipophile Kohlenwasserstoffrest zunehmend an Gewicht, das Lösungsverhalten ändert sich zwei Phasen bei höheren Alkoholen Säure (pKs-Wert) und basische Eigenschaften o der amphotere Charakter des Wassers gilt im Prinzip auch für Alkohole In Gegenwart starker Säuren lagert sich ein Proton an eines der freien Elektronenpaare an es entsteht Oxonium-Ion, der Alkohol hat als Base reagiert umgekehrt ist die Abspaltung eines Protons aus der Hydroxygruppe möglich; Acidität von Alkoholen ist aber schwächer als die des Wassers, d.h. in wäßriger Lösung erhält man kein Alkoholat-Ion, sondern immer nur OH--Ionen pKs-Wert: 16 Redox-Beziehungen zwischen Alkoholen und Carbonylverbindungen o Aldehyde und Ketone entstehen bei der milden Oxidation von Alkoholen; primäre Alkohole bilden Aldehyde, sekundäre bilden Ketone Aldehyde reagieren weiter zu Carbonsäure 8. Struktur von Ether, Thioether, Disulfide 9. Delokalisierte -Systeme und Licht-Absorption Konjugierte Diene o Verbindungen mit zwei Doppelbindungen heißen Alkadiene oder auch kurz Diene o Vor dem Stammnamen gesetzte Ziffern geben die Lage der Doppelbindungen an o konjugierte Doppelbindungen: Verbindungen wie das 1,3-Buten enthalten Doppelbindungen, die mit Einfachbindungen alternieren o isolierte Doppelbindungen: Doppelbindungen sind durch mehrere Einfachbindungen voneinander getrennt o Besonderheit konjugierter Diene drückt sich z.B. darin aus, dass Brom sich nicht nur an eine der beiden Doppelbindungen addiert (1,2-Addition), sondern auch ein 1,4-Additionsprodukt entsteht Mesomerie Die Verteilung von Elektronenladung (Delokalisierung) über mehrere Atome hinweg führt zu einer Stabilisierung, d.h. einer energetisch tieferen Lage des Moleküls. Diesem Phänomen begegnet man bei Molekülen, die sich durch mehrere Grenzformeln darstellen lassen. Bei den mesomeren Grenzstrukturen sind immer s- und p-Elektronen beteiligt. Je mehr mesomere Grenzformeln sich zeichnen lassen, desto energieärmer ist das Molekül! Ein besonders wichtiger Fall von Delokalisierung durch Resonanzhybride liegt bei aromatischen Verbindungen vor. In der Reihe Cyclohexen, 1,3Cyclohexadien und 1,3,5-Cyclohexatrien würde die Energie (hier: Hydrierungswärme) des 1,3,5-Cyclohexatrien viel höher liegen, wenn es nicht durch Resonanz stabilisiert wäre Stabilität konjugierter Diene: o bei Verbindungen mit konjugierten Doppelbindungen wird auch zwischen den sp2-C-Atomen, die nur einfach verbunden sind, eine zusätzliche Bindung wirksam, so dass π-Elektronen der Molekülorbitale im Prinzip über alle vier CAtome delokalisiert sind o solche Systeme sind energieärmer als solche mit zwei isolierten Doppelbindungen Terpene Terpene sind in der Natur weit verbreitet, vor allem in Pflanzen als Bestandteile der ätherischen Öle. Viele Terpene sind Kohlenwasserstoffe, man findet jedoch auch sauerstoffhaltige Verbindungen wie Alkohole, Aldehyde und Ketone (Terpenoide). Ihr Baustein ist der Kohlenwasserstoff Isopren, CH2=C(CH3)-CH=CH2 (Isoprenregel, Wallach 1887). Die Terpenkohlenwasserstoffe haben demnach die Summenformeln (C5H8)n, man teilt sie nach der Anzahl der Isopreneinheiten ein: Anzahl der Isopreneinheiten Monoterpene 2 Sesquiterpene 3 Diterpene 4 Triterpene 6 Tetraterpene 8 Beispiele für Monoterpene sind: Pinen, Nerol, Citral, Campher, Menthol, Limonen. Beispiele für Sesquiterpene sind: Nerolidol, Farnesol. Beispiele für Diterpene sind: Phytol, Vitamin A1. Ein Beispiel für ein Triterpen ist Squalen, und Carotin (Provitamin A1) ist ein Tetraterpen. 10.Carbonylverbindungen Nomenklatur der Aldehyde und Ketone o Aldehyd: an einem endständigen C immer =O und -H Endung –al an den Namen des entsprechenden Alkans Carbonylkohlenstoffgruppe erhält immer Position 1 Keton: an Carbonylkohlenstoffatom sind zwei weiter C-Atome gebunden Endung –on an den Namen des entsprechenden Alkans längst, Carbonylkohlenstoff enthaltende Kette wird so nummeriert, dass dieses C-Atom die niedrigste Nummer erhält Struktur der Carbonylgruppe o Sauerstoffatom ist durch Doppelbindung an C-Atom gebunden o Doppelbindung ist durch hohe Elektronegativität des O-Atoms stark polarisiert Sauerstoff negative und Kohlenstoff positive Ladung Reaktivität der Carbonylgruppe o stark polarisiert o Carbonyl-O-Atom: nucleophiles Zentrum Elektrophil lagert sich eher an o Carbonyl-C-Atom: elektrophiles Zentrum wird eher von Nucleophil angegriffen o greift Nuecleophil am C-Atom an, verschiebt sich das π-Elektronenpaar zum O-Atom hin, das ein Proton (Elektrophil) anlagert C-Atom geht von sp2 in sp3 über in dieser Reaktion sind Aldehyde etwas reaktiver als Ketone o reicht Nucleophilie nicht aus, dann können starke Säuren katalytisch wirken Addition von Wasser zu Hydraten o Wasser greift das Carbonyl-C-Atom von Aldehyden und Ketonen nucleophil an und gibt ein Proton an das Carbonyl-O-Atom ab o Formal addiert sich Wasser an die C=O-Dopelbindung, es entsteht ein Hydrat, das mit der Ausgangsverbindung im Gleichgewicht steht o der Grad der Hydratisierung schwankt bei einzelnen Verbindungen und ist beim Formaldehyd und Acetalaldehyd höher als beim Aceton Addition von Alkoholen o Analog dem Wasser regieren auch Alkohole, dabei entstehen aus Aldehyden Halbacetale, aus Ketonen Halbketale o Besonderheit dieser Reaktion ist es, das sich auch eine Alkoholgruppe desselben Moleküls an die CO-Gruppe addieren kann, sofern der Abstand der reagierenden Gruppen günstig ist es entstehen cyclische Halbacetale (Halbketale), die stabiler sind als offenkettige Halbacetale und zur Bildung eines heterocyclischen Ringes führen o Zugabe starker Säuren zur Mischung aus Aldehyd (Keton) und Alkohol katalysiert einerseits die Halbacetalbildung, im Anschluss daran jedoch auch eine Folgereaktion unter Wasserabspaltung entsteht aus dem Halbacetal (Halbketal) ein Carbenium-Ion, das von einem weiteren Alkohol-Moleül nucleophil angegriffen wird und nach Verlust eines Protons zum Acetal (Ketal) wird reversible Reaktion Addition von Aminderivaten o Ammoniak und Amine sind gute Nucleophile o es entsteht Azomethin, oder auch Schiff’sche Base Oxidation der Aldehyde o Aldehyde können weiter zu Carbonsäuren oxidieren o dabei wird ein H-Atom abgespalten und eine OH-Gruppe an der freien Stelle gebunden 11.Enole und Enone; ,-ungesättigte Alkohole, Aldehyde und Ketone Keto-Enol-Tautomerie und CH-Acidität o Die Polarisierung der Carbonylgruppe wirkt sich auch noch auf das benachbarte C-Atom aus, das als α-C-Atom bezeichnet wird an ihm hängende H-Atome (α-ständige H-Atome) zeigen eine für C-H-Bindungen ungewöhnlche Acidität (pKs= 19-21 für Aldehyde und Ketone) o in Gegenwart starker Basen bildet sich ein Anion, das mesomeriestabilisiert ist frei gewordenes Elektronenpaar und die damit verbundene negative Ladung sind zwischen dem α-C-Atom und dem Carbonyl-O-Atom verteilt Mesomerie stabilisiert das Anion, dies steigert in der Ausgangsverbindung die Tendenz der Protonenabgabe und ist somit Ursache für die Acidität o das aus einem Aldehyd (R=H) oder Keton gebildete Anion hat zwei Möglichkeiten, beim Ansäurern wieder ein Proton aufzunehmen: an das ursprüngliche α-C-Atom zur Ketoform am Enolat-O-Atom zur Enolform (Name: Doppelbindung und OHGruppe) o Keto- und Enolform stehen miteinander im Gleichgewicht Konstitutionsisomere, die in diesem speziellen Fall Tautomere heißen o im Endeffekt wandert ein Proton von einem α-C-Atom zum O-Atom der Carbonylgruppe oder in umgekehrter Richtung; dabei ordnen sich die πElektronen um Chelatkomplexe o organische Moleküle, die nicht nur ein, sondern mehrere Donor-Atome besitzen, mit denen sie an dasselbe Zentralatom herantreten, heißen Chelator, das entstehende Teilchen ist dann ein Chelat-Komplex o Zweizähnige Chelatoren sind z.B. Ethylendiamin oder das Anion der Aminosäure Glycin. Mit Cu2+ bilden sie Chelatkomplexe, deren Gesamtladung im ersten Beispiel +2, im zweiten 0 beträgt o Chelatkomplexe entstehen bevorzugt, wenn der Ring, den das Zentralatom mit dem Chelator bildet, 5- oder 6-gliegrig ist nicht gespannt und damit energetisch begünstigt Aldoladdition und Aldolkondensation o in stark alkalischer Lösung dimerisiert Acetaldehyd zum „Aldol“, einer Verbindung, die je eine Aldehyd- und Hydroxygruppe enthält o Formal ist ein Acetaldehyd-Molekül unter Spaltung einer C-H-Bindung an die CO-Gruppe eines zweiten Moleküls Acetaldehyds addiert worden dieser Teilschritt heiß Aldol-Addition o Aldol ist in der Regel instabil und wird beim erhitzen oder nach Ansäuern der Lösung dehydratisiert es entsteht eine zur CO-Gruppe konjugierte C=CDoppelbindung; Aus dem Additionsprodukt wird ein Kondensationsprodukt o bedeutsam an dieser Reaktion ist, dass C-Atome verknüpft werden und so aus kürzeren längere Ketten entstehen 12.Carbonsäuren Nomenklatur der Carbonsäuren o an den Stammnamen des Alkans wird die Endung –aäure angehängt o Häufig werden Trivialnamen benutzt: Ameisensäure (Methansäure) Essigsäure (Ethansäure) Buttersäure (Butansäure) Benzoesäure (Benzolcarbonsäure) Struktur o Carbonsäuren können durch Oxidation von primären Alkoholen oder Aldehyden hergestellt werden o funktionelle Gruppe ist die Carboxylgruppe (-COOH) o die Carboxylgruppe enthält ein sp2-hybridisiertes C-Atom, ist eben gebaut und stark polarisiert o beide Sauerstoffatome haben zwei freie Elektronenpaare und tragen negative Partialladungen o Carboxylgruppe ist hydrophil und bestimmt die Löslichkeit mit zunehmender Länge sinkt die Wasserlöslichkeit rapide o Siedepunkt ist relativ hoch, weil Carbonsäuren untereinander Wasserstoffbrücken ausbilden Acidität und Basizität der Carbonsäuren o wie der Name schon sagt reagieren Carbonsäuren in wäßriger Lösung sauer. Hierbei geben sie das Proton der Carboxylgruppe ab und gehen in das mesomeriestabilisierte Carboxylatanion über o allgemein hängt die Acidität einer organischen Verbindung RX-H von zwei Faktoren ab: 1. von der Elektronegativität des Atoms X 2. von Einflüssen, die das Anion RK+ im Vergleich zur undissoziierten Verbindung RX-H stabilisieren Derivate von Carbonsäuren o die Carbonsäuren sind der Stamm einer großen Familie von Verbindungen, die entstehen, wenn die OH-Gruppe der Carboxylgruppe durch andere polare Reste ersetzt wird o man bezeichnet die Abkömmlinge der Carbonsäuren als Carbonsäurederivate, weil sie sich bei der Hydrolyse alle wieder in die zugehörige Carbonsäure rückverwandeln lassen o trotz unterschiedlicher Substituenten reagieren Carbonsäure-Derivate sehr ähnlich o Beispiele: Anhydrid, Thioester, Ester, Amid, Chlorid Ester, Amide, Anhydride und Halogenide o Veresterung – Verseifung Löslichkeiten homologer Carbonsäuren(-salze), Dualismus lipophiler Teil R, hydrophiler Teil -COO- (>> -COOH) Salze amphiphil, Wirkung als Detergentien (Tenside); Einfluß auf Oberflächenspannung, Micell-Bildung, Lösen von Fett ("Schmutz") in Wasser; Struktur Fette: Triester von Fettsäuren mit Glycerin, Verseifung zu Kern(Natron-) bzw. Schmier-(Kali-)-Seifen ("Seifensiederei"); Probleme biologischer Abbau, Schaum-Bildung, Wasserhärte, Eutro- phierung (Phosphate); Entwicklungen u. a. Sulfonate mit linearen Alkyl-Ketten, nichtionische Alkyl-polyglycol- Derivate; "Calgon" º "calcium gone" (Alkylpolyphosphate) für Wasserenthärtung; 1869 – Margarine (Film) Hydrolysegeschwindigkeit o V = k * [Ester] * [Nucleophil] Reaktionskinetik o die Reaktionskinetik beschäftigt sich mit der Geschwindigkeit chemischer Reaktionen Katalyse Entropie Exergone und endergone Reaktionen Amide, Struktur der Aminbindung Natürliche Ester Lipide Fette Tenside Micellen o Wasser hydratisiert nur das lipophile Ende von Stearat, das lipophile Ende wird wie Öl aus dem Wasser herausgedrängt o An der Oberflächse bildet sich zunächst eine monomolekulare Schicht des Stearats, was die Oberflächenspannung stark erniedrigt o weitere Stearat-Ionen lagern sich so zusammen, dass die lipophilen Enden miteinander in Kontakt stehen (hydrophobe Wechselwirkung) und das Wasser aus ihrer Mitte verdrängen, während die negativen Enden eine hydrophile Hülle um den lipophilen Kern bilden solche Aggregate heißen Micellen Iodzahl o 13.Aromatische Verbindungen sechsring, also cyclisch; planar; eine Doppelbindung entspricht 2 π-Elektronen Die systematische Benennung von Benzolderivaten o befindet sich schon ein Substituent am Benzolring, dann gibt es für einen zweiten 3 verschiedene Positionen, die als ortho (o), meta (m) und para (p) bezeichnet werden o bei mehr als 2 Substituenten am Ring werden die C-Atome von 1-6 nummeriert und Zahlen vor die Substituenten gesetzt Struktur und Resonanzstruktur von Benzol o alle sechs C-Atome des Benzols sind sp2-hybridisiert und liegen in einer Ebene o die sechs einfach besetzten p-Orbitale dieser Atome stehen senkrecht zu dieser Ebene, überlappen und bilden π-Molekülorbitale, die mit insgesamt sechs Elektronen besetzt sind und zu einer völlig gleichmäßigen Elektronenverteilung oberhalb und unterhalb des Sechsrings führen o Als Folge der Delokalisierung gibt es im Benzol keine Doppel- und Einfachbindungen mehr: der Ring ist symmetrisch und alle C-C-Bindungen sind gleich lang und damit kürzer als C-C_Einfachbindungen und länger als C=C-Doppelbindungen Hückel-Regel o die in einem Ring delokalisierten π-Elektronen führen immer dann zu einem energiearmen Molekül mit aromatischen Eigenschaften, wenn sich (4n + 2) πElektronen auf alle Ringatome verteilen können. Im Falle des Benzols (n=1) sind dies sechs π-Elektronen Elektrophile aromatische Substitution o am Beispiel der Bromierung in Gegenwart von Eisen: 1. Bildung des eigentlichen Katalysators Eisen(III)-bromid durch Oxidation von Eisen mit Brom 2. Bildung des Elektrophils Br+ durch heterolytische Spaltung des Brom-Moleküls in Gegenwart von FeBr3 dieses weist am Eisen eine Elektronenlücke auf und übernimmt deshalb ein Nucleophil wie z.B. Br3. Angriff des Elektrophils Br+ auf das π-System des Benzols und Ausbildung einer σ-Bindung mit einem Ring-C-Atom; der entstehende Komplex ist mesomeriestabilisiert, d.h. die positive Ladung ist auf die Ring-C-Atome wie angegeben verteilt. Der σKomplex ist bei dieser Reaktion eine nachweisbare Zwischenstufe 4. Abspaltung eines Protons vom einzigen tetraedrischen C-Atom imσKomplex unter Rückbildung des stabilen Benzolrings. Damit ist das H-Atom der Ausgangsverbindung durch ein Br-Atom substituiert worden 5. Freisetzung von Bromwasserstoff, Rückbildung des Katalysators 14.Phenole und Chinone Beispiele für Phenole o Phenol o α-Naphtol o β-Naphtol o Hydrochinon o Hydroxygruppe steht unmittelbar am aromatischen Kern Acidität der Phenole o Phenol unterscheidet sich deutlich von Cyclohexanol und Methanol o lässt sich mit Natronlauge neutralisieren, das gebildete Salz, Natrium-phenolat, ist wie viele Salze gut wasserlöslich, während Phenol selbst weniger löst o schwache Säure: pKs-Wert = 10 Chinone o enthalten zwei CO-Gruppen, die in einem Sechsring durch konjugierte C=CDoppelbindungen verknüpft sind o man unterscheidet p-Chinone (CO-Gruppen liegen sich im Ring gegenüber) und o-Chinone (nicht gegenüber) o Substituenten am Ring wirken sich nicht aus o wichtigste Eigenschaft: Reduzierung zum Hydrochinon Hydrochinon o zweiwertiges Phenol o farblos o gutes Reduktionsmittel o kann zu gelber Verbindung oxidiert werden 1,4-Benzochinon Redox-Beziehung Chinon-Hydrochinon o Chinone sind reduzierbar zu Hydrochinon o Reduktionsmittel kann z.B. Wasserstoff sein, mit Edelmetall-Katalysatoren oder enzymatisch aktiviert o durch Substituenten am Chinonring lassen sich Redox-Eigenschaften graduell beeinflussen o Reaktionen unter physiologischen Bedingungen laufen fast alle bei konstantem pH-Wert ab o dieses Redoxsystem kann für genaue pH-Wert-Messungen eingesetzt werden Mischung aus gleichen Teilen Chinon und Hydrochinon, die einen schwerlöslichen grünen Komplex (Chinhydron) bilden chemisch inertes Platinblech in wäßrige Suspension von Hydrochinon eintauchen Potential, das am Platin im Vergleich zu einer Referenzelektrode abgegriffen wurde, verändert sich entsprechend dem pH-Wert 15. Amine Basizität der Amine o Amine sind wie Ammoniak Basen und lagern ein Proton an das freie Elektronenpaar an Chemische Reaktionen: o Alkylierung o Amid-Bildung Sulfonamide und Diazotierung 16.Kohlenhydrate siehe Unterlagen!!! Monosaccharide Einfacher Zucker Aldosen und Ketosen Cyclische Formen von Zuckern Anomere Zucker: Mutarotation der Glucose Oxidation und Reduktion von Zuckern Disaccharide Polysaccharide Identifizierung von Disacchariden (Bsp. Saccharose und Maltose) 17.Aminosäuren bestehen immer aus: R – CH – COOH / NH2 verschiedene Reste und Namen: Name Abkürzung Glycin Gly Alanin Ala Serin Ser Cystein Cys Asparaginsäure Asp Glutaminsäure Glu Rest -H -CH3 -CH2-OH -CH2-SH -CH2-COOH -CH2-CH2-COOH Säure-Basen-Eigenschaften der Aminosäuren o Aminosäuren enthalten im selben Atom eine funktionelle Gruppe mit sauren und eine mit basischen Eigenschaften o in einer Verbindung der allgemeinen Formel A gibt die Carboxylgruppe in wäßriger Lösung ein Proton ab, das sich an das freie Elektronenpaar der Aminogruppe anlagern kann o die ungeladene Form des Moleküls a steht mit einem Zwitter-Ion B im Gleichgewicht Isoelektrischer Punkt o Isoelektrischer Zustand: Zahl der negativen Ladungen kompensiert gerade mit der der positiven. Die Aminosäure liegt überwiegend als Zwitter-Ion vor, das nach außen elektrisch neutral ist o der pH-Wert, an dem der isoelektrische Zustand erreicht ist, heißt isoelektrischer Punkt. Er ist eine für jede Aminosäure charakteristische Konstante, die von den pKs-Werten der funktionellen Gruppen abhängt Chemische Reaktionen o Ester- und Amidbildung Beachte: 2 verschiedene fuktionelle Gruppen vorhanden! im Glycin z.B. lässt sich die Carboxylgruppe mit Methanol in Gegenwart von HCl verstern o Peptidbindung Biochemisch bedeutsam ist, dass sich zwei und mehr Aminosäuren zu langen Ketten verknüpfen lassen Betrachten wir zunächst wieder das Glycin: Reagiert die Carboxylgruppe des ersten Moleküls mit der Aminogruppe des zweiten, so wird formal Wasser abgespalten und es entsteht ein Säureamid Die Säureamidbindung, die die Moleküle verknüpft, heißt in diesem Fall Peptidbindung o Bildung von Schiff’schen Basen: Amine sind gute Nucleophile bei der Reaktion primärer Amine mit Aldehyden und Ketonen laufen folgende Vorgänge ab: das Amin greift das Carbonyl-C-Atom nucleophil an und bildet ein Zwischenprodukt (Zwitter-Ion), das formal durch Verschiebung eines Protons vom N zum O in das eigentliche Additionsprodukt übergeht. Diese ist nicht stabil, sondern eliminiert und Säurekatalyse leicht Wasser das Kondensationsprodukt heißt allgemein Schiff’sche Base oder Azomethin 18.Peptide und Proteine Primärstruktur der Peptide und Proteine o die Sequenz einer Polypeptidkette wird als Primärstruktur bezeichnet o aus 2 Aminosäuren entsteht ein Dipeptid o bei den Peptiden verzichtet man aus Übersichtsgründen häufig auf die Strukturformel und verwendet statt dessen die üblichen Abkürzungen der Aminosäuren o jede Peptidkette hat ein Aminoende und ein Carboxylende, die in der abgekürzten Schreibweise durch H bzw. OH gekennzeichnet sind Klassische Sequenzanalyse o Sangers Proteinsequenzierung o Edman-Abbau Sekundärstruktur der Proteine o Peptidketten ordnen sich und bilden stabile Molekülformen aus o Stabilisierung durch Wasserstoffbrücken, die zwischen dem Carbonyl-O-Atom einer und der NH-Gruppe einer anderen Amidgruppe ausgebildet werden o NH-Gruppe ist Donator, CO-Gruppe der Akzeptor -Helix und Faltblattstruktur o Faltblatt: Ebenen der Peptidgruppen sind gegeneinander gewinkelt, Reste am α-Atom stehen senkrecht zur Laufrichtung der Ketten o α–Helix: Peptidkette windet sich zu einer rechtsgängigen Spirale auf, die durch intramolekulare Wasserstoffbrücken stabilisiert sind CO-Gruppe in einer Windung und NH-Gruppe der vierten darauffolgenden Aminosäure in der nächsten Windung stehen sich gegenüber Tertär- und Quartärstruktur o Tertiärstruktur: räumliche Anordnung der funktionellen Gruppen Schäden besonders gravierend o Quartärstruktur: ??? 19.Heterocyclische Verbindungen Fünfgliedrige aromatische Heterocyclen o Heterocyclen entsprechen in ihrem rinförmigen Aufbau den Cycloalkanen oder den aromatischen Kohlenwasserstoffen, wie z.B. Cyclopentan oder Benzol o Merkmal für einen Heterocyclus ist, dass sich neben Kohlenstoffatomen auch noch andere Atome wie N-, O- oder S-Atome am Aufbau der Ringe beteiligen o man unterscheidet zwischen aromatischen und aliphatischen Heterocyclen o mit Pyrrol, Furan und Thiophen lernen wir die kleinsten aromatischen Heterocyclen mit einem Heteroatom im Ring kennen o hier ist jeweils ein freies Elektronenpaar am Heteroatom mit zwei Doppelbindungen konjugiert; da ein 6π-Elektronensystem entsteht, sind die Verbindungen aromatisch Pyrrolring, Furanring, Nucleinsäuren o Pyrrolring: sehr schwache Base, eher gibt es das Proton vom N-Atom ab und wird zum Anion Heteroatom: N C-Atome des Fünfrings sind, verglichen mit dem Benzol, elektronenreicher und reagieren leichter mit Elektrophilen fügt man durch Reaktionen vier Pyrrolringe zu einem Ring zusammen, ensteht das Grundgerüst wichtiger natürlicher Pyrrolderivate: Chlorophyll, Cytochrome, Häm Furanring: Heteroatom: O Nucleinsäure: es kommen viele Bausteine darin vor: Phosphorsäure, Zucker, Purinund Pyrimidinbasen DNA: Basen bilden untereinander Wasserstoffbrückenbindungen aus und zwar treten Adenin mit Thymin und Guanin mit Cytosin in Wechselwirkung. Die Basen erkennen sich gegenseitig. Eine optimale Zahl an H-Brücken gibt es, wenn die zweite Kette zur ersten komplementär ist, dass also jeder Base in Kette 1 der passende artner gegenübersteht Doppelhelix 20.Stofftrennung Prinzipien der Chromatographie: o Chromatographie beschreibt ganz allgemein unterschiedliche Verfahren zur Stofftrennung durch Verteilung der zu trennenden Stoffe zwischen einer ruhenden (stationären) Phase und einer darüber hinwegströmenden (mobilen) Phase. Die beiden Phasen besitzen bei der Flüssigkeitschromatographie eine unterschiedliche Polarität o je nach Aggregatszustand der Phasen und apparativem Aufbau unterscheidet man verschiedene Verfahren o bei der stationären Phase kann es sich sowohl um einen Feststoff (Adsorptionschromatographie) als auch um eine auf ein Trägermaterial gezogene Flüssigkeit (Verteilungschromatographie) handeln, die mit der mobilen Phase nicht mischbar ist o Das Prinzip der Verteilungschromatographie beruht auf einer unterschiedlichen Verteilung der zu trennenden Stoffe zwischen der stationären und der mobilen Phase, wobei Polarität und Größe (Beweglichkeit) entscheidend sind o Polare Substanzen halten sich bevorzugt in der polaren Phase auf und umgekehrt o Stofftrennung durch Differenz der Wanderungsgeschwindigkeiten o wichtige Chromatographie-Arten: Papierchromatographie Säulenchromatographie Dünnschichtchromatographie Gaschromatographie Retentionsfaktor bei Dünnschichtchromatographie: Retentionsfaktor = Substanzstrecke / Laufmittelstrecke