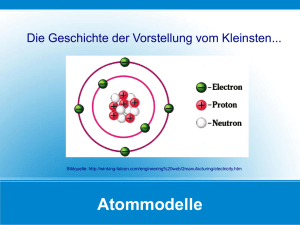
Umweltchemie - Ihre Homepage bei Arcor
Werbung
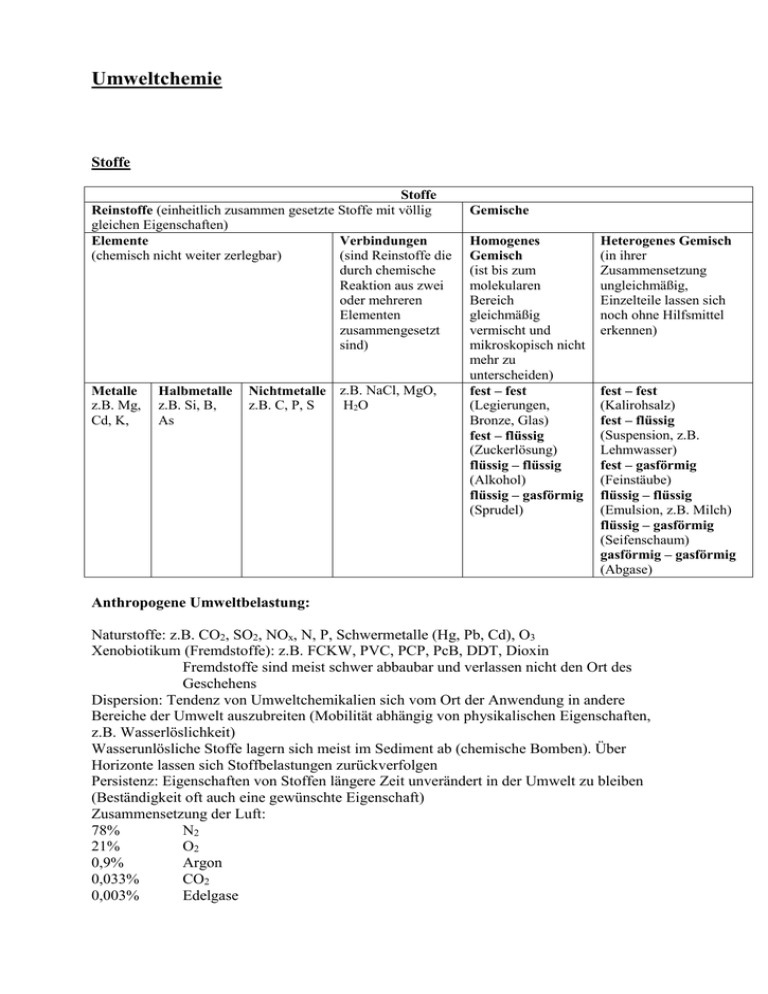
Umweltchemie Stoffe Stoffe Reinstoffe (einheitlich zusammen gesetzte Stoffe mit völlig gleichen Eigenschaften) Elemente Verbindungen (chemisch nicht weiter zerlegbar) (sind Reinstoffe die durch chemische Reaktion aus zwei oder mehreren Elementen zusammengesetzt sind) Metalle z.B. Mg, Cd, K, Halbmetalle z.B. Si, B, As Nichtmetalle z.B. NaCl, MgO, z.B. C, P, S H2O Gemische Homogenes Gemisch (ist bis zum molekularen Bereich gleichmäßig vermischt und mikroskopisch nicht mehr zu unterscheiden) fest – fest (Legierungen, Bronze, Glas) fest – flüssig (Zuckerlösung) flüssig – flüssig (Alkohol) flüssig – gasförmig (Sprudel) Heterogenes Gemisch (in ihrer Zusammensetzung ungleichmäßig, Einzelteile lassen sich noch ohne Hilfsmittel erkennen) fest – fest (Kalirohsalz) fest – flüssig (Suspension, z.B. Lehmwasser) fest – gasförmig (Feinstäube) flüssig – flüssig (Emulsion, z.B. Milch) flüssig – gasförmig (Seifenschaum) gasförmig – gasförmig (Abgase) Anthropogene Umweltbelastung: Naturstoffe: z.B. CO2, SO2, NOx, N, P, Schwermetalle (Hg, Pb, Cd), O3 Xenobiotikum (Fremdstoffe): z.B. FCKW, PVC, PCP, PcB, DDT, Dioxin Fremdstoffe sind meist schwer abbaubar und verlassen nicht den Ort des Geschehens Dispersion: Tendenz von Umweltchemikalien sich vom Ort der Anwendung in andere Bereiche der Umwelt auszubreiten (Mobilität abhängig von physikalischen Eigenschaften, z.B. Wasserlöslichkeit) Wasserunlösliche Stoffe lagern sich meist im Sediment ab (chemische Bomben). Über Horizonte lassen sich Stoffbelastungen zurückverfolgen Persistenz: Eigenschaften von Stoffen längere Zeit unverändert in der Umwelt zu bleiben (Beständigkeit oft auch eine gewünschte Eigenschaft) Zusammensetzung der Luft: 78% N2 21% O2 0,9% Argon 0,033% CO2 0,003% Edelgase Stoffkreisläufe Stickstoffkreislauf Stickstoff wird von allen Lebewesen benötigt, da er Bestandteil von Aminosäuren in Proteinen, von DNA und von Vitaminen ist. Doch befindet sich der irdische Stickstoff (1015 Tonnen) zu 99% in der Atmosphäre, von wo ihn nur spezielle Bakterien und - durch Symbiose mit derartigen Bakterien an bzw. in ihren Wurzeln - auch einige wenige Pflanzen aufnehmen können. Alle anderen Pflanzen und vor allem Tiere und Menschen sind auf den Stickstoff-Kreislauf in der Biosphäre angewiesen. Dass dieser Kreislauf trotz seiner Engpässe funktioniert, zeigen Stoff-Bilanzen und Abschätzungen von Bio- und Ökologen. Demnach wurde der verfügbare Stickstoff während der Erdgeschichte schon 500 bis 1000-mal von Lebewesen in ihren Körper eingebaut und wieder ausgeschieden, während er jedoch rund 200.000-mal ein- und ausgeatmet wurde. Nitrifikation Pflanzen können zwar Ammonium (NH4+) aufnehmen, bevorzugen aber Nitrate (NO3-), wobei der Boden nicht angesäuert wird. Zwei Gruppen von Bakterien, Nitritbakterien und Nitratbakterien oxidieren in einem zweistufigen aeroben Prozess bei Energiegewinnung Ammoniak über die Zwischenstufe Nitrit zu Nitrat: Dieser Prozess, der in Böden und in Gewässern abläuft, wird Nitrifikation genannt. Denitrifikation Bestimmte Bakterien können unter anaeroben Bedingungen auch Nitrit für die Oxidation von organischen Stoffen oder H2 nutzen und auf diese Weise Energie gewinnen. Nitrit wird dabei über mehrere Zwischenstufen zu N2 reduziert. Aus Nitrat wird also durch diesen bakteriellen Prozess, der Denitrifikation genannt wird, N2 gebildet, der zum großen Teil in die Atmosphäre entweicht. Wasserkreislauf Durch Verdunstung an der Meeresoberfläche gelangt das Wasser als Luftfeuchtigkeit in die Atmosphäre. Spielen Kondensationsvorgänge eine Rolle, bildet sich Bewölkung, aus der das Wasser in Form von Regen oder Schnee wieder austritt und zur Erdoberfläche zurückfällt. Ein Teil regnet über den Meeren ab, ein anderer Teil gelangt über das Festland und gibt hier seinen Niederschlag ab. Ein Teil des Wassers verdunstet, ein anderer Teil versickert im Erdboden und gelangt über die pflanzliche Transpiration wieder in die Erdatmosphäre. Sickerwasser dient aber auch zur Auffüllung des Grundwassers, das wiederum in Wasserquellen zutage tritt oder unterirdisch direkt den Flüssen zugeführt wird. In den Polargebieten und in Hochgebirgen wird wiederum ein Teil der Niederschläge in fester Form als Eis gespeichert, wo es allerdings auch zum Teil wiederum durch Verdunstung in die Atmosphäre gelangt. Kohlenstoffkreislauf Der Kohlenstoffkreislauf ist hauptsächlich ein Kohlenstoffdioxid (CO2) Kreislauf, der aus vielen Teilschritten besteht: Die wichtigsten sind die Assimilation (Aufnahme) von CO2 durch Pflanzen in der Photosynthese, und der entgegen gesetzte Vorgang, also die Rückführung von Kohlenstoffdioxid, die Respiration (Veratmung) des von den Pflanzen produzierten Sauerstoffs zu CO2. Anthropogen werden fossile Brennstoffe (Erdöl, Erdgas, Kohle) verbrannt. Diese bestehen zum größten Teil aus Kohlenstoff. Bei der Verbrennung dieser Brennstoffe wird Kohlenstoffdioxid frei, das wiederum in die Atmosphäre transportiert wird. Freier Kohlenstoff kommt so gut wie nicht vor, da dieser sehr reaktionsfreudig ist. Häufigste Verbindungen: CO, CO2, CH, CaCO3 Phosphorkreislauf Phosphor ist das wichtigste wachtumslimitierende Element des Ökosystems. In den Kreislauf wird Phosphor in Form des Phosphat-Ions (PO4 3-) gebracht. Entweder können Phosphate durch Auswaschung aus dem Muttergestein den Pflanzen zur Verfügung gestellt werden, oder sie werden bergmännisch abgebaut. Phosphor wird in Form des Phosphat-Ions in den Kreislauf gebracht. Pflanzen nehmen Phosphat auf, und geben Phosphor an den Boden ab, wo dieses durch Bakterien wieder zu Phosphaten umgewandelt wird. Durch Auswaschung gelangt das Phosphat über Flüsse und das Grundwasser in die Meere. In den Meeren werden die Phosphate von Phytoplankton verstoffwechselt, und Phosphor und Phosphate an das Meer (bzw. an das Zooplankton) abgegeben. Fische sind in den Kreislauf mit eingebunden, da diese das Zooplankton aufnehmen. Der Kreislauf wird durch die Entnahme von Meereslebewesen wieder geschlossen. Der Phosphorkreislauf ist also ein Zusammenspiel zwischen den Umwandlungen von Phosphat und Phosphor. In Organismen liegt mehr als die Hälfte des Phosphors in Phosphatform vor, der Rest in anorganischen Molekülen oder in organischen Verbindungen. Schwefelkreislauf Sulfat (SO42-) spielt im Schwefelkreislauf eine wichtige Rolle, da Schwefel hauptsächlich in Sulfatform in den Kreislauf gebracht wird. Sulfat kann zum Beispiel als Gips (CaSO4) oder als Bittersalz (MgSO4) gebunden sein. Pflanzen nehmen den Schwefel in Sulfatform über die Wurzeln direkt auf, und verstoffwechseln diesen durch Reduktionsvorgänge zu schwefelhaltigen Aminosäuren. Der von den Pflanzen aufgenommene Schwefel wird über die Nahrungskette an die Konsumenten weitergegeben, und über die Ausscheidungen wieder zurückgeführt. Die Ausscheidungen (organische Rückstände von Pflanzen und Tieren) werden durch Destruenten (zuerst durch Abfallfresser wie Würmer und Milben, und dann durch Mineralisierer (Bakterien, Pilze) zu anorganischen Stoffen abgebaut. Durch diesen Prozess gelangt der im Organismus gebundene Schwefel wieder in den Stoffkreislauf zurück. Der größte Teil des Schwefels wird durch diese Zersetzung wieder in den Kreislauf zurückgebracht. Auch durch Verwitterung von schwefelhaltigen Mineralien gelangt Schwefel in den Kreislauf. Sauerstoffkreislauf Der Sauerstoffkreislauf ist eng mit dem Kohlenstoffdioxid und dem Wasserkreislauf verbunden. Molekularer Sauerstoff ist für lebende Organismen ein starkes Zellgift. In der Luft hat sich ein stabiler Sauerstoffgehalt von ca. 21 Volumen -% eingestellt. Der Sauerstofftransport in den Ökosystemen erfolgt hauptsächlich mit Sauerstoff, der in Verbindungen wie Kohlenstoffdioxid, Wasser und Kohlenhydraten gebunden ist. Prinzipiell spielt Sauerstoff bei allen Oxidations- und Reduktionsvorgängen in allen Stoffkreisläufen eine entscheidende Rolle. O2 wird molekular in der Atmosphäre (durch Grünpflanzen) und in der Hydrosphäre (durch Algen) durch die Photosynthese freigesetzt. O2 -Verbraucher sind Land- (Mensch, Tiere) und Wasserlebewesen (Phytoplankton). Da bei Grünpflanzen in der Nacht die Vorgänge der Photosynthese umgekehrt ablaufen, zählen diese dann auch zu den O2- Verbrauchern. Bei Vulkanen reagiert freiwerdendes Kohlenmonoxid mit Sauerstoff in der Luft zu Kohlenstoffdioxid. Und auch in der Ozonschicht laufen ebenso sauerstoffbildende und sauerstoffverbrauchende Vorgänge ab. Atomaufbau Das Atom ist der kleinste chemisch nicht weiter teilbare Baustein der Materie. Im engeren Sinne sind Atome elektrisch neutral, jedoch werden oft auch Ionen unter dem Begriff Atom gefasst. Atome bestehen aus einem Atomkern mit positiv geladenen Protonen und elektrisch neutralen Neutronen und einer Atomhülle aus negativ geladenen Elektronen. Atome gleicher Anzahl der Protonen, der Kernladungszahl, gehören zu demselben Element. Bei neutralen Atomen ist Anzahl von Protonen und Elektronen gleich. Die physikalischen Eigenschaften der Atomhülle bestimmen das chemische Verhalten eines Atoms. Atome gleicher Kernladungszahl besitzen dieselbe Atomhülle und sind damit chemisch nicht unterscheidbar. Die Anzahl der Protonen in einem Atom ist die Kernladungszahl oder auch Ordnungszahl (Stellung des Elements im Periodensystem der chemischen Elemente), die Summe der Protonen und Neutronen die Massenzahl. Einfaches Bild eines Helium – Atoms. Zwei Elektronen umkreisen einen Kern aus zwei Protonen und zwei Neutronen. Das atomare Schalenmodell ist ein Atommodell, nach dem sich die Protonen und Neutronen eines Atoms im zentralen Atomkern und die Elektronen in um diesen angeordneten Schalen befinden. Die innerste Schale wird K-Schale genannt und fasst maximal zwei Elektronen; auf der nächsten Schale, der L-Schale, können maximal acht Elektronen untergebracht werden. Die weiter außen liegenden Schalen können zwar mehr als acht Elektronen enthalten, bei den Hauptgruppen-Elementen spielen diese zusätzlichen Elektronen aber so gut wie keine Rolle, so dass man von acht Elektronen pro Schale ausgehen kann. Mit dem Schalenmodell der Atome lassen sich die unterschiedlichen Eigenschaften der Elemente gut erklären. Die Alkalimetalle besitzen z.B. nur ein einziges Außenelektron (Valenzelektron) und können dieses besonders leicht abgeben (niedrige Ionisierungsenergie). Daher sind Alkalimetalle besonders reaktiv. Den Halogenen andererseits fehlt nur ein Elektron für eine voll besetzte Außenschale, daher nehmen sie gern Elektronen von anderen Elementen auf (z.B. von Natrium) und sind ebenfalls sehr reaktiv. Die Edelgase wiederum besitzen bereits eine voll besetzte Außenschale (Edelgaskonfiguration) und zeigen daher überhaupt keine Neigung, chemische Reaktionen einzugehen. Periodensystem der Elemente Nicht nach Atommasse geordnet Nach Kernladungszahl (Protonenanzahl) geordnet Jedes Element hat eine unterschiedliche Anzahl an Protonen Innerhalb einer Periode nimmt die Protonenanzahl von links nach rechts zu In den Spalten (Gruppen) sind die Elemente nach durch ihre Eigenschaften gruppiert 8 Hauptgruppen 1. Hauptgruppe (Wasserstoff – Alkalimetalle): z.B. H, Na, K Sind am leichtesten zu ionisieren. Sind immer einwertig positive (haben ein Elektron zu wenig), bilden Ionenbindungen 2. Hauptgruppe (Erd – Alkalimetalle): z.B. Mg, Ca Zweiwertig positiv. Unedle Metalle, bilden Ionenbindungen 3. Hauptgruppe (Bor – Gruppe): z.B. B, Al Erdmetalle, kovalente Bindungen (Elektronenpaarbindung) 4. Hauptgruppe (Kohlenstoff – Gruppe): z.B. C, Si, Pb, Sind Metalle, Nichtmetalle sowie Halbmetalle, bilden kovalente Bindungen 5. Hauptgruppe (Stickstoff – Gruppe): z.B. N, P Bilden kovalente Bindungen 6. Hauptgruppe (Chalcogene): O, S Sind zweifach negativ 7. Hauptgruppe (Halogene/Salzbildner): F, Cl Einwertig negativ, reaktionsfreudigsten Elemente 8. Hauptgruppe (Edelgase): He, Ne Extrem reaktionsträge WERTIGKEIT: Gibt an mit welcher Anzahl ein Atom ein anderes maximal binden kann z.B. 1 Stickstoffatom C (4 – wertig/ 4. Hauptgruppe) kann 4 Wasserstoffatome H (einwertig/ 1. Hauptgruppe) binden: CH4 IONENBINDUNG: Findet zwischen Metallen und Nichtmetallen statt, z.B. zwischen Natrium (Na) und Chlor (Cl). Dabei entsteht Na+Cl- : Natrium gibt dabei sein einziges Valenz – Elektron (Elektron auf der äußeren Schale ab), Chlor nimmt dieses Elektron auf, nun haben beide eine volle äußere Schale. ELEKTRONENPAARBINDUNG (Atombindung): Bildung von gemeinsamen Elektronenpaaren, erfolgt nur zwischen Nichtmetallen Unpolare Atombindung: z.B. O2, N2, H2, Cl2 Polare Atombindung: HCL, H2O (Molekül besitz zwei verschiedene Ladungsschwerpunkt, dieser resultiert aus der unterschiedlichen Elektronegativität der Element, sind in einem Element mehr Protonen vorhanden, werden von dort aus die Elektronen stärker angezogen) METALLBINDUNG: Die meisten Metalle der Hauptgruppen besitzen nur wenige Außenelektronen, oft 1 bis 3. Diese Außenelektronen der Metalle können leicht vom Metallatom abgegeben werden, da die Atomkerne auf die Außenelektronen nur geringfügige Anziehungskräfte ausüben. Dadurch entstehen positiv geladene Metall-Ionen und nahezu frei bewegliche Elektronen. Diese frei beweglichen Elektronen ermöglichen daher die gute elektrische Leitfähigkeit und die hohe Wärmeleitfähigkeit der Metalle. Man bezeichnet die freien Elektronen im metallischen Festkörper auch als Elektronengas, weil sich die Elektronen wie Gasteilchen frei bewegen können. Das Elektronengas befindet sich zwischen den Metall-Ionen. Man spricht auch von einer Elektronengaswolke. KOMPLEXBINDUNG: Entstehen durch Reaktion zwischen Zentralatom und Liganden (andere Atomgruppe), Liganden werden dabei an Zentralatom gebunden. Komplexbindungen nutzen die schon vorhandenen Bindungen (Atombindung, Ionenbindung, etc.) Zwei verschiedene Komplexbindungen: Zentralatom ist ein Nichtmetall: Zentralatom liefert das gemeinsame Elektronenpaar Zentralatom ist ein Metall: Ligand liefert das gemeinsame Elektronenpaar Säuren, Basen und Salze Säuren: Verwendung im täglichen Leben als z.B. Essigsäure, Zitronensäure, Kohlensäure Säuren entstehen immer aus Nichtmetalloxiden und Wasser. SO2 + H2O H2SO3 CO2 + H2O H2CO3 Säuren sind Wasserstoffverbindung. Sie dissozieren in positiv geladene H+ - Ionen und negativ geladene Säurerest – Ionen. Der Ph – Wert einer Säure liegt unter 7,0. Es gibt ein – und zweiwertige Säuren, je nach abdissozieren H+ - Ionen. Sauerstoffsäuren enthalten Sauerstoff, z.B. H2SO4 (Schwefelsäure) Sauerstofffreie Säuren, z.B. HCl (Salzsäure) Einteilung in starke (HCl, HF/Flusssäure, H2SO4, HNO3/Salpetersäure) mittelstarke (H3PO4/Phosporsäure) und schwache Säuren (H2CO3/Kohlensäure, H2SO3/schweflige Säure). Diese Einteilung entspricht nicht der Wirkung sondern dem Dissoziationsgrad. (Starke Säuren/Laugen dissozieren in Wasser vollständig, entsprechen dissozieren schwache Säuren/Basen unvollständig) Säure Kohlensäure Schweflige Säure Schwefelsäure Schwefelwasserstoff Salzsäure Essigsäure Formel H2CO3 H2SO3 H2SO4 H2 S HCL CH3COOH Säurerestion Karbonation Sulfition Sulfation Sulfidion Chloridion Azetation Basen/Laugen/Hydroxide: Verwendung im täglichen Leben als z.B. Salmiakgeist (Ammoniak in Wasser), Natronlauge (NaOH), Kaliumlauge (KOH), Laugen im ZementLaugen sind gefährlicher als Säuren, selbst in hoch verdünnter Konzentration haben sie Wirkungen auf Organismen, z.B. Schleimhautreizungen. Laugen entstehen immer aus Metalloxiden und Wasser. Na2O + H2O 2NaOH CaO + H2O Ca(OH)2 Ausnahme bildet Ammoniak (NH3 + H2O NH4OH). Sie dissozieren in positiv geladene Metall – Ionen und negativ geladene Hydroxid – Ionen (OH-). Der Ph – Wert einer Base liegt über 7,0. Die Wertigkeit richtet sich nach der Anzahl dissozierter Hydroxid – Ionen. Einteilung in starke (NaOH/Natronlauge, KOH/Kaliumlauge) und schwache Basen (Mg(OH)2/Magnesiumlauge) Base Natriumhydroxid Kaliumhydroxid Kalziumhydroxid Magnesiumhydroxid Aluminiumhydroxid Ammoniumhydroxid Formel NaOH KOH Cl(OH)2 Mg(OH)2 Al(OH)3 NH4OH Salze: Lebensgrundlage von Pflanzen (Düngemittel) Salze sind chemische Verbindungen (zumeist aus Metall und Nichtmetall), die eine aus Ionen bestehende Kristallstruktur haben. Prinzipiell kann man Salze als Reaktionsprodukte einer Säure mit einer Base auffassen. Salze sind eine neutrale Verbindung. Salze werden nach dem Säurerest benannt, Endungen z.B. id, at, it. Alle Salze die aus Sauerstofffreien Säuren entstanden sind enden mit id (z.B. Natriumchlorid NaCl) Metall + Säure = Salz + Wasserstoff (Zn + 2 HCl ZnCl2 + H2) Metalloxid + Säure = Salz + Wasser (CuO + H2SO4 CuSO4 + H2O) Säure + Lauge = Salz + Wasser (HCl + NaOH NaCl + H2O) Salz – Formel NaCl CaF2 FeS CaCO3 Na2SO4 KNO3 Na3PO4 CaSiO3 CH3COONa NaNO2 CaSO3 Name Natriumchlorid Kalziumfluorid Eisensulfid Kalziumkarbonat Natriumnitrat Kaliumnitrat Natriumphosphat Kalziumsilikat Natriumazetat Natriumnitrit Kalziumsulfit pH – Wert: Der pH-Wert ist der negative dekadische Logarithmus der Oxoniumionenkonzentration und damit ein Maß für die Stärke der sauren bzw. basischen Wirkung einer Lösung. Der Begriff leitet sich von pondus Hydrogenii oder potentia Hydrogenii (lat. pondus = Gewicht; potentia = Kraft; hydrogenium = Wasserstoff) ab. pH 0 bis <7 entspricht einer sauren Lösung pH 7 entspricht einer neutralen Lösung pH >7 bis 14 entspricht einer alkalischen Lösung Säure – Basen – Reaktionen: Protolyse: Protonen werden abgegeben und wieder aufgenommen (Chemische Reaktion) Neutralisation: HCl + NaOH NaCl + H2O (Säure + Lauge Neutralsalz und Wasser Hydrolyse: NaCl + H2O HCl + NaOH (Salz + Wasser Säure und Base) Pufferlösung: In einer Pufferlösung ändert sich der pH-Wert bei Zugabe einer Säure oder Base wesentlich weniger stark, als dies in einer ungepufferten Lösung der Fall wäre. Im Idealfall geht man davon aus, dass die zugegebene Säure oder Base komplett von der Pufferlösung abgefangen wird und sich der pH-Wert nicht ändert. Solche Lösungen enthalten eine Mischung aus einer schwachen Säure und ihrer konjugierten Base (oder des jeweiligen Salzes). Der pH-Wert bestimmende Faktor ist das Verhältnis bzw. das Protolyse – Gleichgewicht des Pufferpaares. Pufferlösungen bestehen immer aus einer schwachen Säure die als OH- - Ionenfänger wirkt und aus dem Salz der schwachen Säure, dem H+ - Ionenfänger. Aus einer starken Säure die ins Puffersystem gelangt wird eine schwache Säure. Pufferkapazität: Menge einer Säure/Base die hinzu gegeben werden muss um einen Liter einer Pufferlösung um den pH –Wert um eine Einheit zu verändern. Chemische Reaktionen: Zwei chemische Bestandteile reagieren miteinander. Es kommt zu einer neuen Chemischen Zusammensetzung (neuer Stoff) z.B. 2 Na + 2 H2O 2 NAOH + H2 Atome werden nicht neu gebildet und auch nicht zerstört. Chemische Teilchen müssen sich in einem Reaktionsraum befinden und aufeinander treffen (siehe Brownsche Molekularbewegung: thermisch getriebene Eigenbewegung der Moleküle) Exergonische Reaktion: Energie wird bei der Reaktion freigesetzt (Atmung) Endergonische Reaktion: Energie wird benötigt um eine Reaktion ablaufen zu lassen (Photosynthese) Durch Katalysatoren (z.B. Enzyme) wird die benötigte Aktivierungsenergie heruntergesetzt. Der Katalysator verbraucht sich dabei nicht. Redox – Reaktionen: Oxidation und Reduktion laufen bei der Redox – Reaktion immer nebeneinander ab. Klassische Definition: Reaktion mit Sauerstoff. Der Stoff, der dabei den Sauerstoff abgibt, ist das Oxidationsmittel, das die Oxidation des Reaktionspartners bedingt. Gleichzeitig ist der Stoff, der den Sauerstoff aufnimmt das Reduktionsmittel, das die Reduktion des Reaktionspartners ermöglicht, indem es durch die eigene exotherme Oxidation die benötigte Energie für die Reduktion liefert. S + O2 SO2 + Energie Schwefel bzw. Magnesium ist der Elektronendonator/ Sauerstoff der Elektronenakzeptor 2 Mg + O2 2 MgO + Energie Oxidationen finden auch ohne Beteiligung von Sauerstoff statt: 2 Fe + 3 Cl2 2 FeCl3 + Energie Reduktion: Im einfachsten Sinne ist eine Reduktion die Abgabe von Sauerstoff. Wenn z.B. rotes Quecksilberoxid gespalten wird, so handelt es sich um eine Reduktion: 2HgO → 2Hg + O2 Eine Erweiterung des Redoxbegriffes ergab sich, als festgestellt wurde, dass auch die Reaktionen, an denen kein Sauerstoff beteiligt ist, nach einem ähnlichen chemischen Prinzip ablaufen wie Redoxreaktionen mit Sauerstoffbeteiligung. Gemeinsam ist die Abgabe beziehungsweise Aufnahme von Elektronen. Nach der neuen Definition sind entsprechend Redoxreaktionen chemische Reaktionen, bei denen gleichzeitig eine Reduktion (Elektronenaufnahme), und eine Oxidation (Elektronenabgabe) statt findet; insgesamt werden ein oder mehrere Elektronen übertragen. Da in einem chemischen System keine freien Elektronen vorliegen können, ist die Reduktion eines Stoffes zwangsläufig von der Oxidation eines anderen Stoffes begleitet. Gleichzeitig ändern sich die Oxidationszahlen der Reaktionspartner: Das Reduktionsmittel gibt Elektronen ab und wechselt selbst in eine höhere Oxidationsstufe (es wird somit oxidiert); das Oxidationsmittel nimmt Elektronen auf und wechselt in eine niedrigere Oxidationssstufe (es wird somit reduziert). Chemie der Lithosphäre Die Lithosphäre umfasst die Erdkruste und Teile des Erdmantels. Die Mächtigkeit der Lithosphäre kann von wenigen Kilometern bei mittelozeanischen Rücken bis über 200 km bei alten kontinentalen Schilden variieren, und beträgt im Mittel etwa 100 km. 99 % der Lithosphäre bestehen aus nur 9 Elementen (49% O, 23% Si, 8% Al, 5% Fe, 4% Ca, Na, …) Die Pedosphäre (Bodenhülle) ist ein Teil der Geosphäre und bezeichnet die Trennschicht zwischen Atmosphäre und Lithosphäre. Die Pedosphäre makiert damit den Grenzbereich der Erdoberfläche, in dem sich die Lithosphäre, die Hydrosphäre, die Atmosphäre und die Biosphäre überschneiden. Sie kann dabei wenigen Dezimeter bis mehrere Meter Mächtigkeit haben. Durch die Verwitterung der Gesteine, die Zersetzung von biologischen Substanzen auf aeroben Weg kommt es zu einer Herausbildung eines Bodens. Je nach geographischer Breite beziehungsweise den geochemischen wie geologischen Randbedingungen, entwickelt sich ein anderer Bodentyp. Bodenbestandteile: Anorganische Bestandteile (Minerale) Abgestorbenes, teilweise zersetztes organisches Material Bodenorganismen (Pflanzen und Tiere) Bodenluft Bodenwasser Humus: Gesamtheit der im Boden befindlichen abgestorbenen organischen Substanzen (postmortalisches Material) Humus ist die bedeutendste Stickstoffquelle und reguliert Wasser-, Luft-, und Wärmehaushalt Tonminerale: Schichtförmig aufgebaute reaktive, quellfähige Alumosilikate mit Wassermolekülen in ihrer Struktur und geringen Mengen an Magnesium, Eisen, Natrium, Kalium und Calcium. Tonminerale sind kleine Teilchen mit großer Oberfläche. Ihre Funktionen sind Pufferwirkung, Ionenaustausch (Kationen binden und gegen andere austauschen) und Wasserspeicherung. Wichtigste Tonminerale: Kaolinit Montmorillonit Al4Si4O10(OH)8 Al2(SiO10)(OH)2 (3 – schicht Tonmineral) Aufbau eines Tonkomplexes Si – O – Tetraeder Al – O – OH – Oktaeder Si – O – Tetraeder Ca2+ Ca2+ Ca2+ K+ Si – O – Tetraeder Al – O – OH – Oktaeder Si – O – Tetraeder Ca2+ Ca2+ Ca2+ K+ Si – O – Tetraeder Al – O – OH – Oktaeder Si – O – Tetraeder Jeweils eine Elementarschicht besteht aus einer Schicht Al – O – OH – Oktaeder umgeben von zwei Si – O – Tetraeder Schichten Kationen sorgen für Zusammenhalt zwischen den Tonteilchen. Durch reversible Einlagerung von Wasser quellen die Tonteilchen auf. Dabei gilt: je mehr Wasser, desto mehr Quellung. Tonminerale als Ionenaustauscher: Zusammenspiel von Adsorption (Bindung von Nährelementen) und Desorption (Freisetzung von Nährelementen. Nährelemente sind als Ionen an Tonminerale gebunden. Ein zweiwertiges Ionen hat dabei eine höhere Bindungskraft wie ein einwertiges. Bei einem Überangebot von einwertiges Ionen können diese jedoch den Platz eines zweiwertigen Ions übernehmen. Ursachen für natürliche Bodenversauerung: Saurer Regen Humifizierung (Huminsäuren) Wurzelsäuren Optimale Verfügbarkeit von Nährstoffen für die Pflanzen: N, S P, B pH 7 – 8 pH 6 – 7 Ca, Mg Cu, Zn Fe, Mn Mo (Molybdän) pH > 7,5 pH 5 – 7 pH 3 pH > 8 Der Boden als Puffer: Je nach Zusammensetzung kann ein Boden Protonen in einem bestimmten Umfang reversibel oder irreversibel abfangen. Dabei sind die verschiedensten Bodenteilchen beteiligt. Bei Säureeintrag in den Boden wird zunächst Kalk aufgelöst: CO32- HCO3- CO2 (Karbonat – Pufferbereich) Pufferbereiche sind an pH – Werte des Bodens gebunden. Bei weiterem H+ - Eintrag übernehmen Tonminerale die Pufferung. Protonen (H+) können Nährstoff – Kationen wie K+, Ca+, Mg2+, ablösen und sich an ihrer Stelle anlagern. Für die Kationen besteht nun erhöhte Auswaschungsgefahr. Ab dem pH – Wert 4,2 übernehmen positiv geladene polymere Hydroxykomplexe des Aluminiums die Pufferung und wandeln in hydratisierte Aluminiumionen um (Al – Pufferbereich) Ab einem pH – Wert um 2 (Kommt in der Natur sehr selten vor), können Eisenhydroxide im Boden als Puffer wirken. pH 8,6 – 6,2 6,2 – 5,0 5,0 – 4,2 Pufferbereich Kalziumkarbonat (Bedeutendster Puffer, je mehr Karbonat, desto höher die Pufferwirkung) Silikat 4,2 – 3,0 Austauscher (Austausch puffersystem) Tonminerale Aluminium 3,0 - Eisen Reaktion CaCO3 +H2CO3 Ca2 + 2HCO3- Pflanzenhemmung Pufferkapazität Geringe Hemmung 300 kmol durch großes Ca/K H+/ %CaCO3 – Verhältnis und Anionenüberschuß CaAl2Si2O8 (Ca – Feldspat) + 2 H2CO3 + H2O Ca2+ + 2 HCO32 AlOOH + H+ + H2O Al2(OH)5+ Keine Hemmung 25 kmol Hemmung nicht toleranter Arten durch Aluminiumtoxizität Hemmung aller Pflanzen durch Aluminiumtoxizität und Kalkmangel Hemmung aller Pflanzen durch Al / Fe – Toxizität 7,5 kmol AlOOH + 3H+ Al3+ + 2 H2O FeOOH + 3 H+ Fe3+ + 2H2O 150 kmol Verwitterung: Die Verwitterung ist die Zerstörung / Auflösung erdoberflächennaher Gesteine und Mineralien durch physikalische, chemische und biogene Einflüsse oder Prozesse. Die dabei entstehenden Böden übernehmen zum großen Teil die wesentlichen Eigenschaften des Ausgangsgesteins (kalkhaltig, elementreich,…) Physikalische Verwitterung (mechanisch): Temperaturverwitterung: Durch unterschiedliche Erwärmung und somit unterschiedlicher Ausdehnung der verschieden Oberflächen kommt es zu Spannungen im Gefüge, die durch Risse oder Sprünge deutlich werden. Manche Materialien (z.B. Calcit) platzen dabei sogar parallel zur Oberfläche ab. Frostsprengung: Die Frostsprengung wird durch Wasser hervorgerufen, welches in kleine Risse und Klüfte des Materials eindringt und bei Temperaturen unter 0 °C gefriert. Diese Risse als Grundlage der Frostverwitterung gehen dabei aus tektonischen Prozessen wie beispielsweise einer Druckentlastung und anderen Verwitterungsarten wie zum Beispiel der Temperaturverwitterung hervor. Aufgrund der Dichteanomalie des Wassers vergrößert das Wasser beim Gefrieren sein Volumen um rund 9 %. Diese Volumenzunahme führt zur mechanischen Ausdehnung der Klüfte des Materials und damit zu einer Lockerung des Materialverbandes, eventuell sogar auch zur Absprengung einzelner Teilstücke. Die Sprengwirkung kann unter der Vorraussetzung einer Sättigung mit Wasser und Temperaturen um -22 °C einen Druck von 2100kg/cm² erreichen. Wurzelsprengung: Durch Eindringen und Dickenwachstum von Wurzeln in feine Risse werden Materialien ausgeweitet und gelockert. Es entstehen dabei Kräfte von etwa 10 kg/cm² Salzsprengung: Bei der Kristallisation von Salzkristallen im Zuge der Verdunstung von Wasser aus einer salzhaltigen Lösung vergrößern die Salze ihr Volumen und üben einen Druck auf sie umgebenden Kluftgrenzen aus. Sie haben daher, wie das Eis bei der Frostverwitterung, eine Ausweitung der Gesteinsklüfte zur Folge. Dabei wirken Kräfte von 1000 kg/cm². Biologische Verwitterung: Es handelt sich hierbei um eine von Pflanzen und Tieren verursachte Verwitterung. Die von diesen Lebewesen abgesonderten Huminsäuren greifen Gesteine und Mineralien an und zerlegen diese. Vor allem der aus abgestorbenen pflanzlichen und tierischen Resten bestehende Humus enthält in hohe Masse Huminsäuren. Auch Pflanzen geben Wurzelsäuren ab, die in Kombination mit Wurzelsprengung an der Verwitterung beteiligt sind. Chemische Verwitterung: Lösungsverwitterung Die Lösungsverwitterung greift vor allem Salz- und Karbonatgesteine an, deren Minerale in Lösung gehen oder Kristallwasser aufnehmen. Im einfachsten Fall werden Salze im Boden durch einsickerndes Wasser herausgelöst, wodurch Hohlräume einstürzen können (siehe Dolinen auf der schw. Alb). Kohlensäureverwitterung Kohlensäure (H2CO3) bildet sich in der Natur zum Beispiel durch Lösung des in der Luft enthaltenen Kohlendioxids (CO2) im Regenwasser (H2O). Kalkstein besteht hauptsächlich aus dem schwer wasserlöslichen Calcit (CaCO3). Kohlensäure löst Calcit und es entsteht Kalziumhydrogenkarbonat (Ca(HCO3)2), das sich sehr gut im Wasser löst. Salz + H2O + CO2 Kohlensäure Dort wo also viel CO2 vorhanden ist, verläuft die Verwitterung schneller ab. Rauchgasverwitterung Hierbei handelt es sich um eine Verwitterungsart bedingt durch Rauchgasemissionen aus anthropogenen und vulkanischen Quellen. Rauchgas besteht vor allem aus Kohlendioxid, Schwefeldioxid, Stickstoffoxid und Wasserdampf. Bei unvollständigen Verbrennungen können auch noch andere Gase in großen Mengen entstehen, wie zum Beispiel Kohlenmonoxid oder Wasserstoff. Rauchgas zeigt je nach Zusammensetzung ein in der Regel sehr aggressives chemisches Verhalten, weshalb es auch dazu neigt andere Materialien anzugreifen und zu zersetzen. Saurer Regen und die damit verbundenen Verwitterungserscheinungen nach dem Typ der Salzverwitterung sind die Folge. Oxidationsverwitterung Besonders bei Gesteinen, die Eisen, Schwefel oder Mangan enthalten, kann der Luftsauerstoff in Verbindung mit Wasser chemische Reaktionen hervorrufen. Oxide werden gebildet (Veränderte Lösungseigenschaften.) Mit der Oxidationsverwitterung geht eine deutliche Farbänderung des Materials einher. Hydrolytische Verwitterung Durch die Anlagerung von Wassermolekülen an die Ionen eines Kristallgitters entsteht zum einen Druck durch Volumenvergrößerung, zum anderen werden H+-Ionen des Wassers gegen Ionen des Minerals ausgetauscht. z.B. Kalifeldspat (K, Al, Si) + H2O. Kalium wird zu Kaliumkarbonat, Aluminium wird hydroxiert und Silicium wird oxidiert. Das hydroxierte Aluminium und das oxidierte Silicium bilden Tonminerale. Chemie der Hydrosphäre Als Hydrosphäre bezeichnet alle an der Erdoberfläche befindlichen oder oberflächennahen mit flüssigem Wasser erfüllten Räume. Hierzu gehören die Weltmeere, Flüsse, Seen, aber auch das Grundwasser. Die Hydrosphäre bedeckt etwa 70 % der Erdoberfläche und beeinflusst das Klima und die Biosphäre in vielfältiger Weise. Eigenschaften des Wassers Dipol: Sauerstoff hat eine höhere Elektronegativität als der Wasserstoff. Durch die dreieckige Geometrie des Moleküls und die unterschiedlichen Teil - Ladungen der Atome hat es auf der Seite des Sauerstoffs negative und auf der Seite der beiden Wasserstoffatome positive Polarität Kohäsionskraft: Der Zusammenhalt oder auch die innere Eigenfestigkeit (Kohäsion) eines Stoffes wird durch die gegenseitige Anziehungskraft zwischen Molekülen eines Stoffes verursacht. Oberflächenspannung: Wasser weist eine vergleichsweise große Oberflächenspannung auf, da sich die Wassermoleküle gegenseitig relativ stark anziehen. Die Oberflächenspannung nimmt bei zunehmender Temperatur ab. Wärmebewegung Hohe Wärmekapazität: Das bedeutet, dass Wasser vergleichsweise viel Energie aufnimmt und sich die Temperatur dabei wenig erhöht und dass es beim Abkühlen ebensoviel Energie wieder abgibt. Guter Wärmeleiter Dichteanomalie: Normalerweise weist ein Stoff seine größte Dichte im Festzustand bei 0 K auf. Wasser jedoch besitzt seine höchste Dichte bei 4°C. Das heißt, Wasser dehnt sich bei Temperatur unter 4°C wieder aus. Löslichkeit von Stoffen: Wasser kann durch seine polaren Eigenschaften gut polare Stoffe lösen. Dabei wird in warmem Wasser die Löslichkeit erhöht. Unpolare Stoffe sind in Wasser nicht löslich (Fette, Öle) Dissoziation von Salzen, Säuren und Basen: In Wasser wird der Zerfall eines Moleküls in seine Bestandteile angeregt oder er läuft selbsttätig ab. (Zucker in Kaffee) Löslichkeit von Gasen: Siehe Sprudel (Wärme abhängig) oder Sauerstoff in Wasser für Lebewesen Wasserhärte: Die Härte des Süßwassers ist ein Maß dafür, wie gut es sich zum Waschen eignet und wie weit es zur Verkalkung von Leitungen oder Maschinen führt (Kesselstein). Dafür ist der Gehalt an Erdalkali-Verbindungen entscheidend. Das sind im wesentlichen Kalzium- und Magnesium-Verbindungen sowie in Spuren Barium und Strontium. Das ist nicht der gesamte Salzgehalt des Wassers; natürliches Wasser enthält auch Natrium- und Kalium-Verbindungen und andere Salze in geringen Mengen. Die Bezeichnung "hartes" Wasser kommt ursprünglich daher, dass sich früher, als man Wäsche noch mit Seife wusch, die Kalzium- und Magnesiumsalze der Seifen in der Wäsche festsetzten. Dies führte nach dem Trocknen dazu, dass sich der Stoff hart anfühlte. Entstehung der Wasserhärte: Kohlendioxid-haltiges Niederschlagswasser löst in Gesteinsschichten Mineralien heraus. Die unterschiedliche Wasserhärte hängt von der Gesteinsschicht und Verweildauer des Wassers in dieser Schicht ab. Beim Kochen geschieht folgendes: Kalzium/Magnesium-Hydrogenkarbonat + Wärmeenergie --> Kalzium/Magnesium-Karbonat + Kohlensäure Die Kohlensäure entweicht beim Kochen aus dem Wasser, so dass beim Abkühlen die entstandenen Karbonate nicht wieder gelöst werden können: sie setzen sich als Kesselstein ab. Die Wasserhärte wird in Deutschland in Grad deutscher Härte, °dH gemessen: Härtebereich 1: weiches bis mäßig hartes Wasser 0° - 10° dH Härtebereich 2: ziemlich hartes Wasser 10° - 16° dH Härtebereich 3: hartes Wasser über 16° dH Einträge ins Gewässer Nitrat, Nitrit, Ammonium: Phosphat: Landwirtschaft, Haushalte und gewerbliche Abwässer Landwirtschaft, Haushalte und gewerbliche Abwässer, chemische Industrie, Metallverarbeitung Salze (Chlorid, Sulfat): Kaliwerke Schwermetalle: Chemische Industrie, Lacke und Farben, Bootsanstriche, Galvanische Betriebe Pflanzenschutzmittel: Landwirtschaft und Forstwirtschaft Tenside: Haushalt, Gewerbliche Abwässer, Endokrin wirksame Stoffe: Haushalte, Gewerbliche Abwässer, Gummi – und Kunststoffindustrie Organochlorverbindungen: Chemische Industrie, Landwirtschaft Gewässergüte Physikalisch – chemisch Beurteilung nach O2 – Gehalt im Wasser pH – Wert (Wasserpflanzen haben eine breite pH - Wert Toleranz) NH4+ (Ammonium), ab pH 8 wandelt sich Ammonium in Ammoniak um (giftig) CSB (chemischer Sauerstoffbedarf), Messung organischer Anteile im Wasser Sauerstoffverbrauch TOC: Der gesamte organische Kohlenstoff oder TOC (engl.: total organic carbon) ist ein Summenparameter in der Wasser- bzw. Abwasseranalytik und spiegelt die Belastung des Wassers/Abwassers mit organischen Stoffen wieder. Der TOC wird in mg/l angegeben und meist in automatisierten Messverfahren ermittelt. Saubere Gewässer weisen einen TOC-Gehalt von 1-2 mg/l auf. In stark verschmutzten Gewässern kann der Wert auf über 10 mg/l steigen. AOX: Menge an adsorbierten Halogenen Temperatur: wichtig für Wachstum und Löslichkeit von Gasen Sichttiefe: Die Secchischeibe (nach Angelo Secchi) dient der Schätzung der Sichttiefe im Wasser und damit als Schätzmethode für die Abnahme der Lichtintensität im Wasser. Es handelt sich hierbei um eine weiße oder auch schwarz/weiße Scheibe von rund 25 cm Durchmesser, welche mit einigen Löchern perforiert ist. An einer markierten Leine wird diese in die Tiefe versenkt, bis ihrer Umrissen gerade eben verschwinden. Leitfähigkeit Ökomorphologische Beurteilung nach Naturnähe Ausbauzustand Aus beiden ergeben sich Natürlichkeitsklassen: 1 : natürlicher Zustand 2: Zustand wenig beeinträchtigt 3: Zustand stark beeinträchtigt 4: Naturfremder Zustand Biologische Beurteilung bei Fließgewässern: Saprobien – Index: Die Saprobie (biologische Gewässergüte) zeigt die Belastung der Fließgewässer mit organischen, biologisch abbaubaren Stoffen an. Diese werden von Bakterien, Pilzen und Einzellern unter Verbrauch von Sauerstoff abgebaut. Aber auch die höheren Tiere wie Würmer, Kleinkrebse und Insektenlarven mit ihren unterschiedlichen Ernährungsweisen und Sauerstoffbedürfnissen sind wichtige Indikatoren der Saprobie. Dabei haben verschiedene Organismen unterschiedliche Reaktionszeiten auf Umwelteinflüsse: Bakterien, Pilze, Algen, Rädertierchen reagieren innerhalb von Sekunden bis Tagen, Insekten innerhalb (von Tagen) bis Monaten, Krebse und höhere Pflanzen oft erst innerhalb von Jahren. An Probestellen zur Erfassung der Gewässergüte werden die verschiedenen Teillebensräume (z.B. Steine, Holz, Sand, Schlamm, Pflanzen) nach den vorkommenden Gewässerorganismen abgesucht und die gesammelten Tiere (Mikround Makroorganismen) bestimmt. Aus der Häufigkeit der Arten und den spezifischen Saprobiewerten wird dann der Saprobienindex berechnet. Die vier Gewässergütestufen des Saprobiensystems werden durch drei Zwischenstufen ergänzt, so dass eine biologische Klassifikation eines Fließgewässers in sieben Stufen möglich ist: Güteklasse I (unbelastet bis sehr gering belastet, Kartierung in dunkelblau): Reines, stets annähernd sauerstoffgesättigtes Wasser, nährstoffarm, geringer Bakteriengehalt, mäßig dicht besiedelt. Laichgewässer für Salmonidae. Nur in Quellbächen und anthropogen unbeeinfußten Gebieten. Saprobienindex kleiner 1,5, Sauerstoffgehalt 95-105%, BSB5 ca. 1 mg/l. Güteklasse I-II (gering belastet, Kartierung in hellblau): Geringe organische oder anorganische Nährstoffzufuhr, keine nennenswerte Sauerstoffzehrung. Vielfältige und dichte Besiedlung. In der Regel Oberläufe von Gebirgs- und Mittelgebirgsbächen. Saprobienindex 1,5-1,8, Sauerstoffsättigung 85-95%, BSB5 1,0-2,0 mg/l, Ammonium bis 0,1 mg/l. Güteklasse II (mäßig belastet, Kartierung in dunkelgrün): Mäßige Verunreinigung und noch gute Sauerstoffversorgung. Sehr große Artenvielfalt und Individuendichte: Algen, Schnecken, Kleinkrebse, Insektenlarven, insbesondere große Flächen mit Wasserpflanzen. Ertragreiche Fischgewässer. Mittel- und Unterläufe großer Flüsse und sommerwarme Flachlandbäche. Saprobienindex 1,8-2,3, Sauerstoffgehalt mehr als 6 mg/l, BSB5 2-6 mg/l, Ammonium bis 0,3 mg/l. Güteklasse II-III (kritisch belastet,Kartierung in gelbgrün): Belastung mit organischen sauerstoffzehrenden Stoffen bewirkt kritischen Zustand. Fischsterben wegen Sauerstoffmangels möglich, Artenrückgang bei Makroorganismen, Massenentwicklungen auch von Algen. Saprobienindex 2,3-2,7, Sauerstoffsättigung zum Teil weniger als 50%, BSB5 5-10 mg/l, Ammonium bis 1,0 mg/l. Güteklasse III (stark verschmutzt,Kartierung in gelb): Starke organische sauerstoffzehrende Verschmutzung und dadurch meist niedriger Sauerstoffgehalt. Örtlich Faulschlammablagerungen und Kolonien von fadenförmigen Abwasserbakterien. Populationen von Schwämmen, Egeln, Wimpertierchen und Wasserasseln größer als der Algen. Geringe Fischereierträge, periodisches Fischsterben. Saprobienindex 2,7-3,2, Sauerstoffgehalt zum Teil unter 2 mg/l, BSB5 7-13 mg/l, Ammonium über 0,5 mg/l; kann bis zu mehreren ml/l erreichen. Güteklasse III-IV (sehr stark verschmutzt,Kartierung in orange): Weitgehend eingeschränkte Lebensbedingungen durch Verschmutzung und geringen Sauerstoffgehalt; verstärkt durch toxische Stoffe. Zeitweilig totaler Sauerstoffschwund. Trübung durch Abwasserschwebstoffe, Faulschlammablagerungen mit Zuckmückenlarven und Schlammröhrenwürmer. Abwasserpilz bedeckt Gewässergrund, deutlicher Abwassergeruch. Kaum Fischpopulationen. Saprobienindex 3,2-3,5, Sauerstoffgehalt unter 1 mg/l, BSB510-20 mg/l, Ammonium mehrere mg/l, oft auch toxische Stoffe. Güteklasse IV (übermäßig verschmutzt, Kartierung in rot): Übermäßige Verschmutzung durch organische sauerstoffzehrende Abwässer, Fäulnisprozesse vorherrschend. Sauerstoff über lange Zeiten nur in sehr niedrigen Konzentrationen oder nicht vorhanden. Besiedlung nur durch Bakterien und Geißeltierchen, zeitweilige biologische Verödung. Abwasserpilz und Schwefelbakterien lassen Gewässer weiß erscheinen. Saprobienindex größer 3,5, Sauerstoffgehalt gegen 0 mg/l, BSB5 mehr als 15 mg/l, Ammonium mehrere mg/l, auch toxische Stoffe. Nach der Wiedervereinigung wurde eine achte Güteklasse eingeführt, die seit 1995 aber nicht mehr verwendet wird: Güteklasse V (ökologisch zerstört): Biologisches Gleichgewicht zerstört, keine Besiedlung oder nur durch spezialisierte Bakterien. Insbesondere anaerobe Gewässer mit Sulfatreduktion und sehr starker toxischer Belastung. Biologische Beurteilung von Stehenden Gewässern Da die biologische Zonierung in stehenden Gewässern eine andere als in Fließgewässern ist, eignet sich das Saprobiensystem nur sehr beschränkt zur Qualitätsbeurteilung von stehenden Gewässern. Deshalb werden stehende Gewässer mit dem Trophiensystem nach dem Grad ihrer Trophierung in Trophiestufen gemessen. Oligotroph (Trophiestufe I): Oligotroph sind Gewässer mit wenig Nährstoffen und daher geringer organischer Produktion. Die geringe Phosphatzufuhr begrenzt das Pflanzenwachstum. Das Plankton ist zwar artenreich aber individuenarm. Das Gewässer bietet nur wenigen Fischen Lebensraum. Oligotrophe Gewässer haben meist bekieste Ufer mit geringem Pflanzenbewuchs, sie sind sehr klar. Das Wasser erscheint blau bis grün. Die Sauerstoffsättigung am Ende der Sommerstagnation liegt bei mehr als 70%. Die Sichttiefe beträgt bis zu 6 m, allerdings mindestens 3 m). Mesotroph (Trophiestufe II): Mesotroph werden Gewässer genannt, die sich in einem Übergangsstadium von der Oligotrophie zur Eutrophie befinden. Der Nährstoffgehalt ist höher und Licht kann noch in tiefere Wasserschichten eindringen. Mit zunehmender Dichte des Phytoplanktons ändert sich die Eindringtiefe des Lichtes. Die Sichttiefe beträgt noch mehr als zwei Meter und die Sauerstoffsättigung am Ende der Sommerstagnation zwischen 30 und 70%. Eutroph (Trophiestufe III): Eutroph sind Gewässer mit hohem Nährstoffgehalt und daher hoher Produktion von Biomasse. Die untere Wasserschicht eutropher Gewässer ist im Sommer sehr sauerstoffarm, die obere dagegen übersättigt mit Sauerstoff. Das Plankton ist sehr arten- und individuenreich. Der Grund des Gewässers ist mit einer anaeroben Faulschlammschicht bedeckt, die massenhaft mit Schlammröhrenwürmern und Zuckmückenlarven besiedelt sind. Nach der Frühjahrs-Vollzirkulation tritt häufig Algenblüte auf. Das Wasser ist trüb und meist grünlich bis gelbbraun gefärbt. Die Sichttiefe liegt in der Regel unter zwei Metern und die Sauerstoffsättigung am Ende der Sommerstagnation unter 30%. Hypertroph (Trophiestufe IV, auch Polytroph): Hypertroph nennt man Gewässer, bei welchen die Eutrophierung so weit fortgeschritten ist, dass im Gewässer zum Ende der Sommerstagnation der Sauerstoff weitgehend aufgebraucht ist. Nur die obersten Wasserschichten weisen für spezialisierte Organismen noch tolerierbare Wachstumsbedingungen auf. Nachts und morgens kommt es häufig zu Fischsterben. Die Sichttiefe liegt unter einem Meter. Eutrophierung Kurz nach der Frühjahrs-Vollzirkulation ist die Wachstumsrate von Algen auf Grund der steigenden Temperaturen, besseren Lichtverhältnissen und ausreichender Versorgung mit Nährsalzen sehr hoch, was zur Wassereintrübung (Algenblüte) führt. Dadurch ist in den unteren Schichten des Gewässers nicht mehr genügend Licht vorhanden, es kommt dort zum Absterben der Algen. Eine Zunahme von Algen bedeutet zunächst eine Sauerstoff- und Nahrungsanreicherung für das Gewässer. Dadurch finden Konsumenten wie Herbivoren und Carnivoren optimale Wachstumsbedingungen vor. Das Phytoplankton (Algen) vermehrt sich explosionsartig, wodurch die Zooplanktonen ein erhöhtes Nahrungsangebot vorfinden. Da das Zooplankton aber auch Sauerstoff verbraucht, geht der Sauerstoffgehalt des Wassers kurzerhand stark zurück. Das schnelle Sterben der Organismen, was zum Teil durch die Sauerstoffverknappung begünstigt wird, bewirkt ein Absinken der toten Biomasse auf den Grund des Sees. Dort wird diese bakteriell abgebaut, was zuerst noch auf aerobe Weise, also unter Sauerstoffverbrauch geschieht. Das führt schließlich zu einer völligen Sauerstoffarmut, sodass die Biomasse nur noch von anaeroben Destruenten abgebaut werden kann. Hierbei entstehen Ammoniak, Methan und Schwefelwasserstoff, die Zellgifte darstellen. Bei Vollzirkulation können diese Giftstoffe auch in die obere Wasserschicht gelangen. Da der anaerobe Abbau wesentlich langsamer abläuft als der aerobe, häuft sich am Boden Faulschlamm an. Oligotrophe und eutrophe Seen befinden sich im Gleichgewicht, aber auf unterschiedlichem Niveau des Biomasse-Umsatzes: Schwankungen der Umweltbedingungen können bis zu einer gewissen Grenze der Belastung ausgeglichen werden („Selbstreinigungskraft“ der Gewässer). Ist die Störung des Gleichgewichtes so groß, dass sie nicht mehr rückgängig gemacht werden kann, geht der See in einen anderen Zustand über, wobei die Hypertrophierung der stabilste (aber nicht gerade der positivste) Zustand ist, da ein umgekipptes Gewässer ohne Einfluss von außen nicht mehr in einen oligo- oder eutrophen Zustand zurückkehren kann.