Mit Skizzen unterrichten - Fachdidaktik Chemie ETH
Werbung
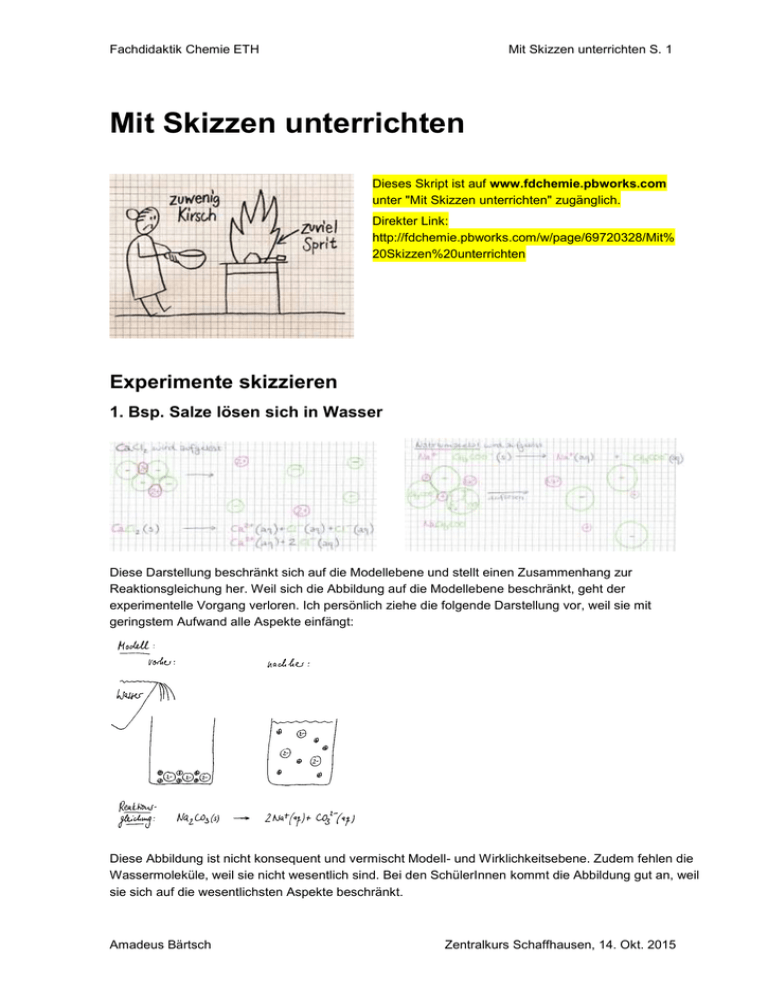
Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 1 Mit Skizzen unterrichten Dieses Skript ist auf www.fdchemie.pbworks.com unter "Mit Skizzen unterrichten" zugänglich. Direkter Link: http://fdchemie.pbworks.com/w/page/69720328/Mit% 20Skizzen%20unterrichten Experimente skizzieren 1. Bsp. Salze lösen sich in Wasser Diese Darstellung beschränkt sich auf die Modellebene und stellt einen Zusammenhang zur Reaktionsgleichung her. Weil sich die Abbildung auf die Modellebene beschränkt, geht der experimentelle Vorgang verloren. Ich persönlich ziehe die folgende Darstellung vor, weil sie mit geringstem Aufwand alle Aspekte einfängt: Diese Abbildung ist nicht konsequent und vermischt Modell- und Wirklichkeitsebene. Zudem fehlen die Wassermoleküle, weil sie nicht wesentlich sind. Bei den SchülerInnen kommt die Abbildung gut an, weil sie sich auf die wesentlichsten Aspekte beschränkt. Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 2 2. Bsp. Fällungsreaktionen Sie demonstrieren die Fällung von Kalk und erklären die Reaktion an der Wandtafel. Die Schülerinnen und Schüler schreiben mit. Vorschlag für die Wandtafeldarstellung. Eine ähnliche Art der Darstellung findet sich auch in Lehrbüchern: Quelle: Elemente, Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer, Zug, S. 154 (2008) Chemie heute SII, Schroedel, Braunschweig, 2009 R. E. Dickerson & I. Geis, Chemie - eine lebendige und anschauliche Einführung, Verlag Chemie, Weinheim, 1981 Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 3 3. Bsp. Viele Salze enthalten Kristallwasser CuSO4 · 5 H2O CuSO4 + 5 H2O Kupfer(II)-sulfat Pentahydrat wird zu wasserfreiem Kupfer(II)-sulfat und Wasser Hier ist die Wahrnehmungs- und Teilchenebene sauber getrennt und doch so nahe beieinander, dass klar wird, was zusammen gehört. Skizzen haben viele Vorteile Flaschen müssen nicht angeschrieben werden Graphiken sind prägnant Die Erklärung kann entwickelt werden Schreibende Schüler, befassen sich länger mit dem Thema Jetzt oder nie! Mein Grundsatz: Experimente immer skizzieren! Schülerinnen haben das Experiment in den Unterlagen Ich setze einen Titel, beschrifte die Geräte und vergesse die Ziele nicht Es wird klar wo die Substanzen sind und die chemischen Reaktionen ablaufen. Skizzen vermitteln zwischen Beobachtung und Reaktionsgleichung, zwischen Wirklichkeits- und Modellebene Nachteile Die Darstellung muss gut überlegt werden Skizzieren muss geübt werden Tipp Die Skizze gut überlegen und so lange verbessern, bis sie übersichtlich ist und mit wenig Text viel aussagt. Schüler übernehmen die Skizze unverändert. Ist sie nach 2 Wochen immer noch verständlich? Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 4 Apparaturen skizzieren 1. Destillation Selten passen die Abbildungen aus dem Internet zur tatsächlich verwendeten Apparatur. Statt selber eine Abbildung zu entwerfen oder die Bilder zu bearbeiten, fordere ich die SchülerInnen auf, die Apparatur zu skizzieren. Vorgehen IU: Rotweinflasche zeigen. Wir wollen herausfinden, woraus Wein besteht. Alle nach vorn bitten Sagen, dass die Apparatur skizziert werden muss Aufbau und Funktion der Apparatur erklären Destillation starten Schüler gehen an den Platz und skizzieren mit Bleistift. Die Lehrperson geht durch die Klasse, hilft und kritisiert individuell und zeigt manchmal einen Kühler. Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 5 Einige Skizzen werden projiziert und die Apparaturen im Plenum verglichen. Für den Fall, dass keine brauchbare Skizze dabei ist, zeige ich meine Version. Skizzen mit Fachbegriffen ergänzen 2. Erdgas verbrennen und Abgase analysieren Experiment: Welche Abgase entstehen bei der Verbrennung von Erdgas CH 4? Auftrag: Abbildung so beschriften, dass das Experiment auch in 2 Monaten noch verständlich ist. Damit CH4 zu CO2 und H2O wird, wird Sauerstoff aus der Luft benötigt. Aus dem Experiment kann in der Anfangsphase des Chemieunterrichts die Reaktionsgleichung entwickelt werden. Was bringen Skizzen von Apparaturen? Skizzen zwingen zur Vereinfachung: Die SuS lernen Wichtiges von Unwichtigem zu unterscheiden. Skizzen werden entwickelt. Abbildungen verraten oft das Resultat, bevor man nachgedacht hat. Bild und Text stehen nahe beieinander. Ideen und Fragen der Klasse können jederzeit eingebaut werden Einfache Skizzen können von den Schülerinnen und Schülern ohne weiteres übernommen werden. Sind die Abbildungen zu perfekt, müssen oft Kopien abgegeben werden. Wenn Schülerinnen und Schüler selber skizzieren, setzen sie sich aktiv mit dem Unterrichtsgegenstand auseinander. Sie müssen ein Gerät durchschauen, wenn sie eine Skizze entwerfen und genau beobachten, wenn sie ein Experiment festhalten. Die Lehrperson braucht nur in der Klasse zu zirkulieren, wenn sie feststellen will, was in den Köpfen angekommen ist. Anders als bei einem Text genügt schon ein Blick auf die Skizzen. Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 6 Skizzen in Prüfungsfragen 1.Bsp. Warum sind Flugzeuge viel schneller als Schiffe? Bitte argumentiere mit dem Teilchenmodell Tabitha Hughes (14): Janez Krebs (14): Simon Felix (14): "Die Teilchen in der Luft sind nicht eng zusammen und bewegen sich sehr schnell für ein Flugzeug ist es einfacher sie zu durchqueren. Das ist auch der Grund warum Jets so weit oben fliegen da ist die Luft dünner = tiefere Dichte." Alessandro Vitali (14): "In der Luft gibt es weniger Widerstand als im Wasser: Luftteilchen sind weiter voneinander entfernt, bzw. die Dichte von Luft ist kleiner. Im Wasser ist die Dichte und somit der Widerstand grösser, mehr Teilchen müssen beiseite geschoben werden. Zudem sind Flugzeuge aerodynamischer und meistens auch kleiner." Nina Dahinden (14): Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 7 2. Bsp. Wie kann man mit Gold und Magnesium eine Batterie bauen? a) Erklären Sie die Batterie mit einer Skizze und schreiben Sie alle Bestandteile an. b) Welche Reaktionen laufen ab? c) Welche Spannung erreicht die Batterie? Die Schülerinnen und Schüler haben die formalen Teilaufgaben b) und c) meist gut gelöst. Die Skizzen zeigen jedoch Mängel im Verständnis der Prozesse. 3. Bsp. In einer Elektrolyse wird Kupfer mit Gold überzogen. a) Skizzieren Sie das Experiment und beschriften Sie die wesentlichen Teile. b) Formulieren Sie Reduktion und Oxidation. Lösung: a) b) Die Batterie oder eine andere Stromquelle überträgt Elektronen auf das Kupfer. Dort findet die Reduktion statt: Au3+ + 3 e Au Der Plus-Pol der Batterie saugt Elektronen ab: Ox: Au Au3+ + 3 e Der Plus-Pol besteht aus Gold und löst sich allmählich auf. In der Lösung bleibt die 3+ Konzentration von Au konstant. Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 8 4. Bsp. Nebel a) Zeichne Nebel im Teilchenmodell und schreibe die Teilchen an. b) Warum verschwindet der Nebel um die Mittagszeit häufig und macht der Sonne Platz? Voraussetzung: In der Stunde wurde Luft im Teilchenmodell dargestellt Lösung a) Gasförmige Teilchen haben grosse Abstände. Im Nebel gibt es Luft und Wasser (1P). Luft besteht aus Stickstoff und Sauerstoff (1P). Im Nebel gibt es winzige Wassertröpfchen (1P), die die Sicht behindern. Stickstoff Sauerstoff Wasser b) Die Sonne erwärmt den Nebel. Die Teilchen werden schneller. Das Wasser verdunstet und die Tröpfchen werden zu Wasserdampf. Einzelne Teilchen sind nicht sichtbar (1P) Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 9 Aufgaben im Chemieunterricht 1. Skizzen um einen Text zu vertiefen Die Wärmebewegung Stoffteilchen wie Ionen oder Moleküle lassen sich infolge ihrer Kleinheit (...) visuell (mit den Augen) nicht erfassen. Trotzdem gibt es viele Fakten – nachstehend werden einige erwähnt –, die unmißverständlich zeigen, daß diese kleinen Stoffteilchen in fortwährender, ungeordneter Eigenbewegung sein müssen! Öffnet man z.B. in einem Zimmer eine Flasche, die eine stark riechende Stoffart enthält, so stellt man nach und nach diesen Geruch im ganzen Zimmer fest, auch wenn keine feststellbare Luftbewegung vorhanden ist. Dabei bemerkt man den Geruch zuerst in der Nähe der Flasche, später aber auch in weiterer Entfernung. Riechen kann man einen Stoff nur dann, wenn dessen Teilchen auf die Sinneszellen der Nasenschleimhaut gelangen; sie provozieren dort Reaktionen, welche über die Nervenbahnen ins Gehirn "gemeldet" werden; dieses erzeugt dann die von uns wahrgenommene Geruchsempfindung. Ohne Eigenbewegung der Stoffteilchen wäre es völlig undenkbar, daß diese "von selbst" die Flasche verlassen, sich durch die Luft hindurch ausbreiten und auf die Nasenschleimhaut gelangen könnten! Auch der Gasdruck läßt sich ohne die fortwährende Eigenbewegung der Gasteilchen nicht erklären. Eingeschlossene Gase üben auf die Gefäßwände eine Druck-Kraft aus, was ohne weiteres an prallen Bällen oder Autoreifen erkannt wird. In Gasen liegen aber die Teilchen nicht beisammen! Beweis: könnte man denn einen Ball oder einen Autoreifen (deren Volumen vorgegeben sind) noch stärker aufpumpen, d.h. noch mehr Gasmoleküle einfüllen, wenn kein Platz mehr da wäre? Wenn nun also Gasteilchen, die nicht beisammen liegen, trotzdem fortwährend (auch "oben"!) auf die Gefäßwände drücken, so müssen sie infolge ihrer Eigenbewegung "wie ein Hagelwetter" auf die Gefäßwände prasseln, an denen sie zurückprallen; diese fortwährenden Stöße erzeugen die beobachtbare und meßbare Druck-Kraft. Die Intensität der Eigenbewegung der Stoffteilchen hängt von der Temperatur (Wärmezustand) ab; daher spricht man von der Wärmebewegung oder thermischen Bewegung (thermos: Wärme) der Stoffpartikeln. Erwärmt man z.B. ein Gefäß, das ein Gas enthält, so wird die Druck-Kraft größer (Bälle oder Autoreifen werden praller). Da also bei höherer Temperatur die gleiche Gasteilchenzahl im vorgegebenen Volumen eine größere Druck-Kraft erzeugt, heißt dies, daß die Gasteilchen heftiger auf die Gefäßwände prallen. – Kühlt man hingegen ab, so nimmt auch der Gasdruck ab, was zeigt, daß die Intensität der Wärmebewegung der Stoffteilchen mit sinkender Temperatur abnimmt. Quelle: Arnold Arni, Grundkurs Chemie I, Wiley-VCH, Weinheim (1998) Der Text verzichtet auf Fachworte und beschreibt in eindrucksvollen Bildern, wie sich die Moleküle bewegen. Das Verständnis kann vertieft werden, wenn die Schülerinnen in einer Aufgabe selber Moleküle skizzieren. So setzen sie sich aktiv mit der Wärmebewegung auseinander und müssen ihre Modellvorstellung konkretisieren. Aufgabe Zeichnen Sie die Moleküle und deuten Sie die Wärmebewegung mit Pfeilen an: Luft Velopneu: Moleküle innerhalb und ausserhalb Heissluftballon: Moleküle innen und aussen Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 10 Im Unterricht lohnt es sich, wenn die Lehrperson das erste Beispiel vormacht und einige Moleküle von Luft skizziert. Da Luft im wesentlichen aus 4/5 Stickstoff N2 und 1/5 Sauerstoff O2 besteht müssen N2 und O2 im Verhältnis 4:1 gezeichnet werden. Die Moleküle sind weit voneinander weg und bewegen sich mit ähnlicher Geschwindigkeit. Dann können die Schüler selbständig arbeiten. Die Lehrperson kann Folien für den Hellraumprojektor verteilen und im Anschluss einige Vorschläge im Plenum zur Diskussion stellen: Welche der folgenden Skizzen zeigt die Teilchen in einem Heissluftballon am besten? Vorschlag 1 Vorschlag 2 Vorschlag 3 Vorschlag 2 offenbart eine Fehlvorstellung: Die Moleküle sollten wild durcheinander fliegen und zufällig auf die Ballonhülle treffen. Die Luft innerhalb des Ballons ist heisser als aussen. Deshalb sind die Moleküle innen mit längeren Pfeilen versehen um die grössere Geschwindigkeit anzudeuten. Wenn sie schneller sind haben weniger Moleküle im Ballon Platz und die Abstände werden grösser, ähnlich einer Tanzfläche, die bei einer lebhaften Musik weniger Paare aufnehmen kann. Vorschlag 3 zeigt grössere Abstände und damit eine geringere Dichte des Ballons. Dieser Ballon kann wegen der geringeren Dichte abheben. Der Ballon 1 hingegen würde sinken, weil seine Dichte grösser ist als die Dichte in der Umgebung. Vorschlag 3 zeigt die Situation in einem Hessluftballon am besten. Es ist allerdings zu bemängeln, dass die Moleküle in der Umgebung allzu nah beieinander dargestellt. Die Abstände zwischen den Molekülen müssten wesentlich grösser sein. Fazit: Wenn Schülerinnen selber skizzieren, setzen sie sich aktiv mit der Modellvorstellung auseinander. Die Skizzen geben Anlass zu einer Diskussion verschiedner Vorschläge, die die Erkenntnisse sichern. 2. Reaktionsgleichung zu einer Skizze formulieren Kalk auflösen Salzsäure, Putzessig, WC-Ente und Schnellentkalker mit Sulfamin- oder Zitronensäure lösen Kalk auf 1. Experiment auf dem Hellraumprojektor demonstrieren. Ein Stück Marmor mit ca.0,5 M Salzsäure bedecken. Die Gasblasen sind nur dann gut zu erkennen, wenn der Kalk unter dem Flüssigkeitsspiegel liegt. Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 11 2. Erklärung mit einer Skizze Aufgabe: Geben Sie die Edukte und Produkte an und formulieren Sie die Reaktionsgleichung, die zur Skizze passt. CaCO3(s) + 2 HCl(g) Ca2+(aq) + CO2(g) + H2O + 2 Cl- Wenn Sie den Prozess schrittweise beschreiben, wird es sehr unübersichtlich. Mir gefällt deshalb die oben stehende pauschale Reaktionsgleichung besser. HCl(g) Cl-(aq) + H3O+(aq) CaCO3(s) Ca2+(aq) + CO32-(aq) H3O+(aq) + CO32-(aq) HCO3-(aq) + H3O (aq) + HCO3 (aq) H2CO3(aq) H2CO3(aq) CO2(g) + H2O 3. Erklärung mit einer Skizze weiterführen Puffer Bei Zugabe einer Säure nimmt die Konzentration von H3O+ zu und der pH-Wert in Wasser sinkt stark: Säure, die in eine Pufferlösung gegeben wird mit der vorhandenen Base. Es entsteht kein H 3O+ und der pH bleibt nahezu konstant. Aufgabe: a) Was geschieht, wenn Base in eine Pufferlösung gelangt? Erklären Sie die Vorgänge mit einer Skizze. b) Es wird immer mehr Base zugesetzt. Wie lange kann der Puffer den pH konstant halten? Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015 Fachdidaktik Chemie ETH Mit Skizzen unterrichten S. 12 Die Skizzen sind extreme Vereinfachungen der Abbildung von Dickerson & Geis zur Wirkung von Puffern (R. E. Dickerson & I. Geis, Chemie - eine lebendige und anschauliche Einführung, Verlag Chemie, Weinheim, 1981) 4. Eine anspruchsvolle Skizze in Worte fassen Antibiotika Antibiotika sind ausgezeichnete Medikamente, weil sie sehr gut wirken und die Bakterien im menschlichen Körper – also die Ursache der Infektion – bekämpfen. Erklärung mit einer Skizze Amadeus Bärtsch Zentralkurs Schaffhausen, 14. Okt. 2015