doc
Werbung

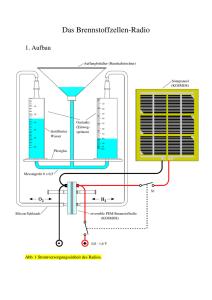
TPH LB Photovoltaik Brennstoffzelle 1 Lernziel Bei Durchführung der Übung erlernt der/die Studierende den Aufbau und die Wirkungsweise einer Brennstoffzelle. Er/sie lernt experimentell die Kennlinienaufnahme einer Brennstoffzelle und die Berechnung des Wirkungsgrades. 2 Vorbereitung Aufbau und Funktion von Solarzellen (eine weitere Übung ) und von Brennstoffzellen. Teile der Übung können nach Rücksprache entfallen, wenn die Übung Solarzelle bereits absolviert wurde. 3 Versuchsaufbau Abb.1 Der Strom aus den Solarzellen zersetzt im Elektrolyseur Wasser. Die entstehenden Gase werden der Brennstoffzelle zugeführt. Dort wird der Wasserstoff kontrolliert verbrannt. Bei der chemische Reaktion erfolgt der Elektronenaustausch über einen äußeren Stromkreis, der sofort die elektrische Energie liefert. 4 Grundlagen 4.1. Solarzelle Um die Vorgänge in einer Solarzelle zu verstehen, ist es hilfreich, sich zunächst mit dem p-n-Übergang bei Halbleitern zu befassen (Solarzelle sind speziell konzipierte pnÜbergänge). Mit einem der Physikbücher neben sich sollten. Sie die folgenden Lücken ausfüllen können. In einem reinen Halbleiter wie z.B. einem Silizium (Si)-Kristall liegt das Leitungsband energetisch über dem ....... ,beide Bänder sind durch eine ....... getrennt. Sie beträgt bei Si etwa 1,1 eV. Im Leitungsband sind Elektronen frei beweglich und tragen zur Leitfähigkeit bei, im Valenzband sind Elektronen gebunden, sie leiten den Strom ....... . Beim Si-Kristall ist das Valenzband mit 4 Valenzelektronen gefüllt, das Leitungsband ist bei ihm ....... . Bei T = 0 ist solch ein Halbleiter daher ein Isolator, erst bei merklich höheren Temperaturen fängt er an zu leiten. Ein n-Halbleiter entsteht, wenn man einen Si-Kristall z.B. mit Arsen (As) , das 5 Valenzelektronen besitzt, dotiert. n-Halbleiter haben daher viele freie ... im Leitungsband und besitzen eine gewisse Leitfähigkeit. Es gibt im n-Halbleiter genauso viele freie Elektronen wie ortsfeste As+-Ionen, der nHalbleiter ist daher elektrisch ....... . Es bilden sich keine Raumladungen, die den Ladungsfluss behindern. Ein p-Halbleiter entsteht, wenn man einen Si-Kristall z.B. mit Aluminium (Al) , das 3 Valenzelektronen ..........( ... und weiter analog zum n-Halbleiter). Bei der Herstellung (Abb.2) eines p-n-Übergangs .................... Elektronen aus dem n-Halbleiter in den p-Halbleiter. Dort fallen sie in die ... ............des Valenzbandes. Mit den ortsfesten Al --Ionen bilden sie daher eine negative Raumladung (Abb.3.). Im n-Halbleiter fehlen die wegdiffundierten Elektronen, die ortsfesten As+-Ionen erzeugen dort eine positive Raumladung. Beide Raumladungen bilden zwischen sich ein elektrisches........... aus. Es zieht positive Ladungen nach rechts und negative Ladungen nach links, so dass die Diffusion schnell beendet wird. Die Raumladungszone beträgt nur einige m. Der p-n-Übergang ist stromlos. Haiml / Klammler FH-Salzburg 1/6 TPH LB Photovoltaik Abb.2 Abb.3 Abb.4 Was geschieht nun, wenn (Abb.4) im Bereich zwischen den Raumladungen einfallendes Licht (Photonen) absorbiert wird? Abb.5 Solarzelle. Einfallendes Licht erzeugt freie Ladungen. Solarzellen sind großflächige p-n-Übergänge. Sie besitzen ein schmales, stark dotiertes n-Gebiet und ein wesentlich breiteres p-Gebiet, das zum Rand hin (in Abb.5 nach rechts) immer stärker dotiert ist. Man erhält dadurch eine erheblich weitere Raumladungszone, das elektrische Feld reicht weit in das p-Gebiet herein. Die von den einfallenden Photonen erzeugten freien Elektronen und Löcher werden von diesem Feld sofort getrennt, die Löcher werden in Feldrichtung zum p-Kontakt gezogen, die Elektronen zum n-Kontakt. Die entstehende Spannung an den Kontakten beträgt etwa 0,5 V. 4.2. Elektrolyseur Im Elektrolyseur wird Wasser zersetzt, um Wasserstoff und Sauerstoff für den Betrieb der Brennstoffzelle zu erzeugen. Die Vorgänge bei der Elektrolyse werden hier nicht weiter diskutiert. Sie finden dazu etwas in den Chemie- oder Physikbüchern, wenn es Sie interessiert. 4.3. Brennstoffzelle Abb.6 Eine Brennstoffzelle selbst besteht aus zwei Elektroden und dem Elektrolyten. Die Anode wird mit dem Brennstoff, die Kathode mit dem Oxidanten versorgt. Das Grundprinzip einer Brennstoffzelle ist die direkte Stromerzeugung aus einem Brennstoff (z. B. Wasserstoff) und einem Oxidanten (Sauerstoff) in einem elektrochemischen Prozess. Im Versuch hier wird eine PEM- Brennstoffzelle (s.u.) benutzt. Bei ihr werden an der Anode Wasserstoffmoleküle unter Abgabe von Elektronen zu positiv geladenen Wasserstoff-Ionen oxidiert. Der Elektrolyt ist protonenleitend. Er lässt daher nur und nur die Wasserstoff-Ionen zur Kathode hindurch diffundieren. Die abgegebenen Elektronen fließen über den äußeren Stromkreis zur Kathode. Mit dem von außen zugeführtem Sauerstoff entsteht dort Wasser. Anode 2 H2 4 H+ + 4e- Oxidation Kathode O2 + 4 H+ + 4 e- 2 H2O Reduktion Gesamtreaktion 2 H2 + O2 2 H2O Haiml / Klammler FH-Salzburg 2/6 TPH LB Photovoltaik Die elektrochemische Energieumwandlung in der PEM-Brennstoffzelle ist praktisch der Umkehrvorgang der Wasserelektrolyse. Eine Brennstoffzelle liefert damit wie Batterie und Akkumulator Energie aus einem elektrochemischen Prozess. Der wesentliche Unterschied besteht darin, dass bei der Brennstoffzelle die Elektroden selbst nicht umgewandelt werden. Die Brennstoffzelle kann also nicht entladen werden, ihr muss zum Betrieb ständig Brennstoff zugeführt werden. PEM: Die Brennstoffzelle ist in der Polymerelektrolyt-Membran-Technologie ausgeführt. Der Begriff Polymer-Elektrolyt-Membran-Brennstoffzelle (PEMFC) bezieht sich auf die protonenleitende Polymerfolie, die als Elektrolyt dient. Nur Protonen ( H+ ) können durch diese Folie diffundieren. Der Begriff PEM steht für Proton Exchange Membrane und FC für Fuel Cell. Abb.7 Querschnitt durch eine Brennstoffzelle Die Elektroden, Anode und Kathode, bestehen aus porösen Kohlenstoffmatten, die mit fein verteiltem Platin beschichtet sind. Platin ist chemisch sehr stabil und dient hier als Katalysator für die Wasserstoffoxidation und die Sauerstoffreduktion. Die Produktionskosten für Brennstoffzellen hängen erheblich von der verwendeten Platinmenge ab. Man benutzt daher Körner, die nur einige m-groß sind. Moderne Zellen arbeiten z. Zt. mit 0,1 mg Platin pro cm2. Die Elektrolytmembran (Nafion), die die Protonen leitet, wird auf der Basis von Teflon hergestellt. An die Kohlenstoffkette dieses Polymers werden Sulfonsäuregruppen (-SO3H) angehängt. Der Wasserstoff dieser Gruppe ist so schwach gebunden, dass es die Diffusion durch die Membran ermöglicht. Die Kohlenstoffmatten werden bei hohen Temperaturen mit der Membran so verpresst, dass sich die Membran in die Poren hinein drückt. An den Stellen, wo Kohlenstoff, Naflion und Platin gleichzeitig Kontakt haben, bilden sich die wesentlichen Reaktionszentren. Die Elektroden-Membran-Einheit ist weniger als 1 mm dick. 5. Übungsdurchführung 5.1. Solarmodul: Wie viel Strom liefert es unter Last? Abb.8 Versuchsanordnung nach Abb. 8. Abstand Lampe – Solarmodul etwa 20 cm . Warten Sie drei Minuten, bis sich das Modul gleichmäßig erwärmt hat. Haiml / Klammler FH-Salzburg 3/6 TPH LB Photovoltaik Messen Sie zunächst (ohne Widerstand) den Kurzschlussstrom, er sollte etwa 250 mA betragen. Schalten Sie die Widerstände dazu und messen Sie für 8 Werte jeweils Spannung und Strom. Messen Sie auch die Leerlaufspannung . Auswertung Zeichnen Sie das I = I(U) Diagramm des Solarmoduls und interpretieren Sie die Kennlinie. Der Strom, den die Solarzellen erzeugen, hängt ab von .............. , bei Belastung mit großen Widerstand wird ............. . Zeichnen Sie das P = P(U) Diagramm (Leistung P = U I ) . Bei welchen Werten gibt das Solarmodul demach seine maximale Leistung ab? 5.2. Elektrolyseur: Wann fängt er an, Gas zu produzieren? Abb. 9 Versuchsanordnung nach Abb. 9. Verändern Sie den Strom durch den Elektrolyseur, indem Sie z.B. die Lampe vor dem Solarmodul verschieben. Beginnen Sie mit einem kleinen Strom von etwa 10 mA, beobachten Sie die Gasentwicklung und messen Sie die Spannung am Elektrolyseur. Bestimmen Sie 7 weitere Wertepaare bis maximal 250 mA. Auswertung Zeichnen Sie das I = I(U) Diagramm und interpretieren Sie die Kennlinie. Zeichnen Sie in Ihr P-U- Diagramm von 5.1 (Solarmodul) das P = P(U) Diagramm dieses Elektrolyseurs zusätzlich mit ein. Bei geringen Spannungen von z.B. 1 V beobachtet man noch keinen Elektrolysestrom, die entstehenden Gase werden zunächst von den Elektroden absorbiert. Es entsteht eine galvanische Zelle, deren Polarisationsspannung der angelegten entgegenwirkt. Erhöht man die äußere Spannung, wird mehr Gas absorbiert. Erst wenn der Gasdruck an den Elektroden den Wert des äußeren Luftdrucks erreicht, beginnen Gasblasen aufzusteigen. Eine weitere Steigerung der äußeren Spannung führt dann zu einer kontinuierlichen Gasentwicklung und zu einem expotentiellem Anstieg des Elektrolysestroms (Kennlinie). Theoretisch sollte die Zersetzung unter Standardbedingungen bei 1,23 V beginnen. 5.3. Brennstoffzelle: Wie viel elektrische Energie wird erzeugt? Abb.10 Versuchsanordnung nach Abb. 10. Verbinden Sie dazu das Solarmodul zusätzlich mit dem Elektrolyseur, Abstand wieder etwa 20 cm. Lassen Sie bitte zunächst die Anlage etwa 3 Minuten mit einem Lastwiderstand R = 5 laufen. Verschließen Sie dann die beiden unteren, kurzen Schläuche der Brennstoffzelle. Betreiben Sie die Anlage im Leerlauf . Warten Sie bis der Wasserstofftank des Elektrolyseurs die 10 mlMarkierung erreicht hat. Trennen Sie danach das Solarmodul vom Elektrolyseur. Messen Sie zunächst den Kurzschlussstrom. Verändern Sie den Widerstandswert und messen Sie für 8 Werte jeweils Spannung und Strom. Messen Sie auch die Leerlaufspannung (Schalter: offen) und ersetzen Sie Haiml / Klammler FH-Salzburg 4/6 TPH LB Photovoltaik den Widerstand durch den Motor und die Lampe und nehmen Sie auch diese Werte auf. Auswertung Zeichnen Sie das U = U(I) Diagramm und interpretieren Sie die Kennlinie. Zeichnen Sie das P = P(I) Diagramm. Bei welchem Strom gibt die Brennstoffzelle ihre maximale Leistung ab? 5.4. Bestimmung der Leckrate Wenn an der Brennstoffzelle kein elektrischer Lastwiderstand angeschlossen ist, kann auch kein Elektronenfluss stattfinden. Im Idealfall wird dann auch kein Brennstoff oxidiert und verbraucht werden. Tatsächlich besitzt aber so ein System mit seinen Dichtungen und Übergängen immer eine gewisse Leckrate auf. Wie groß ist sie? Versuchsanordnung nach Abb. 1, das Volt- und das Amperemeter aus Versuch 5.3 entfernen Abstand Lampe – Solarmodul etwa 20 cm ( Strom ca. 250 mA). Führen Sie bitte die Punkte 1. bis 5. aus 5.3 noch einmal durch. Es wird jetzt kein Brennstoff mehr produziert. Die Brennstoffzelle läuft im Leerlaufbetrieb ohne Last. Im Idealfall müsste das Wasserstoffvolumen im Elektrolyseur konstant bleiben. Messen Sie jetzt bitte die Zeit, in der das Wasserstoffvolumen um 3 ml abgenommen hat. Auswertung Zeit t = .........min, Wasserstoffverlust aus Speicher V= .......cm3 Leckrate des Systems V/t= .................cm3/s 5.5. Wie groß ist der Wirkungsgrad der Brennstoffzelle? Der Energie-Wirkungsgrad einer Anlage gibt das Verhältnis von abgegebener, nutzbarer Energie zu zugeführter Energie an. Abgegeben wird von der Brennstoffzelle elektrische Energie, zugeführt wird ihr chemische Energie. Beide Energieanteile sollen Sie hier bestimmen. Stellen Sie die elektrische Verbindung Elektrolyseur – Solarmodul wieder her. Füllen Sie den Wasserstoffspeicher des Elektrolyseurs erneut bis zur 10 ml-Markierung auf und unterbrechen Sie danach die elektrische Verbindung Elektrolyseur – Solarmodul. Schließen Sie das Volt- und das Amperemeter an die Brennstoffzelle an und stellen Sie einen Lastwiderstand R = 5 ein (Schaltung wie in Versuch 5.3). Messen Sie bitte die Zeit, in der das Wasserstoffvolumen um 5 ml abgenommen hat. Messen Sie außerdem Strom und Spannung der Brennstoffzelle. Auswertung Beispiel: Messwerte: R = 3 , t = 180 s, V = 3.5 cm³, U = 0.75 V, I = 70 mA Die nutzbare elektrische Energie EElt ergibt sich aus EElt = U I t . Um die zugeführte chemische Energie EChem zu bestimmen, muss man die molare Verbrennungsenthalpie von Wasserstoff nachschlagen. Sie beträgt bei Raumtemperatur und Normaldruck –286 kJ/mol. Die Verbrennung von einem Mol Wasserstoff ( 24000 cm3 ) liefert danach eine Energie von 286 kJ. Für ein Wasserstoffvolumen von 3.5 cm3 ergibt sich mit den Beispielwerten: EElt= 0,75V *0,07 A *180 s = 9, 45 J EChem= 3,5 cm³ * 286000 J mol-1 / 24000 cm3 mol-1 = 41, 71 J nutzbare Energie 9,45 / zugeführte Energie = 9.45J / 41.71J = 0.23 Beim Faraday-Wirkungsgrad interessiert man sich für die umgesetzten Volumen um eine Ladungsmenge zu erzeugen: Haiml / Klammler FH-Salzburg 5/6 TPH LB Photovoltaik Wegen H2 - ergeben 1 mol Wasserstoffgas 2 mol Elektronen. 1 mol Elektronen entsprechen einer Ladungsmenge von 96500 C. 24000 cm3 Wasserstoffgas erzeugen daher theoretisch 2 96500 As = 193000 As. Im Versuch wurde die Ladungsmenge Q = I t = 0,07 A *180 s = 12,6 C erzeugt. Der theoretisch zu erwartende Wasserstoffverbrauch beträgt daher: V H2 = 12, 6 As * 24000 cm3 / 193 000 As = 1, 57 cm3 Vom gemessenen Volumen V = 3,5 cm3 muss das Leckvolumen abgezogen werden. Bei einer Leckrate von 0,01 cm3/s beträgt es für 180 s beispielsweise 1,8 cm3 = VH2 (theoretisch) / VH2 (gemessen) = 1.57 cm3 / 1.7 cm3 = 0.92 Berechnen Sie bitte mit Ihren eigenen Messwerten diese beiden Wirkungsgrade. Haiml / Klammler FH-Salzburg 6/6