Universität Konstanz Fachbereich Biologie Priv.
Werbung
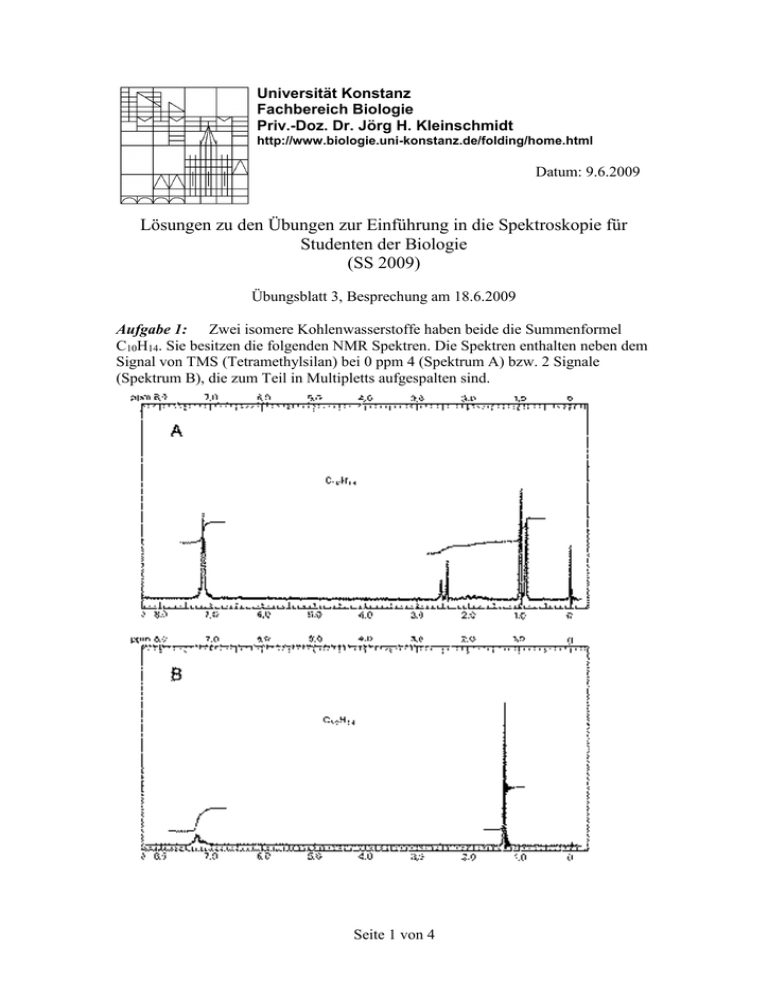
Universität Konstanz Fachbereich Biologie Priv.-Doz. Dr. Jörg H. Kleinschmidt http://www.biologie.uni-konstanz.de/folding/home.html Datum: 9.6.2009 Lösungen zu den Übungen zur Einführung in die Spektroskopie für Studenten der Biologie (SS 2009) Übungsblatt 3, Besprechung am 18.6.2009 Aufgabe 1: Zwei isomere Kohlenwasserstoffe haben beide die Summenformel C10H14. Sie besitzen die folgenden NMR Spektren. Die Spektren enthalten neben dem Signal von TMS (Tetramethylsilan) bei 0 ppm 4 (Spektrum A) bzw. 2 Signale (Spektrum B), die zum Teil in Multipletts aufgespalten sind. Seite 1 von 4 Analysieren Sie zuerst das einfachere Spektrum B. a) b) c) d) Welche Protonenarten (d.h. welche Molekülgruppen) enthalten die Spektren (vergleichen Sie mit dem unten angegebenen Schema für die chemischen Verschiebungen verschiedener Protonenarten) ? Geben Sie an, welches ganzzahlige Verhältnis der Zahlen der Protonen in den identifizierten Gruppen mit der angegebenen Summenformel im Einklang steht (d.h. wie viele Protonen gehören zur jeweiligen Protonenart) ? Zwei der Signale in Spektrum a sind Dubletts. Was lässt sich daraus für die Zahl der unmittelbar benachbarten Protonen dieser absorbierenden Wasserstoffkerne ableiten? Um welche Verbindungen handelt es sich? Lösung: Spektrum B a) Es gibt zwei Protonenarten die aufgrund ihrer chemischen Verschiebung von 7.2 ppm den Aromaten bzw. den Methylgruppen zuzuordnen sind. b) die Zahl der Protonen läßt sich aus den Flächen der Absorptionspeaks entnehmen. Die Höhendifferenz der über die Peaks gezeichnen Integrationslinien ist ein direktes Maß für den Anteil der Protonenart an der Gesamtzahl der Protonen: Es ergibt sich für zum Beispiel für die Zahl der aromatischen Protonen: Seite 2 von 4 H arom. Höhendifferenz der aromat. Integrationslinie Gesamtzahl der Protonen Summe der Höhendifferenzen aller Integrationslinien Damit gibt es 5 aromatische Protonen und 9 Protonen, die nichtaromatisch sind. Die nichtaromatischen Protonen sind magnetisch equivalent, d.h. sie besitzen dieselbe chemische Umgebung. Die einzige mögliche Verbindung, die mit dem Spektrum und der Summenformel C10H14 in Einklang steht, ist eine Verbindung der folgenden Struktur: CH3 CH3 CH3 Spektrum A a) Es gibt 4 verschiedene Protonenarten. Ein Signal zeigt aromatische Protonen an, drei Signale zeigen aliphatische Protonen, bei denen es sich um Protonen primärer, sekundärer oder tertiärer Kohlenstoffatome handeln muss, das heißt z.B. um Methyl- oder Methylenprotonen. b) Da das Molekül insgesamt 14 Protonen enthält, ergeben sich die Zahlen der Protonen in den 4 verschiedenen Gruppen aus den relativen Anteilen der jeweiligen Integrale (Einzelhöhendifferenz der Integrationslinie) dieser Gruppen an der Gesamtabsorption (Summe aller Höhendifferenzen), gerundet auf ganzahlige Werte: Aromat (=7.15 ppm): 1. Aliphat . Gruppe ( = 2.5 ppm): 2. Aliphat. Gruppe ( = 1.7-2.1 ppm): 3. Aliphat. Gruppe (= 1.0 ppm): c) 0.38*14 = 5.3 ≈ 5 0.13*14 = 1.8 ≈ 2 0.063*14 = 0.88 ≈ 1 0.44*14 = 6.1≈ 6 den zwei Protonen des Dubletts bei =2.5 ppm muss ein Proton benachbart sein, dass durch die beiden möglichen Einstellungen seines Spins und seine damit verbundenen verschiedenen magnetischen Momente das B0 -Feld am Ort dieser beiden Protonen entweder erhöht oder erniedrigt, sodass zwei Resonanzfälle (eben ein Dublet) beobachtet werden. Dasselbe gilt für die 6 Protonen die bei =1 ppm eine Dublett Absorptionslinie zeigen. Dass die Signale bei =1 ppm (2 Protonen) und =2.5 ppm (6 Protonen) jeweils nur in Dubletts aufspalten, zeigt, dass diese chemisch verschiendenen Protonenarten nicht unmittelbar miteinander gekoppelt sind, sondern räumlich voneinander getrennt sind. Seite 3 von 4 d) Die einzige denkbare Struktur des Moleküls, die mit den Beobachtungen a-c kompatibel ist, ist die folgende CH3 CH CH2 CH3 Aufgabe 2: Der Kern g-Faktor des Protons ist gN 5.585 . Das gyromagnetische Verhältnis des Protons ist ( 1 H ) 47894152.9 As / kg . Es steht ein Magnetfeld B0 der Stärke 12 T (1 T = 1 Vsm–2 = 1 JA–1m–2) zur Verfügung. Bei welcher Frequenz zeigt ein isoliertes Proton eine NMR Absorption ? Bei welcher Frequenz ein isoliertes Kohlenstoffatom 13 C ? Es ist gN(13C)=1.404 und ( 13C) 4.7815 10 7 Ckg1 Lösung: Es gilt: H 2h B h B0 gN N B0 g 1 H 1 0 H 2h B gN 1 H 1 0 h Damit folgt 5.585 47894152 2 As J 12 kg Am 2 510866051 Js 510 MHz kg m 2 Analog zur Lösung für das Proton erhält man mit g(13C) und ( 13C) also Resonanzfrequenz 128 MHz . Seite 4 von 4