Aufschlusstechniken in der analytischen Chemie
Werbung

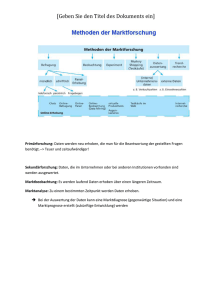
AUMT Aufschlusstechniken 8AUK Aufschlusstechniken in der analytischen Chemie 1. Einführung In der analytischen Chemie ist bei festen Proben in fast allen Fällen ein Aufschließen oder Lösen der Probe nötig. Dies hier ist ein Überblick und ein Vergleich über die gängigen Methoden. Aufschlüsse sind nötig um die Probe In eine messgerechte Form zu bringen und Um sie bestmöglich zu homogenisieren. (Lösen wäre die beste Form, ist aber nicht immer möglich) 2. Techniken Es werden zum Aufschließen 4 Techniken verwendet: Schmelzaufschluss (fusion) Verbrennung, combustion Kaltplasma – Veraschung Nasschemische Aufschlüsse 2.1 Schmelzaufschluss Beim Schmelzaufschluss wird die feste Probe mit einem ca. 10-fachen Überschuss an festem Aufschlussmittel vermengt und erhitzt. Die sich dadurch bildende Schmelze wird für die weitere Analytik verwendet. Als Aufschlussmittel werden Na-/K-/Li- Salze verwendet, da alle Verbindungen dieser Elemente Wasserlöslich sind. z.B.: Na2CO3, KNaCO3, Na2O2 Kaliumhydrogensulfat KHSO4 K2S2O7 (Kaliumpyrosulfat) Lithiummetaborat Li2B4O7, ist eine Vorbereitungstechnik für die RFA (z.B.: für Zement und Rohmaterialien Der Aufschluss wird anschließend aufgelöst oder ausgelaugt. Nachteil: Hohe Blindwerte Hohe Gesamtsalzkonzentration der Aufschlusslösung stört (z.B.: beim Zerstäuben) 2.2 Verbrennung Bei der Verbrennung, oder auch combastion, wird mit hochreinem O2 (O2: 5.0 ist zu 99,999% rein) gearbeitet. Dadurch kommt es zu keinen Problemen mit den Blindwerten. Anwendungen: brennbare Stoffe 2.2.1 Verbrennung nach Wickbold: Die verwendete Apparatur besteht zur Gänze aus Quarz (SiO2), die Flamme ist eine H2/O2 – Mischung (Knallgas). Anwendung: Bestimmung von Schadstoffen in Brennstoffen (z.B.: S, Cl, P, …) Seite 1 von 4 AUMT Aufschlusstechniken 8AUK z.B.: Schwefel Bei der Verbrennung einsteht SO2 das absorbiert wird in einer 3%-igen H2O2 SO3 + H2O H2SO4 Die entstehende Schwefelsäure wird anschließend bestimmt. Chlor Wird ebenfalls in Wasser absorbiert. Über die entstehende Salzsäure wird Chlorid bestimmt. 2.3 Kaltplasma – Veraschung Ein Plasma ist ein ionisiertes Gas, mit einem mindestens 1%igen ionisierten Anteil. In einem Quarzgefäß befindet sich die brennbare Probe unter Unterdruck mit einem geringen Anteil an O2. Von außen wird der O2 durch ein Hochfrequenzfeld angeregt. Es entsteht ein Plasma, die Temperatur beträgt dabei nur wenige 100°C. Die Probe verglimmt, die Asche wird in hochreiner Säure gelöst und für die weitere Analytik herangezogen. Asche ist der Anteil an anorganischen Bestandteilen in einer organischen Probe. Anwendung: Poly Tetra Fluor Ethylen, PTFE ( Teflon), Graphit. 2.3.1 High –Pressure – Asher (Hochdruckveraschung) Ist ein in Graz entwickeltes Verfahren, bei dem mit erhöhtem Druck gearbeitet wird, dadurch wird auch der Siedepunkt erhöht. In einem Autoklaven wird bei einer T von bis zu 300°C auf Quarzaufschlussgefäße ein Druck von 100 bar angelegt. Solange der Innendruck, der durch die Reaktion entstehenden Gase, diese 100 bar nicht übersteigt kommt es zu keinen Verlusten. Das Aufschlussgefäß ist ca. 15 cm hoch und 2-3 mm dick, da Quarz sehr stabil ist. Der Druck im Inneren setzt sich zusammen aus den nitrosen Gasen und aus dem entstehenden CO2. Die max. Einwaage beträgt 100 mg C. Da eine trockene organische Substanz aus ca. 50 Ma% C besteht wird etwa 200 mg Probe eingewogen und dazu 2 ml HNO3 gegeben. Anschließend wird alles auch 250 °C aufgeheizt für ca. 90 min. Die organischen Substanzen werden alle oxidiert, die Asche löst sich in der HNO3. Es werden 1 Blindwert und 3 Proben in Parallelbestimmung bearbeitet. Vorteil: System ist ein Refernzverfahren zur Überprüfung der Vollständigkeit eines Verfahrens Liefert den geringsten Restkohlenstoffgehalt. (= jener C, der nicht zu CO2 wurde) Der Restkohlenstoffgehalt kann bei der Analytik stören, da die wässrige Probe durch den gelösten Kohlenstoff eine andere Viskosität bekommt und dadurch anders zerstäubt wird, als ein rein wässriges System. Es geht auch mit einem Kunststoffgefäß (z.B.: PVC), bei 300°C und 120 min. Nachteil: Lange Aufschlussdauer (min. 4h, da es auch auskühlen muss!) Bei Fetten und Ölen kann es mit der HNO3 zu spontanen Reaktionen kommen, durch die Bildung von Nitroglycerin (kann bei allen p – Aufschlüssen passieren) Seite 2 von 4 AUMT Aufschlusstechniken 8AUK 2.3.2 Pressuriced Mirkowave digestion (PMD) Bei dieser Methode gibt es keinen Außendruck. Stattdessen, steigt ein Stempel mit dem p, sobald er beim max. p den Lichtstrahl durchbricht wird die Mikrowelle ab geschalten und der Aufschluss beendet. Die verwendete Gleitlippendichtung hält dicht und kann sich gleichzeitig bewegen. Wegen des Fehlenden Differenzdrucks muss das Gefäß dem p standhalten. Da das Gefäß durch die Oxidation heiß wird, wird es gekühlt durch einen Luftstrom. Vorteil: Nachteil: 2.4 gesamte Aufschlussdauer ca. 20min 10min Aufschluss, 10min Abkühlen da kein so hoher p möglich ist, funktionieren schwer aufschließbare Stoffe (z.B.: PNC) nicht. Nassaufschluss, digestion Bei diesem Verfahren wird ausschließlich Säure als Aufschlussmittel verwendet: Salpetersäure, HNO3 Salzsäure, HCl Schwefelsäure, H2SO4 Flusssäure, HF Perchlorsäure, HClO4 2.4.1 Salpetersäure Vorteil: Nachteil: Ausweg: es ist ein starkes Oxidationsmittel (Ox. - Mittel) und stört nicht bei der Nachfolgenden Analytik es hat einen relativ niedrigen Siedepunkt. Da eine Temperaturänderung von 10°C eine Verdopplung bis Verdreifachung der Reaktionsgeschwindigkeit bringt, ist dies ein Entscheidender Nachteil. Bei dem Aufschluss wird mit Druck gearbeitet, das bringt eine Erhöhung des Siedepunktes und dadurch eine kürzere Aufschlussdauer. 2.4.2 Salzsäure Nachteil: Ausweg: HCl hat einen niedrigen Siedepunkt und ist kein Ox. – Mittel. Deshalb wird es nie allein verwendet. 3HCl + HNO3 Königswasser Es bildet sich dadurch NOCl, das in NO und Chlor – Radikale zerfällt. Chlor – Radikale lösen fast alle Metalle. Aufschluss genormt als DIN 38414(/DEV – S7) Seite 3 von 4 AUMT Aufschlusstechniken 8AUK 2.4.3 Schwefelsäure Vorteil: Nachteil: relativ hoher Siedepunkt (>300°C, ca. 330°C) schwaches Ox. – Mittel, das zwar die Probe gut zersetzten kann aber nicht aufschließen kann. Deshalb wird es vorwiegend in Gemischen verwendet. z.B.: Fisch H2SO4 + HNO3 + KMnO4 !!!Vorsicht: Niemals Kaliumpermanganat in Schwefelsäure geben, es bildet sich sonst explosives Mn2O7 !!!! Der Fisch wird zuerst zersetzt mit Schwefelsäure, oxidiert mit HNO3 und KMnO4. 2.4.4 Flusssäure Flusssäure wird zum Aufschließen von Silikaten verwendet. SiO2 + 4HF + H2SO4 SiF4 + 2H2O Das flüchtige SiF4 wird abgeraucht, die zugesetzte Schwefelsäure bindet das Wasser. Nachteil: Flusssäure (HF) ist extrem gefährlich für den Menschen. Es erzeugt schwer heilende Wunden, die bei schweren Verätzungen zu einer Amputation führen können! HF ist kein Ox.- Mittel! 2.4.5 Perchlorsäure Vorteil: HClO4ist ein extrem starkes Oxidationsmittel mit einem hohen Siedepunkt (>300°C) Nachteil: kann zu sehr heftigen Explosionen führen, wenn es in Kontakt mit organischen Substanzen kommt. Es kann sich anlagern und dann plötzlich und unerwartet reagieren. Beim arbeiten mit HClO4 muss der komplette Arbeitsplatz aus Glas oder Keramik bestehen, da es mit Kunststoffen reagieren kann. Es gibt heute keinen Grund mehr damit zu arbeiten, wird deshalb nicht mehr verwendet. 3. Herstellung hochreiner Säuren Alle Aufschlussmethoden sind auf hochreine Säuren angewiesen. Die Herstellung dieser Säuren erfolgt mittels „sub boiling still“. Dabei wird unter dem Siedepunkt destilliert (= Verdunstung). Der Behälter besteht aus Quarz, für die Reinigung von HF muss er aus Teflon bestehen. Der Connector ist ein Aussenschliff, also ein umgedrehter Schliff, um einen Kontakt zwischen Säure und Schliff zu verhindern. Man kann mit dieser Methode auch hochreines Wasser destillieren. Seite 4 von 4