Ideale und Reale Gase
Werbung

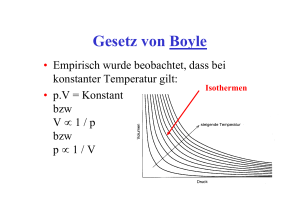
Ideale und Reale Gase Die Grundlagen für die Gastheorien wurden um das 17 Jahrhundert durch das Gesetz von Boyle, das Gesetz von Gay-Lussac, das Gesetz von Amontons und das Prinzip von Avogadro begründet. Gesetz von Boyle: Bei gleicher Temperatur verhält sich das Volumen eines Gases umgekehrt proportional zum Druck. Gesetz von Gay-Lussac: Das Volumen eines Gases ist proportional zu seiner Temperatur Gesetz von Amontons: Der Druck eines Gases ist proportional zu seiner Temperatur Prinzip von Avogadro: Bei gleicher Temperatur und gleichem Druck beinhalten gleiche Gasvolumina dieselbe Anzahl an Teilchen. Die Kombination dieser Gesetze führt zur Idealen Gasgleichung: Das ideale Gasgesetz ist ein Grenzgesetz, das das Verhalten der Gase bei niedrigem Druck beschreibt. Es gilt näherungsweise auch für reale Gase unter normalen Bedingungen. Das ideale Gasgesetz ist eine Zustandsgleichung. p⋅V=n⋅R⋅T Die ideale Gaskonstante R lässt sich experimentell bestimmen indem man Druck und Temperatureiner bestimmten Menge Gas in einem Behälter bekannten Volumens misst. Dabei werden mehrere Messungen bei unterschiedlichem Druck durchgeführt und anschließend auf den Wert 0 extrapoliert. Kinetische Gastheorie Die Kinetische Gastheorie ist ein Modell zur Berechnung quantitativer Werte eines Gases. Diese Theorie geht von gewissen Grundlagen aus. 1. Ein Gas besteht aus Molekülen mit der Masse m und dem Durchmesser d in dauernder, regelloser Bewegung. 2. Die Größe der Moleküle ist vernachlässigbar, denn ihre Durchmesser sind wesentlich kleiner als die durchschnittlich zwischen zwei Stößen zurückgelegte Strecke. 3. Die Moleküle üben - außer bei Stößen - keinerlei Wechselwirkungen aufeinander aus. Aus diesen Zusammenhängen ergibt sich die kinetische Gasgleichung: p * V = (1/ 3) * n * M * c^2 c ist die quadratisch gemittelte Geschwindigkeit der Teilchen Die kinetische Gastheorie liefert den Beweis, dass Gase aus Teilchen bestehen. Die Maxwellsche Geschwindigkeitsverteilung In Luft unter Normalbedingungen stößt jedes Molekül pro Nanosekunde etwa 6mal auf ein anderes Teilchen. Die Geschwindigkeit der einzelnen Moleküle ändert sich dabei fortlaufend. der Anteil der Moleküle mit einer bestimmten Geschwindigkeit wird durch die Geschwindigkeitsverteilung beschrieben. Die Gleichung für diese Verteilung wurde von James Clerk Maxwell aufgestellt und wird daher Maxwellsche Geschwindigkeitsverteilung genannt. Der Anteil f der Moleküle, die eine Geschwindigkeit im schmalen Intervall zwischen v und (v + Δv) haben ist gegeben durch: Reale Gase Anders als Ideale Gase haben reale Gase sehr Wohl potentielle Wechselwirkungen und ein Atomvolumen. Weiters existiert eine Anziehung zwischen den Teilchen welche überwunden werden muss um ein Gas in der Gasphase zu halten (siehe Joule Thompson-Effekt). Reale haben eine Kritische Temperatur bei der sie unter keinem Druck zu einer Flüssigkeit komprimiert werden können. Diese Temperatur ist eine Folge der Anziehungs- und Abstoßungskräfte welche nur in realen Gasen beachtet werden. Zustandsgleichungen für reale Gase Für ideale Gase gilt: Der Faktor p·Vm/RT wird für reale Gase Kompressionsfaktor genannt. Er weicht deutlich von 1 ab und ist stark druckabhängig. Die Virialgleichung Um die Abweichung des Kompressionsfaktors von 1 beschreiben bzw. korrigieren zu können liegt es nahe einen den gemessenen Werten entsprechenden Korrekturfaktor anzugeben. Man geht bei diesem rein empirischen, also nur aus der Beobachtung und nicht aus einer Modellvorstellung, abgeleiteten Ansatz von einer sogenannten Reihenentwicklung aus. Die ideale Gasgleichung ist nur der erste Term eines langen Ausdrucks. B,C,… sind empirische Koeffizienten die Tabelliert sind. Vaan der Waals- Gleichung: Die van der Waals- Gleichung ist ein Physikalische Überlegung die sowohl das Eigenvolumen der Teilchen als auch die Wechselwirkungen der Teilchen untereinander berücksichtigt. Die b- Konstante berücksichtigt das Teilchenvolumen und die a- Konstante die Aufschlgshäufigkeit und die mittlere Aufschlagsstärke. Diese Gleichung wird in der Realität für nicht ideal anzunehmende Gase zum abschätzen des Druckes verwendet.